Expression of urate hydrolase pseudogene in placentae tissues of preeclampsia and its molecular mechanism
-
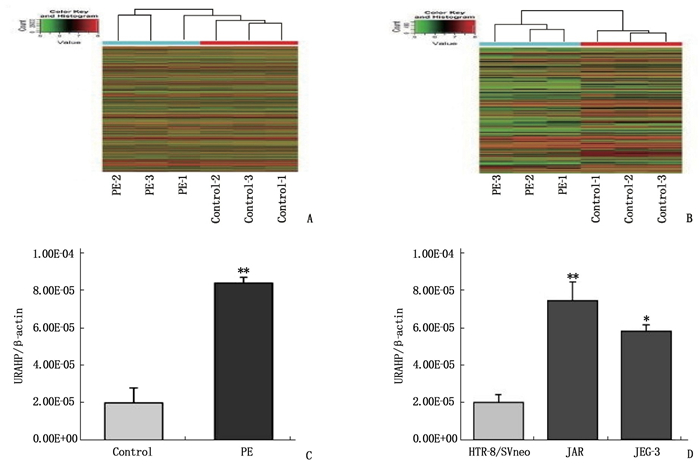
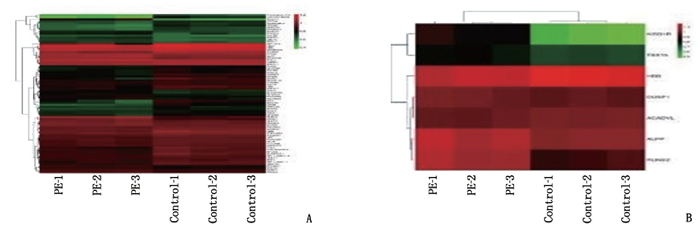
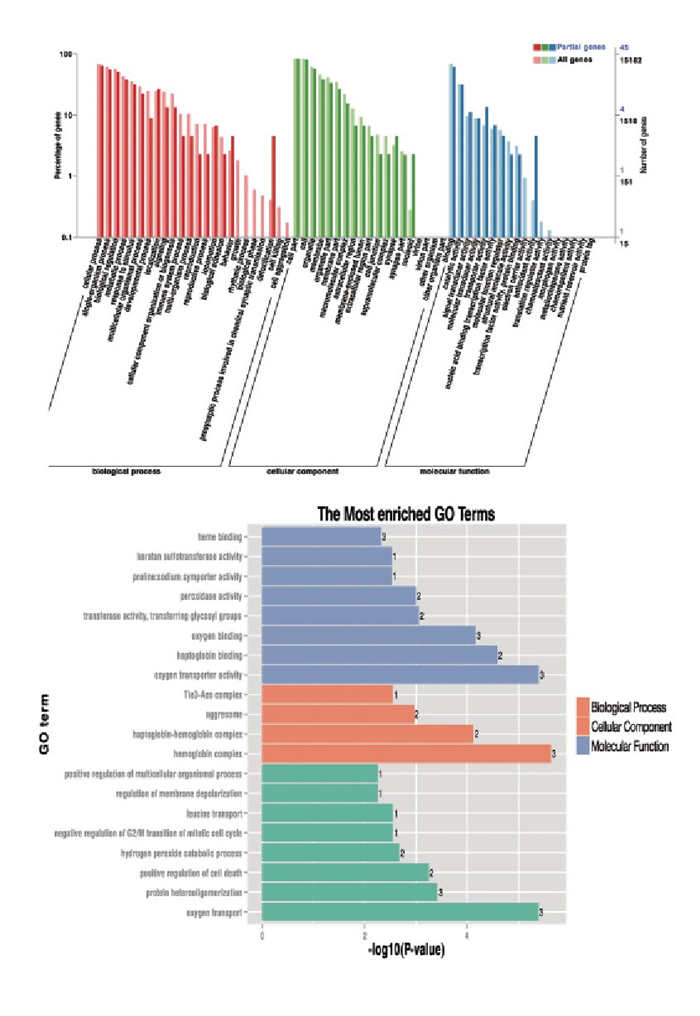
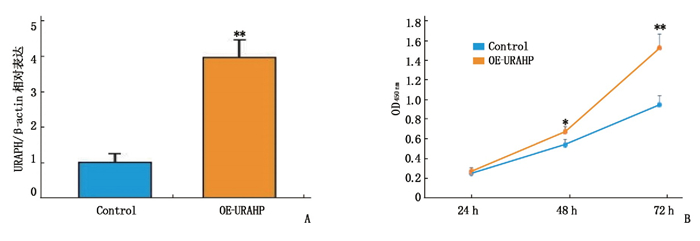
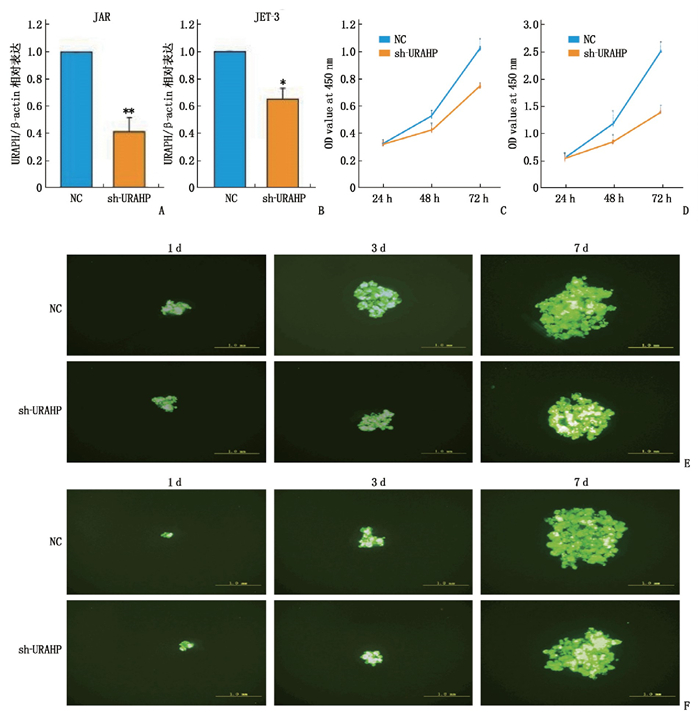
摘要:目的 探讨长链非编码RNA(LncRNA)尿酸盐水解酶假基因(URAHP)在子痫前期胎盘组织中的异常表达及其对滋养层细胞增生、侵袭的影响。方法 选取子痫前期及正常孕妇胎盘组织6例,其中PE组纳入子痫前期患者3例,对照组纳入正常妊娠孕妇3例。筛选2组差异表达LncRNA和miRNA;分析LncRNA URAHP在2组胎盘组织中的差异表达。采用CCK-8法,分析URAHP对滋养层细胞增生及侵袭的影响。测定URAHP和吻素受体(KISS1R)在JAR、JET-3、HTR-8/SVneo细胞系中的表达。结果 通过分析鉴定了205个差异表达基因,其中56个上调,149个下调。与正常妊娠相比,子痫前期患者胎盘组织中假基因URAHP表达增加,差异有统计学意义(P < 0.05)。URAHP的下调可改变JAR/JET-3细胞增殖能力;URAHP过表达可促进HTR-8/SVneo细胞增殖。KISS1R是URAHP在子痫前期胎盘中的共表达基因。结论 假基因URAHP可能与子痫前期发病有关。Abstract:Objective To investigate the abnormal expression of long non-coding RNA (LncRNA) urate hydrolase pseudogene (URAHP) in the placental tissue of preeclampsia and its effects on proliferation and invasion of trophoblast cells.Methods Six cases of preeclampsia and normal maternal placental tissue were selected, among whom three patients with preeclampsia were selected as PE group, and three normal pregnant women as control group. The differentially expressed LncRNAs and miRNAs in the two groups were screened; the differential expression of LncRNA URAHP in the placental tissues of the two groups was analyzed. CCK-8 method were used to analyze the effects of URAHP on trophoblastic proliferation and invasion. The expressions of URAHP as well as KISS1R in JAR, JET-3 and HTR-8/SVneo cell lines were determined.Results A total of 205 differentially expressed genes were identified, among which 56 were up-regulated and 149 were down-regulated. The expression of URAHP pseudogenes was significantly increased in placental tissues of preeclampsia patients compared with those of the normal pregnant women (P < 0.05). Downregulation of URAHP could change the proliferation ability of JAR/Jet-3 cells; the overexpression of URAHP promoted the proliferation of HTR-8/SVneo cells. KISS1R was the co-expression gene of URAHP in the placenta of preeclampsia.Conclusion Pseudogene URAHP may be associated with the onset of preeclampsia.
-
Keywords:
- long non-coding RNA /
- urate hydrolase pseudogene /
- preeclampsia /
- placenta /
- cell proliferation
-
右美托咪定(Dex)是高选择性α2肾上腺素能受体激动剂,在麻醉、镇静与术后镇痛中发挥了重要作用[1-2]。Dex具有独特的药理学特性,能够模拟自然睡眠状态的镇静,还可协同镇痛,降低应激反应,稳定血流动力学,并且对呼吸无抑制作用,在产科麻醉与镇痛中已有应用[3-4]。作者对Dex在产科麻醉与镇痛中的研究进展进行综述。
1. Dex的药理学特性
Dex通过作用于中枢和外周神经系统的α2受体而发挥相应作用。Dex能够特异性地激动脑干中蓝斑核α2受体,引发并维持非快速眼动睡眠状态来发挥镇静效应,这种镇静催眠状态模拟了自然睡眠状态,能够被语言或者一定程度的刺激唤醒,并且在镇静过程中不会产生呼吸抑制[5]。Dex与α2肾上腺素能受体结合,通过抑制G蛋白的激活和减少环磷酸腺苷(cAMP)的释放,有效抑制神经元的兴奋性和去甲肾上腺素的释放,进而减弱中枢神经系统传导的交感神经兴奋性,终止疼痛信号的传导,最终抑制了神经递质及P物质的释放,发挥镇痛作用[6]。与临床上常用的镇静、镇痛药物相比, Dex的临床优势在于无呼吸抑制、镇静期间可被唤醒,并且其镇痛作用还具有剂量依赖性。除了良好的镇静、镇痛作用外, Dex还具有稳定血流动力学、抗寒战、抗炎、降低应激反应和抗心律失常等作用[5]。Dex通过上调Cx43、抑制炎症和纤维化,在缺血性心肌病中发挥抗心律失常作用,其抗心律失常和抗炎作用可能是通过AMP活化蛋白激酶(AMPK)磷酸化和核因子-κB (NF-κB)活化的抑制来介导[7]。非房室分析显示Dex分布半衰期为5~10 min, 消除半衰期为2~3 h, 清除率约39 L/h。若使用负荷剂量, Dex的起效时间为10~15 min; 若未使用负荷剂量,其起效时间和达峰时间均会延长[5]。
2. Dex在剖宫产手术麻醉中的应用
剖宫产手术大多采用椎管内麻醉,大部分产妇在清醒状态下会处于紧张、焦虑状态,若椎管内麻醉阻滞不全,则产妇会对腹膜牵拉、子宫探查等操作感到不适与疼痛,降低了产妇满意度。根据Dex的镇静镇痛、抗交感、抗焦虑和无呼吸抑制等多种药理特性,大量研究对Dex在剖宫产中的应用进行了探索。Meta分析[8]结果表明, Dex可安全用于全身麻醉或椎管内麻醉的剖宫产,在不同麻醉方式中都能显著增强术中的镇痛效果,且能够降低术后不良反应的发生率,如恶心、呕吐等; 由于Dex脂溶性的特点,其胎盘转移率较低,对新生儿1、5 min Apgar评分以及脐血气均无显著影响,同时能够有效稳定产妇血流动力学、不影响产妇呼吸功能。
2.1 剖宫产手术麻醉中Dex的静脉应用
一项对全身麻醉下择期剖宫产产妇的临床研究中,将120例产妇随机分为右美托咪定组[D组, Dex诱导0.5 μg/kg, 维持0.5 μg/(kg·h)]、瑞芬太尼组[R组,诱导0.5 μg/kg, 维持2 μg/(kg·h)]和对照组(C组,生理盐水),结果表明D组较R组、C组的术后1、2 h的视觉模拟评分法(VAS)评分显著降低,且D组术后3 h补救性镇痛药物曲马多总用量显著低于C组。虽然瑞芬太尼在剖宫产全身麻醉中对血流动力学稳定性有较好的控制作用,但Dex除了稳定血流动力学的优势外,对新生儿Apgar评分、术后镇痛、儿茶酚胺释放也有更好的控制作用[9]。静脉泵注Dex[负荷剂量0.2 μg/kg, 维持剂量0.4或0.6 μg/(kg·h)]除了具备完善的镇痛效果外,还可以减轻产妇应激反应,通过对血糖和血清皮质醇等指标的监测,发现Dex使得应激反应指标更为稳定[2]。腰麻患者应用效应室靶控输注(TCI)静脉泵注Dex时,发现效应室浓度(Ce)与改良警觉/镇静评分(MOAA/S评分)和脑电双频指数(BIS)显著相关,中度和深度镇静时分别为0.89、1.19 ng/mL[10]。但该研究纳入了择期骨科手术患者,缺乏产妇的相关数据研究。
2.2 剖宫产手术麻醉中硬膜外应用
择期剖宫产术应用罗哌卡因和吗啡行硬膜外麻醉(0.75%罗哌卡因12 mL、吗啡2 mg), 并在实施麻醉时辅助硬膜外推注Dex (0.5 μg/kg), 同时术后48 h硬膜外镇痛中加入Dex(吗啡2 mg和右美托咪定200 μg于100 mL 0.2%罗哌卡因中混合,输注2 mL/h), 可显著减轻术中及术后内脏疼痛,在术中及分娩后产生更好的镇静作用,不增加吗啡相关副作用[11]。
2.3 剖宫产手术麻醉中鞘内应用
目前美国食品和药物管理局(FDA)尚未批准Dex可用于鞘内注射,但Dex在国内外已经作为局麻药佐剂应用于临床。基础研究[12]表明Dex鞘内注射不会产生组织学神经毒性,组织学检查也未发现神经元体或轴突病变、神经胶质增生或髓鞘损伤。最新纳入了10项随机对照试验(RCT)的Meta分析显示,在出生后1、5 min的Apgar评分,脐动脉氧分压、二氧化碳分压,脐带血pH值等指标方面,与对照组相比, Dex对新生儿结局无影响,鞘内给予Dex能显著延长产妇术后无痛时间,降低术后寒战发生率,改善腰麻的阻滞效果[13]。对152例足月剖宫产产妇的研究中,鞘内注射15 mg布比卡因与7.5 μg Dex后, BIS值、Ramsay评分、术中及术后的VAS评分与安慰剂组比较有显著差异,但对副反应发生率无显著影响,也未发现神经毒性反应,其良好的镇痛机制可能是脊髓中肾上腺素能受体通过依赖G蛋白钾通道而使脊髓中间神经元超极化,从而减少了初级神经末梢的神经递质释放,进而发挥有效镇痛的作用[14]。2020年发表的一项针对健康产妇在腰-硬联合麻醉下剖宫产的前瞻性、双盲、随机剂量反应试验[15]结果显示,与单纯蛛网膜下腔给予罗哌卡因组(11.4 mg, 95%CI为11.1~11.7 mg)相比,蛛网膜下腔给予罗哌卡因联合5 μg Dex组(9.4 mg, 95%CI为9.0~9.7 mg)的半数有效量(ED50)降低约18%, 并且罗哌卡因联合5 μg Dex组寒战的发生率显著低于对照组(P < 0.05), 而2组感觉阻滞和运动阻滞的发生时间无显著差异,低血压、心动过缓、恶心呕吐、瘙痒等不良反应也无显著差异。
2.4 剖宫产手术中抗寒战的作用
椎管内麻醉后下肢血管扩张,加之产妇精神高度紧张、大面积皮肤消毒、手术刺激、失血补液等,使得剖宫产术中低体温和寒战的发生率极高,严重影响了产妇的麻醉体验。ZHANG J等[16]进行的Meta分析共纳入1 760例产妇,结果显示Dex作为椎管内麻醉辅助用药可以预防产妇寒战的发生,同时能提高椎管内麻醉阻滞效能。NASSERI K等[17]及HE L等[18]的随机对照研究中,在布比卡因的基础上加入5 μg Dex,能有效降低术中寒战的发生率以及寒战强度。Dex不增加机体产热,也不能减少热量的丢失,但在胎儿娩出后静脉泵注0.5 μg/(kg·h) Dex却能减轻蛛网膜下腔阻滞后产妇的寒战程度,减少焦虑的发生,降低低体温发展为寒战的可能性,其机制可能是通过特异性激动脊髓和大脑相关受体抑制交感活性来减少寒战的发生[19]。
2.5 剖宫产手术中稳定循环的作用
对于妊娠合并高血压的产妇,紧张、疼痛、手术创伤等刺激导致产妇血流动力学波动较大,极易发生血压居高不下,骤升的血压也易诱发子痫,甚至导致产妇和围产儿死亡。Dex的镇静、稳定血流动力学作用对于妊娠期高血压综合征(妊高征)的产妇具有重要意义,通过减轻交感神经系统的刺激以降低儿茶酚胺的释放,从而减轻先兆子痫产妇血流动力学反应,使产妇血压、心率趋于平稳状态[2]。边晶等[20]研究结果发现,静脉泵注0.8 μg/kg Dex可有效抑制腰麻下剖宫产术中牵拉反应等,并且产妇循环系统波动幅度较小。此外,静脉给予高剂量(1.0 μg/kg)或低剂量(0.5 μg/kg)Dex均能够有效防止剖宫产术中使用欣母沛引起的恶心、呕吐、血压升高等不良反应,提高产妇的舒适度和满意度[21]。
3. Dex在剖宫产术后镇痛中的应用
剖宫产术后切口疼痛剧烈,导致产妇精神、睡眠、食欲欠佳,同时机体耗氧量增加,不利于产妇术后恢复。剖宫产术后镇痛包括静脉泵镇痛、神经阻滞镇痛、局部浸润麻醉镇痛、硬膜外镇痛等。
3.1 静脉镇痛
研究[22-23]显示,术后静脉泵镇痛方式中添加Dex 1.5 μg/kg或2.0 μg/kg能起到良好的镇痛效果,并且Dex可模拟自然睡眠以改善术后睡眠质量,尤其是能有效逆转手术当晚的睡眠剥夺情况,提高产妇睡眠效率,同时不引起产妇催乳素含量的变化。术后镇痛使用布托啡诺[3.00 μg/(kg·h)]复合Dex[0.05 μg/(kg·h)]时,产妇即使是在宫缩状态下的VAS评分仍显著降低,且术后镇痛过程中未见呼吸抑制、低血压、心动过缓以及恶心、呕吐等不良反应[24]。荟萃分析[25]结果表明,静脉镇痛泵曲马多复合Dex在镇痛效果和安全性方面优于单纯曲马多。NIE Y Y等[26]多中心研究结果显示,剖宫产术后使用舒芬太尼联合Dex可以显著提高镇痛效果,降低产妇术后不良反应的发生概率,还有助于产妇胃肠功能恢复。
3.2 神经阻滞与局部浸润麻醉镇痛
腹横肌平面阻滞是神经阻滞镇痛中最常用的方法,在腹横肌平面阻滞剂布比卡因中辅以0.5 μg/kg的Dex可以延长术后首次使用补救镇痛药物的时间,还可降低剖宫产后24 h内阿片类药物的用量[27-28]。BHARDWAJ S等[29]比较了单独使用局麻药和局麻药配伍Dex用于剖宫产切口皮下局部浸润麻醉的效果,结果显示局麻药配伍Dex可以更有效地减轻术后切口疼痛,减少术后额外镇痛需求,无明显不良反应。
3.3 硬膜外镇痛
硬膜外自控镇痛应用也较为广泛,在硬膜外镇痛泵中添加Dex不仅能较大程度缓解术后疼痛,也能缓解产妇焦虑症状,增加泌乳素的浓度,促进泌乳[30]。MO Y S等[31]观察术后硬膜外镇痛方式中添加Dex的镇痛效果及产妇不良反应发生情况,结果显示其镇痛效果显著,并可降低剖宫产术后恶心、呕吐和皮肤瘙痒发生率。
4. Dex在分娩镇痛中的应用
硬膜外镇痛作为分娩镇痛中最有效的镇痛方式,技术较为成熟,在保证母婴安全的前提下,可有效提高产妇诊疗舒适度。BRUMMETT C M等[32]通过动物研究发现, Dex通过阻断超极化激活阳离子电流以增加局麻药镇痛的持续时间,能够使镇痛的持续时间延长约75%; 同时,通过阻断动作电位中钠离子内流,可增强局麻药对细胞膜钠通道的阻滞作用,以增强镇痛强度。小剂量、低浓度罗哌卡因(0.125%)复合Dex(0.5 mg/kg)用于孕产妇安全、有效,能提高镇痛效果,稳定血液动力学,并且未出现运动阻滞、分娩过程延长等相关副反应[33]。WANGPING Z等[34]对分娩镇痛的最佳剂量的研究中发现,当0.1%罗哌卡因与Dex联合应用时, Dex用于硬膜外分娩镇痛的最佳浓度为0.5 μg/mL。CHENG Q J等[35]研究显示,低剂量罗哌卡因(0.08%)与0.5 μg/mL Dex合用时分娩镇痛效果较佳。0.1%罗哌卡因联合Dex用于分娩镇痛时能够缩短第1产程分娩时间,产妇未出现过度的镇静,无呼吸抑制等情况发生; 与芬太尼等阿片类药物相比,复合Dex不会引起皮肤瘙痒,同时能够减少阿片类药物引起的不良反应[4]。分娩镇痛泵中添加Dex后能观察到产妇VAS评分显著下降,同时还能减少硬膜外药物使用剂量。ZHANG W等[36]研究表明与0.5 μg/mL Dex合用时,罗哌卡因的EC50从0.083%降至0.062%。ABDALLA W等[37]研究证实Dex具有阿片样物质的保护作用,从而降低镇痛需要,瑞芬太尼联合Dex可使瑞芬太尼用量减少53.3%, 尤其是在第2产程中可显著降低镇痛药物需求。此外,Dex用于硬膜外分娩镇痛时,能够明显降低去甲肾上腺素等血浆儿茶酚胺水平,降低活化部分凝血活酶时间(APTT)及凝血酶原时间(PT), 改善分娩后高凝状态等[38]。
5. Dex对新生儿与产妇泌乳的影响
产科麻醉时用药极为慎重,多数麻醉药物对新生儿有不良影响,主要担忧在于药物对新生儿呼吸的抑制。《右美托咪定临床应用专家共识(2018)》中提到: “Dex的pH在5~7, 分子量较大(236 D), 与血浆蛋白结合率高达94%, 故Dex从血浆向乳汁转移的量非常少,再者口服生物利用度低,故经乳汁分泌对新生儿的影响可忽略。”[5]。通过测定乳汁中Dex浓度并计算相对婴儿摄取量时,结果显示所有婴儿摄取量均小于10%, 也未观察到新生儿出现中枢神经系统抑制[24]。Dex用于围产期不会影响产妇泌乳和产褥早期子宫复旧,甚至还可以促进催乳素分泌,并明显提前产后泌乳始动时间[39]。
6. 小结
目前, Dex应用于产科麻醉属超说明书用药,临床上通过椎管内和神经周围的给药方式也未被FDA批准,但国内外大量研究表明Dex用于产科麻醉在镇痛效果、预防各类不良反应以及增强分娩镇痛效果等方面都体现出优越性。随着医学研究的进步和发展, Dex应用于产科麻醉与镇痛的相关高质量研究会逐渐增多,涵盖临床麻醉的各个方面, Dex在产科麻醉与镇痛中必将拥有更广阔的应用前景。
-
表 1 基因的特异性引物信息表
引物名称 引物序列5′→3′ 扩增长度/bp URAHP 上游引物: AGGTGTCAATGAAGTTAGTGCCA 287 下游引物: ATCTTCCCAGCGAGATGTCC β-actin 上游引物: GTGGCCGAGGACTTTGATTG 73 下游引物: CCTGTAACAACGCATCTCATATT -
[1] 李冠琳, 杨慧霞. 子痫前期的发病机制及亚型分类[J]. 中华围产医学杂志, 2017, 20(12): 899-903. [2] XU Y, XIA X, JIANG Y, et al. Down-regulated lnc RNAAGAP2-AS1 contributes to pre-eclampsia as a competing endogenous RNA for JDP2 by impairing trophoblastic phenotype[J]. JCell Mol Med, 2020, 24(8): 4557-4568. doi: 10.1111/jcmm.15113
[3] ZHENG L L, HUANG J, SU Y, et al. Overexpression of tissue factor pathway inhibitor 2 attenuates trophoblast proliferation and invasion in preeclampsia[J]. Hum Cell, 2020, 33(3): 512-520. doi: 10.1007/s13577-020-00322-0
[4] ZHU H, KONG L. Lnc RNA CRNDE regulates trophoblast cell proliferation, invasion, and migration via modulating mi R-1277[J]. Am J Transl Res, 2019, 11(9): 5905-5918. http://www.ncbi.nlm.nih.gov/pubmed/31632559
[5] JIANG X, NING Q. Long noncoding RNAs as novel players in the pathogenesis of hypertension[J]. Hypertension Research, 2020, 43(7): 597-608. doi: 10.1038/s41440-020-0408-2
[6] HE T Q, QIAO Y, LV Y, et al. lncRNA FAM99A is downregulated in preeclampsia and exerts a regulatory effect on trophoblast cell invasion, migration and apoptosis[J]. Mol Med Rep, 2019, 20(2): 1451-1458. http://www.ncbi.nlm.nih.gov/pubmed/31173227
[7] ZHENG L L, ZHOU K R, LIU S, et al. dream Base: DNAmodification, RNA regulation and protein binding of expressed Pseudogenes in human health and disease[J]. Nucleic Acids Res, 2018, 46(D1): D85-D91. doi: 10.1093/nar/gkx972
[8] CHEN X, WAN L, WANG W, et al. Re-recognition of pseudogenes: From molecular to clinical applications[J]. Theranostics, 2020, 10(4): 1479-1499. doi: 10.7150/thno.40659
[9] SCAROLA M, COMISSO E, PASCOLO R, et al. Epigenetic silencing of Oct4 by a complex containing SUV39H1 and Oct4pseudogene lncRNA[J]. Nat Commun, 2015, 6: 7631. doi: 10.1038/ncomms8631
[10] GUO X Q, DENG L, DENG K Y, et al. Pseudogene PTENP1 suppresses gastric cancer progression by modulating PTEN[J]. Anticancer Agents Med Chem, 2016, 16(4): 456-464. doi: 10.2174/1871520615666150507121407
[11] SHIN E K, KANG H Y, YANG H, et al. The regulation of fatty acid oxidation in human preeclampsia[J]. Reprod Sci, 2016, 23(10): 1422-1433. doi: 10.1177/1933719116641759
[12] PATOUGHI M, GHAFOURI-FARD S, ARSANG-JANG S, et al. GAS8 and its naturally occurring antisense RNA as biomarkers in multiple sclerosis[J]. Immunobiology, 2019, 224(4): 560-564. doi: 10.1016/j.imbio.2019.04.005
[13] KAPUSTIN R V, DROBINTSEVA A O, ALEKSEENKOVA EN, et al. Placental protein expression of kisspeptin-1(KISS1)and the kisspeptin-1 receptor(KISS1R)in pregnancy complicated by diabetes mellitus or preeclampsia[J]. Arch Gynecol Obstet, 2020, 301(2): 437-445. doi: 10.1007/s00404-019-05408-1
[14] QIAO C, WANG C, ZHAO J, et al. Elevated expression of Ki SS-1 in placenta of Chinese women with early-onset preeclampsia[J]. PLo S One, 2012, 7(11): e48937. doi: 10.1371/journal.pone.0048937
-
期刊类型引用(8)
1. 姚艳琼,余涛,宁幢. 罗哌卡因复合右美托咪定硬脊膜穿破硬膜外阻滞在妊娠期高血压产妇分娩中的应用效果. 中国处方药. 2025(04): 76-79 .  百度学术
百度学术
2. 严冰,方付权,康仙慧,祝胜美. 右美托咪定在产科手术麻醉与分娩镇痛中的应用阐述. 现代医学与健康研究电子杂志. 2024(13): 135-138 .  百度学术
百度学术
3. 钟永灿,廖晓阳,陈桂培. 右美托咪定复合芬太尼和氟比洛芬酯用于剖宫产术后产妇自控静脉镇痛的效果. 中国医药科学. 2024(14): 85-88 .  百度学术
百度学术
4. 王志远,张舒依,韩孟阳,靳尧,赵林. 右美托咪定联合纳布啡在腹腔镜胆囊切除术全身麻醉中的效果及对患者苏醒期的影响. 中国药物滥用防治杂志. 2024(09): 1600-1604 .  百度学术
百度学术
5. 芮鹏. 右美托咪定改善患者苏醒期躁动发生的研究进展. 中国城乡企业卫生. 2023(03): 38-40 .  百度学术
百度学术
6. 刘海涛,田利川,赵贺,王圣华,李亚华. 右美托咪定复合布托啡诺对超重、肥胖经产妇分娩镇痛效果的影响. 西部医学. 2023(05): 715-718+723 .  百度学术
百度学术
7. 谭燕,何芳,钟长云. 右美托咪定对剖宫产手术麻醉及术后镇痛的效果分析. 河北医药. 2022(04): 539-542 .  百度学术
百度学术
8. 李红燕. 右美托咪定对产科椎管内麻醉术后寒战效果评定. 中国医药指南. 2022(32): 82-84 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
