Predictive value of umbilical vein blood brain-derived neurotrophic factor level for brain injury of neonates delivered by the pregnant with gestational diabetes mellitus
-
摘要:目的 探讨妊娠期糖尿病(GDM)孕妇分娩的新生儿脐血脑源性神经营养因子水平(BDNF)对脑损伤的预测价值。方法 选择92例GDM足月分娩产妇为观察组,同期选择健康产妇80例为对照组。基于产后3 d颅脑超声、核磁共振成像(MRI)结合新生儿行为神经测定(NBNA)评分对新生儿是否发生脑损伤进行判定。采用酶联免疫分析(ELISA)法检测各组新生儿BDNF水平,比较观察组、对照组新生儿脑损伤发生率。采用受试者工作特征(ROC)曲线评估BDNF对GDM孕妇分娩的新生儿合并脑损伤的预测价值。结果 观察组新生儿脑损伤发生率及脐静脉血BDNF水平均高于对照组,新生儿NBNA评分低于对照组,差异有统计学意义(P < 0.05)。观察组脑损伤新生儿脐静脉血BDNF水平高于非脑损伤新生儿,NBNA评分低于非脑损伤新生儿,差异有统计学意义(P < 0.05)。对照组脑损伤、非脑损伤新生儿脐静脉血BDNF水平、NBNA评分比较,差异无统计学意义(P>0.05)。BDNF水平为13.8 μg/L时,约登指数最大,数值为0.346,此时曲线下面积为0.732,灵敏度及特异度分别为79.71%、55.86%。结论 GDM产妇足月分娩新生儿发生脑损伤的风险明显增高,早期检测脐静脉血BDNF水平对预测脑损伤的发生具有较好的预测性。Abstract:Objective To investigate the predictive value of umbilical vein blood brain-derived neurotrophic factor(BDNF) level for brain injury of neonates delivered by the pregnant with gestational diabetes mellitus(GDM).Methods A total of 92 full-term birth pregnant women with GDM were selected as observation group, while 80 healthy pregnant women were selected as control group. Based on the result of brain ultrasound, magnetic resonance imaging (MRI) and neonatal behavioral neuroassay (NBNA) score at 3 days postpartum, the neonatal brain injury conditions were determined. The umbilical vein blood BDNF levels were measured by enzyme-linked immunoassay (ELISA). The incidence of brain injury was compared between the observation group and the control group. The predictive value of cord blood BDNF for brain injury in full-term newborns was evaluated by Receiver Operating Characteristics (ROC) curve.Results The incidence of neonatal brain injury, and BDNF level in neonatal cord blood in the observation group were significantly higher than those in the control group (P < 0.05). The neonatal NBNA score in the observation group was significantly lower than that in the control group (P < 0.05). In observation group, the level of BDNF in neonatal cord blood of the brain injury neonates was higher, and the neonatal NBNA score in the brain injury group was lower than that in the non-brain injury ones (P < 0.05). There were no differences in BDNF level and NBNA score of brain injury between brain injury neonates and non-brain injury newborns in the control group (P>0.05). When the BDNF level was 13.8 μg/L, the Yodeng index was the highest, with its value of 0.346 and the area under the curve was 0.732, with sensitivity and specificity of 79.71% and 55.86%, respectively.Conclusion The risk of brain injury in the full-term newborns delivered by GDM mothers is higher, early detection of BDNF in umbilical vein blood has a good accuracy in predicting the occurrence of brain injury.
-
新生儿脑损伤是围产期常见的严重并发症,主要由宫内缺氧、羊水异常、产道挤压伤、产后窒息、低体质量等原因引起[1]。研究[2-3]发现,妊娠期糖尿病(GDM)产妇无论是阴道分娩还是剖宫产、足月产、早产儿均有较高的脑损伤发生率,多认为与高糖直接毒性作用有关,但缺乏直接的动物模型理论支持,且具体机制不清楚。此外,新生儿脑损伤的临床诊断主要依靠颅脑超声、CT或磁共振成像、脑电图以及新生儿行为神经测定(NBNA)评分进行综合判断[4-5], 具有较大的滞后性,不能及时发现产后脑损伤患儿或高危儿。尽管有研究[6-7]提出,寻找神经元特异性烯醇化酶(NSE)、S100B蛋白等敏感性生化标志物作为诊断依据,但是缺乏大样本数据和循证医学证据,尚不能在临床中推广应用。新生儿脐带是连接母体与胎儿进行物质交换的唯一通道,母体的高糖环境也可能通过脐血对胎儿产生直接影响[8]。脑源性神经营养因子(BDNF)广泛分布于中枢神经系统,具有较好的组织特异性[9], 在正常生理情况下主要发挥维持神经生长、损伤修复、突触连接、递质释放以及神经功能表达等作用[10]。创伤性脑损伤发生时,血脑屏障结构和功能被破坏,可释放大量BDNF入血而易被检测,与创伤性脑损伤的发生和严重程度往往具有较高的一致性[11]。本研究探讨GDM产妇分娩的新生儿脑损伤的发生风险,并通过检测脐静脉血BDNF水平预测脑损伤的发生率,现报告如下。
1. 资料与方法
1.1 一般资料
选择2019年2月—2020年2月入院足月分娩的92例GDM产妇为观察组,同期选择非GDM健康产妇80例为对照组。纳入标准: 符合GDM诊断标准者[12]; 自然妊娠者; 孕妇合并严重基础疾病或除GDM外的其他妊娠并发症、宫内感染、宫内窘迫、产时窒息; 胎盘早剥、胎盘老化、发育不良者; 有不良生育史者; 辅助生殖技术妊娠者; 双胎或多胎产妇。排除标准: 产妇有妊娠期并发症; 围生期窒息缺氧新生儿; 新生儿有遗传代谢性疾病、神经系统畸形及其他系统严重畸形。2组产妇和新生儿一般临床资料比较,差异无统计学意义(P>0.05), 具有可比性。见表 1。
表 1 2组一般临床资料比较(x±s)[n(%)]临床资料 观察组(n=92) 对照组(n=80) 产妇年龄/岁 25.6±3.2 26.7±3.4 孕周/周 38.9±1.2 38.6±0.1 初产妇 55(59.8) 45(56.2) 经产妇 37(40.2) 35(43.8) 体质量指数/(kg/m2) 26.5±2.3 26.9±2.4 顺产 63(68.5) 53(66.3) 剖宫产 29(31.5) 27(33.7) 平均动脉压/mmHg 75.6±4.3 74.2±3.6 胆固醇/(mmol/L) 6.2±1.1 6.4±1.3 男性新生儿 50(54.3) 43(53.8) 女性新生儿 42(45.7) 37(46.2) 新生儿出生体质量/g 3 425.0±236.0 3 528.0±347.0 新生儿1 min Apgar评分/分 9.1±0.5 9.3±0.6 新生儿出生血糖/(mmol/L) 5.5±1.1 5.6±1.1 1.2 研究方法
针对GDM产妇血糖水平高于11.1 mmol/L或出现糖尿病并发症的产妇,应积极控制血糖在正常范围。根据胎儿宫内发育、产程、产道结构以及产妇意愿综合评估顺产或剖宫产情况。
全部孕妇分娩即刻采集新生儿脐静脉血检测BDNF水平,根据新生儿产后3 d颅脑超声或核磁共振成像(MRI)结合NBNA评分确诊是否发生脑损伤[13], 比较健康孕妇、GDM孕妇新生儿脑损伤发生率。采集6 mL脐静脉血置于抗凝管中, BDNF检测采用酶联免疫分析(ELISA)法,操作步骤严格按说明书由专人完成,试剂购自美国Sigma公司,每例样本分别检测3次并取平均值。确诊为脑损伤的患儿应积极进行临床干预,如吸氧、保温箱管理、神经康复、营养神经药物治疗等。
1.3 统计学处理
采用SPSS 20.0软件进行统计检验,符合正态分布的计量资料以(x±s)表示, 2组比较采取LSD-t检验。非正态分布的计量资料用M(P25, P75)表示, 2组比较采用Mann-WhitneyU检验。计数资料采取百分数表示, 2组比较χ2检验。绘制受试者工作特征曲线(ROC)评估BDNF对新生儿脑损伤的预测价值。所有统计分析均以α=0.05作为检验水准。P < 0.05为差异有统计学意义。
2. 结果
2.1 观察组和对照组新生儿脑损伤发生率、BDNF水平及NBNA评分比较
观察组新生儿脑损伤发生率及脐静脉血BDNF水平均高于对照组,差异有统计学意义(t=2.923, P=0.004); 观察组新生儿NBNA评分低于对照组,差异有统计学意义(t=2.542, P=0.014)。见表 2。
表 2 2组新生儿脑损伤、脐静脉血BDNF水平、NBNA评分比较(x±s)M(P25, P75)[n(%)]组别 n 脑损伤 BDNF/(μg/L) NBNA/分 观察组 92 11(11.96)* 10.9(7.7, 11.2)* 33.27±8.23* 对照组 80 3(3.75) 8.1(3.5, 14.6) 38.34±9.16 BDNF: 脑源性神经营养因子; NBNA: 新生儿行为神经测定。与对照组比较, *P < 0.05。 2.2 2组脑损伤、非脑损伤新生儿脐静脉血BDNF水平、NBNA评分比较
BDNF水平为非正态分布,采用Mann-Whitney U检验; NBNA评分为正态分布,采用LSD-t检验。观察组脑损伤新生儿脐静脉血BDNF水平高于非脑损伤新生儿,差异有统计学意义(P < 0.05), 脑损伤新生儿NBNA评分低于非脑损伤新生儿,差异有统计学意义(P < 0.05)。对照组脑损伤新生儿脐静脉血BDNF水平高于非脑损伤新生儿,脑损伤新生儿NBNA评分低于非脑损伤新生儿,但差异无统计学意义(P>0.05)。见表 3。
表 3 2组脑损伤、非脑损伤新生儿脐静脉血BDNF水平、NBNA评分比较脑损伤情况 观察组 对照组 BDNF/(μg/L) NBNA/分 BDNF/(μg/L) NBNA/分 脑损伤 14.1(12.0, 14.8)* 31.07±6.67* 8.3(5.0, 9.6) 37.71±6.41 非脑损伤 7.6(4.8, 10.1) 35.61±7.35 7.9(4.3, 8.8) 39.56±5.88 BDNF: 脑源性神经营养因子; NBNA: 新生儿行为神经测定。 2.3 BDNF对GDM孕妇新生儿脑损伤的预测价值
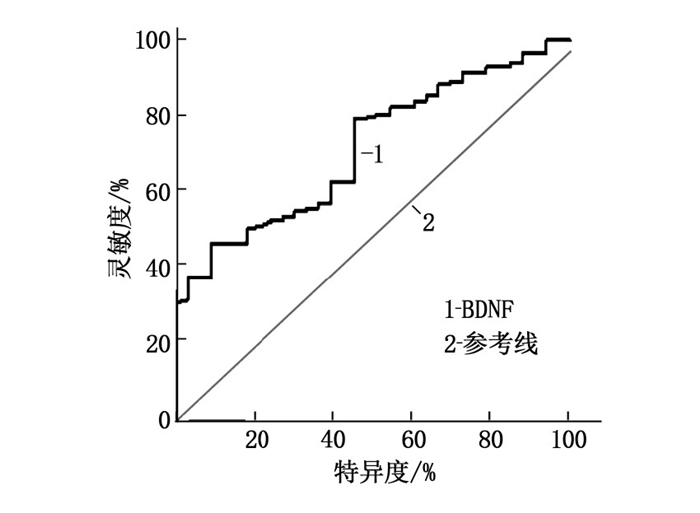
ROC曲线结果显示, BDNF水平为13.8 μg/L时,约登指数最大为0.346, 此时曲线下面积为0.732(95% CI: 0.646~0.805), 灵敏度及特异度分别为79.71%、55.86%。见图 1。
3. 讨论
SHU X等[14]研究指出,BDNF能够抑制脑缺血后葡萄糖不耐受的发生。BDNF通过与其高亲和力受体原肌球蛋白受体激酶B(TrkB)结合,在促进神经元存活、突触可塑性和记忆功能方面发挥着关键作用[15]。BDNF属于神经营养素家族成员,是目前研究最成熟的一类分子,主要由神经元和神经胶质细胞分泌的内源性肽构成,主要生物学功能是调节整个中枢神经系统的功能、生存和发育,尤其具有调节突触可塑性、保护神经元免受氧化应激和凋亡损伤等功能[16]。新生儿脑损伤的发生可能与BDNF表达异常或功能障碍密不可分。
本研究结果显示,观察组新生儿脑损伤发生率高于对照组,说明GDM是诱导新生儿脑损伤发生的重要不利因素,推测可能是因为高糖环境可直接对脑组织产生毒性作用,或者通过糖基化产物作用于脑组织,影响神经元细胞的生存、诱导细胞缺氧性损害[17]。本研究也显示,观察组脑损伤患儿BDNF水平高于非脑损伤新生儿,这提示脐血BDNF水平与新生儿脑损伤的发生具有相关性,因此在GDM孕妇分娩时检测脐血BDNF水平对评估新生儿是否发生脑损伤具有一定的临床价值。对正常孕妇分娩的脑损伤与非脑损伤新生儿进行分析, 2组脐静脉血BDNF水平、NBNA评分比较,差异无统计学意义(P>0.05), 提示脑损伤新生儿脐静脉血BDNF水平升高可能与母体高血糖环境存在一定相关性,但具体原因尚不完全清楚,需要进一步研究验证。
NBNA是一种综合性行为神经检查方法,用于评价新生儿行为能力、神经反射及状态,广泛用于早期发现新生儿脑损伤的行为神经异常情况[18-19]。SULLIVAN S等[20]通过研究发现,缺氧缺血性脑病患儿的NBNA评分越低,脑损害越严重。荣昆等[21]对80例妊娠期糖尿病孕妇分娩的新生儿NBNA评分结果发现,妊娠期糖尿病新生儿NBNA评分低,脑电图有显著异常。本研究表明,妊娠期糖尿病孕妇分娩的新生儿NBNA评分较对照组偏低,提示新生儿存在神经行为落后情况,可能存在脑损伤。
本研究采用ROC曲线分析了BDNF对GDM新生儿脑损伤的预测价值,结果显示, BDNF预测新生儿脑损伤发生的准确度为较高,为临床采用脐静脉血检测BDNF水平预测新生儿脑损伤的发生提供了数据支持,但需进一步扩大样本量建立更精确的参考值以指导临床应用。
综上所述, GDM产妇足月分娩新生儿发生脑损伤的风险明显升高,早期检测脐静脉血BDNF水平对预测脑损伤的发生具有较高的预测性。本研究的不足之处在于样本量较小,新生儿脑损伤例数较少,还需要进一步扩大样本量来证实该研究结果。
-
表 1 2组一般临床资料比较(x±s)[n(%)]
临床资料 观察组(n=92) 对照组(n=80) 产妇年龄/岁 25.6±3.2 26.7±3.4 孕周/周 38.9±1.2 38.6±0.1 初产妇 55(59.8) 45(56.2) 经产妇 37(40.2) 35(43.8) 体质量指数/(kg/m2) 26.5±2.3 26.9±2.4 顺产 63(68.5) 53(66.3) 剖宫产 29(31.5) 27(33.7) 平均动脉压/mmHg 75.6±4.3 74.2±3.6 胆固醇/(mmol/L) 6.2±1.1 6.4±1.3 男性新生儿 50(54.3) 43(53.8) 女性新生儿 42(45.7) 37(46.2) 新生儿出生体质量/g 3 425.0±236.0 3 528.0±347.0 新生儿1 min Apgar评分/分 9.1±0.5 9.3±0.6 新生儿出生血糖/(mmol/L) 5.5±1.1 5.6±1.1 表 2 2组新生儿脑损伤、脐静脉血BDNF水平、NBNA评分比较(x±s)M(P25, P75)[n(%)]
组别 n 脑损伤 BDNF/(μg/L) NBNA/分 观察组 92 11(11.96)* 10.9(7.7, 11.2)* 33.27±8.23* 对照组 80 3(3.75) 8.1(3.5, 14.6) 38.34±9.16 BDNF: 脑源性神经营养因子; NBNA: 新生儿行为神经测定。与对照组比较, *P < 0.05。 表 3 2组脑损伤、非脑损伤新生儿脐静脉血BDNF水平、NBNA评分比较
脑损伤情况 观察组 对照组 BDNF/(μg/L) NBNA/分 BDNF/(μg/L) NBNA/分 脑损伤 14.1(12.0, 14.8)* 31.07±6.67* 8.3(5.0, 9.6) 37.71±6.41 非脑损伤 7.6(4.8, 10.1) 35.61±7.35 7.9(4.3, 8.8) 39.56±5.88 BDNF: 脑源性神经营养因子; NBNA: 新生儿行为神经测定。 -
[1] 甘斌, 杨树杰, 易海英, 等. 糖尿病母亲婴儿脑损伤高危因素分析[J]. 中华实用诊断与治疗杂志, 2014, 28(12): 1246-1248. https://www.cnki.com.cn/Article/CJFDTOTAL-HNZD201412045.htm [2] 范伟, 郝丽, 殷其改, 等. 妊娠期糖尿病母亲分娩新生儿的脐血血清S100B蛋白、caspase-3蛋白含量与新生儿行为神经测定评分的相关性研究[J]. 中华妇幼临床医学杂志: 电子版, 2017, 13(2): 189-193. doi: 10.3877/cma.j.issn.1673-5250.2017.02.012 [3] 张应金, 梁凤潇, 苏永棉, 等. 妊娠期糖尿病母亲新生儿脐血S100B蛋白、GFAP和NSE值对新生儿脑损伤的临床意义[J]. 现代诊断与治疗, 2017, 28(7): 1183-1185. doi: 10.3969/j.issn.1001-8174.2017.07.005 [4] 唐亚娟, 赖为柽, 曾飘逸, 等. 实时剪切波弹性成像评价新生儿脑损伤的临床研究[J]. 临床超声医学杂志, 2020, 22(1): 61-63. https://www.cnki.com.cn/Article/CJFDTOTAL-LCCY202001026.htm [5] 王桂芳, 王艳蕊, 张玉. 血糖异常足月新生儿血清S100-β蛋白水平和振幅整合脑电图变化及其临床意义[J]. 新乡医学院学报, 2020, 37(1): 87-90. https://www.cnki.com.cn/Article/CJFDTOTAL-XXYX202001023.htm [6] 刘小晓, 张晓英. 血清NSE及aEEG动态变化早期预测窒息新生儿脑损伤的意义[J]. 江苏大学学报: 医学版, 2020, 30(2): 154-159, 164. https://www.cnki.com.cn/Article/CJFDTOTAL-ZJYZ202002013.htm [7] 江余明, 曾峰, 李志鸿. 神经元特异性烯醇化酶在新生儿脑损伤中的应用进展[J]. 国际儿科学杂志, 2018, 45(1): 39-43. doi: 10.3760/cma.j.issn.1673-4408.2018.01.011 [8] 张琦, 姜泓, 冯慧玲. 新生儿脑损伤生物标志物研究进展[J]. 新乡医学院学报, 2019, 36(10): 990-995, 1000. https://www.cnki.com.cn/Article/CJFDTOTAL-XXYX201910022.htm [9] 郭晓玥, 邵珲, 王妍, 等. 脑组织S100B蛋白及脑源性神经营养因子对胎鼠宫内脑损伤的预测价值[J]. 实用妇产科杂志, 2017, 33(9): 670-674. https://www.cnki.com.cn/Article/CJFDTOTAL-SFCZ201709014.htm [10] 陈梅花, 陈贵珍, 贾万钧, 等. 大鼠弥漫性脑损伤后脑源性及胶质细胞源性神经营养因子时序性表达的实验研究[J]. 中国医药导报, 2014, 11(19): 17-20, 169. https://www.cnki.com.cn/Article/CJFDTOTAL-YYCY201419007.htm [11] 张利超, 张强. 颅脑损伤后BDNF及其小分子模拟物的治疗潜力[J]. 中国临床神经外科杂志, 2018, 23(11): 757-759. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGLC201811022.htm [12] 中华医学会妇产科分会产科学组. 妊娠合并糖尿病诊治指南(2014)[J]. 中华妇产科杂志, 2014, 49(8): 561-569. doi: 10.3760/cma.j.issn.0529-567x.2014.08.001 [13] 郭晓燕, 袁丽君, 张海霞. 新生儿低血糖性脑损伤MRI诊断与预后评估[J]. 中国实用神经疾病杂志, 2017, 20(12): 67-68. doi: 10.3969/j.issn.1673-5110.2017.12.025 [14] SHU X, ZHANG Y, XU H, et al. Brain-derived neurotrophic factor inhibits glucose intolerance after cerebral ischemia[J]. Neural Regen Res, 2013, 8(25): 2370-2378.
[15] 王静, 郑荣秀. BDNF修饰的骨髓间充质干细胞对缺氧缺血性脑损伤大鼠脑区BDNF/TrkB信号通路表达的影响与意义[J]. 中国妇幼保健, 2019, 34(7): 1656-1659. https://www.cnki.com.cn/Article/CJFDTOTAL-ZFYB201907066.htm [16] YU K W, WANG C J, WU Y, et al. An enriched environment increases the expression of fibronectin typeⅢdomaincontaining protein 5 and brain-derived neurotrophic factor in the cerebral cortex of the ischemic mouse brain[J]. Neural Regen Res, 2020, 15(9): 1671-1677. doi: 10.4103/1673-5374.276339
[17] 文丹, 陈勇. 脑源性神经营养因子基因多态性与妊娠糖尿病及新生儿早产的关系[J]. 临床和实验医学杂志, 2019, 18(13): 1397-1401. doi: 10.3969/j.issn.1671-4695.2019.13.015 [18] BYRNE E, CAMPBELL S K. Physical therapy observation and assessment in the neonatal intensive care unit[J]. Phys Occup Ther Pediatric, 2013, 33(1): 39-74. doi: 10.3109/01942638.2012.754827
[19] VOIGT B, BRANDL A, PIETZ J, et al. Negative reactivity in toddlers born prematurely: indirect and moderated pathways considering selfregulation, neonatal distress and parenting stress[J]. Infant Behav Dev, 2013, 36(1): 124-138. doi: 10.1016/j.infbeh.2012.11.002
[20] SULLIVAN S, FRIESS SH, RALSTON J, et al. Behavioral deficits and axonal injury persistence after rotational head injury are direction dependent[J]. J Neurotrauma, 2013, 30(7): 538-545. http://europepmc.org/articles/PMC3636580/
[21] 荣昆, 高缨. 妊娠期糖尿病对围生期新生儿神经行为发育的影响[J]. 中国妇幼保健, 2015, 30(20): 3353-3355. https://www.cnki.com.cn/Article/CJFDTOTAL-ZFYB201520010.htm -
期刊类型引用(5)
1. 曾秋莹,方丽珊,许青,黄丽媛. 妊娠期糖尿病母亲新生儿脐血膜联蛋白A7水平与脑损伤的相关性研究. 中国现代药物应用. 2024(02): 70-72 .  百度学术
百度学术
2. 孙大权,王鑫. 早产儿脑损伤高危因素分析与前瞻性队列建立研究. 现代医学与健康研究电子杂志. 2023(15): 17-20 .  百度学术
百度学术
3. 杨菊荣,王菊霞,刘艳,卢晓丽,柴瑞峰. 神经功能指标联合磷酸酶和张力蛋白同源物检测对重型颅脑损伤患者预后的预测价值. 陕西医学杂志. 2023(11): 1593-1597 .  百度学术
百度学术
4. 黄晓靖,肖玲玲. 营养治疗对妊娠期糖尿病孕妇血糖控制、妊娠结局的影响研究. 糖尿病新世界. 2022(21): 192-195 .  百度学术
百度学术
5. 李大爽,唐正荣,杨伟丽,刘漫君,刘凤年,邓毅. GDM孕妇分娩新生儿脐血IGF-1及BDNF 表达与脑损伤的相关性研究. 华夏医学. 2022(06): 28-34 .  百度学术
百度学术
其他类型引用(4)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
