Retroperitoneal leiomyosarcoma involving the renal vein and inferior vena cava: a case report
-
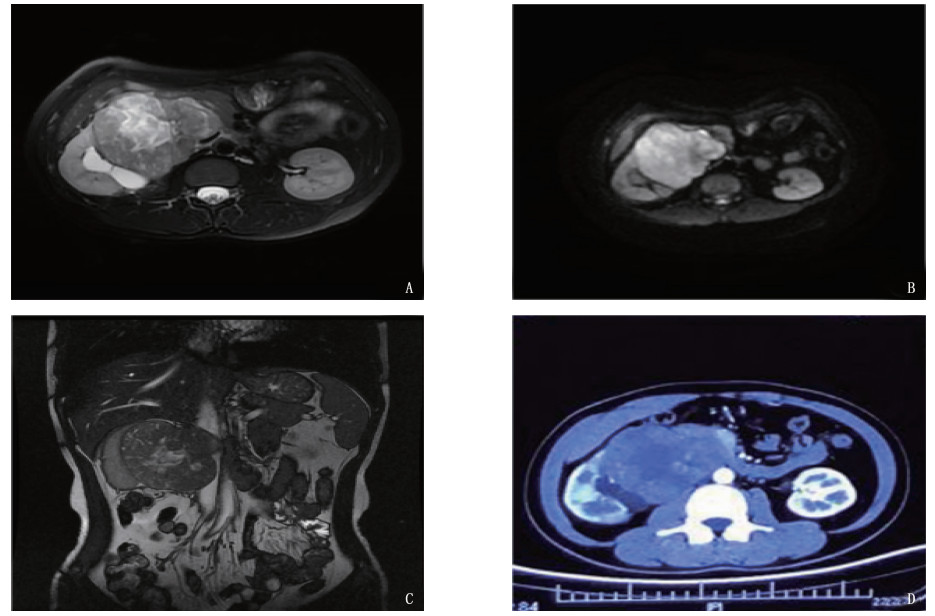
摘要: 1例32岁女性患者因右侧间断性腰痛入院,影像学检查提示,腹膜后占位,压迫右肾、下腔静脉。患者行右肾根治性切除术联合下腔静脉人造血管移植术,术后病理检查显示为腹膜后平滑肌肉瘤,术后予以多柔比星、环磷酰胺、顺铂化疗。术后复查见下腔静脉血栓形成,予利伐沙班抗凝治疗。随访半年无不适、复发或转移。Abstract: A 32-year-old female patient was admitted to hospital due to intermittent right pain in waist. Imaging findings revealed a retroperitoneal space occupying which compressed right kidney and inferior vena cava. Radical nephrectomy combined with artificial vascular transplantation were performed. Pathological examination confirmed as retroperitoneal leiomyosarcoma. Chemotherapy of doxorubicin, cyclophosphamide and cisplatin in combination was used after surgery. Rivaroxaban was given for anticoagulation due to inferior vena cava thrombosis during the follow-up. No discomfort, recurrence or metastasis were found after half a year follow-up.
-
Keywords:
- retroperitoneal sarcoma /
- leiomyosarcoma /
- inferior vena cava
-
隐球菌是一种广泛存在于周围环境的机会致病菌,尤其是被鸽粪污染的土壤中[1], 其中人类可感染的隐球菌主要为新生隐球菌和格特隐球菌。隐球菌病最早于1894年被发现,目前已成为全球性分布的侵袭性真菌病(IFP)[2]。近年来,由于化疗、器官移植免疫抑制治疗的广泛应用和人类免疫缺陷病毒感染的流行,新生隐球菌的感染率明显上升[3]。随着新生隐球菌耐药性的上升[4-5], 新生隐球菌感染已成为全球性的公共卫生问题,每年可造成100多万人感染和约60万人死亡[6], 因此临床亟需探寻新的抗真菌药物靶点。
噻苯达唑(TBZ)既是真核生物微管蛋白抑制剂(可破坏微管的定位和抑制其组装)[7], 也是延胡索酸还原酶抑制剂(可影响真核细胞内线粒体氧化呼吸链),理论上具有驱虫及抗真菌作用[8]。本研究参照美国临床实验室标准化研究所(CLSI)颁布的M27-A3方案,测定TBZ和抗真菌药物氟康唑(FLU)、两性霉素B(AMB)、泊沙康唑(POS)、伊曲康唑(ITR)、伏立康唑(VOR)单独应用对20株新生隐球菌临床株的最低抑菌浓度(MIC),并观察TBZ分别联合FLU、AMB、POS、ITR、VOR对新生隐球菌的体外协同抑菌效果,现报告如下。
1. 材料与方法
1.1 材料
1.1.1 实验菌株
本研究选用荆州市中心医院真菌实验室保存的20株新生隐球菌临床株进行实验,菌株均已进行形态学和分子生物学鉴定,且实验开始前使用沙堡式琼脂培养基活化2~3 d(37 ℃)。药敏试验应用近平滑念珠菌ATCC22019作为质控菌株。
1.1.2 药物
TBZ(批号148-79-8, 纯度>99%)、AMB(批号1397-89-3, 纯度≥98%)、POS(批号171228-49-2, 纯度>99%)、FLU(批号86386-73-4, 纯度>99%)、VOR(批号137234-62-9, 纯度>99%)和ITR(批号84625-61-6, 纯度>99%), 均购自Selleck公司。将上述药物用二甲亚砜(DMSO)配置并保存,浓度均为1 600 μg/mL。
1.2 方法
1.2.1 菌液和药液制备
参照CLSI M27-A3方案中推荐的方法配制培养基,将经过三氮吗啡啉丙磺酸钠缓冲(pH值7.0)的RPMI 1640液体培养液过滤灭菌。用无菌0.9%氯化钠注射液收集新生隐球菌孢子,用血细胞计数板调整孢子量为(1~5)×106 CFU/mL, 然后用RPMI 1640液体培养液稀释1 000倍,最后得到的菌液浓度为(1~5)×103 CFU/mL。TBZ用倍比稀释法配制7个浓度梯度且浓度为0.5~32.0 μg/mL, FLU、POS、AMB、VOR和ITR用倍比稀释法配制8个浓度梯度且浓度均为0.062 5~8.000 0 μg/mL。
1.2.2 药敏试验
联合药敏试验采用棋盘法,将菌液和2种药物分别加入96孔培养板中[9]。首列(首行)第1孔作为生长对照孔(无药物孔),第2~8行浓度依次递增地加入TBZ 50 μL, 每行9孔,第2~9列浓度依次递增加入1种抗真菌药物50 μL, 每列8孔,再向生长对照孔和有药液的孔加入100 μL菌液,最后向第1列的1~8孔和第1行的1~9孔加入RPMI 1640液体培养液50 μL, 每1种菌液均使用5个96孔培养板,将TBZ分别与FLU、POS、AMB、VOR、ITR中的1种采用上述棋盘法操作后置于培养箱培养24 h后观察结果。
1.2.3 MIC测定和分数抑菌浓度指数(FICI)计算
除AMB的MIC是与生长对照孔相比100%生长抑制所对应的最低浓度外,其余药物的MIC是与生长对照孔相比50%生长抑制所对应的最低浓度,读取各药物单独和联合用药时的MIC。FICI指联合用药时各药MIC值除以单独用药时MIC值的商之和,即FICI=MICA联合/MICA单独+MICB联合/MICB单独。FICI < 0.50为协同关系, 0.50~4.00为无关, >4.00为拮抗关系。
2. 结果
本研究观察TBZ和5种抗真菌药物单独应用对新生隐球菌的MIC后发现, TBZ对新生隐球菌菌株的MIC为8.0~32.0 μg/mL, 表明TBZ具有一定的抗新生隐球菌作用; 抗真菌药物AMB、FLU、ITR、POS、VOR单独应用对新生隐球菌菌株的MIC分别为0.250 0~8.000 0、1.000 0~8.000 0、0.062 5~2.000 0、0.062 5~4.000 0、0.062 5~1.000 0 μg/mL, 提示新生隐球菌对VOR最为敏感,对AMB、FLU的敏感性较低,见表 1。
表 1 TBZ和5种抗真菌药物单独应用对20株新生隐球菌的体外抑菌效果菌株编号 MIC/(μg/mL) TBZ AMB FLU ITR POS VOR 5338 16.0 0.250 0 2.000 0 0.062 5 0.250 0 0.062 5 5781 16.0 0.500 0 4.000 0 0.062 5 0.062 5 0.062 5 7109 8.0 0.500 0 8.000 0 2.000 0 1.000 0 0.125 0 7394 8.0 1.000 0 1.000 0 0.062 5 0.062 5 0.062 5 7764 8.0 0.500 0 2.000 0 0.500 0 0.250 0 0.062 5 7789 32.0 8.000 0 1.000 0 0.062 5 0.062 5 0.062 5 7906 16.0 0.500 0 8.000 0 1.000 0 1.000 0 0.062 5 8026 8.0 0.250 0 4.000 0 0.062 5 0.062 5 0.062 5 8061 16.0 0.250 0 1.000 0 0.500 0 0.250 0 0.062 5 G4 32.0 0.500 0 8.000 0 1.000 0 2.000 0 1.000 0 G5 32.0 4.000 0 2.000 0 2.000 0 2.000 0 0.500 0 G6 8.0 4.000 0 2.000 0 0.062 5 0.062 5 0.062 5 G8 16.0 1.000 0 8.000 0 0.062 5 0.062 5 0.062 5 G9 8.0 0.500 0 2.000 0 1.000 0 1.000 0 0.125 0 G10 32.0 8.000 0 8.000 0 1.000 0 4.000 0 1.000 0 G11 16.0 8.000 0 4.000 0 0.250 0 0.500 0 0.125 0 G12 8.0 1.000 0 4.000 0 0.062 5 0.062 5 0.062 5 Z1 8.0 1.000 0 1.000 0 0.250 0 0.250 0 0.062 5 Z2 8.0 0.500 0 2.000 0 0.500 0 0.500 0 0.062 5 Z3 8.0 4.000 0 4.000 0 1.000 0 0.250 0 0.062 5 MIC: 最低抑菌浓度; TBZ: 噻苯达唑; AMB: 两性霉素B; FLU: 氟康唑; ITR: 伊曲康唑; POS: 泊沙康唑; VOR: 伏立康唑。 联合药敏试验结果显示, TBZ与抗真菌药物联合应用可将抗真菌药物对新生隐球菌的MIC降低2~4倍, TBZ与AMB联合应用对7株新生隐球菌有协同作用, TBZ与FLU联合应用对8株新生隐球菌有协同作用, TBZ与ITR联合应用对4株新生隐球菌有协同作用, TBZ与POS联合应用对5株新生隐球菌有协同作用, TBZ与VOR联合应用对1株新生隐球菌有协同作用,见表 2。
表 2 TBZ分别联合5种抗真菌药物对新生隐球菌的体外抑菌效果菌株编号 TBZ联合AMB TBZ联合FLU TBZ联合ITR TBZ联合POS TBZ联合VOR TBZ MIC/(μg/mL) AMB MIC/(μg/mL) FICI TBZ MIC/(μg/mL) FLU MIC/(μg/mL) FICI TBZ MIC/(μg/mL) ITR MIC/(μg/mL) FICI TBZ MIC/(μg/mL) POS MIC/(μg/mL) FICI TBZ MIC/(μg/mL) VOR MIC/(μg/mL) FICI 5338 8.0 0.062 5 0.75 1.0 0.500 0 0.31 0.5 0.062 5 1.03 1.0 0.062 5 0.31 0.5 0.062 5 1.03 5781 16.0 0.062 5 1.13 1.0 0.250 0 0.13 0.5 0.062 5 1.03 2.0 0.062 5 1.13 0.5 0.062 5 1.03 7109 8.0 0.062 5 1.13 8.0 0.062 5 1.01 8.0 0.062 5 1.03 1.0 0.250 0 0.38 0.5 0.125 0 1.06 7394 8.0 0.062 5 1.06 0.5 0.250 0 0.31 0.5 0.062 5 1.06 0.5 0.062 5 1.06 0.5 0.062 5 1.06 7764 8.0 0.125 0 1.25 1.0 0.250 0 0.25 1.0 0.125 0 0.38 1.0 0.125 0 0.63 0.5 0.062 5 1.06 7789 4.0 0.062 5 0.13 0.5 0.250 0 0.27 0.5 0.062 5 1.02 0.5 0.062 5 1.02 0.5 0.062 5 1.02 7906 2.0 0.062 5 0.25 16.0 0.062 5 1.01 8.0 0.250 0 0.75 8.0 0.062 5 0.56 4.0 0.062 5 1.25 8026 2.0 0.125 0 0.75 8.0 0.062 5 1.02 0.5 0.062 5 1.06 0.5 0.062 5 1.06 0.5 0.062 5 1.06 8061 0.5 0.062 5 0.28 4.0 0.500 0 0.75 1.0 0.125 0 0.31 0.5 0.125 0 0.53 0.5 0.062 5 1.03 G4 8.0 0.062 5 0.38 0.5 8.000 0 1.02 8.0 0.500 0 0.75 2.0 0.500 0 0.31 0.5 1.000 0 1.02 G5 2.0 1.000 0 0.31 4.0 2.000 0 1.13 8.0 1.000 0 0.75 0.5 1.000 0 0.52 4.0 0.250 0 0.63 G6 0.5 0.062 5 0.08 8.0 0.125 0 1.06 0.5 0.062 5 1.06 0.5 0.062 5 1.06 0.5 0.062 5 1.06 G8 8.0 0.062 5 0.56 2.0 0.125 0 0.14 0.5 0.062 5 1.03 0.5 0.062 5 1.03 0.5 0.062 5 1.03 G9 8.0 0.062 5 1.13 8.0 0.062 5 1.03 8.0 0.062 5 1.06 2.0 0.062 5 0.31 0.5 0.062 5 0.56 G10 2.0 0.125 0 0.08 2.0 4.000 0 0.56 4.0 0.250 0 0.38 1.0 0.500 0 0.16 0.5 0.125 0 0.14 G11 8.0 0.062 5 0.51 4.0 0.125 0 0.28 8.0 0.125 0 1.00 2.0 0.062 5 0.25 0.5 0.062 5 0.53 G12 8.0 0.062 5 1.06 4.0 0.125 0 0.53 0.5 0.062 5 1.06 0.5 0.062 5 1.06 0.5 0.062 5 1.06 Z1 8.0 0.062 5 1.06 1.0 0.125 0 0.25 2.0 0.062 5 0.50 2.0 0.062 5 0.50 0.5 0.062 5 1.06 Z2 8.0 0.500 0 2.00 4.0 1.000 0 1.00 8.0 0.500 0 2.00 4.0 0.125 0 0.75 0.5 0.062 5 1.06 Z3 8.0 0.062 5 1.02 8.0 1.000 0 1.25 1.0 0.250 0 0.38 4.0 0.125 0 1.00 0.5 0.062 5 1.06 TBZ: 噻苯达唑; AMB: 两性霉素B; FLU: 氟康唑; ITR: 伊曲康唑; POS: 泊沙康唑; VOR: 伏立康唑; MIC: 最低抑菌浓度; FICI: 分数抑菌浓度指数。 3. 讨论
苯并咪唑化合物TBZ具有广泛的生物活性,对多种胃肠道线虫及肺部、皮肤等组织内寄生虫均有驱除效果。TBZ通过寄生虫类脂质屏障被吸收,在虫体细胞内与微管蛋白结合,阻碍其进一步聚合装配成微管,进而抑制寄生虫分泌颗粒和亚细胞器运动[10]。相关研究[11]指出,新型微管相关cap-甘氨酸蛋白Cgp1控制新生隐球菌的生长、分化和毒力,而TBZ可以影响微管的定位并抑制其组装,此外Cgp1过表达菌株对TBZ的敏感性增加。TBZ还可以影响虫体的能量代谢,一方面抑制虫体对葡萄糖的摄取,导致糖原耗竭,另一方面抑制寄生性蠕虫延胡索酸还原酶活性,而后者的催化反应是糖酵解过程不可或缺的环节,也是此类生物获得能量的来源[12]。糖酵解受阻可使得三磷酸腺苷(ATP)生成减少,导致虫体代谢障碍,进而实现抗寄生虫作用。相关研究[13]证明,在真菌的生长发育中,延胡索酸还原酶同样起着关键作用,其通过影响真核细胞内线粒体氧化呼吸链而使菌体能量代谢失衡。在大多数已知的生物体中,延胡索酸还原酶是膜结合型,氧是线粒体呼吸链最重要的末端电子受体[14]。有氧呼吸链的主要功能是将质子电转出线粒体或细胞膜,以产生质子动力,驱动FoF1-ATP酶合成ATP[15]。然而,微需氧环境中低等真核生物呼吸链相关研究[16-17]结果表明,线粒体还原型烟酰胺腺嘌呤二核苷酸(NADH)-延胡索酸还原酶系统(延胡索酸呼吸)在无氧能量代谢中起重要作用。ENIAFE J等[18]指出,延胡索酸还原酶也可作为化疗靶点在肿瘤治疗中发挥作用。另有研究[19]证实,TBZ对白念珠菌、青霉菌等也具有抑制作用。
在致病性真菌感染中,新生隐球菌一直是除念珠菌属以外最为常见的致病真菌,也是很常见的侵袭性真菌,严重危害患者健康,且致死率高[20]。AMB为多烯类抗生素,可与真菌胞膜上的固醇类结合,改变膜的通透性,使菌体破坏,起到杀菌作用,是目前治疗新生隐球菌病的首选药物之一[21]。临床实践指南[22]和专家共识[23]都建议首选AMB联合氟胞嘧啶作为新生隐球菌病的诱导治疗方案,病情稳定后首选大剂量FLU作为巩固期治疗方案,或联合氟胞嘧啶使用,也可单用AMB、ITR、VOR,或在此基础上联用氟胞嘧啶。随着越来越多的临床耐药菌株的出现,有报道[24]称新生隐球菌生物膜可明显降低菌株对唑类药物的敏感性。因此,寻找新的抗真菌靶点,增强新生隐球菌病的疗效,已成为临床迫切需求。本研究观察结果显示, TBZ单独应用具有一定的抗新生隐球菌作用,将TBZ分别与FLU、ITR、POS、VOR、AMB联合应用可降低这5种抗真菌药物对新生隐球菌的MIC, 其中TBZ联合FLU或AMB的协同作用更好。值得注意的是,VOR是FLU的衍生物,对新生隐球菌的敏感性高,耐受性好[25], 但TBZ联合VOR的协同效果并不明显。
综上所述,TBZ具有一定的抗新生隐球菌作用,在体外与常用抗真菌药物FLU、ITR、POS、VOR、AMB联用时可起到协同作用,降低抗真菌药物对部分新生隐球菌菌株的MIC。本研究为TBZ的抗真菌作用提供了体外实验证据,丰富了TBZ与抗真菌药物联合应用对新生隐球菌抑制作用的数据,未来可进一步深入研究新生隐球菌呼吸链关键酶的作用机制,从而为抗真菌药物新作用靶点的研究提供理论依据。此外,TBZ体外抗真菌效果与体内抗真菌效果可能存在一定差异,故还需开展更多的临床研究进一步验证TBZ应用于新生隐球菌感染治疗中的可行性。
-
[1] RAJIAH P, SINHA R, CUEVAS C, et al. Imaging of uncommon retroperitoneal masses[J]. Radiographics: a review publication of the Radiological Society of North America, Inc, 2011, 31(4): 949-76. doi: 10.1148/rg.314095132
[2] COOLEY C L, JAGANNATHAN J P, KURRA V, et al. Imaging features and metastatic pattern of non-IVC retroperitoneal leiomyosarcomas: are they different from IVC leiomyosarcomas[J]. Journal of computer assisted tomography, 2014, 38(5): 687-92. doi: 10.1097/RCT.0000000000000097
[3] 陈贵兵, 晏阳, 肖春红, 等. 原发性腹膜后平滑肌肉瘤局部复发和预后分析[J]. 中华外科杂志, 2014, 52(2): 105-108. doi: 10.3760/cma.j.issn.0529-5815.2014.02.006 [4] 王关卉儿, 何廉波, 杨恺惟, 等. 腹膜后平滑肌肉瘤11例临床及病理分析[J]. 中华泌尿外科杂志, 2016, 37(12): 916-919. doi: 10.3760/cma.j.issn.1000-6702.2016.12.010 [5] 杨文昶, 李睿东, 张鹏, 等. 原发性腹膜后平滑肌肉瘤31例诊治分析[J]. 腹部外科, 2019, 32(6): 435-438. doi: 10.3969/j.issn.1003-5591.2019.06.011 [6] OLIMPIADI Y, SONG S, HU J S, et al. Contemporary Management of Retroperitoneal Soft Tissue Sarcomas[J]. Current oncology reports, 2015, 17(8): 39. doi: 10.1007/s11912-015-0462-0
[7] SHINDO S, MATSUMOTO H, OGATA K, et al. Surgical treatment of retroperitoneal leiomyosarcoma invading the inferior vena cava: report of three cases[J]. Surgery today, 2002, 32(10): 929-933. doi: 10.1007/s005950200185
[8] 房杰, 沈晨阳, 李清乐, 等. 腹膜后平滑肌肉瘤侵犯下腔静脉1例[J]. 中外健康文摘, 2010, 7(31): 113-113. https://www.cnki.com.cn/Article/CJFDTOTAL-RMJZ201602060.htm [9] MARKO J, WOLFMAN D J. Retroperitoneal Leiomyosarcoma From the Radiologic Pathology Archives[J]. Radiographics: a review publication of the Radiological Society of North America, Inc, 2018, 38(5): 1403-1420. doi: 10.1148/rg.2018180006
[10] 李晶英, 冯元春, 赵殿江. 腹膜后平滑肌肉瘤的临床、CT表现及病理分析[J]. 中国CT和MRI杂志, 2018, 16(2): 48-50. https://www.cnki.com.cn/Article/CJFDTOTAL-CTMR201802015.htm [11] STORM F K, MAHVI D M. Diagnosis and management of retroperitoneal soft-tissue sarcoma[J]. Annals of surgery, 1991, 214(1): 2-10. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1358407
[12] LI B, LUO C H, ZHENG W. Risk factors for recurrence and survival in patients with primary retroperitoneal tumors[J]. Journal of BUON: official journal of the Balkan Union of Oncology, 2013, 18(3): 782-787. http://europepmc.org/abstract/med/24065499
[13] HARTMAN D S, HAYES W S, CHOYKE P L, et al. From the archives of the AFIP. Leiomyosarcoma of the retroperitoneum and inferior vena cava: radiologic-pathologic correlation[J]. Radiographics: a review publication of the Radiological Society of North America, Inc., 1992, 12(6): 1203-1220. doi: 10.1148/radiographics.12.6.1439022
[14] TEIXEIRA F J R, JR., DO COUTO NETTO S D, PERINA A L F, et al. Leiomyosarcoma of the inferior vena cava: Survival rate following radical resection[J]. Oncology letters, 2017, 14(4): 3909-3916. doi: 10.3892/ol.2017.6706
[15] LIU D, REN H L, LIU B, et al. Renal Function Preservation in Surgical Resection of Primary Inferior Vena Cava Leiomyosarcoma Involving the Renal Veins[J]. European journal of vascular and endovascular surgery: the official journal of the European Society for Vascular Surgery, 2018, 55(2): 229-239. doi: 10.1016/j.ejvs.2017.11.031
[16] PANTOJA J L, PATEL R P, BARIL D T, et al. Caval reconstruction with undersized ringed graft after resection of inferior vena cava leiomyosarcoma[J]. Ann Vasc Surg, 2020, 65: 25-32. doi: 10.1016/j.avsg.2019.11.007
[17] KALLURI A G, JAIN A K, RODRIGUEZ H E, et al. Polytetrafluoroethylene is a safe and effective interposition conduit for caval reconstruction after resection of primary leiomyosarcoma of the inferior vena cava[J]. Ann Vasc Surg, 2019, 58: 289-294. doi: 10.1016/j.avsg.2018.12.068
[18] PERVAIZ N, COLTERJOHN N, FARROKHYAR F, et al. A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma[J]. Cancer, 2008, 113(3): 573-581. doi: 10.1002/cncr.23592
[19] LE CESNE A, OUALI M, LEAHY M G, et al. Doxorubicin-based adjuvant chemotherapy in soft tissue sarcoma: pooled analysis of two STBSG-EORTC phase Ⅲclinical trials[J]. Annals of oncology: official journal of the European Society for Medical Oncology, 2014, 25(12): 2425-2432. doi: 10.1093/annonc/mdu460
[20] 李倩, 周宇红, 王妍, 等. 吉西他滨联合多西他赛一线治疗复发/转移性腹膜后平滑肌肉瘤[J]. 肿瘤, 2015, 35(1): 65-71. https://www.cnki.com.cn/Article/CJFDTOTAL-ZZLL201501011.htm [21] VAN DER GRAAF W T, BLAY J Y, CHAWLA S P, et al. Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomised, double-blind, placebo-controlled phase 3 trial[J]. Lancet, 2012, 379(9829): 1879-1886. doi: 10.1016/S0140-6736(12)60651-5
-
期刊类型引用(1)
1. 柴春艳,王婷. 老年肺隐球菌感染临床分析并文献复习. 临床误诊误治. 2023(02): 1-4+10 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
