Relationships between expressions of Yes associated protein as well as carbonic anhydrase IX protein and occurrence as well as development of nasopharyngeal carcinoma
-
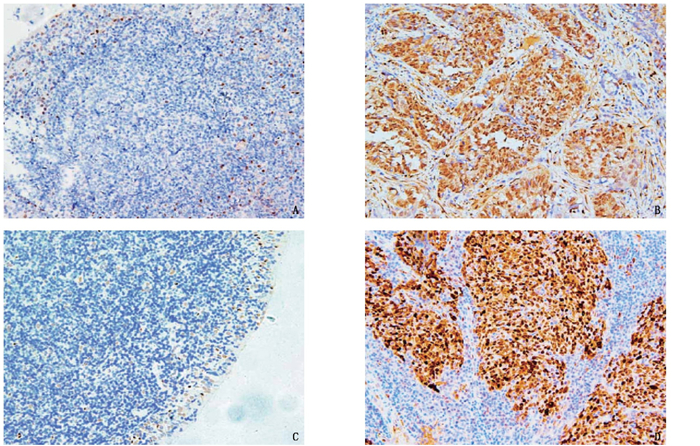
摘要:目的 探讨鼻咽癌组织中Yes相关蛋白(YAP)、碳酸酐酶Ⅸ蛋白的表达与肿瘤发生发展的关系。方法 选取鼻咽癌组织标本80例为鼻咽癌组,鼻咽黏膜慢性炎症组织80例为对照组,采用免疫组化染色检测2组标本中YAP蛋白、碳酸酐酶Ⅸ蛋白表达情况,并分析不同年龄、性别及病理学特征的鼻咽癌组织中YAP蛋白、碳酸酐酶Ⅸ蛋白表达差异。结果 鼻咽癌组标本中YAP蛋白、碳酸酐酶Ⅸ蛋白阳性表达率分别为76.25%、58.75%,高于对照组的36.25%、20.00%,差异有统计学意义(P < 0.05)。在未分化及病理学分期Ⅲ、Ⅳ期的鼻咽癌组织中,YAP蛋白阳性表达率高于分化型及病理学分期Ⅰ、Ⅱ期的鼻咽癌组织,差异有统计学意义(P < 0.05)。在不同年龄、性别、病灶最大径、是否发生淋巴结转移、病理学分化程度、病理学分期的鼻咽癌组织中,碳酸酐酶Ⅸ蛋白阳性表达率差异均无统计学意义(P>0.05)。结论 鼻咽癌组织中YAP蛋白、碳酸酐酶Ⅸ蛋白表达显著上调,其中YAP蛋白表达与肿瘤的发生发展关系密切。Abstract:Objective To investigate the relationship between the expression of Yes associated protein (YAP), carbonic anhydrase Ⅸ protein and occurrence, development of nasopharyngeal carcinoma.Methods Totally 80 tissue specimens of nasopharyngeal carcinoma were selected as nasopharyngeal carcinoma group, and 80 chronic inflammation tissues of nasopharyngeal mucosa were selected as control group. The expression of YAP protein and carbonic anhydrase IX protein in both groups were detected by immunohistochemistry, and the differences of YAP protein and carbonic anhydrase Ⅸ protein expression in nasopharyngeal carcinoma tissues with different age, gender and pathological characteristics were analyzed.Results The positive expression rates of YAP protein and carbonic anhydrase Ⅸ protein in the nasopharyngeal carcinoma group were 76.25% and 58.75% respectively, which were significantly higher than 36.25% and 20.00% in the control group (P < 0.05).The positive expression rates of YAP protein in the non-differentiated and pathological phase Ⅲ to Ⅳ nasopharyngeal carcinoma tissues were significantly higher than those in the differentiated and pathological phase Ⅰ to Ⅱ nasopharyngeal carcinoma tissues (P < 0.05). There were no significant differences in the positive expression rate of carbonic anhydrase Ⅸ protein in nasopharyngeal carcinoma tissues of patients with different ages, gender, maximum diameter of focus, condition of lymph node metastasis, pathological differentiation and pathological phase (P>0.05).Conclusion The expressions of YAP protein and carbonic anhydrase Ⅸ protein in nasopharyngeal carcinoma tissues are significantly up-regulated, and YAP protein expression is closely related to the occurrence and development of tumor.
-
心房颤动(简称“房颤”)是临床较为常见的心律失常类型,也是除高血压、冠心病之外的第三大类心血管疾病,可增加缺血性脑卒中、周围动脉栓塞、心力衰竭甚至死亡的风险[1-2]。流行病学数据[3]显示,全球范围内房颤的患病率正逐年上升,且随着年龄的增长显著增高。根据Framingham心脏研究(FHS)的数据,在过去50年中,房颤患病率增加了约3倍。《2023年美国心脏病学会/美国心脏协会(ACC/AHA)心房颤动诊疗指南》[4]显示,2020年全球房颤患病人群已增长至约5 000万。目前,房颤的发病机制尚未完全阐明,但既往研究[1, 5]表明,氧化应激、炎性反应、心房重构等病理生理过程与房颤的发生及发展密切相关。白脂素最早由ROMERE C等[6]在早衰综合征中发现并命名,是由前纤维蛋白原基因编码的前纤维蛋白经过C段裂解产生的一条特殊的短肽结构。研究[6-7]发现白脂素在肌肉、皮肤、心脏和肝脏等组织或器官中均有表达。白脂素与多种代谢紊乱性疾病密切相关,包括糖尿病、肥胖、多囊卵巢综合征(PCOS)以及代谢综合征等。在心血管疾病方面,ACARA A C等[8]认为白脂素可作为预测不稳定型心绞痛患者急性冠状动脉综合征严重程度的可靠生物标志物。一项队列研究[9]发现,扩张型心肌病白脂素水平较高者的心血管不良事件发生更少。虽然白脂素可通过多种途径广泛参与炎症反应、氧化应激、细胞凋亡等病理生理过程[10-11], 但其与房颤相关性的研究仍不足。本研究探讨血清白脂素水平与房颤的相关性,现报告如下。
1. 资料与方法
1.1 一般资料
选取2021年10月—2023年10月在青岛市市立医院心内科住院治疗的房颤患者85例为房颤组,患者均通过心电图诊断,且符合2016年欧洲心脏病学会房颤管理指南的诊断要求。选择同期正常窦性心律者86例为非房颤组。排除标准: ①有糖尿病、炎症性疾病、肿瘤、过敏、自身免疫性疾病、血液病以及其他心律失常性疾病者; ② 8周内有胰岛素、抗生素及免疫抑制剂应用史者; ③病历不完整、缺失和失访人群。本研究符合赫尔辛基宣言,研究方案已获医院伦理委员会批准(KTLL202306133),所有患者及家属均知情同意并签署知情同意书。
1.2 方法
收集所有患者的年龄、性别、吸烟史、饮酒史和既往病史(高血压、冠心病等)等资料。在禁食8 h或更长时间后,收集所有患者静脉血以检测甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、白细胞(WBC) 计数、血红蛋白(HGB)、血小板(PLT)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、肌酐(Cr)、尿酸(UA)、尿素氮(BUN)、C反应蛋白(CRP)、B型钠尿肽(BNP)、高敏肌钙蛋白Ⅰ(hs-CTNI)、纤维蛋白原(FIB)等。记录体质量指数(BMI), 使用慢性肾脏病流行研究(CKD-EPI) 方程计算估算的肾小球滤过率(eGFR)。所有患者均行经食道超声心动图或经胸超声心动图检查,采用Mindray公司生产的超声心动图仪M55进行心脏彩色多普勒超声检查,由2位经验丰富的超声科医师确定检查结果。记录超声心动图的相关参数,包括左心房内径(LAD)、左心室舒张末期直径(LVEDd)、左心室射血分数(LVEF)、室间隔厚度(ISW)和左心室后壁厚度(LVPW)。
1.3 血清白脂素浓度的测定
将所有受试者禁食8 h后采集的静脉血样本使用离心机以3 000 r/min离心20 min, 取上清液置入EP管中,样品储存在-80 ℃的冰箱中。使用酶联免疫吸附试验盒(ELISA试剂盒,中国江苏酶免实业有限公司生产,货号MM-1650H1)检测血清白脂素水平。批内变异系数<10%, 批间变异系数<12%。
1.4 统计学分析
采用SPSS 26.0软件对数据进行统计学分析。服从正态分布或近似正态分布的计量资料采用(x±s)表示,组间比较采用t检验,偏态分布的资料采用中位数和四分位数[M(P25, P75)]表示,采用Wilcoxon秩和检验进行组间比较。计数资料以[n(%)]表示,组间比较采用卡方检验。采用Spearman相关性分析评估不同指标与血清白脂素的相关性。采用多因素Logistic回归模型分析血清白脂素与房颤的相关性,并根据潜在混杂因素建立线性逐步回归模型。采用受试者工作特征(ROC)曲线评估白脂素对房颤的诊断价值。P<0.05为差异有统计学意义。
2. 结果
2.1 临床资料比较
与非房颤组相比,房颤组血清白脂素、BNP、hs-CTNⅠ、Cr、UA、LAD、LVEDd、ISW、LVPW、尿酸与高密度脂蛋白胆固醇比值(UA/HDL-C)升高,HDL-C、LVEF水平降低,差异均有统计学意义(P<0.05)。见表 1。
表 1 非房颤组组与房颤组临床资料及各项生化指标比较(x±s)[n(%)][M(P25, P75)]指标 非房颤组(n=86) 房颤组(n=85) χ2/t/Z P 年龄/岁 65.33±14.63 68.69±11.78 2.745 0.099 男性 41(47.67) 45(52.94) 0.474 0.491 吸烟史 23(26.74) 28(32.94) 0.784 0.376 饮酒史 14(16.28) 17(20.00) 0.399 0.528 高血压史 40(46.51) 58(68.23) 8.246 0.004 体质量指数/(kg/m2) 24.85±3.97 25.75±3.30 2.557 0.112 总胆固醇/(mmol/L) 4.28±1.03 4.02±1.07 2.644 0.106 甘油三酯/(mmol/L) 1.20(0.89, 1.62) 1.11(0.87, 1.61) -0.721 0.471 低密度脂蛋白胆固醇/(mmol/L) 2.52±0.78 2.42±0.67 0.739 0.391 高密度脂蛋白胆固醇/(mmol/L) 1.13(0.94, 1.33) 0.98(0.89, 1.17) -2.848 0.004 B型钠尿肽/(pg/mL) 33.45(20.30, 10.50) 123.00(68.70, 345.55) -6.633 <0.001 高敏肌钙蛋白I/(ng/mL) 0.004(0.002, 0.009) 0.007(0.003, 0.240) -2.740 0.006 白细胞计数/(×109/L) 5.99±1.78 6.33±1.84 1.458 0.229 血红蛋白/(g/L) 130.08±15.58 134.32±21.82 2.139 0.145 血小板/(×109/L) 200.50(177.75, 233.00) 191.00(155.00, 221.00) -1.905 0.057 C反应蛋白/(mg/L) 0.79(0.50, 3.43) 1.14(0.50, 3.06) -0.163 0.870 肌酐/(μmol/L) 64.68±11.61 73.94±18.30 15.683 <0.001 估算肾小球滤过率/[mL/(min·1.73 m2)] 90.65±12.77 86.95±15.13 2.986 0.086 尿素氮/(mmol/L) 6.45±8.55 6.55±2.10 0.011 0.918 尿酸/(μmol/L) 352.18±70.24 399.58±87.09 15.367 <0.001 尿酸与高密度脂蛋白胆固醇比值/(×10-3) 338.91±103.85 373.50±110.81 4.438 0.037 天冬氨酸氨基转移酶/(U/L) 22.84±16.74 22.16±7.56 0.118 0.732 丙氨酸氨基转移酶/(U/L) 21.27±10.80 20.20±10.45 0.426 0.515 纤维蛋白原/(g/L) 2.84±0.51 2.96±0.77 1.545 0.216 左心房内径/mm 35.81±3.55 42.66±4.95 108.068 <0.001 左心室舒张末期直径/mm 45.86±3.46 48.64±5.59 15.273 <0.001 左心室射血分数/% 60.40±3.99 55.74±8.41 21.464 <0.001 室间隔厚度/mm 9.42±1.48 10.00±2.06 4.372 0.038 左心室后壁厚度/mm 8.46±1.08 9.11±1.11 15.048 <0.001 白脂素/(pg/mL) 313.85±39.15 351.82±41.80 37.598 <0.001 2.2 白脂素与其他临床指标的相关性分析
采用Spearman相关性分析探讨血清白脂素与其他临床指标的相关性。结果显示, 白脂素与BMI(r=0.345, P<0.001)、TG(r=0.183, P=0.017)、BNP(r=0.283, P<0.001)、WBC(r=0.208, P=0.006)、UA(r=0.300, P<0.001)、LAD (r=0.340, P<0.001)、LVEDd (r=0.272, P<0.001)及LVPW(r=0.154, P=0.044)均呈正相关,与LVEF呈负相关(r=-0.319, P<0.001)。见表 2、图 1。
表 2 血清白脂素与其他临床指标的相关性分析变量 r P 年龄 0.078 0.308 体质量指数 0.345 <0.001 总胆固醇 0.036 0.640 甘油三酯 0.183 0.017 低密度脂蛋白胆固醇 0.064 0.409 高密度脂蛋白胆固醇 -0.620 0.417 B型钠尿肽 0.283 <0.001 高敏肌钙蛋白Ⅰ 0.129 0.093 白细胞计数 0.208 0.006 血红蛋白 0.007 0.928 血小板 -0.008 0.922 C反应蛋白 -0.072 0.348 肌酐 0.072 0.350 估算肾小球滤过率 -0.025 0.744 尿素氮 0.138 0.073 尿酸 0.300 <0.001 尿酸与高密度脂蛋白胆固醇比值 0.088 0.250 天冬氨酸氨基转移酶 0.087 0.260 丙氨酸氨基转移酶 -0.049 0.523 纤维蛋白原 0.016 0.837 左心房内径 0.340 <0.001 左心室舒张末期直径 0.272 <0.001 左心室射血分数 -0.319 <0.001 室间隔厚度 0.009 0.911 左心室后壁厚度 0.154 0.044 2.3 房颤影响因素的Logistic回归分析
采用单因素和多因素Logistic回归分析,并建立逐步回归模型,分析房颤的影响因素。将收集的各项临床资料作为自变量进行单因素Logistic回归分析,结果显示,白脂素(模型1, OR=1.025, 95%CI: 1.015~1.035, P<0.01)、HDL-C、BNP、UA、UA/HDL-C、LAD、LVEDd、LVEF、ISW及LVPW为房颤的影响因素,见表 3。采用多因素Logistic回归分析,在调整潜在混杂因素(年龄、性别、BMI)后建立模型2, 白脂素仍为
表 3 房颤的单因素Logistic回归分析变量 B Wald P OR(95%CI) 白脂素 0.025 25.040 <0.001 1.025(1.015~1.035) 高密度脂蛋白胆固醇 -1.773 6.639 0.010 0.170(0.044~0.654) B型钠尿肽 0.009 18.498 <0.001 1.009(1.005~1.013) 尿酸 0.008 12.947 <0.001 1.008(1.004~1.012) 尿酸与高密度脂蛋白胆固醇比值 0.003 4.272 0.039 1.003(1.000~1.006) 左心房内径 0.368 44.803 <0.001 1.445(1.297~1.609) 左心室舒张末期直径 0.164 12.428 <0.001 1.179(1.078~1.292) 左心室射血分数 -0.236 16.676 <0.001 0.790(0.705~0.885) 室间隔厚度 0.191 4.040 0.044 1.210(1.005~1.457) 左心室后壁厚度 0.545 12.955 <0.001 1.725(1.282~2.321) 房颤的危险因素(OR=1.026, 95%CI: 1.015~1.036, P<0.01)。在模型2的基础上进一步调整其他相关因素(HDL-C、BNP、UA、UA/HDL-C、LAD、LVEDd、LVEF、ISW和LVPW)建立模型3, 结果显示高水平血清白脂素是房颤的独立危险因素(OR=1.020, 95%CI: 1.005~1.036, P=0.01)。见图 2。
2.4 血清白脂素对房颤的诊断价值
ROC曲线分析结果显示,根据最大约登指数,白脂素诊断房颤的最佳临界值为337.78 pg/mL, 曲线下面积(AUC)为0.745(95%CI: 0.670~0.819, P<0.001), 灵敏度为64.7%, 特异度为79.1%。绘制白脂素与LAD联合预测的ROC曲线,结果显示AUC为0.897(95%CI: 0.850~0.944, P<0.001), 当约登指数为0.671时,敏感度为77.6%, 特异度为89.5%。见图 3。
3. 讨论
房颤是一种常见的心律失常类型,而心房重构是房颤发生和维持的重要病理基础,心房重构包括心房结构重构(心房纤维化、心房扩大等)和心房电重构(电生理、离子通道表达变化等)[12-14]。研究[15]显示白脂素可通过激活蛋白激酶C-δ(PKCδ)相关内质网(ER)应激/炎症通路导致胰岛素抵抗(IR)和胰岛素敏感性受损,而胰岛素抵抗可介导丝裂原活化蛋白激酶(MAPK)通路诱导心房纤维化和离子通道表达变化,从而促进房颤的发生[16]。SELCOKI Y等[17]认为LAD与心房纤维化呈正相关。RUDRA P等[18]发现LAD是房颤的自主预测因子,而LVEF与房颤进展呈负相关。上述研究表明,左心房扩大和左心室功能受损可能会增加房颤的发生风险。朱丽雯等[19]研究发现白脂素对心肌有保护作用,能显著改善左心室功能。ZHANG Z B等[11]研究结果显示,与载体预处理过的间充质干细胞(MSCs)相比,白脂素预处理的MSCs显著改善了LVEF,并抑制了心肌梗死后4周的心肌纤维化。本研究发现,血清白脂素水平与LAD呈显著正相关,与LVEF呈显著负相关。白脂素作为一种新型炎症介质,广泛参与炎症反应。炎症本身及其与心脏自主神经系统的相互作用均可促进房颤的发生和进展。白脂素可调节白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的表达[20]。TLR4是Toll样受体(TLR)之一,已被证明与内皮功能障碍和血管重塑有关,同时参与炎症因子的转录调控以及氧化应激[21], 炎症因子可通过激活先天免疫系统的TLR来促进心房重塑[22]。白脂素可调节TLR4/JNK/NF-κB通路以发挥促炎作用,白脂素的表达降低时,炎症反应减轻[10]。JUNG T W等[15]报道,白脂素通过诱导炎症标志物(IL-6表达、ⅠκB磷酸化及核因子-κβ核移位)激活炎症反应。因此,白脂素可通过炎症反应参与房颤的发生与发展。
脂肪因子由脂肪组织分泌,与血糖、血脂和血管特性密切相关。既往研究[23]表明,各种脂肪因子在心血管疾病尤其是房颤的发生和发展中起着至关重要的作用,这可能与脂肪因子介导炎症反应、影响自主神经功能和心肌纤维化的机制有关[24]。研究[25-26]表明,脂肪因子中的网膜素-1、Apelin和脂联素具有显著的心脏保护作用,而抵抗素、趋化素和内脂素具有心脏毒性。肥胖患者体内多种脂肪因子分泌水平的变化会影响血流动力学、心脏结构和功能,从而升高房颤的发病率[27]。FUKUI A等[28]发现瘦素信号转导可促使血管紧张素-Ⅱ诱导房颤和心房纤维化。此外,低水平的血浆脂联素与阵发性房颤显著相关[29]。白脂素是一种新型脂肪因子,主要由白色脂肪组织分泌。本研究结果显示,与非房颤组相比,房颤组的血清白脂素水平显著升高。此外,本研究建立了线性逐步回归模型,逐步调整影响房颤的其他混杂因素,经统计分析发现白脂素与房颤的OR值始终大于1且差异有统计学意义,表明白脂素是房颤的独立危险因素。肥胖是房颤的重要危险因素,可影响心房的离子通道变化及结构重塑,从而增高房颤发生的风险[30-31]。既往关于白脂素与肥胖的相关研究结果存在差异, NAIEMIAN S等[32]认为2型糖尿病(T2DM)患者的血清白脂素水平与BMI呈正相关。本研究也发现血清白脂素水平与BMI呈显著正相关(r=0.345, P<0.01)。然而, LONG W J等[33]认为,肥胖儿童的白脂素水平显著低于正常体质量儿童,且白脂素水平存在性别差异。CHANG C L等[34]认为在PCOS患者中,血清白脂素与BMI无显著相关性。因此,血清白脂素与肥胖相关指标的关系仍需进一步研究。
糖尿病和冠状动脉疾病(CAD)被认为是房颤的重要危险因素[35-36]。白脂素可作用于大脑中的AgRP+神经元以刺激食欲,同时还可与肝脏中的G蛋白偶联受体(OLFR734)结合以激活G蛋白-cAMP-PKA通路,促进肝脏葡萄糖分泌[6, 37]。多项研究[38-39]证实, 2型糖尿病患者的血清白脂素水平显著升高。此外,白脂素可诱导P38/Elk-1途径促使细胞内胆固醇排泄,通过减少脂质积累,在动脉粥样硬化中发挥作用[21]。MORADI N等[40]认为, CAD患者较健康人群的血清白脂素水平显著升高。本研究探讨了血清白脂素水平与房颤的相关性,发现白脂素是房颤的独立危险因素,且对房颤具有较高的诊断价值。血栓栓塞事件是房颤致残、致死的主要并发症,既往研究[41]发现,包括IL-6、CRP和肿瘤坏死因子-α(TNF-α) 等在内的多种炎症因子可促进组织因子(TF)、血管性血友病因子(vWF)和P-选择素的合成,驱动血小板活化,从而导致房颤相关血栓形成。白脂素的高度表达可能会增强胰岛素抵抗,增加血管通透性,激活MAPK信号传导,以促使血管内皮细胞(ECs)表达增强,进而增高血管炎症因子水平。一项关于白脂素在下肢动脉疾病中作用的研究[42]发现,白脂素可增强转化生长因子-β(TGF-β)信号通路,诱导血管内皮-间质转化(EndMT), 导致血管损伤。白脂素可能通过多种途径参与房颤患者血栓形成的病理生理过程。
本研究的局限性: 首先,本研究的样本量较小,研究结果需要在较大的样本量和其他种族中进行验证; 其次,本研究为分析白脂素与房颤相关性的临床实验,探讨了房颤发生及发展中白脂素可能参与的病理生理过程,但更深层次的机制需进一步的基础实验进行分析验证。
综上所述,本研究发现房颤患者血清白脂素水平显著升高,且白脂素为房颤的独立危险因素,表明白脂素可能参与房颤相关的心房重塑、炎症反应、氧化应激等病理生理过程。血清白脂素水平对房颤具有较高的诊断价值,白脂素联合LAD对房颤诊断价值更高。
-
表 1 2组标本中YAP蛋白、碳酸酐酶Ⅸ蛋白阳性表达率比较[n(%)]
组别 n YAP蛋白 碳酸酐酶Ⅸ蛋白 阳性 阴性 阳性 阴性 鼻咽癌组 80 61(76.25)* 19(23.75)* 47(58.75)* 33(41.25)* 对照组 80 29(36.25) 51(63.75) 16(20.00) 64(80.00) 与对照组比较, *P < 0.05。 表 2 鼻咽癌组不同临床病理学特征下YAP蛋白阳性表达率比较[n(%)]
因素 n YAP阳性 YAP阴性 χ2 P 年龄 ≥60岁 42 34(80.95) 8(19.05) 1.080 0.299 < 60岁 38 27(71.05) 11(28.95) 性别 男 52 38(73.08) 14(26.92) 0.826 0.363 女 28 23(82.14) 5(17.86) 分化程度 未分化 51 43(84.31) 8(15.69) 5.052 0.025 分化型 29 18(62.07) 11(37.93) 病理学分期 Ⅰ、Ⅱ期 35 21(60.00) 14(40.00) 9.073 0.003 Ⅲ、Ⅳ期 45 40(88.89) 5(11.11) 病灶最大径 >2.0 cm 45 37(82.22) 8(17.78) 2.026 0.155 ≤2.0 cm 35 24(68.57) 11(31.43) 淋巴结转移 是 45 38(84.44) 7(15.56) 3.814 0.051 否 35 23(65.71) 12(34.29) 表 3 鼻咽癌组不同临床病理学特征下碳酸酐酶Ⅸ蛋白阳性表达率比较[n(%)]
因素 n 碳酸酐酶Ⅸ蛋白阳性 碳酸酐酶Ⅸ蛋白阴性 χ2 P 年龄 ≥60岁 42 28(66.67) 14(33.33) 2.287 0.130 < 60岁 38 19(50.00) 19(50.00) 性别 男 52 33(63.46) 19(36.54) 1.361 0.243 女 28 14(50.00) 14(50.00) 分化程度 未分化 51 32(62.75) 19(37.25) 0.927 0.336 分化型 29 15(51.72) 14(48.28) 病理学分期 Ⅰ、Ⅱ期 35 24(68.57) 11(31.43) 2.477 0.116 Ⅲ、Ⅳ期 45 23(51.11) 22(48.89) 病灶最大径 >2.0 cm 45 29(64.44) 16(35.56) 1.376 0.242 ≤2.0 cm 35 18(51.43) 17(48.57) 淋巴结转移 是 45 30(66.67) 15(33.33) 2.660 0.103 否 35 17(48.57) 18(51.43) -
[1] ZAMANIAN AZODI M, REZAEI TAVIRANI M, REZAEITAVIRANI M, et al. Nasopharyngeal carcinoma protein interaction mapping analysis via proteomic approaches[J]. Asian Pac J Cancer Prev, 2018, 19(3): 845-851. http://www.ncbi.nlm.nih.gov/pubmed/29582644
[2] FANG Y, XU C, WU P, et al. Prognostic role of C-reactive protein in patients with nasopharyngeal carcinoma: a meta-analysis and literature review[J]. Medicine(Baltimore), 2017, 96(45): e8463. http://pubmedcentralcanada.ca/pmcc/articles/PMC5690726/
[3] WANG M H, ZHOU X M, ZHANG M Y, et al. BMP2 promotes proliferation and invasion of nasopharyngeal carcinoma cells via m TORC1 pathway[J]. Aging(Albany NY), 2017, 9(4): 1326-1340. http://europepmc.org/articles/PMC5425130/
[4] AI P, LI Z P, JIANG Y, et al. Tumor microenvironment contributes to Epstein-Barr virus anti-nuclear antigen-1 antibody production in nasopharyngeal carcinoma[J]. Oncol Lett, 2017, 14(2): 2458-2462. doi: 10.3892/ol.2017.6461
[5] YE M, HUANG W, WU W W, et al. FM807, a curcumin analogue, shows potent antitumor effects in nasopharyngeal carcinoma cells by heat shock protein 90 inhibition[J]. Oncotarget, 2017, 8(9): 15364-15376. doi: 10.18632/oncotarget.14970
[6] 吴孟超. 外科学[M]. 8版. 北京: 人民卫生出版社, 2013: 1-10. [7] SHAN Y, YOU B, SHI S, et al. Hypoxia-induced matrix metalloproteinase-13 expression in exosomes from nasopharyngeal carcinoma enhances metastases[J]. Cell Death Dis, 2018, 9(3): 382. doi: 10.1038/s41419-018-0425-0
[8] JIANG C, LI L, LI J C, et al. Circulating EBV micro RNABART2-5p helps to diagnose nasopharyngeal carcinoma & screen for high risk individuals precisely[J]. Cancer Research, 2017, 77(13): 722-722.
[9] ZHANG W, ZHANG Y L, XI S M. Upregulation of lncRNAHAGLROS enhances the development of nasopharyngeal carcinoma via modulating mi R-100/ATG14 axis-mediated PI3K/AKT/m TOR signals[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 3043-3052. doi: 10.1080/21691401.2019.1640233
[10] ZHANG Y Y, XU Z N. mi R-93 enhances cell proliferation by directly targeting CDKN1A in nasopharyngeal carcinoma[J]. Oncol Lett, 2018, 15(2): 1723-1727. http://www.ncbi.nlm.nih.gov/pubmed/29859935
[11] ZHOU J, WANG D, ZHENG J H, et al. Predictive value of excision repair cross-complementation group 1 protein in locoregionally advanced nasopharyngeal carcinomas receiving cisplatin-based concurrent chemoradiotherapy[J]. J Cancer Res Ther, 2018, 14(Supplement): S145-S151. http://europepmc.org/abstract/MED/29439312
[12] LEE C C, LIN M L, MENG M, et al. Galangin induces p53-independent S-phase arrest and apoptosis in human nasopharyngeal carcinoma cells through inhibiting PI3K-AKT signaling pathway[J]. Anticancer Res, 2018, 38(3): 1377-1389. http://europepmc.org/abstract/MED/29491062
[13] YU B B, LIN G X, LI L, et al. Cofilin-2 Acts as a marker for predicting radiotherapy response and is a potential therapeutic target in nasopharyngeal carcinoma[J]. Med Sci Monit, 2018, 24: 2317-2329. doi: 10.12659/MSM.909832
[14] LI L, ZHOU F J, LIN F Z, et al. Clinicopathologic characteristics of thyroid-like low-grade nasopharyngeal papillary adenocarcinoma: a case report[J]. Appl Immunohistochem Mol Morphol, 2019, 27(8): e81-e84. doi: 10.1097/PAI.0000000000000545
[15] CHUNG A K, OUYANG C N, LIU H, et al. Targeted sequencing of cancer-related genes in nasopharyngeal carcinoma identifies mutations in the TGF-βpathway[J]. Cancer Med, 2019, 8(11): 5116-5127. doi: 10.1002/cam4.2429
[16] MA W L, FENG L, ZHANG S S, et al. Induction of chemokine(C-C motif)ligand 5 by Epstein-Barr virus infection enhances tumor angiogenesis in nasopharyngeal carcinoma[J]. Cancer Sci, 2018, 109(5): 1710-1722. doi: 10.1111/cas.13584
[17] DOURTHE M E, BOLLE S, TEMAM S, et al. Childhood nasopharyngeal carcinoma: state-of-the-art, and questions for the future[J]. J Pediatr Hematol Oncol, 2018, 40(2): 85-92. doi: 10.1097/MPH.0000000000001054
[18] CAO C N, JIANG F, JIN Q F, et al. Paranasal sinus invasion in nasopharyngeal carcinoma after intensity-modulated radiotherapy[J]. Cancer Res Treat, 2019, 51(1): 73-79. doi: 10.4143/crt.2017.607




 下载:
下载:



 苏公网安备 32100302010246号
苏公网安备 32100302010246号