Effects of circ-0005273 targeting miR-1200 on the proliferation and apoptosis of esophageal cancer Eca109 cells
-
摘要:目的 探讨circ-0005273对食管癌细胞增殖和凋亡的影响及可能机制。方法 收集41例食管癌患者的癌组织及癌旁组织,采用实时荧光定量聚合酶链式反应(RT-qPCR)检测组织中circ-0005273和miR-1200表达。体外培养食管癌Eca109细胞,分别转染circ-0005273小干扰RNA、miR-1200模拟物,或共转染circ-0005273小干扰RNA与miR-1200抑制剂。采用CCK-8法和克隆形成实验检测细胞增殖;流式细胞术检测细胞凋亡;蛋白印迹法检测细胞中cleaved-caspase9、cleaved-caspase3蛋白表达;双荧光素酶报告基因实验验证miR-1200与circ-0005273调控关系。结果 食管癌组织中circ-0005273的表达量高于癌旁组织,而miR-1200的表达量低于癌旁组织,差异均有统计学意义(P<0.05)。干扰circ-0005273表达或过表达miR-1200后,Eca109细胞光密度(OD)值和克隆形成数降低,凋亡率和cleavde-caspase9、cleavde-caspase3蛋白的表达量增加,差异均有统计学意义(P<0.05)。circ-0005273靶向负调控miR-1200,干扰miR-1200可逆转干扰circ-0005273对Eca109细胞增殖和凋亡的影响。结论 circ-0005273在食管癌组织中呈高表达,干扰circ-0005273可能通过靶向负调控miR-1200阻碍了食管癌细胞增殖,并加剧了细胞凋亡。
-
关键词:
- 食管癌 /
- circ-0005273 /
- miR-1200 /
- 细胞增殖 /
- 凋亡
Abstract:Objective To investigate the effects of circ-0005273 on the proliferation and apoptosis of esophageal cancer cells and its possible mechanism.Methods The cancer tissues and adjacent tissues of 41 patients with esophageal cancer were collected, and the expression of circ-0005273 and miR-1200 in the tissues were detected by real-time fluorescence quantitative polymerase chain reaction (RT-qPCR). Esophageal cancer Eca109 cells were cultured in vitro, and were respectively transfected with circ-0005273 small interfering RNA (si-circ-0005273) or miR-1200 mimic, or co-transfected with circ-0005273 small interfering RNA and miR-1200 inhibitor. CCK-8 method and clone formation experiment were used to detect cell proliferation, flow cytometry was used to detect cell apoptosis, the western blotting was used to detect the protein expression of cleaved-caspase9 and cleaved-caspase3 in cells, and the dual luciferase reporter gene experiment was used to verify the regulatory relationship between miR-1200 and circ-0005273.Results The expression of circ-0005273 in esophageal cancer tissues was significantly higher than that in adjacent tissues, but the expression of miR-1200 was significantly lower than that in adjacent tissues (P < 0.05). After disturbing circ-0005273 or over-expressing miR-1200, the optical density (OD) value and clone formation number of Eca109 cells significantly decreased (P < 0.05), but the apoptosis rate and the protein expression of cleavde-caspase9 and cleavde-caspase3 increased significantly (P < 0.05). Circ-0005273 was able to target and negatively regulate miR-1200, and disturbing miR-1200 reversed the effect of disturbing circ-0005273 on the proliferation and apoptosis of Eca109 cells.Conclusion Circ-0005273 is highly expressed in esophageal cancer tissues. Disturbing circ-0005273 may hinder the proliferation of esophageal cancer cells and aggravate cell apoptosis by targeting and negatively regulating miR-1200.-
Keywords:
- esophageal cancer /
- circ-0005273 /
- miR-1200 /
- cell proliferation /
- apoptosis
-
食管癌是常见的恶性肿瘤,其发病机制尚未阐明,且缺乏有效的治疗方法[1]。研究[2-4]表明,原癌基因的异常激活及抑癌基因的失活在肿瘤的发生发展中起关键作用,分析肿瘤中异常表达的基因分子及其对肿瘤发生发展的影响可为肿瘤的治疗提供分子靶点。环状RNA(circRNA)和微小RNA(miRNA)是两类小分子非编码RNA, 其中circRNA可发挥miRNA分子海绵作用,进而调控miRNA靶基因的表达,二者在肿瘤的进展中发挥重要的调控作用。研究发现, circ-0005273在乳腺癌[5]、胰腺癌[6]、结肠癌[7]和甲状腺乳头状癌[8]中的表达均显著上调,可促进肿瘤的进展,或可作为肿瘤治疗的分子靶点。
Circular RNA Interactome靶基因在线软件预测显示, circ-0005273可能发挥miR-1200分子海绵作用。研究[9]发现, miR-1200在神经胶质瘤中表达下调,通过靶向上调其表达可阻碍神经胶质瘤细胞的增殖、迁移和侵袭能力,其在神经胶质瘤中发挥抑癌基因作用。本研究以食管癌Eca109细胞为研究对象,探讨circ-0005273、miR-1200对Eca109细胞增殖和凋亡的影响,分析circ-0005273能否靶向调控miR-1200而发挥作用,以明确circ-0005273和miR-1200对食管癌发生发展的影响,现报告如下。
1. 资料与方法
1.1 一般资料
选取2017年8月—2019年10月在本院确诊并行手术治疗的41例食管癌患者的食管癌组织及癌旁组织,其中女8例,男33例,平均年龄(49.25±8.53)岁; TNM分期Ⅰ期3例, Ⅱ期16例, Ⅲ期22例; 低分化19例,中分化18例,高分化4例。纳入标准: 首次确诊者; 术后病理确诊为食管鳞状细胞癌者。排除标准: 合并其他恶性肿瘤者; 合并糖尿病、高血压等慢性疾病者。本研究经本院伦理委员会批准,患者知情同意。
1.2 细胞和试剂
Eca109细胞系购自中国科学院上海细胞库; RPMI 1640培养基、细胞计数试剂盒-8(CCK-8)、Annexin V-FITC/PI细胞凋亡试剂盒、二喹啉甲酸(BCA)蛋白检测试剂盒和双荧光素酶活性检测试剂盒购自北京索莱宝; 胎牛血清(FBS) 购自杭州四季青; PCR引物、circ-0005273小干扰RNA(si-circ-0005273)及乱序无意义阴性序列(si-NC)、miR-1200模拟物(mimcs)及模拟对照序列(miR-NC)、miR-1200抑制剂(anti-miR-1200)及抑制剂阴性序列(anti-miR-NC)、circ-0005273野生型质粒(WT-circ-0005273)和突变型质粒(MUT-circ-0005273)购自上海生工; RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒购自大连宝生物; LipofectamineTM 2000试剂盒购自美国Invitrogen公司; 兔抗人活化的半胱天冬酶9(cleaved-caspase9)、活化的半胱天冬酶3(cleaved-caspase3)抗体购自美国Santa Cruz公司。
1.3 方法
1.3.1 实时荧光定量聚合酶链式反应(RT-qPCR)
检测组织中circ-0005273和miR-1200表达: 将收集的癌组织和癌旁组织在液氮保护下进行研磨,采用RNA抽提试剂盒提取组织中总RNA。经逆转录后,行PCR扩增。扩增程序为95 ℃下10 min, 95 ℃下10 s, 58 ℃下30 s, 72 ℃下30 s, 共35个循环。引物序列: circ-0005273上游5′-AATGCCTGTGAACCCATAGTG-3′, 下游5′-CTGACAGCATGAGCATCCCT-3′; GAPDH上游5′-AGAAGGCTGGGGCTCATTTG -3′, 下游5′-AGGGGCCATCCACAGTCTTC-3′; miR-1200上游5′-ACACTCCAGCTGGGCTCCTG AGCCATTCTG-3′, 下游5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGAGGC TCA-3′; U6上游5′-CTCGCTTCGGCAGCACA-3′, 下游5′-AACGCTTCACGAATTTGCGT-3′。2-△△Ct法计算circ-0005273相对于GAPDH、miR-1200相对于U6的表达水平。
1.3.2 细胞培养和转染
在超净工作台中复苏Eca109细胞,加含10 % FBS的RPMI 1640培养基,并转移至25 cm2培养瓶中,于培养箱中培养。将对数期Eca109细胞接种于6孔板中(5.0×105个/孔),采用LipofectamineTM 2000脂质体转染法,分别转染si-circ-0005273(si-circ-0005273组)、si-NC(si-NC组)、miR-1200 mimcs(miR-1200组)、miR-NC(miR-NC组)、共转染si-circ-0005273与anti-miR-1200(si-circ-0005273+anti-miR-1200组)、si-circ-0005273与anti-miR-NC(si-circ-0005273+anti-miR-NC组)。转染后12 h, 更换含10 % FBS的RPMI 1640培养基,再培养24 h, 收集细胞备用。
1.3.3 CCK-8法检测细胞增殖
将各组Eca109细胞接种于96孔板中(2.5×104个/孔),培养24 h, 加10 μL CCK-8试剂,孵育2 h, 采用酶标仪(λ=450 nm)检测各孔光密度(OD)值。
1.3.4 克隆形成实验
将各组Eca109细胞接种于6孔板中(1.0×104个/孔),每2 d更换1次培养基,培养14 d后,弃培养基。采用4 %多聚甲醛固定30 min、0.4 %结晶紫染色20 min后,显微镜观察,对超过50个细胞的克隆进行计数。
1.3.5 流式细胞术检测细胞凋亡
将各组Eca109细胞接种于6孔板中(5.0×105个/孔),培养24 h后收集细胞。采用PBS清洗2次, 1 500转/min离心5 min, 弃上清。采用Annexin V-FITC/PI试剂盒,上流式细胞仪检测细胞凋亡情况。
1.3.6 Western Blot法检测cleaved-caspase9、cleaved-caspase3蛋白表达
将各组Eca109细胞接种于6孔板中(5.0×105个/孔),培养24 h后,采用RIPA试剂提取细胞中总蛋白。经BCA法定量、SDS-PAGE电泳、转膜及5%脱脂奶粉封闭后,分别采用cleaved-caspase9(1∶ 500)、cleaved-caspase3(1∶ 500)和β-actin(1∶ 500)一抗在4 ℃冰箱中进行孵育,过夜后再用山羊抗兔二抗(1∶ 2 000) 在37 ℃摇床中孵育1 h。最后加显影液避光显影,曝光拍照, Image J软件分析cleaved-caspase9、cleaved-caspase3相对于GAPDH的表达量。
1.3.7 双荧光素酶报告基因实验
将Eca109细胞接种于6孔板中(5.0×105个/孔),采用LipofectamineTM 2000脂质体转染法,分别共转染WT-circ-0005273与miR-1200 mimcs、WT-circ-0005273与miR-NC、MUT-circ-0005273与miR-1200 mimcs、MUT-circ-0005273与miR-NC。转染后12 h, 换新鲜培养基,再培养24 h, 收集细胞并裂解, 1 500转/min离心5 min, 取上清,检测荧光素酶活性(以萤火虫荧光强度与海肾荧光强度的比值表示)。
1.4 统计学分析
采用SPSS 22.0软件分析实验数据。计量资料以均数±标准差(x±s)表示。2组间比较采用独立样本t检验。P<0.05表示差异有统计学意义。
2. 结果
2.1 癌旁组织、食管癌组织中circ-0005273和miR-1200的表达
癌旁组织、食管癌组织中circ-0005273的表达量分别为(1.00±0.06)、(4.21±0.32), miR-1200的表达量分别为(1.00±0.09)、(0.43±0.03)。癌旁组织与食管癌组织中circ-0005273和miR-1200的表达比较,差异均有统计学意义(tcirc-0005273=63.131, P<0.05; tmiR-1200=38.472, P<0.05)。
2.2 干扰circ-0005273表达对食管癌Eca109细胞增殖的影响
结果显示, si-circ-0005273组Eca109细胞中circ-0005273表达量低于si-NC组,差异有统计学意义(P<0.05), 表明干扰circ-0005273表达的Eca109细胞构建成功; 干扰circ-0005273表达后, Eca109细胞OD值和克隆形成数也降低,差异有统计学意义(P<0.05), 表明干扰circ-0005273表达抑制食管癌Eca109细胞增殖。见表 1。
表 1 干扰circ-0005273表达对食管癌Eca109细胞增殖的影响(x±s)(n=9)组别 circ-0005273 OD450 nm值 克隆形成数/个 si-NC组 1.00±0 0.81±0.06 92.24±7.81 si-circ-0005273组 0.33±0.03* 0.35±0.03* 41.03±4.08* 与si-NC组比较, * P<0.05。 2.3 干扰circ-0005273表达对食管癌Eca109细胞凋亡的影响
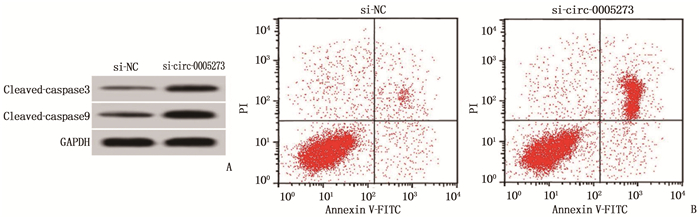
干扰circ-0005273表达后, Eca109细胞凋亡率升高,细胞中凋亡相关蛋白cleavde-caspase9和cleavde-caspase3的表达量增加,差异均有统计学意义(P<0.05), 说明干扰circ-0005273表达可促进食管癌Eca109细胞凋亡。见图 1、表 2。
表 2 干扰circ-0005273表达对食管癌Eca109细胞凋亡的影响(x±s)(n=9)组别 凋亡率/% cleavde-caspase3蛋白 cleavde-caspase9蛋白 si-NC组 6.11±0.56 0.24±0.02 0.31±0.03 si-circ-0005273组 22.86±2.53* 0.65±0.04* 0.75±0.05* 与si-NC组比较, * P<0.05。 2.4 circ-0005273靶向调控miR-1200的表达
Circular RNA Interactome靶基因在线软件预测显示, circ-0005273与miR-1200的核苷酸序列存在连续结合位点。共转染miR-1200与WT-circ-0005273的食管癌Eca109细胞荧光素酶活性为(0.53±0.04), 低于共转染miR-NC与WT-circ-0005273的细胞荧光素酶活性(1.05±0.08), 差异有统计学意义(t=17.441, P<0.05); 共转染miR-1200与MUT-circ-0005273的食管癌Eca109细胞荧光素酶活性为(1.01±0.06), 与共转染miR-NC与MUT-circ-0005273的细胞荧光素酶活性(1.02±0.07)比较,差异无统计学意义(t=0.325, P>0.05), 说明circ-0005273可靶向结合miR-1200。同时, si-circ-0005273组食管癌Eca109细胞中miR-1200的表达量为(3.06±0.24), 高于si-NC组的(0.97±0.06), 差异有统计学意义(t=25.345, P<0.05), 说明circ-0005273负调控miR-1200。见图 2。
2.5 过表达miR-1200对食管癌Eca109细胞增殖和凋亡的影响
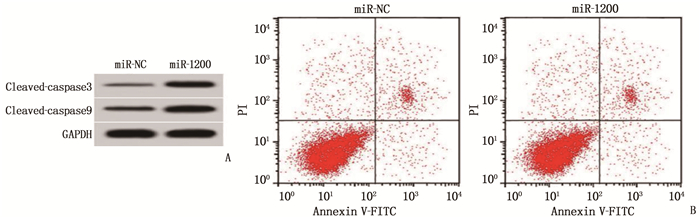
结果显示, miR-1200组Eca109细胞中miR-1200表达量高于miR-NC组,差异有统计学意义(P<0.05), 表明过表达miR-1200的Eca109细胞构建成功; 过表达miR-1200后, Eca109细胞OD值和克隆形成数降低,凋亡率及凋亡相关蛋白cleavde-caspase9和cleavde-caspase3的表达量增加,差异均有统计学意义(P<0.05), 说明过表达miR-1200阻碍食管癌Eca109细胞增殖,并促进其凋亡。见图 3、表 3。
表 3 过表达miR-1200对食管癌Eca109细胞增殖和凋亡的影响(x±s)(n=9)组别 miR-1200 OD450 nm值 克隆形成数/个 凋亡率/% cleaved-caspase3蛋白 cleaved-caspase9蛋白 miR-NC组 1.00±0 0.83±0.07 94.51±7.93 6.49±0.53 0.23±0.02 0.29±0.02 miR-1200组 3.12±0.25* 0.42±0.05* 50.76±5.99* 18.97±1.62* 0.61±0.05* 0.69±0.05* 与miR-NC组比较, * P<0.05。 2.6 干扰miR-1200逆转了干扰circ-0005273表达对食管癌Eca109细胞增殖和凋亡的作用
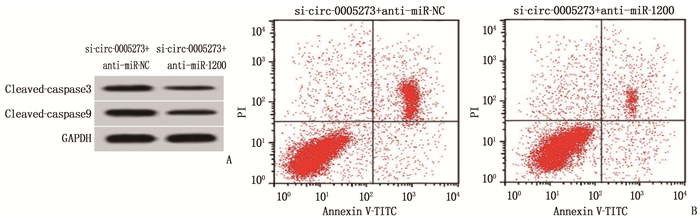
与si-circ-0005273+anti-miR-NC组比较, si-circ-0005273+anti-miR-1200组Eca109细胞中miR-1200表达量降低,细胞OD值和克隆形成数升高,凋亡率及凋亡相关蛋白cleavde-caspase9和cleavde-caspase3的表达量减少,差异均有统计学意义(P<0.05), 说明干扰miR-1200可逆转干扰circ-0005273表达对食管癌Eca109细胞增殖的抑制作用及凋亡促进作用。见图 4、表 4。
表 4 干扰miR-1200逆转干扰circ-0005273对食管癌Eca109细胞增殖和凋亡的作用(x±s)(n=9)组别 miR-1200 OD450 nm值 克隆形成数/个 凋亡率/% cleaved-caspase3蛋白 cleaved-caspase9蛋白 si-circ-0005273+anti-miR-NC组 1.00±0 0.34±0.03 40.33±4.15 23.86±2.66 0.67±0.05 0.76±0.06 si-circ-0005273+anti-miR-1200组 0.39±0.04* 0.71±0.05* 83.48±6.56* 12.11±1.21* 0.32±0.03* 0.41±0.04* 与si-circ-0005273+anti-miR-NC组比较, * P<0.05。 3. 讨论
食管癌的发病机制较为复杂,受遗传、基因和环境等多种因素的影响[10]。分析食管癌中异常表达的基因分子及其对食管癌发生发展的影响和作用机制,可为治疗提供分子靶点。研究表明,多种circRNA在食管癌中异常表达,如circ-LRP6[11]、circLPAR3[12]和circRNA_001275[13]等circRNA在食管癌中表达上调,促进食管癌的进展; 而circ_RNA0023397[14]、circLARP4[15]和circ-Foxo3[16]等circRNA在食管癌中表达降低,对食管癌的进展起抑制作用。本研究结果显示,食管癌组织中circ-0005273的表达量高于癌旁组织,干扰circ-0005273引起食管癌细胞增殖受阻,而凋亡加剧,提示circ-0005273作为致癌基因促进食管癌的进展,其可能成为食管癌治疗的分子靶点。
细胞凋亡受多种基因分子和信号通路的影响,其中在线粒体信号通路介导的细胞凋亡过程中,由于线粒体膜电位的降低,导致大量细胞色素C进入细胞质,与Apaf-1结合,进而激活caspase级联反应,诱导细胞凋亡[17]。研究[18]显示, caspase9是caspase级联反应的起始分子,其在受到凋亡信号刺激后,被激活生成cleavde-caspase9, 进而激活下游效应的caspase3; caspase3被激活后,生成cleavde-caspase3, 进而剪切细胞内各种底物,诱导细胞凋亡。本研究显示,干扰circ-0005273表达增加了食管癌细胞中cleavde-caspase9和cleavde-caspase3蛋白的表达量,提示circ-0005273可能通过调控caspase级联反应来影响食管癌细胞凋亡。
研究[19]显示circRNA可与miRNA竞争性结合,调控miRNA靶基因的表达,进而发挥生物学调控作用。为了进一步探究circ-0005273参与调控食管癌细胞增殖和凋亡的分子机制,本研究证实了circ-0005273靶向结合并负向调控miR-1200, 这与本研究中食管癌组织中circ-0005273表达升高而miR-1200表达降低的结果一致。研究[20]显示, circ_0001785在骨肉瘤细胞系中高表达,敲减circ_0001785可减弱骨肉瘤细胞的增殖能力,并诱导骨肉瘤细胞凋亡,其作用机制与竞争性结合miR-1200并正向调控HOXB2的表达有关,为阐明骨肉瘤发病机制提供了新的思路; circ_0026359在胃癌中表达升高,其通过靶向抑制miR-1200并促进POLD4的表达增强胃癌细胞的顺铂抗性, circ_0026359/miR-1200/POLD4轴可能为逆转胃癌细胞顺铂抗性提供了分子靶点[21]。本研究显示,过表达miR-1200对食管癌细胞增殖起抑制作用,而对其凋亡发挥促进作用,且干扰miR-1200逆转了干扰circ-0005273对食管癌细胞增殖和凋亡的影响,进而提示circ-0005273通过靶向负调控miR-1200来影响食管癌细胞的增殖和凋亡,进而促进食管癌的发展进程。
本研究也存在不足之处: miR-1200靶基因及下游信号通路对食管癌发生发展的影响还未进行研究,且未在体内验证circ-0005273/miR-1200轴对食管癌发生发展的影响,这将是后续研究的重点。
综上所述,食管癌组织中circ-0005273表达升高,而miR-1200表达降低; 干扰circ-0005273可有效阻碍食管癌细胞的增殖能力,并诱导食管癌细胞凋亡,其作用机制可能与靶向负调控miR-1200有关, circ-0005273/miR-1200轴可能为食管癌发病机制的阐明及治疗靶点的选择提供了新途径。
-
表 1 干扰circ-0005273表达对食管癌Eca109细胞增殖的影响(x±s)(n=9)
组别 circ-0005273 OD450 nm值 克隆形成数/个 si-NC组 1.00±0 0.81±0.06 92.24±7.81 si-circ-0005273组 0.33±0.03* 0.35±0.03* 41.03±4.08* 与si-NC组比较, * P<0.05。 表 2 干扰circ-0005273表达对食管癌Eca109细胞凋亡的影响(x±s)(n=9)
组别 凋亡率/% cleavde-caspase3蛋白 cleavde-caspase9蛋白 si-NC组 6.11±0.56 0.24±0.02 0.31±0.03 si-circ-0005273组 22.86±2.53* 0.65±0.04* 0.75±0.05* 与si-NC组比较, * P<0.05。 表 3 过表达miR-1200对食管癌Eca109细胞增殖和凋亡的影响(x±s)(n=9)
组别 miR-1200 OD450 nm值 克隆形成数/个 凋亡率/% cleaved-caspase3蛋白 cleaved-caspase9蛋白 miR-NC组 1.00±0 0.83±0.07 94.51±7.93 6.49±0.53 0.23±0.02 0.29±0.02 miR-1200组 3.12±0.25* 0.42±0.05* 50.76±5.99* 18.97±1.62* 0.61±0.05* 0.69±0.05* 与miR-NC组比较, * P<0.05。 表 4 干扰miR-1200逆转干扰circ-0005273对食管癌Eca109细胞增殖和凋亡的作用(x±s)(n=9)
组别 miR-1200 OD450 nm值 克隆形成数/个 凋亡率/% cleaved-caspase3蛋白 cleaved-caspase9蛋白 si-circ-0005273+anti-miR-NC组 1.00±0 0.34±0.03 40.33±4.15 23.86±2.66 0.67±0.05 0.76±0.06 si-circ-0005273+anti-miR-1200组 0.39±0.04* 0.71±0.05* 83.48±6.56* 12.11±1.21* 0.32±0.03* 0.41±0.04* 与si-circ-0005273+anti-miR-NC组比较, * P<0.05。 -
[1] MENG L, LIU S, DING P, et al. Circular RNA ciRS-7 inhibits autophagy of ESCC cells by functioning as miR-1299 sponge to target EGFR signaling[J]. J Cell Biochem, 2020, 121(2): 1039-1049. doi: 10.1002/jcb.29339
[2] WANG H L, WANG H R, LIANG Y, et al. Hsa_circ_0006571 promotes spinal metastasis through sponging microRNA-138 to regulate sirtuin 1 expression in lung adenocarcinoma[J]. Transl Lung Cancer Res, 2020, 9(6): 2411-2427. doi: 10.21037/tlcr-20-1250
[3] ZHANG C C, LI Y, FENG X Z, et al. Circular RNA circ_0001287 inhibits the proliferation, metastasis, and radiosensitivity of non-small cell lung cancer cells by sponging microRNA miR-21 and up-regulating phosphatase and tensin homolog expression[J]. Bioengineered, 2021, 12(1): 414-425. doi: 10.1080/21655979.2021.1872191
[4] WEN Y, LI B, HE M, et al. circHIPK3 promotes proliferation and migration and invasion via regulation of miR-637/HDAC4 signaling in osteosarcoma cells[J]. Oncol Rep, 2021, 45(1): 169-179. http://www.ncbi.nlm.nih.gov/pubmed/33416147
[5] WANG X H, JI C L, HU J S, et al. Hsa_circ_0005273 facilitates breast cancer tumorigenesis by regulating YAP1-hippo signaling pathway[J]. J Exp Clin Cancer Res, 2021, 40(1): 29. doi: 10.1186/s13046-021-01830-z
[6] HOU Y S, LI X. Circ_0005273 induces the aggravation of pancreatic cancer by targeting KLF12[J]. Eur Rev Med Pharmacol Sci, 2020, 24(22): 11578-11586. https://pubmed.ncbi.nlm.nih.gov/33275224/
[7] YANG H, LI X, MENG Q, et al. CircPTK2(hsa_circ_0005273) as a novel therapeutic target for metastatic colorectal cancer[J]. Mol Cancer, 2020, 19(1): 13. doi: 10.1186/s12943-020-1139-3
[8] ZHANG W, ZHANG H, ZHAO X. circ_0005273 promotes thyroid carcinoma progression by SOX2 expression[J]. Endocr Relat Cancer, 2020, 27(1): 11-21. doi: 10.1530/ERC-19-0381
[9] PAN B, ZHAO M, WANG N, et al. LncRNA RGMB-AS1 promotes glioma growth and invasion through miR-1200/HOXB2 axis[J]. Onco Targets Ther, 2019, 12: 10107-10114. doi: 10.2147/OTT.S230098
[10] 刘明建. 肿瘤坏死因子受体相关蛋白1的表达与食管癌临床病理特征及预后的关系探讨[J]. 实用临床医药杂志, 2019, 23(6): 110-112. doi: 10.7619/jcmp.201906029 [11] WANG J, ZHU W, TAO G, et al. Circular RNA circ-LRP6 facilitates Myc-driven tumorigenesis in esophageal squamous cell cancer[J]. Bioengineered, 2020, 11(1): 932-938. doi: 10.1080/21655979.2020.1809922
[12] SHI Y, FANG N, LI Y, et al. Circular RNA LPAR3 sponges microRNA-198 to facilitate esophageal cancer migration, invasion, and metastasis[J]. Cancer Sci, 2020, 111(8): 2824-2836. doi: 10.1111/cas.14511
[13] ZOU F W, YANG S Z, LI W Y, et al. circRNA_001275 upregulates Wnt7a expression by competitively sponging miR-370-3p to promote cisplatin resistance in esophageal cancer[J]. Int J Oncol, 2020, 57(1): 151-160. http://www.ingentaconnect.com/content/sp/ijo/2020/00000057/00000001/art00012
[14] LI X Y, YANG B, SUN Y, et al. Effect of hsa_circ_RNA0023397 regulation of miR-106b expression on proliferation and apoptosis of esophageal cancer cells[J]. Eur Rev Med Pharmacol Sci, 2020, 24(17): 8855-8862. https://www.europeanreview.org/article/22825
[15] CHEN Z, YAO N, GU H, et al. Circular RNA_LARP4 sponges miR-1323 and hampers progression of esophageal squamous cell carcinoma through modulating PTEN/PI3K/AKT pathway[J]. Dig Dis Sci, 2020, 65(8): 2272-2283. doi: 10.1007/s10620-019-05973-0
[16] XING Y, ZHA W J, LI X M, et al. Circular RNA circ-Foxo3 inhibits esophageal squamous cell cancer progression via the miR-23a/PTEN axis[J]. J Cell Biochem, 2020, 121(3): 2595-2605. doi: 10.1002/jcb.29481
[17] 王晓庚, 刘林, 左健, 等. 沉默FoxM1通过促进线粒体释放细胞色素C诱导口腔鳞癌细胞凋亡[J]. 中国病理生理杂志, 2019, 35(3): 430-435. doi: 10.3969/j.issn.1000-4718.2019.03.008 [18] 余鑫, 米智华, 高巨. 自噬在机械通气致大鼠脑组织神经元凋亡中的作用[J]. 实用临床医药杂志, 2019, 23(8): 12-15, 21. doi: 10.7619/jcmp.201908003 [19] LIU Z, HU G, ZHAO Y, et al. Silence of cZNF292 suppresses the growth, migration, and invasion of human esophageal cancer Eca-109 cells via upregulating miR-206[J]. J Cell Biochem, 2020, 121(3): 2354-2362. doi: 10.1002/jcb.29458
[20] LI S, PEI Y, WANG W, et al. Circular RNA 0001785 regulates the pathogenesis of osteosarcoma as a CeRNA by sponging miR-1200 to upregulate HOXB2[J]. Cell Cycle, 2019, 18(11): 1281-1291. doi: 10.1080/15384101.2019.1618127
[21] ZHANG Z, YU X, ZHOU B, et al. Circular RNA circ_0026359 enhances cisplatin resistance in gastric cancer via targeting miR-1200/POLD4 pathway[J]. Biomed Res Int, 2020, 2020: 5103272. https://pubmed.ncbi.nlm.nih.gov/32855967/
-
期刊类型引用(0)
其他类型引用(1)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号