Effect of luteolin on the proliferation, apoptosis and Hippo/Yes-related protein pathway of lung epithelial cells induced by bleomycin
-
摘要:目的 探究木犀草素(Lut)对博来霉素(BLM)诱导的人肺正常上皮细胞(BEAS-2B细胞)增殖、凋亡及Hippo/Yes相关蛋白(YAP)通路的影响。方法 体外培养BEAS-2B细胞,使用4、8、12、24 μg/mL BLM诱导12、24、48 h,筛选BLM诱导浓度和时间。将BEAS-2B细胞分为对照组、BLM组以及Lut低、中、高浓度组。各组细胞培养24 h后,倒置显微镜观察细胞形态学变化;采用CCK-8法检测细胞增殖能力;采用流式细胞术检测细胞凋亡率;采用蛋白免疫印迹法(Western blot)检测Hippo/YAP通路相关蛋白-哺乳动物STE20样蛋白激酶1(MST1)、大肿瘤抑制因子1(LAST1)和YAP磷酸化水平。结果 BLM诱导24 h后BEAS-2B细胞的半数抑制浓度(IC50)约为8 μg/mL,所以本研究选取8 μg/mL BLM诱导细胞24 h。与对照组相比,BLM组细胞较小,边缘不规则,细胞间隙增加,细胞增殖能力、MST1、LAST1和YAP蛋白磷酸化水平显著降低(P < 0.05),凋亡率显著升高(P < 0.05);与BLM组相比,Lut低、中、高浓度组细胞形态趋于正常,细胞增殖能力、MST1、LAST1和YAP磷酸化水平依次升高(P < 0.05),凋亡率依次降低(P < 0.05)。结论 Lut可能通过激活BEAS-2B细胞中Hippo/YAP信号通路,提高BLM诱导后细胞的增殖能力,抑制细胞凋亡。Abstract:Objective To explore the effect of luteolin(Lut)on the proliferation, apoptosis and the Hippo/Yes-related protein (YAP) pathway of human lung epithelial cell (BEAS-2B cells) induced by bleomycin(BLM).Methods BEAS-2B cells were cultured in vitro, and induced with 4, 8, 12 and 24 μg/mL BLM for 12, 24 and 48 h, respectively, to determine the BLM induction concentration and time. The BEAS-2B cells were divided into control group, BLM group, and Lut low, medium and high concentration groups. After 24 hours of cell culture in each group, the morphological changes of the cells were observed with an inverted microscope; the cell proliferation ability was detected by the CCK-8 method; the rate of cell apoptosis was detected by flow cytometry; Western blot was used to detect Hippo/YAP pathway related proteins-mammalian Sterile20-like 1(MST1), the large tumour suppressor 1 (LAST1) and YAP phosphorylation levels.Results The half maximal inhibitory concentration (IC50) of BEAS-2B cells after 24 hours of BLM induction was about 8 μg/mL, so 8 μg/mL BLM was selected to induce cells for 24 hours. Compared with the control group, the BLM group had smaller cells, irregular edges, increased intercellular space, the cell proliferation ability, MST1, LAST1 and YAP phosphorylation levels significantly decreased, and apoptosis rate significantly increased (P < 0.05); compared with the BLM group, the cell morphology of the Lut low, medium, and high concentration groups tended to be normal, and the cell proliferation ability, MST1, LAST1 and YAP protein phosphorylation levels increased successively (P < 0.05), and the rate of apoptosis decreased successively (P < 0.05).Conclusion Lut may activate the Hippo/YAP signaling pathway in BEAS-2B cells, increase the proliferation of BEAS-2B cells induced by BLM, and inhibit cell apoptosis.
-
Keywords:
- luteolin /
- bleomycin /
- lung epithelial cells /
- Hippo/Yes-associated protein pathway /
- proliferation /
- apoptosis
-
肺上皮细胞是维持肺结构完整性以及正常肺功能的重要细胞[1-2]。木犀草素(Lut)可抑制下咽癌细胞、乳腺癌细胞、膀胱癌细胞增殖、侵袭和迁移并诱导其凋亡[3-5]。Hippo/Yes相关蛋白(YAP)通路已被证明与结肠癌、胃癌、肝癌等肿瘤的发生发展相关[6]; 该通路与主动脉瘤、组织纤维化、病毒性肝炎等人类疾病密切相关,通过低表达大肿瘤抑制基因2抑制Hippo信号通路,能改善急性呼吸窘迫综合征的肺水肿现象,调控肺内炎症反应[7]; YAP作为枢纽可通过调控Hippo通路抑制肝癌细胞增殖[8]。其中, 哺乳动物STE20样蛋白激酶1(MST1)和大肿瘤抑制基因(LAST1)为Hippo信号通路的上游效应蛋白,二者被磷酸化后可作用于YAP,且在正常情况下, YAP在细胞质中可参与正常组织的调节及代谢,维持细胞的正常状态。目前, Lut对博来霉素(BLM)诱导的肺上皮细胞Hippo/YAP通路及增殖凋亡的影响,尚未有报道。本研究将不同浓度的Lut应用于BLM体外诱导的BEAS-2B细胞后,检测其增殖及凋亡情况,并分析Hippo/YAP通路上MST1、LAST1和YAP的磷酸化水平,初步探讨其分子机制,为临床治疗肺损伤提供理论依据。
1. 材料与方法
1.1 材料
1.1.1 细胞株
人肺正常上皮细胞(BEAS-2B细胞,目录号: SCSP-5067), 由中国科学院典型培养物保存委员会细胞库提供。
1.1.2 主要试剂及仪器
胎牛血清(FBS)和DMEM/F12培养基均购自美国Giboc公司; 四甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)和β-actin鼠抗均购自美国Sigma公司; Lut 20 mg/支(纯度98%)购自上海源叶生物科技有限公司; 蛋白提取试剂盒、ECL显色试剂盒和BCA蛋白定量试剂盒购自北京中杉金桥生物科技有限公司; 细胞凋亡检测试剂盒购自嘉美生物技术有限公司; 96孔培养板和CKK-8试剂盒均购自上海生工生物工程有限公司; MST1、LAST1、YAP、p-MST1、p-LAST1、p-YAP兔单克隆抗体以及辣根过氧化物酶标记的羊抗兔IgG二抗均购自美国Abcam公司; 酶标仪Fax-20100购自美国INStat公司; 蛋白凝胶成像仪购自美国Bio-Red公司; CKX41倒置显微镜购自日本Olympus公司。
1.2 方法
1.2.1 细胞培养
将BEAS-2B细胞接种至含10% FBS的DMEM/F12培养基中,并置于37 ℃、含5% CO2的恒温细胞培养箱中培养,当细胞密度大于80%时,用含0.25% EDTA-Na2的胰蛋白酶消化并传代。
1.2.2 筛选BLM的诱导浓度
将对数期的BEAS-2B细胞使用含0.25% EDTA-Na2的胰蛋白酶消化,用不含FBS的DMEM/F12培养基制成细胞悬液,并调整细胞浓度为5×104个/mL, 每孔各取200 μL接种至96孔板后持续培养24 h,使细胞铺满孔底。使用适量磷酸缓冲液(PBS)溶解BLM,设置对照组(不含BLM)以及4、8、12、24 μg/mL BLM诱导12、24、48 h后的实验组,各实验组中分别加入含4、8、12、24 μg/mL BLM且用不含FBS的DMEM/F12培养基培养; 对照组细胞仅在培养基中添加溶剂。每组设置6个复孔,每孔各加入MTT溶液20 μL, 继续孵育4 h后,吸取各孔细胞上清液,加入150 μL的DMSO, 充分震荡混匀,反应15 min并用全自动酶标仪检测各孔在570 nm处的吸光度(OD值),然后计算细胞存活率。细胞存活率(%)=(实验组OD570 nm-空白组OD570 nm)/(对照组OD570 nm-空白组OD570 nm)×100%。
1.2.3 细胞分组及处理方法
以0.05% DMSO为溶剂,将Lut粉末溶解,配制Lut溶液,选取BLM 8 μg/mL作用24 h为诱导的浓度和时间。将BEAS-2B细胞分为BLM组(加入终浓度为8 μg/mL的BLM)、Lut低、中、高浓度组(根据参考文献[9]及前期预实验分别在培养基中加入终浓度为60、80、100 μmol/L的Lut和8 μg/mL的BLM混合溶液)、对照组(仅在培养基中添加等量溶剂)。各组均使用不含FBS的DMEM/F12培养基继续培养24 h后,检测各项指标。
1.2.4 倒置显微镜观察各组细胞形态
收集上述1.2.3中分组并培养24 h后的各组细胞,去除旧培养基, PBS清洗3次后,置于倒置显微镜下观察各组细胞形态。
1.2.5 CCK-8法检测各组细胞增殖能力
收集细胞接种至96孔板(1.0×105个/孔)中,使用不同浓度Lut(60、80、100 μmol/L)和8 μg/mL BLM分别处理24 h后加入10 μL CKK-8试剂于每个孔中,然后孵育2 h, 采用全自动酶标仪检测450 nm波长下各孔细胞的OD值, OD值越大表示细胞增殖能力越强。
1.2.6 流式细胞仪检测细胞凋亡率
收集上述1.2.3中分组并培养24 h后的各组细胞,按细胞凋亡检测试剂盒(FragELTM DNA Fragmentation Detection Kit)说明书严格操作,上流式细胞仪检测细胞凋亡,每组设置6个重复。
1.2.7 蛋白免疫印迹法(Western blot)方法检测BEAS-2B细胞MST1、LAST1和YAP蛋白磷酸化水平
收集上述1.2.3中分组并培养24 h后的各组细胞,使用蛋白提取试剂盒提取各组细胞总蛋白。使用BCA蛋白定量试剂盒对蛋白进行定量,然后进行SDS-PAGE、转膜、抗体封闭、1∶1 000浓度稀释后的MST1、LAST1、YAP、p-MST1、p-LAST1、p-YAP和1∶20 00浓度稀释后的β-actin一抗4 ℃过夜孵育、含辣根过氧化物酶缀合的IgG二抗中室温孵育2 h, 用ECL显色试剂盒显色,凝胶成像仪拍照,分析灰度值,以β-actin为内参,分析蛋白相对表达水平。
1.3 统计学分析
本研究所得数据均采用SPSS 22.0软件进行统计学分析,计量资料以(x±s)表示, 2组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验; P < 0.05表示差异有统计学意义。
2. 结果
2.1 BLM诱导对BEAS-2B细胞存活率的影响
随着BLM诱导浓度的升高以及诱导时间的延长, BEAS-2B细胞存活率逐渐降低(P < 0.05)。BLM诱导24 h BEAS-2B细胞的半数抑制浓度(IC50)约为8 μg/mL, 所以后续将选取8 μg/mL BLM作用24 h为BLM诱导BEAS-2B细胞的浓度和时间。见表 1。
表 1 各浓度BLM诱导不同时间后BEAS-2B细胞存活率比较(n=6)(x±s)BLM浓度 细胞存活率/% 12 h 24 h 48 h 4 μg/mL 71.78±0.95 57.41±0.25 30.82±0.22 8 μg/mL 59.79±0.37* 49.61±0.31* 25.45±0.43* 12 μg/mL 41.35±0.96*# 30.85±0.27*# 17.97±0.31*# 24 μg/mL 33.23±0.37*#△ 20.32±0.23*#△ 11.31±0.20*#△ 与同时点4 μg/mL浓度比较, *P < 0.05; 与同时点8 μg/mL浓度比较, #P < 0.05;
与同时点12 μg/mL浓度比较, △P < 0.05。2.2 Lut对BLM诱导的BEAS-2B细胞增殖能力的影响
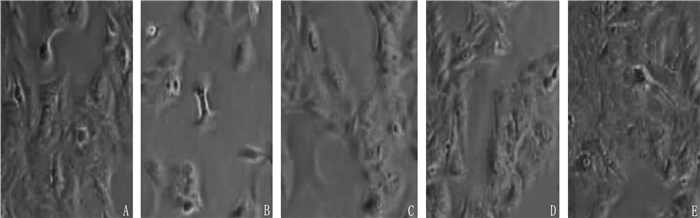
观察细胞形态后发现: 对照组细胞形态正常,大小均匀,排列紧密且呈三角形鹅卵石样,可见胞内细胞质均匀透亮; BLM组细胞较小,细胞呈梭形、纺锤形,边缘不规则,细胞间隙增加; Lut低、中、高浓度组细胞形态逐渐趋于正常。见图 1。与对照组OD值(1.00±0.00)相比, BLM组BEAS-2B细胞增殖能力OD值(0.34±0.05)显著降低(P < 0.05); 与BLM组相比, Lut低、中、高浓度组BEAS-2B细胞增殖能力OD值(0.59±0.06)、(0.72±0.09)、(0.86±0.09)逐渐升高(均P < 0.05)。
2.3 Lut对BLM诱导的BEAS-2B细胞凋亡的影响
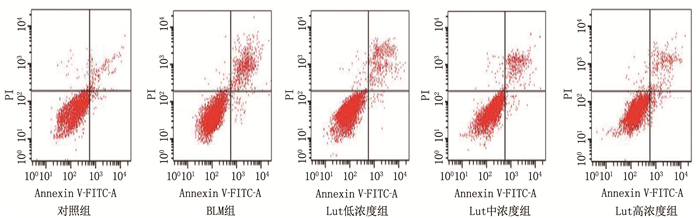
与对照组(3.05±0.41)%相比, BLM组BEAS-2B细胞凋亡率(39.79±4.59)%显著升高(P < 0.05); 与BLM组相比, Lut低、中、高浓度组BEAS-2B细胞凋亡率(21.51±2.36)%、(15.76±1.73)%、(8.30±0.94)%依次降低(均P < 0.05)。见图 2。
2.4 Lut对BLM诱导的BEAS-2B细胞Hippo/YAP通路影响
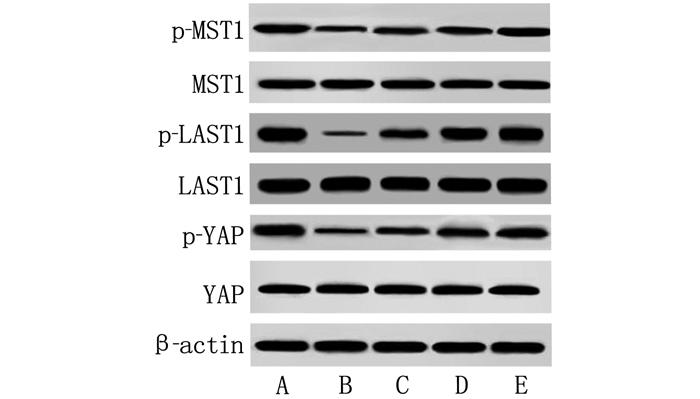
与对照组相比, BLM组BEAS-2B细胞MST1、LAST1和YAP蛋白磷酸化水平显著降低(P < 0.05); 与BLM组相比, Lut低、中、高浓度组BEAS-2B细胞MST1、LAST1和YAP蛋白磷酸化水平依次升高(P < 0.05)。见表 2、图 3。
表 2 各组BEAS-2B细胞MST1、LAST1和YAP磷酸化水平比较(x±s)组别 n p-MST1/MST1 p-LAST1/LAST1 p-YAP/YAP 对照组 6 0.87±0.09 0.92±0.11 0.95±0.10 BLM组 6 0.22±0.03* 0.19±0.02* 0.27±0.03* Lut低浓度组 6 0.52±0.06# 0.43±0.05# 0.55±0.06# Lut中浓度组 6 0.67±0.07#△ 0.62±0.07#△ 0.71±0.08#△ Lut高浓度组 6 0.80±0.11#△▲ 0.89±0.09#△▲ 0.90±0.10#△▲ 与对照组比较, *P < 0.05; 与BLM组比较, #P < 0.05; 与Lut低浓度组比较, △P < 0.05; 与Lut中浓度组比较, ▲P < 0.05。 3. 讨论
大多数肺部疾病最终会导致肺换气功能障碍、呼吸衰竭,其病情进展快,病死率高,但目前对肺部疾病的治疗手段有限且疗效不佳,多数肺部疾病均可引起肺上皮细胞损伤[10-11], 因此,研究如何改善肺上皮细胞损伤对于肺部疾病的治疗至关重要。BLM能够引起肺毒性、肺上皮细胞损伤、肺炎和肺纤维化等多种肺部疾病[12], 所以,本研究在前人研究的基础上使用不同浓度BLM诱导BEAS-2B细胞后,发现随着BLM浓度的升高以及诱导时间的延长, BEAS-2B细胞的存活率显著降低,且其诱导24 h后细胞的IC50约为8 μg/mL, 所以后续选取8 μg/mL BLM诱导细胞24 h构建体外细胞模型。
中医药治疗肺部疾病的历史源远流长,其中, Lut是一种存在于金银花、菊花、荆芥、白毛夏枯草等传统中药中的重要黄酮类化合物,具有抗炎、降糖、抗氧化、抗肿瘤等多种作用,目前在临床上常用于止咳、祛痰、降尿酸等,同时可用于治疗心血管疾病[13]。研究[14-16]发现, Lut能够抑制三阴性乳腺癌、非小细胞肺癌、结肠癌细胞的增殖、迁移及凋亡。Lut具有调节肺上皮离子转运的作用,主要通过提高急性肺损伤中上皮钠通道蛋白表达来实现[17], 治疗由脓毒症诱导的急性肺损伤[18]。但是,关于Lut对BLM诱导的BEAS-2B细胞增殖、凋亡的影响及其作用机制的报道较少。本研究使用Lut作用于BLM诱导的BEAS-2B细胞后,发现其可使形态异常的BEAS-2B细胞趋向正常,并显著提高细胞增殖能力,降低细胞凋亡率,提示Lut具有促进肺上皮细胞增殖、抑制凋亡的作用,但其中的机制尚需进一步研究。
Hippo通路是控制组织器官大小、平衡调控器官体积、调节细胞间接触抑制的重要转导通路。而YAP信号通路已经被证明与肝癌的发生及发展相关[19]。其中YAP是Hippo途径的重要影响因子,其活性对于器官生长、细胞增殖、组织更新与再生至关重要,且能够调控组织病变进程[20]。MST1和LAST1为Hippo/YAP通路的主要效应因子,其磷酸化蛋白可对YAP起作用,进而调节细胞和组织的生长和代谢功能[21]。俞晓军[22]研究发现,尼可地尔可能抑制Hippo/YAP信号通路,进而抑制肺动脉硬化体外模型中肺动脉平滑肌细胞的增殖和迁移。本研究结果显示, Lut作用于BLM诱导的BEAS-2B细胞后, Hippo通路下游MST1、LAST1和YAP磷酸化水平显著提高,提示Lut可能通过促进MST1、LAST1和YAP磷酸化水平,激活Hippo/YAP信号通路,从而提高BEAS-2B细胞增殖能力,抑制其凋亡,与上述俞晓军[22]研究结果一致。研究[23]发现, Lut可显著下调Hippo通路下游LATS1和YAP磷酸化水平,减少YAP核定位,进而改善野百合碱诱导的大鼠肺动脉高血压,但与本研究结果并不一致,可能是由于Lut在不同的组织和细胞中,对Hippo/YAP信号通路所发挥的作用不尽相同,进一步说明Lut对Hippo/YAP信号通路具有调控作用。
综上所述, Lut可能通过激活Hippo/YAP信号通路,缓解BLM诱导的BEAS-2B细胞损伤,提高细胞增殖能力,抑制凋亡。本研究为Lut治疗肺部疾病的相关机制研究提供了一定的参考。然而, BLM诱导肺上皮细胞损伤的相关分子机制十分复杂,尚需后续深入研究。
-
表 1 各浓度BLM诱导不同时间后BEAS-2B细胞存活率比较(n=6)(x±s)
BLM浓度 细胞存活率/% 12 h 24 h 48 h 4 μg/mL 71.78±0.95 57.41±0.25 30.82±0.22 8 μg/mL 59.79±0.37* 49.61±0.31* 25.45±0.43* 12 μg/mL 41.35±0.96*# 30.85±0.27*# 17.97±0.31*# 24 μg/mL 33.23±0.37*#△ 20.32±0.23*#△ 11.31±0.20*#△ 与同时点4 μg/mL浓度比较, *P < 0.05; 与同时点8 μg/mL浓度比较, #P < 0.05;
与同时点12 μg/mL浓度比较, △P < 0.05。表 2 各组BEAS-2B细胞MST1、LAST1和YAP磷酸化水平比较(x±s)
组别 n p-MST1/MST1 p-LAST1/LAST1 p-YAP/YAP 对照组 6 0.87±0.09 0.92±0.11 0.95±0.10 BLM组 6 0.22±0.03* 0.19±0.02* 0.27±0.03* Lut低浓度组 6 0.52±0.06# 0.43±0.05# 0.55±0.06# Lut中浓度组 6 0.67±0.07#△ 0.62±0.07#△ 0.71±0.08#△ Lut高浓度组 6 0.80±0.11#△▲ 0.89±0.09#△▲ 0.90±0.10#△▲ 与对照组比较, *P < 0.05; 与BLM组比较, #P < 0.05; 与Lut低浓度组比较, △P < 0.05; 与Lut中浓度组比较, ▲P < 0.05。 -
[1] 杨航, 张红. 肺泡Ⅱ型上皮细胞与肺部疾病的研究进展[J]. 安徽医药, 2021, 25(2): 217-221. doi: 10.3969/j.issn.1009-6469.2021.02.002 [2] 李莉, 王永艳, 成梦群, 等. 龙胆苦苷对博来霉素诱导肺泡上皮细胞凋亡的抑制作用[J]. 昆明医科大学学报, 2019, 40(6): 11-15. doi: 10.3969/j.issn.1003-4706.2019.06.003 [3] 高琳, 费静, 刘毅, 等. 木犀草素对下咽癌细胞FaDu抑制的作用机制研究[J]. 中国临床药理学杂志, 2020, 36(21): 3497-3499, 3518. https://www.cnki.com.cn/Article/CJFDTOTAL-GLYZ202021025.htm [4] 董欣敏, 郑媞, 张子英, 等. 木犀草素通过逆转OPCML基因甲基化抑制乳腺癌MDA-MB-231细胞增殖[J]. 南方医科大学学报, 2020, 40(4): 550-555. https://www.cnki.com.cn/Article/CJFDTOTAL-DYJD202004017.htm [5] 胡艺还, 高静, 杨宁刚, 等. 木犀草素通过抑制Akt/IKK信号通路抑制膀胱癌5637细胞迁移、侵袭和上皮间质转化[J]. 中国药理学通报, 2020, 36(8): 1083-1088. doi: 10.3969/j.issn.1001-1978.2020.08.010 [6] 齐海霞, 柴艳芬. Hippo信号通路相关分子与肿瘤发生的研究进展[J]. 医学综述, 2020, 26(4): 683-689. doi: 10.3969/j.issn.1006-2084.2020.04.012 [7] 李朗, 董亮, 高飞, 等. Hippo信号通路调控间充质干细胞对ARDS肺损伤修复效应的实验研究[J]. 中华危重病急救医学, 2019(3): 281-287. doi: 10.3760/cma.j.issn.2095-4352.2019.03.005 [8] ZHAO S, XU K, JIANG R, et al. Evodiamine inhibits proliferation and promotes apoptosis of hepatocellular carcinoma cells via the Hippo-Yes-Associated Protein signaling pathway[J]. Life Sci, 2020, 251: 117424. doi: 10.1016/j.lfs.2020.117424
[9] 缪存静, 陈俊杰, 历星, 等. 木犀草素逆转由TGF-β1诱导的人肺癌细胞上皮-间充质转化的实验研究[J]. 中国病理生理杂志, 2019, 35(7): 1163-1168. doi: 10.3969/j.issn.1000-4718.2019.07.002 [10] 刘燕, 周静珠, 周广辉, 等. C/EBPβ与肺上皮细胞间充质转化及肺纤维化的研究进展[J]. 临床肺科杂志, 2019, 24(8): 1540-1543. doi: 10.3969/j.issn.1009-6663.2019.08.045 [11] 亓水芹, 冯向功, 王慧琴. miR-194靶向FoxA1基因对LPS诱导的肺泡上皮细胞损伤影响[J]. 免疫学杂志, 2020, 36(3): 193-200. https://www.cnki.com.cn/Article/CJFDTOTAL-MYXZ202003002.htm [12] 刘思伽, 全紫瑶, 胡必成, 等. Hippo-YAP通路与肿瘤相关性研究进展[J]. 医学研究杂志, 2019, 48(7): 12-15, 27. https://www.cnki.com.cn/Article/CJFDTOTAL-YXYZ201907006.htm [13] 王清岑, 殷新, 周罗慧, 等. 木犀草素心血管保护作用研究进展[J]. 中国现代医学杂志, 2020, 30(11): 57-60. doi: 10.3969/j.issn.1005-8982.2020.11.012 [14] WU H T, LIN J, LIU Y E, et al. Luteolin suppresses androgen receptor-positive triple-negative breast cancer cell proliferation and metastasis by epigenetic regulation of MMP9 expression via the AKT/mTOR signaling pathway[J]. Phytomedicine, 2021, 81: 153437. doi: 10.1016/j.phymed.2020.153437
[15] 任开明, 周兆丽, 石文君. 木犀草素对人非小细胞肺癌A549细胞增殖、凋亡、侵袭及迁移能力的影响[J]. 解剖科学进展, 2019, 25(4): 361-363, 367. https://www.cnki.com.cn/Article/CJFDTOTAL-JPKX201904004.htm [16] 王丽芳, 赵方毓, 唐鲜娥, 等. 木犀草素通过线粒体凋亡途径诱导SW480结肠癌细胞的凋亡作用研究[J]. 中国临床药理学杂志, 2019, 35(17): 1862-1864, 1875. https://www.cnki.com.cn/Article/CJFDTOTAL-GLYZ201917008.htm [17] 刘宏飞, 候亚鹏, 金睿, 等. 木犀草素通过调节上皮钠通道影响肺上皮离子转运[J]. 中药新药与临床药理, 2020, 31(4): 402-408. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXY202004007.htm [18] 孙力超, 陈旭, 姚尧, 等. 木犀草素对脓毒症小鼠急性肺损伤的保护作用[J]. 中华急诊医学杂志, 2019, 28(6): 717-723. doi: 10.3760/cma.j.issn.1671-0282.2019.06.012 [19] 尚璐, 张骁, 陈岩, 等. Hippo/YAP信号通路调控蛋白ACAN作为新型肝细胞肝癌血清肿瘤标志物的研究[J]. 检验医学, 2019, 34(1): 60-66. https://www.cnki.com.cn/Article/CJFDTOTAL-SHYY201901015.htm [20] 陈庆, 殷焦. Hippo通路在感染及肿瘤免疫中的相关作用研究进展[J]. 解放军医学杂志, 2019, 44(9): 791-796. https://www.cnki.com.cn/Article/CJFDTOTAL-JFJY201909015.htm [21] KIM S H, JIN H, MENG R Y, et al. Activating hippo pathway via Rassf1 by ursolic acid suppresses the tumorigenesis of gastric cancer[J]. Int J Mol Sci, 2019, 20(19): 4709. doi: 10.3390/ijms20194709
[22] 俞晓军. 尼可地尔对肺动脉平滑肌细胞增殖、迁移能力和hippo/YAP信号通路的影响[J]. 中国药房, 2020, 21(22): 2736-2740. doi: 10.6039/j.issn.1001-0408.2020.22.09 [23] ZUO W Y, LIU N, ZENG Y H, et al. Luteolin ameliorates experimental pulmonary arterial hypertension via suppressing hippo-YAP/PI3K/AKT signaling pathway[J]. Front Pharmacol, 2021, 12: 663551. doi: 10.3389/fphar.2021.663551
-
期刊类型引用(4)
1. 王献珍,崔强,吴晓伟,张科伟. 藏红花素调节Hippo信号通路对病理性瘢痕成纤维细胞增殖和凋亡的影响. 微循环学杂志. 2024(01): 14-22 .  百度学术
百度学术
2. 王晗,刘正群,朱龙博,李宁,郑梓,闫峻,穆淑琴,孙超. 卫矛醇通过调节Toll样受体4/髓样分化因子88/核因子-κB信号通路缓解脂多糖诱导的猪肠道上皮细胞损伤. 动物营养学报. 2024(06): 3952-3962 .  百度学术
百度学术
3. 杜琪斌,吴冬晴,谭艺莲,罗怡然,吴蓓丽,谷丽丽. 中药活性成分对矽肺的药理作用机制研究进展. 环境与职业医学. 2023(08): 981-988 .  百度学术
百度学术
4. Can Huang,Ling Yuan,Yang Niu,Ya-Ting Yang,Yi-Fan Yang,Yi Nan,Hong-Li Dou,Joanna Japhet. Using Network Pharmacology and Molecular Docking Tools to Investigate the Potential Mechanism of Ephedra-Gypsum in the Treatment of Respiratory Diseases. World Journal of Traditional Chinese Medicine. 2023(02): 150-159 .  必应学术
必应学术
其他类型引用(2)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号