Effect of serum 25-hydroxyvitamin D3 level on cognitive function after stroke in elderly patients with first-episode cerebral infarction
-
摘要:目的 探讨血清25-羟维生素D3[25(OH)D3]对老年首发脑梗死患者卒中后认知功能的影响。方法 选取270例老年首发脑梗死患者作为研究对象,入院时评估美国国立卫生研究院卒中量表(NIHSS)评分、蒙特利尔认知量表(MoCA)评分,随访6个月,于3个月时复测MoCA评分, 6个月时评估改良Rankin量表(mRS)评分。根据3个月时MoCA评分将患者分为早期卒中后认知障碍(PSCI)组和早期卒中后认知正常(Non-PSCI)组,比较2组患者的临床资料; 采用Logistic回归分析确定老年首发脑梗死患者早期PSCI的独立影响因素; 绘制受试者工作特征(ROC)曲线评价血清25(OH)D3水平对老年首发脑梗死患者早期PSCI的预测价值; 根据血清25(OH)D3截断值将患者分为低VD组与正常VD组,比较2组间早期PSCI发病率、MoCA评分差异。结果 270例患者中,早期PSCI发病率高达60.37%(163/270)。血清25(OH)D3水平(OR=0.834, 95%CI为0.766~0.907, P < 0.001)是老年首发急性脑梗死患者早期PSCI的独立影响因素,女性患者血清25(OH)D3水平与脑梗死后早期认知功能的关联强度大于男性患者。血清25(OH)D3预测老年首发脑梗死患者早期PSCI的ROC曲线下面积为0.751(P < 0.05), 最佳截断值为23.17 ng/mL。低VD组早期PSCI发病率高于正常VD组, MoCA评分低于正常VD组,差异有统计学意义(P < 0.05)。结论 正常水平血清25(OH)D3是老年首发脑梗死患者早期PSCI的独立保护性因素。血清25(OH)D3水平会影响老年首发脑梗死患者卒中后认知功能,且对老年女性卒中后认知功能的影响要大于老年男性。Abstract:Objective To investigate the effect of serum 25-hydroxyvitamin D3[25(OH)D3] on cognitive function after stroke in elderly patients with with first-episode ischemic stroke.Methods A total of 270 elderly patients with first-episode cerebral infarction were selected as study subjects. The National Institutes of Health Stroke Scale (NIHSS) scores and Montreal Cognition Scale (MoCA) scores were assessed at admission. The follow-up period lasted 6 months, and the MoCA score was re-measured at 3 months, and the modified Rankin Scale (mRS) score was assessed at 6 months. According to the MoCA score at 3 months, the patients were divided into early post-stroke cognitive impairment (PSCI) group and early post-stroke cognitive normal (non-PSCI) group, and the clinical data of the two groups was compared. Logistic regression analysis was used to determine the independent influencing factors of early PSCI in elderly patients with first-episode cerebral infarction. Receiver operating characteristic (ROC) curve was drawn to evaluate the predictive value of serum 25(OH)D3 level on early PSCI in elderly patients with first-episode cerebral infarction. Patients were further divided into low VD group and normal VD group according to the serum 25(OH)D3 cut-off value, and the early PSCI incidence and MoCA scores between the two groups were compared.Results Among 270 patients, the incidence rate of early PSCI was as high as 60.37% (163/270). Serum 25(OH)D3 level was an independent influencing factor for early PSCI in elderly patients with first-episode acute cerebral infarction(OR=0.834, 95%CI, 0.766 to 0.907, P < 0.001). The correlation between serum 25(OH)D3 level and early cognitive function after cerebral infarction was stronger in female patients than in males. The area under ROC curve of serum 25(OH)D3 in predicting early PSCI of elderly patients with first-episode cerebral infarction was 0.751 (P < 0.05), and the best cutoff value was 23.17 ng/mL. The incidence of early PSCI in low VD group was higher than that in normal VD group, and the MoCA score was lower than that in normal VD group, the difference was statistically significant (P < 0.05).Conclusion Normal serum 25(OH)D3 is an independent protective factor for early PSCI in elderly patients with first-episode cerebral infarction. Serum 25(OH)D3 level can affect the cognitive function after stroke in elderly patients with first-episode cerebral infarction, and its effect on the cognitive function after stroke is greater in elderly women than elderly men.
-
急性脑卒中不仅会导致肢体瘫痪等运动障碍,还会引发认知功能障碍等非运动症状。卒中后认知障碍(PSCI)发病率较高,可影响患者残障功能的恢复,影响其生活质量,增加家庭与社会的负担。维生素D(VD)作为人体必需的维生素之一,主要调节血清钙磷代谢,维持骨骼健康。VD还是一种固醇类衍生物,可与受体结合发挥相应的生物学效应,而其受体广泛存在于脑内神经胶质细胞和神经元细胞中[1]。既往关于VD与认知功能障碍相关性的研究较多,但研究[2-3]结果不完全一致。本研究探讨了血清VD水平对老年首发脑梗死患者卒中后认知功能的影响,以期为老年患者PSCI的预防提供新的思路,现报告如下。
1. 对象与方法
1.1 研究对象
选取2018年4月—2020年7月在本院神经内科住院的老年脑梗死患者作为研究对象。纳入标准: ①病程不超过7 d的首发急性脑梗死患者; ②年龄>60岁者; ③接受头颅MRI检查并确诊为急性脑梗死者; ④能配合完成认知量表评估者; ⑤发病前改良Rankin量表(mRS)评分为0分者。排除标准: ①发病前合并认知功能障碍者; ②经焦虑或抑郁自评量表判定存在焦虑或抑郁者; ③行静脉溶栓或介入取栓者; ④关键部位梗死(如额颞叶、海马、胼胝体、丘脑)者; ⑤发病前有颅脑外伤、脑出血、脑肿瘤或其他脑部疾病者; ⑥帕金森病等神经退行性疾病患者; ⑦合并有严重心、肺疾病或恶性肿瘤者; ⑧随访期间再发脑血管病者。本研究通过医院伦理委员会审核批准,所有患者或其家属签署知情同意书。
1.2 方法
收集所有入选患者的临床资料,包括性别、年龄、受教育年限、既往史、烟酒史、病程等。入院第2天抽取患者空腹静脉血,检测血钙、血清25-羟维生素D3[25(OH)D3]、血清甲状旁腺素、血脂、同型半胱氨酸等血清学指标水平。所有患者接受头颅MRI检查,扫描序列包括弥散加权成像(DWI)、T1加权像(T1WI)、T2加权像(T2WI)和液体衰减反转恢复序列(T2-FLAIR), 扫描覆盖全脑部。脑梗死病因采用类肝素药物治疗急性缺血性脑卒中试验(TOAST)分型进行分类; 梗死部位采用牛津郡社区卒中计划(OCSP)分型进行分类。脑梗死体积计算采用PULLICINO P M等[4]提出的公式。依据头颅MRI冠状位影像,采用内侧颞叶萎缩(MTA)评分表[5]评定海马体萎缩程度; 脑白质疏松严重程度的评定采用Fazekas量表分级方法[6]。所有患者入院时接受美国国立卫生研究院卒中量表(NIHSS)、蒙特利尔认知量表(MoCA)评估,随访6个月, 3个月时复测MoCA评分, 6个月时评估mRS评分。研究期间,所有患者均未接受任何可能影响认知功能的药物治疗或康复治疗。
1.3 观察指标
发病前认知功能采用老年人认知功能减退知情者问卷(IQCODE)[7]评估,发病后认知功能采用MoCA评估,神经功能缺损程度采用NIHSS评估,脑梗死后6个月的预后采用mRS评估。MoCA评分总分30分, < 26分认为存在认知障碍; 评估MoCA各亚项评分,包括视空间/执行功能、命名、记忆、注意力、言语、抽象能力、定向力。MoCA评分由专门受过上海交通大学阿尔茨海默病诊治中心培训并获得量表评估员认证资格的医师进行评估,采用统一标准,尽可能确保评分的一致性和可靠性。MoCA是筛查认知功能障碍的简单有效的工具,其检测出轻度认知功能损害的特异性、敏感性高于简易精神状态量表(MMSE)[8]。入院时MoCA评分采用中文普通话版(v7.1)MoCA进行评估, 3个月时MoCA评分采用北京版MoCA进行评估。mRS评分≤2分判定为转归良好, >2分判定为转归不良。
1.4 统计学分析
采用SPSS 26.0统计学软件分析数据。定性资料以[n(%)]表示,组间比较采用卡方检验; 符合正态分布的定量资料以(x±s)表示, 2组间独立样本比较采用t检验; 不符合正态分布的定量资料以中位数和四分位数间距[M(P25, P75)]表示, 2组间独立样本比较采用Mann-Whitney U检验。采用Logistic回归分析确定老年首发急性脑梗死患者早期PSCI的独立影响因素。血清25(OH)D3与脑梗死后3个月MoCA评分的相关性采用Spearman相关系数分析。绘制受试者工作特征(ROC)曲线评估血清维生素D水平对老年首发脑梗死患者早期PSCI的预测价值。P < 0.05为差异有统计学意义。
2. 结果
2.1 一般资料及临床资料比较
本研究纳入首发急性脑梗死患者289例,剔除失访者12例、随访期间再发脑梗死或短暂性脑缺血发作者6例、死亡者1例后,最终共纳入270例患者,其中女118例,男152例,平均年龄(71.43±6.48)岁。根据脑梗死后3个月时的MoCA评分,将患者分为早期PSCI组与早期卒中后认知正常(Non-PSCI)组,其中早期PSCI组患者163例,占60.37%。
与早期Non-PSCI组比较, 早期PSCI组受教育年限较短,高血压患病率较高,血清25(OH)D3水平、MoCA评分较低,血清甲状旁腺素、同型半胱氨酸、胱抑素C水平和脑白质疏松Fazekas评分较高,差异均有统计学意义(P < 0.05)。2组性别、年龄、既往史、烟酒史、血脂、尿酸、血钙、脑梗死特点(TOAST分型、OCSP分型、部位、梗死体积)、MTA评分、NIHSS评分比较,差异均无统计学意义(P>0.05)。早期PSCI组6个月转归不良率高于早期Non-PSCI组,差异有统计学意义(P < 0.05)。见表 1。
表 1 2组患者一般资料及临床资料比较(x±s)[n(%)][M(P25, P75)]指标 早期PSCI组(n=163) 早期Non-PSCI组(n=107) t/Z/X2 P 性别 女 77(47.24) 41(38.32) 2.090 0.148 男 86(52.76) 66(61.68) 年龄/岁 72.02±6.27 70.54±6.72 1.839 0.067 受教育年限/年 7.20±4.76 9.78±3.27 -5.270 < 0.001 病程/d 2.55±1.61 2.68±1.86 -0.588 0.557 高血压 145(88.96) 73(68.22) 17.856 < 0.001 糖尿病 51(31.29) 39(36.45) 0.774 0.379 冠心病 38(23.31) 20(18.69) 0.828 0.366 房颤 24(14.72) 16(14.95) 0.003 0.959 吸烟史 22(13.50) 18(16.82) 0.566 0.452 酗酒史 16(9.82) 13(12.15) 0.367 0.545 血钙/(mmol/L) 2.17±0.09 2.18±0.09 -1.018 0.310 血清25(OH)D3/(ng/mL) 21.19±5.70 27.42±7.33 -7.830 < 0.001 甲状旁腺素/(pg/mL) 46.21±17.34 41.55±16.22 2.215 0.028 同型半胱氨酸/(μmol/L) 16.74±11.79 11.44±3.52 5.379 < 0.001 尿酸/(μmol/L) 335.96±105.73 323.97±94.13 0.951 0.342 胱抑素C/(mg/L) 1.16±0.41 1.06±0.24 2.570 0.011 总胆固醇/(mmol/L) 4.24±1.07 4.26±1.03 -0.159 0.874 甘油三酯/(mmol/L) 1.75±0.87 1.77±0.92 -0.139 0.889 高密度脂蛋白胆固醇/(mmol/L) 1.19±0.30 1.20±0.28 -0.144 0.885 低密度脂蛋白胆固醇/(mmol/L) 2.64±0.84 2.75±0.87 -1.053 0.293 C反应蛋白/(mg/L) 3.46(1.63, 7.04) 3.41(1.46, 7.06) 0.335 0.737 脂蛋白磷脂酶2/(ng/mL) 166.54±147.73 179.93±164.92 -0.696 0.487 TOAST分型 大动脉 64(39.26) 35(32.71) 4.564 0.335 小血管 86(52.76) 58(54.21) 心源性 12(7.36) 11(10.28) 其他病因 0 2(1.87) 不明原因 1(0.61) 1(0.93) OCSP分型 部分前循环 61(37.42) 29(27.10) 3.634 0.163 腔隙性 52(31.90) 44(41.12) 后循环 50(30.67) 34(31.78) 部位 左侧 63(38.65) 51(47.66) 3.036 0.219 右侧 88(53.99) 52(48.60) 双侧 12(7.36) 4(3.74) 梗死部位 基底节 69(42.33) 44(41.12) 4.028 0.258 脑干 34(20.86) 22(20.56) 小脑 34(20.86) 15(14.02) 枕叶 26(15.95) 26(24.30) 梗死体积/cm3 3.96±2.14 4.06±2.23 0.362 0.717 Fazekas评分/分 3.00(2.00, 4.00) 2.00(1.00, 3.00) 4.374 < 0.001 MTA评分/分 1.00(1.00, 2.00) 1.00(0.00, 2.00) 0.584 0.559 NIHSS评分/分 4.02±1.35 4.01±1.13 0.097 0.923 MoCA评分/分 20.44±4.12 27.21±1.55 -19.012 < 0.001 转归不良 59(36.20) 14(13.08) 17.492 < 0.001 25(OH)D3: 25-羟维生素D3; TOAST: 类肝素药物治疗急性缺血性脑卒中试验; OCSP: 牛津郡社区卒中计划;
MTA: 内侧颞叶萎缩; NIHSS: 美国国立卫生研究院卒中量表; MoCA: 蒙特利尔认知量表。2.2 老年首发脑梗死患者早期PSCI的影响因素分析
以老年患者首发脑梗死后3个月是否发生PSCI为因变量,纳入所有混杂因素,行多变量Logistic回归分析,结果发现高血压、血清同型半胱氨酸水平高、脑白质疏松Fazekas评分高是老年首发脑梗死患者早期PSCI的独立危险因素(P < 0.05), 受教育年限长与血清25(OH)D3水平高是早期PSCI的独立保护因素(P < 0.05), 见表 2。
表 2 老年首发脑梗死患者早期PSCI的影响因素因素 OR 95%CI P 受教育年限 0.813 0.734~0.900 < 0.001 高血压 5.493 1.994~15.132 0.001 同型半胱氨酸 1.476 1.252~1.740 < 0.001 脑白质疏松Fazekas评分 2.034 1.299~3.184 0.002 血清25(OH)D3 0.834 0.766~0.907 < 0.001 25(OH)D3: 25-羟维生素D3。 不同患者群体血清25(OH)D3水平与脑梗死后3个月MoCA总分的Spearman相关系数分析结果提示,全部患者、女性患者、男性患者的血清25(OH)D3水平均与脑梗死后早期认知功能呈显著正相关(P < 0.05), 且女性患者的关联强度大于男性患者,见表 3。
表 3 不同患者群体血清25(OH)D3水平与脑梗死后3个月MoCA总分的相关性血清25(OH)D3水平 早期MoCA总分 相关系数ρ P 全部患者 0.440 < 0.001 女性患者 0.545 < 0.001 男性患者 0.324 < 0.001 25(OH)D3: 25-羟维生素D3; MoCA: 蒙特利尔认知量表。 全部患者血清25(OH)D3水平与脑梗死后3个月MoCA亚项评分的Spearman相关系数分析结果提示,血清25(OH)D3水平与脑梗死后早期视空间/执行功能、命名、注意力、语言、延迟回忆、定向力均呈显著正相关(P < 0.05), 见表 4。
表 4 全部患者血清25(OH)D3水平与脑梗死后3个月MoCA亚项评分的相关性MoCA亚项评分 血清25(OH)D3水平 相关系数ρ P 视空间/执行功能 0.508 < 0.001 命名 0.129 0.034 注意力 0.314 < 0.001 语言 0.125 0.039 抽象 0.119 0.052 延迟回忆 0.234 < 0.001 定向力 0.160 0.008 25(OH)D3: 25-羟维生素D3; MoCA: 蒙特利尔认知量表。 2.3 血清25(OH)D3水平对老年首发脑梗死患者早期PSCI的预测价值
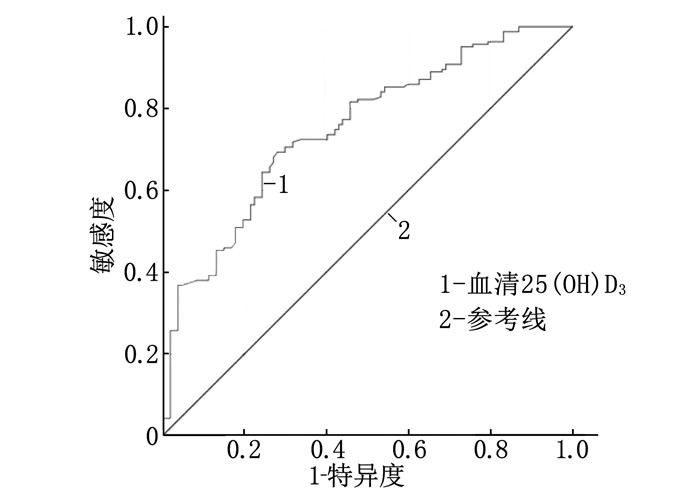
绘制ROC曲线评估血清25(OH)D3水平对老年首发脑梗死患者早期PSCI的预测价值,结果显示血清25(OH)D3水平预测早期PSCI的最佳截断值为23.17 ng/mL, 曲线下面积为0.751(95%CI为0.693~0.809, P < 0.001), 对应的敏感度为0.693, 特异度为0.720, 见图 1。
2.4 不同25(OH)D3水平组患者卒中后早期认知功能比较
按血清25(OH)D3最佳截断值23.17 ng/mL将患者分组, < 23.17 ng/mL者纳入低VD组, ≥23.17 ng/mL者纳入正常VD组。低VD组早期PSCI的发病率高于正常VD组, MoCA评分低于正常VD组, MoCA亚项中视空间/执行功能、注意力、抽象及延迟回忆评分低于正常VD组,差异均有统计学意义(P < 0.05), 见表 5。
表 5 低VD组与正常VD组卒中后早期认知功能比较(x±s)[n(%)]指标 低VD组 正常VD组 (n=160) (n=110) PSCI 124(77.50)* 39(35.45) MoCA评分/分 21.98±4.72* 24.78±4.18 MoCA亚项评分/分 视空间/执行功能 2.84±1.54* 3.98±1.02 命名 2.69±0.59 2.77±0.54 注意力 4.26±1.40* 5.02±1.02 语言 2.39±1.00 2.58±0.73 抽象 1.67±0.61* 1.81±0.44 延迟回忆 2.14±1.69* 2.89±1.56 定向力 5.11±1.02 5.33±0.88 PSCI: 卒中后认知障碍; MoCA: 蒙特利尔认知量表;
25(OH)D3: 25-羟维生素D3。与正常VD组比较, *P < 0.05。3. 讨论
相关研究[9]发现,急性脑梗死患者PSCI的发病率达到80%以上,而认知障碍会影响患者脑梗死后残障功能康复以及远期预后。临床提倡急性脑梗死患者尽早进行康复训练,早期PSCI相较迟发性PSCI对神经功能恢复的影响更大。脑梗死急性期认知功能受多种因素的影响,本研究将早期PSCI定义为卒中后3个月时发生的认知功能障碍,结果显示早期PSCI患者脑梗死后6个月转归不良率显著高于认知正常者。
本研究发现,在老年首发脑梗死患者中,血清25(OH)D3水平低下会导致早期PSCI发病率升高和MoCA评分降低,对MoCA亚项评分普遍有影响,无明显选择性。人体内VD来源于日常摄入的富含VD的食物和阳光中紫外线照射后皮肤合成。老年人群由于日晒时间缩短以及胃肠道对食物中VD吸收能力下降,相较其他成年人群更易发生VD缺乏[10]。血清25(OH)D3水平能综合反映膳食摄入、紫外线照射等多种途径摄入VD的水平,是反映人体VD营养状态和活性的最适宜的指标[11]。VD是一种能通过血脑屏障的亲脂性分子,通过结合VD受体而发挥作用, VD受体广泛存在于皮层神经元[1], 包括影响学习能力和情景记忆的海马体。国内外关于VD与认知功能相关性的研究较多,但结果并不一致,考虑与纳入人群的年龄跨度较大、种族差异有关,且既往研究关注的认知障碍并未区分类型,可能引起一定偏倚。鉴于此,本研究将研究对象的年龄跨度缩小(仅针对老年人群),且将认知功能障碍限定于首发脑梗死后早期PSCI。
血清25(OH)D3水平低下对老年首发脑梗死患者早期PSCI有一定预测价值,其影响脑梗死后认知功能的机制有以下几种可能: ① VD受体在人脑组织中尤其是海马区广泛表达, VD可能通过其特异性受体减少大脑β-淀粉样蛋白(Aβ)沉积[12], 减轻海马神经炎性反应,减少皮层和海马区神经元死亡,起到神经保护作用[13], 从而延缓认知障碍的发生与发展; ② VD受体基因多态性与认知功能障碍相关, VD还可通过上调其受体表达,对抗谷氨酸毒性,控制活性氧和一氧化氮产生的自由基,从而发挥神经保护作用和抗氧化作用[13-14]; ③ VD缺乏会加重胰岛素抵抗,增大代谢障碍风险[15]>, 促使脑小血管病的发生。既往已有大量研究[16-17]明确了脑小血管病与认知功能障碍有密切关系,故推测血清VD水平低下可能通过损害脑小血管而间接影响认知功能。
老年女性绝经后雌激素水平发生显著变化,且对富含VD食物的摄入量、运动量不如男性,故不同性别患者的血清VD水平随年龄下降的速度会有所差异。本研究发现,老年女性患者血清25(OH)D3水平与早期PSCI的关联强度大于老年男性患者,说明血清VD水平对老年女性PSCI的影响大于老年男性,这可能是由于雌激素的神经保护作用减弱[18], 女性更容易受到低水平血清VD对卒中后认知功能的不利影响。临床医生对老年女性急性脑梗死患者需更加关注血清VD水平,若存在血清VD水平低下,应警惕早期PSCI的发生,加强随访,以便尽早发现并尽早干预。
本研究还发现,受教育年限长是老年急性脑梗死患者早期PSCI的独立保护因素。相关研究[19]发现,受教育程度越高,知识储备量越大,患者PSCI的发病率越低,与本研究结果一致。高血压、高同型半胱氨酸血症、脑白质疏松均是老年脑梗死患者早期PSCI的独立危险因素,因此对于患高血压、高同型半胱氨酸血症、脑白质疏松的患者,发生急性脑梗死后应常规筛查,随访卒中后认知功能状况。
本研究存在一定局限性: 首先,本研究为单中心研究,患者均来自本院神经内科,可能会存在一定的选择偏倚; 其次,本研究纳入的混杂因素有限,而影响老年人卒中后认知功能的因素可能还有睡眠状况、VD受体基因型等。因此,后期还应纳入更多的混杂因素开展多中心、大样本量的研究,从而为老年人PSCI的防治提供更深层次的依据。
综上所述,老年首发急性脑梗死患者早期PSCI的发病率较高,高血压、高同型半胱氨酸血症、脑白质疏松、受教育年限短均是早期PSCI的独立危险因素。血清25(OH)D3水平会影响老年首发脑梗死患者卒中后认知功能(尤其是视空间/执行功能、注意力、抽象及延迟回忆功能),是老年首发脑梗死患者早期PSCI的独立影响因素,且对老年女性患者的影响大于老年男性患者。
-
表 1 2组患者一般资料及临床资料比较(x±s)[n(%)][M(P25, P75)]
指标 早期PSCI组(n=163) 早期Non-PSCI组(n=107) t/Z/X2 P 性别 女 77(47.24) 41(38.32) 2.090 0.148 男 86(52.76) 66(61.68) 年龄/岁 72.02±6.27 70.54±6.72 1.839 0.067 受教育年限/年 7.20±4.76 9.78±3.27 -5.270 < 0.001 病程/d 2.55±1.61 2.68±1.86 -0.588 0.557 高血压 145(88.96) 73(68.22) 17.856 < 0.001 糖尿病 51(31.29) 39(36.45) 0.774 0.379 冠心病 38(23.31) 20(18.69) 0.828 0.366 房颤 24(14.72) 16(14.95) 0.003 0.959 吸烟史 22(13.50) 18(16.82) 0.566 0.452 酗酒史 16(9.82) 13(12.15) 0.367 0.545 血钙/(mmol/L) 2.17±0.09 2.18±0.09 -1.018 0.310 血清25(OH)D3/(ng/mL) 21.19±5.70 27.42±7.33 -7.830 < 0.001 甲状旁腺素/(pg/mL) 46.21±17.34 41.55±16.22 2.215 0.028 同型半胱氨酸/(μmol/L) 16.74±11.79 11.44±3.52 5.379 < 0.001 尿酸/(μmol/L) 335.96±105.73 323.97±94.13 0.951 0.342 胱抑素C/(mg/L) 1.16±0.41 1.06±0.24 2.570 0.011 总胆固醇/(mmol/L) 4.24±1.07 4.26±1.03 -0.159 0.874 甘油三酯/(mmol/L) 1.75±0.87 1.77±0.92 -0.139 0.889 高密度脂蛋白胆固醇/(mmol/L) 1.19±0.30 1.20±0.28 -0.144 0.885 低密度脂蛋白胆固醇/(mmol/L) 2.64±0.84 2.75±0.87 -1.053 0.293 C反应蛋白/(mg/L) 3.46(1.63, 7.04) 3.41(1.46, 7.06) 0.335 0.737 脂蛋白磷脂酶2/(ng/mL) 166.54±147.73 179.93±164.92 -0.696 0.487 TOAST分型 大动脉 64(39.26) 35(32.71) 4.564 0.335 小血管 86(52.76) 58(54.21) 心源性 12(7.36) 11(10.28) 其他病因 0 2(1.87) 不明原因 1(0.61) 1(0.93) OCSP分型 部分前循环 61(37.42) 29(27.10) 3.634 0.163 腔隙性 52(31.90) 44(41.12) 后循环 50(30.67) 34(31.78) 部位 左侧 63(38.65) 51(47.66) 3.036 0.219 右侧 88(53.99) 52(48.60) 双侧 12(7.36) 4(3.74) 梗死部位 基底节 69(42.33) 44(41.12) 4.028 0.258 脑干 34(20.86) 22(20.56) 小脑 34(20.86) 15(14.02) 枕叶 26(15.95) 26(24.30) 梗死体积/cm3 3.96±2.14 4.06±2.23 0.362 0.717 Fazekas评分/分 3.00(2.00, 4.00) 2.00(1.00, 3.00) 4.374 < 0.001 MTA评分/分 1.00(1.00, 2.00) 1.00(0.00, 2.00) 0.584 0.559 NIHSS评分/分 4.02±1.35 4.01±1.13 0.097 0.923 MoCA评分/分 20.44±4.12 27.21±1.55 -19.012 < 0.001 转归不良 59(36.20) 14(13.08) 17.492 < 0.001 25(OH)D3: 25-羟维生素D3; TOAST: 类肝素药物治疗急性缺血性脑卒中试验; OCSP: 牛津郡社区卒中计划;
MTA: 内侧颞叶萎缩; NIHSS: 美国国立卫生研究院卒中量表; MoCA: 蒙特利尔认知量表。表 2 老年首发脑梗死患者早期PSCI的影响因素
因素 OR 95%CI P 受教育年限 0.813 0.734~0.900 < 0.001 高血压 5.493 1.994~15.132 0.001 同型半胱氨酸 1.476 1.252~1.740 < 0.001 脑白质疏松Fazekas评分 2.034 1.299~3.184 0.002 血清25(OH)D3 0.834 0.766~0.907 < 0.001 25(OH)D3: 25-羟维生素D3。 表 3 不同患者群体血清25(OH)D3水平与脑梗死后3个月MoCA总分的相关性
血清25(OH)D3水平 早期MoCA总分 相关系数ρ P 全部患者 0.440 < 0.001 女性患者 0.545 < 0.001 男性患者 0.324 < 0.001 25(OH)D3: 25-羟维生素D3; MoCA: 蒙特利尔认知量表。 表 4 全部患者血清25(OH)D3水平与脑梗死后3个月MoCA亚项评分的相关性
MoCA亚项评分 血清25(OH)D3水平 相关系数ρ P 视空间/执行功能 0.508 < 0.001 命名 0.129 0.034 注意力 0.314 < 0.001 语言 0.125 0.039 抽象 0.119 0.052 延迟回忆 0.234 < 0.001 定向力 0.160 0.008 25(OH)D3: 25-羟维生素D3; MoCA: 蒙特利尔认知量表。 表 5 低VD组与正常VD组卒中后早期认知功能比较(x±s)[n(%)]
指标 低VD组 正常VD组 (n=160) (n=110) PSCI 124(77.50)* 39(35.45) MoCA评分/分 21.98±4.72* 24.78±4.18 MoCA亚项评分/分 视空间/执行功能 2.84±1.54* 3.98±1.02 命名 2.69±0.59 2.77±0.54 注意力 4.26±1.40* 5.02±1.02 语言 2.39±1.00 2.58±0.73 抽象 1.67±0.61* 1.81±0.44 延迟回忆 2.14±1.69* 2.89±1.56 定向力 5.11±1.02 5.33±0.88 PSCI: 卒中后认知障碍; MoCA: 蒙特利尔认知量表;
25(OH)D3: 25-羟维生素D3。与正常VD组比较, *P < 0.05。 -
[1] WANG Y J, ZHU J G, DELUCA H F. Where is the vitamin D receptor[J]. Arch Biochem Biophys, 2012, 523(1): 123-133. doi: 10.1016/j.abb.2012.04.001
[2] OWUSU J E, ISLAM S, KATUMULUWA S S, et al. Cognition and Vitamin D in Older African-American Women-Physical performance and Osteoporosis prevention with vitamin D in older African Americans Trial and Dementia[J]. J Am Geriatr Soc, 2019, 67(1): 81-86. doi: 10.1111/jgs.15607
[3] JORDE R, KUBIAK J, SVARTBERG J, et al. Vitamin D supplementation has no effect on cognitive performance after four months in mid-aged and older subjects[J]. J Neurol Sci, 2019, 396: 165-171. doi: 10.1016/j.jns.2018.11.020
[4] PULLICINO P M, PORDELL R. Computed tomography and magnetic resonance of subcortical ischemic lesions[J]. Adv Neurol, 1993, 62: 73-92. http://www.ncbi.nlm.nih.gov/pubmed/8517213
[5] SCHELTENS P, LAUNER L J, BARKHOF F, et al. Visual assessment of medial temporal lobe atrophy on magnetic resonance imaging: interobserver reliability[J]. J Neurol, 1995, 242(9): 557-560. doi: 10.1007/BF00868807
[6] FAZEKAS F, CHAWLUK J B, ALAVI A, et al. MR signal abnormalities at 1.5 T in Alzheimer's dementia and normal aging[J]. AJR Am J Roentgenol, 1987, 149(2): 351-356. doi: 10.2214/ajr.149.2.351
[7] PARK M H. Informant questionnaire on cognitive decline in the elderly (IQCODE) for classifying cognitive dysfunction as cognitively normal, mild cognitive impairment, and dementia[J]. Int Psychogeriatr, 2017, 29(9): 1461-1467. doi: 10.1017/S1041610217000965
[8] PINTO T C C, MACHADO L, BULGACOV T M, et al. Is the Montreal Cognitive Assessment (MoCA) screening superior to the Mini-Mental State Examination (MMSE) in the detection of mild cognitive impairment (MCI) and Alzheimer's Disease (AD) in the elderly[J]. Int Psychogeriatr, 2019, 31(4): 491-504. doi: 10.1017/S1041610218001370
[9] JOKINEN H, MELKAS S, YLIKOSKI R, et al. Post-stroke cognitive impairment is common even after successful clinical recovery[J]. Eur J Neurol, 2015, 22(9): 1288-1294. doi: 10.1111/ene.12743
[10] JOLLIFFE D A, HANIFA Y, WITT K D, et al. Environmental and genetic determinants of vitamin D status among older adults in London, UK[J]. J Steroid Biochem Mol Biol, 2016, 164: 30-35. doi: 10.1016/j.jsbmb.2016.01.005
[11] 成乐, 赵海峰. 中国老年人维生素D摄入与认知障碍防治进展[J]. 中华疾病控制杂志, 2020, 24(5): 602-606. https://www.cnki.com.cn/Article/CJFDTOTAL-JBKZ202005021.htm [12] JIA J Y, HU J, HUO X X, et al. Effects of vitamin D supplementation on cognitive function and blood Aβ-related biomarkers in older adults with Alzheimer′s disease: a randomised, double-blind, placebo-controlled trial[J]. J Neurol Neurosurg Psychiatry, 2019, 90(12): 1347-1352. http://jnnp.bmj.com/content/early/2019/07/11/jnnp-2018-320199.full
[13] YAMINI P, RAY R S, CHOPRA K. Vitamin D3 attenuates cognitive deficits and neuroinflammatory responses in ICV-STZ induced sporadic Alzheimer′s disease[J]. Inflammopharmacology, 2018, 26(1): 39-55. doi: 10.1007/s10787-017-0372-x
[14] GUO X, YUAN J, WANG J, et al. Calcitriol alleviates global cerebral ischemia-induced cognitive impairment by reducing apoptosis regulated by VDR/ERK signaling pathway in rat Hippocampus[J]. Brain Res, 2019, 1724: 146430. doi: 10.1016/j.brainres.2019.146430
[15] GARBOSSA S G, FOLLI F. Vitamin D, sub-inflammation and insulin resistance. A window on a potential role for the interaction between bone and glucose metabolism[J]. Rev Endocr Metab Disord, 2017, 18(2): 243-258. doi: 10.1007/s11154-017-9423-2
[16] ZHANG C E, WONG S M, UITERWIJK R, et al. Intravoxel incoherent motion imaging in small vessel disease: microstructural integrity and microvascular perfusion related to cognition[J]. Stroke, 2017, 48(3): 658-663. doi: 10.1161/STROKEAHA.116.015084
[17] RENSMA S P, VAN SLOTEN T T, HOUBEN A J H M, et al. Microvascular dysfunction is associated with worse cognitive performance: the maastricht study[J]. Hypertension, 2020, 75(1): 237-245. doi: 10.1161/HYPERTENSIONAHA.119.13023
[18] LIU L L, ZHANG C, LV X, et al. Sex-specific associations between lipids and cognitive decline in the middle-aged and elderly: a cohort study of Chinese adults[J]. Alzheimer′s Res Ther, 2020, 12(1): 164. doi: 10.1186/s13195-020-00731-1
[19] OJALA-OKSALA J, JOKINEN H, KOPSI V, et al. Educational history is an independent predictor of cognitive deficits and long-term survival in postacute patients with mild to moderate ischemic stroke[J]. Stroke, 2012, 43(11): 2931-2935. doi: 10.1161/STROKEAHA.112.667618
-
期刊类型引用(6)
1. 黄晨岚. 25羟维生素D、超敏c反应蛋白、估计肾小球滤过率与脑萎缩相关性的临床研究. 黑龙江医药. 2024(01): 44-47 .  百度学术
百度学术
2. 桂千,侯晓夏,徐勤荣,冯红选,吴冠会,卢艳丽,程庆璋. 脑微出血与非关键部位脑梗死患者认知功能的相关性. 实用临床医药杂志. 2023(13): 43-47+52 .  本站查看
本站查看
3. 蹇秋枫,徐荣华,姚倩,周媛媛. 中国老年脑卒中患者认知障碍患病率和影响因素的Meta分析. 中国全科医学. 2023(32): 4070-4079+4088 .  百度学术
百度学术
4. 李梦洁,肖佳男,刘文娟,练芮含,张丽秀. 外周血1, 25-(OH)_2D_3、神经元特异性烯醇化酶、神经胶质纤维酸性蛋白在小儿复杂性惊厥中的表达意义. 中国儿童保健杂志. 2023(11): 1254-1259 .  百度学术
百度学术
5. 张丽. 脑梗死后认知功能损害与神经功能恢复及生活质量的相关性研究. 临床研究. 2022(08): 77-80 .  百度学术
百度学术
6. 雷霄明,薛孟周,夏彬,李晶,郭平平. 血清25-羟维生素D和脂联素与脑白质损伤患者认知功能的相关性研究. 实用临床医药杂志. 2022(19): 33-37 .  本站查看
本站查看
其他类型引用(1)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号