Correlation between programmed cell death-1 receptor gene polymorphism and sensitivity to platinum-based chemotherapy in gastric cancer
-
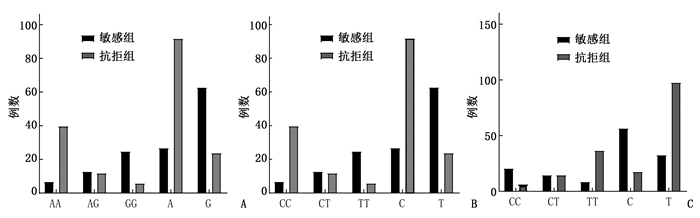
摘要:目的 探讨程序性死亡受体1(PD-1)基因rs36084323、rs2227982、rs7421861位点多态性与胃癌铂类药物化疗敏感性的相关性。方法 选取103例胃癌患者作为研究对象,给予奥沙利铂联合替吉奥(SOX)方案或者紫杉醇脂质体联合顺铂、5-氟尿嘧啶(PCF)方案化疗2个周期,化疗结束后根据实体肿瘤疗效评价标准(RECIST)1.1版将患者分为敏感组45例和抗拒组58例。化疗结束后,采集患者外周静脉血,应用TaqMan探针单核苷酸多态性(SNP)基因分型技术检测PD-1基因rs36084323、rs2227982、rs7421861位点多态性,并分析其与胃癌患者铂类药物化疗敏感性的关系。结果 PD-1基因rs36084323、rs2227982、rs7421861位点基因型频率分布均符合Hardy-Weinberg平衡定律(P>0.05);敏感组与抗拒组的rs2227982、rs7421861位点PD-1基因型、等位基因分布情况比较,差异有统计学意义(P < 0.05)。rs2227982位点TT基因型(OR=1.739,95% CI为1.656~1.867)、CT基因型(OR=1.524,95% CI为1.435~1.663)化疗敏感性较CC基因型提高,T等位基因化疗敏感性较C等位基因提高(OR=1.721,95% CI为1.603~1.851),差异有统计学意义(P < 0.05);rs7421861位点TT基因型(OR=1.605,95% CI为1.556~1.767)、CT基因型(OR=1.414,95% CI为1.372~1.525)化疗敏感性较CC基因型降低,T等位基因化疗敏感性较C等位基因降低(OR=1.531,95% CI为1.423~1.672),差异有统计学意义(P < 0.05)。Logistic回归分析结果显示,分化程度、PD-1基因rs2227982位点多态性、rs7421861位点多态性与胃癌患者铂类药物化疗敏感性显著相关(P < 0.01)。结论 PD-1基因rs2227982、rs7421861位点多态性可能与胃癌患者铂类药物化疗敏感性有关,rs2227982位点携带T等位基因者对铂类药物化疗反应性更好,rs7421861位点携带T等位基因者对铂类药物化疗反应性较差。Abstract:Objective To investigate the correlations between rs36084323, rs2227982, rs7421861 polymorphisms of programmed cell death-1 receptor (PD-1) and sensitivity to platinum-based chemotherapy in gastric cancer.Methods One hundred and three gastric cancer patients were selected as study objects, and given two cycles of oxaliplatin plus tiggio (SOX) or cisplatin, paclitaxel plus 5-fluorouracil (PCF) chemotherapy. After chemotherapy, the patients were divided into sensitive group (45 cases) and resistant group (58 cases) according to RECIST 1.1 version of solid tumor efficacy evaluation criteria(RECIST). After chemotherapy, peripheral venous blood was collected, and the polymorphism of rs36084323, rs2227982 and rs7421861 of PD-1 gene was detected by the TaqMan probe single nucleotide polymorphism (SNP) genotyping technique, and the relationship between the polymorphism and the susceptibility of patients with gastric cancer to platinum chemotherapy was analyzed.Results The genotype frequency distribution of rs36084323, rs2227982 and rs7421861 of PD-1 gene complied with Hardy-Weinberg equilibrium law (P>0.05). The genotype and allele distribution of PD-1 locus rs2227982 and rs7421861 in the sensitive group and the resistant group showed significant differences(P < 0.05). The sensitive of TT genotype of allele T(OR=1.739, 95%CI, 1.656 to 1.867)and CT genotype(OR=1.524, 95%CI, 1.435 to 1.663)to chemotherapy and were significantly higher than that of CC genotype and C allele (P < 0.05). T allele had higher sensitivity to chemotherapy than C allele (OR=1.721, 95%CI, 1.603 to 1.851), and the difference was statistically significant (P < 0.05). TT genotype (OR=1.605, 95%CI, 1.556 to 1.767) and CT genotype (OR=1.414, 95%CI, 1.372 to 1.525) of rs7421861 had lower sensitivity to chemotherapy than CC genotype, and T allele had lower sensitivity to chemotherapy than C allele (OR=1.531, 95% CI, 1.423 to 1.672), and the differences were statistically significant (P < 0.05). Logistic regression analysis showed that the degree of differentiation, rs2227982 polymorphism and rs7421861 polymorphism of PD-1 gene were significantly correlated with the sensitivity to platinum chemotherapy in gastric cancer patients (P < 0.01).Conclusion The polymorphism of rs2227982 and rs7421861 locus of PD-1 gene may be related to the sensitivity of patients with gastric cancer to platinum chemotherapy, and the individuals carrying the T allele of rs2227982 have better response to platinum chemotherapy, and the individuals carrying the C allele of rs7421861 have poor response to platinum chemotherapy.
-
Keywords:
- programmed cell death-1 receptor /
- multinucleotides /
- polymorphism /
- gastric cancer /
- chemotherapy /
- sensitivity
-
肝细胞癌是一种高病死率的原发性肝癌,其具有病情发展迅速、易向周围器官及组织转移等特点,严重威胁患者生命安全[1]。目前,肝切除是肝细胞癌的主要根治性治疗方法之一,但存在术后复发率较高、预后不佳等问题。影响肝细胞癌预后的因素较多,其中肝功能贮备是较为重要的因素。血清铁蛋白广泛存在于肝细胞中,是铁的主要贮存蛋白,能调节机体铁储存,其水平与长期的营养失调密切相关[2-3]。研究[4]显示,当肝细胞受损时,铁蛋白释放入血液,巨噬细胞分泌铁蛋白增加。血清白蛋白是肿瘤患者营养状况的有效评估指标之一,其不仅能反映肝功能,还与直肠癌、食管癌等多种恶性肿瘤的预后相关[5]。本研究通过分析接受肝切除术的原发性肝癌患者的临床资料,探讨术前血清铁蛋白、白蛋白、铁蛋白与白蛋白比值与患者预后的关系,现报告如下。
1. 资料与方法
1.1 一般资料
回顾性分析2015年1月—2020年1月行肝切除术治疗的112例肝细胞癌患者的临床资料,其中男78例,女34例,年龄41~72岁,平均(50.13±4.24)岁; 临床分期包括Ⅰ期45例, Ⅱ期38例, Ⅲ期29例; 肝功能分级A级74例, B级38例。参照《原发性肝癌规范化病理诊断指南》[6]进行诊断: 伴有不同程度肝脏肿大、腹水; 影像检查确诊。纳入标准: ①符合上述诊断标准者; ②临床病史、症状、实验室指标及影像学检查确诊者; ③心、脑、肾等脏器无明显障碍者。排除标准: ①近期接受过正规免疫调节剂治疗者; ②沟通障碍者; ③存在肝脏血管畸形、血管瘤等疾病者; ④日常生活能力丧失者; ⑤无法进行言语交流者; ⑥依从性较差者; ⑦合并凝血功能障碍及血液系统疾病者; ⑧伴有间质性肺炎或心功能不全者。
1.2 方法
采集2组患者入组后第2天清晨空腹静脉血样本,以3 000转/min的速度进行离心,离心半径10 cm, 时间10 min, 将提取到的上层血清置于-20 ℃的冷冻箱内储存以备检测。采用免疫比浊法测定血清铁蛋白、白蛋白水平,试剂盒购自深圳晶美生物技术有限公司,仪器为东芝GA800生化分析仪,操作严格按照试剂盒说明进行。术后均进行电话随访或门诊随访,随访终点为患者死亡或截至随访日期。
1.3 统计学分析
采用SPSS 22.0软件包进行数据处理,计量资料采用均数±标准差(x±s)表示,组间比较采用t检验,计数资料以[n(%)]表示,组间比较采用χ2检验。相关性分析采用Spearman相关系数,采用多因素Cox比例风险回归模型分析预后不良的影响因素, P<0.05为差异有统计学意义。
2. 结果
2.1 术前不同血清铁蛋白、白蛋白及铁蛋白与白蛋白比值患者的生存期比较
112例患者总生存期为5~75个月,平均(53.84±6.51)个月; 对于铁蛋白≥108.63 μg/L、白蛋白≤41.19 g/L、铁蛋白与白蛋白比值≥3.42的患者,其生存期为5~31个月,平均(28.56±3.12)个月; 对于铁蛋白<108.63 μg/L、白蛋白>41.19 g/L、铁蛋白与白蛋白比值<3.42的患者,其生存期为12~75个月,平均(72.11±1.25)个月; 上述不同血清铁蛋白、白蛋白及铁蛋白与白蛋白比值患者的生存期比较,差异有统计学意义(t=101.924, P<0.001)。见图 1。
2.2 术前血清铁蛋白、白蛋白、铁蛋白与白蛋白比值与肝癌临床病理特征的关系
术前不同血清铁蛋白、白蛋白、铁蛋白与白蛋白比值与年龄、性别、症状、乙型肝炎表面抗原(HBsAg)、甲胎蛋白、肿瘤直径、肿瘤多发、肿瘤家族史无相关性(P>0.05), 而术前血清铁蛋白、白蛋白、铁蛋白与白蛋白比值与肝硬化有相关性(P<0.05)。见表 1。
表 1 术前血清铁蛋白、白蛋白、铁蛋白与白蛋白比值与肝癌临床病理特征的关系[n(%)]临床病理 分类 例数 铁蛋白/(μg/L) 白蛋白/(g/L) 铁蛋白与白蛋白比值 ≥108.63 <108.63 ≤41.19 >41.19 ≥3.42 <3.42 年龄 <50岁 52 25(48.08) 27(51.92) 23(44.23) 29(55.77) 20(38.46) 32(61.54) ≥50岁 60 22(36.67) 38(63.33) 24(40.00) 36(60.00) 27(45.00) 33(55.00) 性别 男 78 30(38.46) 48(61.54) 29(37.18) 49(62.82) 31(39.74) 47(60.26) 女 34 17(50.00) 17(50.00) 18(52.94) 16(47.06) 16(47.06) 18(52.94) 症状 有 67 30(44.78) 37(55.22) 28(41.79) 39(58.21) 26(38.81) 41(61.19) 无 45 17(37.78) 28(62.22) 19(42.22) 26(57.78) 21(46.67) 24(53.33) 乙型肝炎表面抗原 阴性 31 12(38.71) 19(61.29) 14(45.16) 17(54.84) 10(32.26) 21(67.74) 阳性 81 35(43.21) 46(56.79) 33(40.74) 48(59.26) 37(45.68) 44(54.32) 甲胎蛋白/(ng/mL) <20 67 33(49.25) 34(50.75) 30(44.78) 37(55.22) 31(46.27) 36(53.73) ≥20 45 14(31.11) 31(68.89) 17(37.78) 28(62.22) 16(35.56) 29(64.44) 肿瘤直径/cm <5 58 25(43.10) 33(56.90) 23(39.66) 35(60.34) 29(50.00) 29(50.00) ≥5 54 22(40.74) 32(59.26) 24(44.44) 30(55.56) 18(33.33) 36(66.67) 肿瘤多发 是 13 3(23.08) 10(76.92) 4(30.77) 9(69.23) 3(23.08) 10(76.92) 否 99 44(44.44) 55(55.56) 43(43.43) 56(56.57) 44(44.44) 55(55.56) 肝硬化 有 77 40(51.95) 37(48.05) 39(50.65) 38(49.35) 42(54.55) 35(45.45) 无 35 7(20.00)* 28(80.00)* 8(22.86)* 27(77.14)* 5(14.29)* 30(85.71)* 肿瘤家族史 有 21 7(33.33) 14(66.67) 9(42.86) 12(57.14) 6(28.57) 15(71.43) 无 91 40(43.96) 51(56.04) 38(41.76) 53(58.24) 41(45.05) 50(54.95) 与有肝硬化比较, *P<0.05。 2.3 多因素Cox比例风险回归分析肝细胞癌患者肝切除术后预后不良的影响因素
多因素Cox比例风险回归分析结果显示,血清铁蛋白≥108.63 μg/L、白蛋白≤41.19 g/L、铁蛋白与白蛋白比值≥3.42、有肝硬化是肝细胞癌患者肝切除术后预后不良的影响因素,见表 2。
表 2 多因素Cox比例风险回归分析肝细胞癌患者肝切除术后预后不良的影响因素因素 β Waldχ2 HR 95%CI P 铁蛋白≥108.63 μg/L 1.569 11.265 2.523 2.051~9.305 <0.001 白蛋白≤41.19 g/L 1.712 10.348 1.649 1.002~7.561 <0.001 铁蛋白与白蛋白比值≥3.42 1.665 11.141 1.742 1.114~6.598 <0.001 有肝硬化 1.452 9.589 2.119 1.459~10.230 <0.001 3. 讨论
目前,肝细胞癌是世界上第六大常见的恶性肿瘤,好发于40岁以上的中老年男性人群中,而中国肝癌发病率与病死率均较高,严重威胁患者的生命安全[7]。肝癌的发病机制较为复杂,可能受环境和饮食的双重因素影响,目前临床多采用肝切除术对肝细胞癌进行治疗,其能将肝脏的局部性病变切除,保留足以维持正常功能的肝组织,具有较好的效果[8-9]。研究[10]显示,肝切除术后5年复发率高达75%, 生存率不足50%, 长期生存率较低。因此,寻找影响肝细胞癌预后的因素对降低术后肿瘤复发率、延长患者生存时间具有重要的意义。
血清铁蛋白是在肝脏合成的,是机体铁的主要贮存形式,能调节铁代谢,还参与造血和免疫系统的调控。人体各组织中均有铁蛋白表达,特别是骨髓、肝脏及脾脏,部分肿瘤也会分泌铁蛋白,当肝细胞受损时,大量血清铁蛋白释放入血,导致其水平升高[11-12]。研究[13]显示,肺癌患者血清铁蛋白显著升高,且与肺癌患者病理类型、肿瘤直径、临床分期等有关,减缓细胞内铁的代谢可抑制肿瘤细胞生长。研究[14]显示,机体营养状态是低蛋白水平和癌症发生的原因,肝细胞癌可导致肝脏受损,促使炎性细胞增多,进而导致体内总蛋白水平升高,抑制白蛋白的合成。白蛋白是机体的内源性营养物质,是反映肝脏蛋白合成和机体炎症反应的指标,其水平降低可导致机体免疫功能下降,肝癌患者伴有不同程度的肝功能损害,白蛋白下降程度更为显著[15]。
研究[16]显示,术前血清白蛋白水平可作为多种恶性肿瘤的预后标记物。本研究应用受试者工作特征曲线(ROC)确定了铁蛋白预测肝细胞癌不良预后的最佳临界值为108.63 μg/L, 白蛋白预测肝细胞癌不良预后的最佳临界值为41.19 g/L, 铁蛋白与白蛋白比值预测肝细胞癌不良预后的最佳临界值为3.42, 术前血清铁蛋白、白蛋白、铁蛋白与白蛋白比值与肝硬化显著相关。分析原因可能为肝细胞癌的发生导致了机体免疫系统异常,肝细胞炎症明显加剧,从而造成肝细胞损伤,导致肝脏功能受损,影响机体铁代谢,清除血清铁蛋白能力下降,从而导致血清铁蛋白水平增高。本研究结果还显示, 112例患者平均总生存期为(53.84±6.51)个月,多因素Cox比例风险回归分析结果显示,血清铁蛋白≥108.63 μg/L、白蛋白≤41.19 g/L、铁蛋白与白蛋白比值≥3.42、有肝硬化是肝细胞癌患者肝切除术后预后不良的影响因素。
综上所述,术前血清铁蛋白≥108.63 μg/L、白蛋白≤41.19 g/L、铁蛋白与白蛋白比值≥3.42是肝细胞癌患者肝切除术预后的独立危险因素,术前血清铁蛋白、铁蛋白与白蛋白比值升高以及白蛋白水平降低提示预后不良。
-
表 1 2组患者基线资料比较(x±s)[n(%)]
指标 敏感组(n=45) 抗拒组(n=58) χ2/t P 年龄/岁 62.27±5.15 62.41±5.03 0.139 0.890 性别 男 26(57.78) 29(50.00) 0.616 0.433 女 19(42.22) 29(50.00) 肿瘤直径/cm 3.51±0.63 3.76±0.71 1.861 0.066 病理类型 腺癌 29(64.44) 33(56.90) 0.705 0.703 印戒细胞癌 15(33.33) 24(41.38) 其他 1(2.23) 1(1.72) 肿瘤部位 胃癌合并淋巴结转移 14(31.11) 15(25.86) 1.640 0.440 胃癌合并腹腔转移 20(44.44) 22(37.93) 胃癌合并肝、肺等其他脏器转移 11(24.44) 21(36.21) TNM分期 ⅢA~ⅢB期 24(53.33) 17(29.31) 6.103 0.013 ⅢC~Ⅳ期 21(46.67) 41(70.69) 分化程度 低度分化 15(33.33) 42(72.41) 15.659 < 0.001 高中度分化 30(66.67) 16(27.59) 化疗方案 SOX方案 27(60.00) 30(51.72) 0.702 0.402 PCF方案 18(40.00) 28(48.28) 表 3 影响胃癌铂类药物化疗敏感性的Logistic回归分析结果
因素 β SE Waldχ2 OR(95%CI) P TNM分期 0.202 0.172 1.379 1.224(0.920~1.321) 0.623 分化程度 0.503 0.169 8.859 1.654(1.521~1.754) 0.003 PD-1基因rs2227982位点多态性 0.472 0.153 9.517 1.603(1.542~1.762) < 0.001 PD-1基因rs7421861位点多态性 0.436 0.148 8.679 1.547(1.462~1.669) 0.002 -
[1] KARIMI P, ISLAMI F, ANANDASABAPATHY S, et al. Gastric cancer: descriptive epidemiology, risk factors, screening, and prevention[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(5): 700-713. doi: 10.1158/1055-9965.EPI-13-1057
[2] 王少明, 郑荣寿, 张思维, 等. 2015年中国胃癌流行特征分析[J]. 中华流行病学杂志, 2019, 40(12): 1517-1521. doi: 10.3760/cma.j.issn.0254-6450.2019.12.003 [3] 张亚娟, 常德, 张健鹏. 肺癌化疗中铂类耐药的研究进展[J]. 中国医学科学院学报, 2017, 39(1): 150-155. doi: 10.3881/j.issn.1000-503X.2017.01.025 [4] 郑艺, 尹继业, 周宏灏, 等. 基因多态性与铂类药物毒性反应研究进展[J]. 中国临床药理学与治疗学, 2014, 19(9): 1051-1056. https://www.cnki.com.cn/Article/CJFDTOTAL-YLZL201409020.htm [5] TANG N, LYU D, ZHANG Y, et al. Association between the ERCC1 polymorphism and platinum-based chemotherapy effectiveness in ovarian cancer: a meta-analysis[J]. BMC Womens Health, 2017, 17(1): 43. doi: 10.1186/s12905-017-0393-z
[6] LIBLAB S, VUSURATANA A, AREEPIUM N. ERCC1, XRCC1, and GSTP1 polymorphisms and treatment outcomes of advanced epithelial ovarian cancer patients treated with platinum-based chemotherapy[J]. Asian Pac J Cancer Prev, 2020, 21(7): 1925-1929. doi: 10.31557/APJCP.2020.21.7.1925
[7] TIBALDI C, LUNGHI A, BALDINI E. Use of programmed cell death protein ligand 1 assay to predict the outcomes of non-small cell lung cancer patients treated with immune checkpoint inhibitors[J]. World J Clin Oncol, 2017, 8(4): 320-328. doi: 10.5306/wjco.v8.i4.320
[8] WU Y, CAO D, QU L, et al. PD-1 and PD-L1 co-expression predicts favorable prognosis in gastric cancer[J]. Oncotarget, 2017, 8(38): 64066-64082. doi: 10.18632/oncotarget.19318
[9] TANG W, CHEN S, CHEN Y, et al. Programmed death-1 polymorphisms is associated with risk of esophagogastric junction adenocarcinoma in the Chinese Han population: a case-control study involving 2, 740 subjects[J]. Oncotarget, 2017, 8(24): 39198-39208. doi: 10.18632/oncotarget.17338
[10] EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1. 1)[J]. Eur J Cancer, 2009, 45(2): 228-247. doi: 10.1016/j.ejca.2008.10.026
[11] 谢晓燕, 李超, 敬梅, 等. ERCC2 Asp312Asn/Lys751Gln基因多态性与晚期非小细胞肺癌铂类药物化疗敏感性相关性的临床观察[J]. 临床和实验医学杂志, 2019, 18(20): 2190-2193. doi: 10.3969/j.issn.1671-4695.2019.20.018 [12] PITT J M, VÉTIZOU M, DAILLōRE R, et al. Resistance mechanisms to immune-checkpoint blockade in cancer: tumor-intrinsic and -extrinsic factors[J]. Immunity, 2016, 44(6): 1255-1269. doi: 10.1016/j.immuni.2016.06.001
[13] BAI J, GAO Z, LI X, et al. Regulation of PD-1/PD-L1 pathway and resistance to PD-1/PD-L1 blockade[J]. Oncotarget, 2017, 8(66): 110693-110707. doi: 10.18632/oncotarget.22690
[14] XIA L, LIU Y, WANG Y. PD-1/PD-L1 blockade therapy in advanced non-small-cell lung cancer: current status and future directions[J]. Oncologist, 2019, 24(suppl 1): S31-S41.
[15] 毛璐, 鞠侯雨, 任国欣. 程序性细胞死亡受体-1与其配体信号通路的调控及其在头颈鳞状细胞癌治疗中的研究进展[J]. 国际口腔医学杂志, 2018, 45(5): 560-565. https://www.cnki.com.cn/Article/CJFDTOTAL-GWKQ201805014.htm [16] WANG X, GUO G, GUAN H, et al. Challenges and potential of PD-1/PD-L1 checkpoint blockade immunotherapy for glioblastoma[J]. J Exp Clin Cancer Res, 2019, 38(1): 87. doi: 10.1186/s13046-019-1085-3
[17] LV J W, LI J Y, LUO L N, et al. Comparative safety and efficacy of anti-PD-1 monotherapy, chemotherapy alone, and their combination therapy in advanced nasopharyngeal carcinoma: findings from recent advances in landmark trials[J]. J Immunother Cancer, 2019, 7(1): 159. doi: 10.1186/s40425-019-0636-7
[18] XU J, ZHANG Y, JIA R, et al. Anti-PD-1 antibody SHR-1210 combined with apatinib for advanced hepatocellular carcinoma, gastric, or esophagogastric junction cancer: an open-label, dose escalation and expansion study[J]. Clin Cancer Res, 2019, 25(2): 515-523. doi: 10.1158/1078-0432.CCR-18-2484
[19] REN H T, LI Y M, WANG X J, et al. PD-1 rs2227982 polymorphism is associated with the decreased risk of breast cancer in northwest Chinese women: a hospital-based observational study[J]. Medicine: Baltimore, 2016, 95(21): e3760. doi: 10.1097/MD.0000000000003760
[20] HASHEMI M, KARAMI S, SARABANDI S, et al. Association between PD-1 and PD-L1 Polymorphisms and the Risk of Cancer: A Meta-Analysis of Case-Control Studies[J]. Cancers (Basel), 2019, 11(8): 1150. doi: 10.3390/cancers11081150
[21] ZANG B, CHEN C, ZHAO J Q. PD-1 gene rs10204525 and rs7421861 polymorphisms are associated with increased risk and clinical features of esophageal cancer in a Chinese Han population[J]. Aging: Albany NY, 2020, 12(4): 3771-3790.
[22] 赵万, 奉林, 余玲玲, 等. PD1多态性与晚期非小细胞肺癌铂类化疗敏感性及骨髓抑制的关系[J]. 肿瘤预防与治疗, 2020, 33(8): 651-657. doi: 10.3969/j.issn.1674-0904.2020.08.004 -
期刊类型引用(3)
1. 肖雷,蒋亚新,许家亮,李海春. 术前白蛋白/铁蛋白比值表达与晚期胃癌根治性术后早期腹腔出血发生的关系. 中国医学工程. 2024(03): 83-87 .  百度学术
百度学术
2. 张士跃,任猛,殷昌斌. 血清铁蛋白/白蛋白比值用于观察ST段抬高型急性冠脉综合征患者介入治疗短期预后. 检验医学. 2024(08): 743-748 .  百度学术
百度学术
3. 王娇,胡宝利,王佳. 胸腔镜肺段切除术后肺部感染的特征及影响因素. 实用中西医结合临床. 2023(13): 54-57 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号