Prediction function of soluble semaphorin 4D level in acute ST segment elevation myocardial infarction with high thrombosis load
-
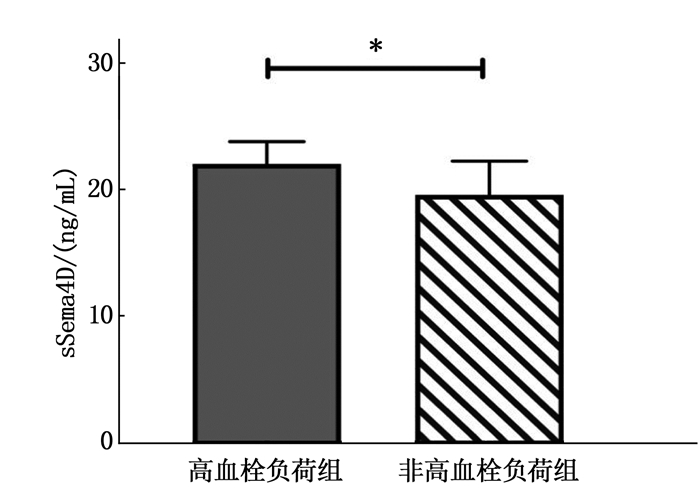
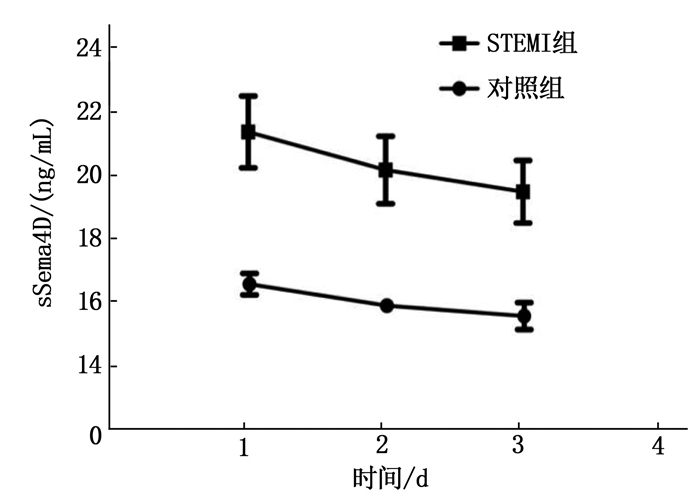
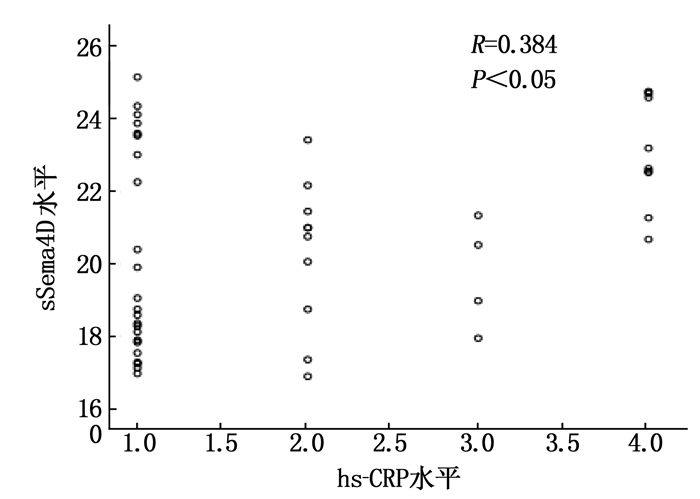
摘要:目的 探讨可溶性信号素4D(sSema4D)水平对急性ST段抬高型心肌梗死(STEMI)高血栓负荷的预测作用。方法 选取STEMI确诊患者46例为STEMI组(高血栓负荷患者20例和非高血栓负荷患者26例),不稳定型心绞痛(UA)患者40例为UA组,同时选取同时间段冠状动脉造影(CAG)阴性患者40例为对照组。测定3组患者血清sSema4D水平,评估sSema4D预测冠状动脉血栓负荷的价值; 分析STEMI患者中血清sSema4D与超敏C反应蛋白(hs-CRP)的相关性。结果 STEMI患者的外周血中sSema4D表达水平高于对照组, STEMI高血栓负荷患者sSema4D表达量高于STEMI非高血栓负荷患者,差异有统计学意义(P < 0.05)。STEMI患者中血清sSema4D与hs-CRP呈正相关(P < 0.05), 相关系数为0.384。结论 在STEMI高血栓负荷患者中sSema4D表达水平较高,可能有一定的预测冠状动脉血栓的价值。Abstract:Objective To investigate the prediction function of soluble semaphorin 4D (sSema4D) level in acute ST segment elevation myocardial infarction (STEMI) with high thrombosis load.Methods A total of 46 patients diagnosed with STEMI were selected as STEMI group (20 patients with high thrombotic load and 26 patients without high thrombotic load), and 40 patients with unstable angina (UA) were selected as UA group. Forty patients with negative coronary angiography (CAG) during the same period were selected as control group. The serum sSema4D levels of patients in three groups were determined, and the value of sSema4D in predicting coronary thrombosis load was evaluated; the correlation between serum sSema4D level and high-sensitivity C-reactive protein (hs-CRP) in STEMI patients was analyzed.Results The expression levels of sSema4D in peripheral blood of STEMI patients were significantly higher than that of the control group, and the expression levels of sSema4D in STEMI patients with high thrombotic load were significantly higher than that of STEMI patients without high thrombotic load (P < 0.05). Serum sSema4D was positively correlated with hs-CRP in STEMI patients (P < 0.05), and the correlation coefficient was 0.384.Conclusion The sSema4D expression levels are higher in STEMI patients with high thrombotic load, which may be of certain value in predicting coronary thrombosis.
-
人微小病毒B19(HPV B19)属于微小病毒科、微小病毒亚科、红病毒属,最早于1975年被发现[1-3]。HPV B19呈二十面体,直径为22~24 nm, 是一种无包膜的单链、线性DNA病毒。HPV B19感染可引起胎儿水肿、再生障碍性贫血、肾小球病等[4-5]多种疾病。HPV B19基因组有2个开放阅读框(ORF), 左端ORF编码对宿主细胞有细胞毒性的结构蛋白NS1, 该序列高度保守; 右端ORF编码该病毒的结构蛋白VP1和VP2, VP1和VP2序列为高变区。
HPV B19以呼吸道传播为主,常在冬季和春季流行,流行病学爆发的周期一般为3~5年,但偶发病例可在全年发生[6]。HPV B19的检测方法主要为特异性免疫球蛋白M(IgM)和免疫球蛋白G(IgG)血清学检测和定量聚合酶链式反应(PCR)病毒核酸检测。本研究基于NS1保守区序列,建立HPV B19的通用型荧光定量PCR检测方法,现报告如下。
1. 材料与方法
1.1 实验材料
本实验室检测样本为单纯疱疹病毒(HSV) 2型、巨细胞病毒(CMV)、B族链球菌(GBS)、乙型肝炎病毒(HBV)、EB病毒(EBV) 阳性DNA样本以及反复流产妇女外周血标本。
1.2 主要仪器和试剂
Probe qPCR Mix(TakaRa, Code No. RR391A); 细菌基因组DNA提取试剂盒(北京天根生化公司, Code No. DP305-02); StepOnePlus荧光定量PCR仪(美国Applied Biosystems公司); Qubit 3核酸/蛋白质定量荧光计(美国Thermo Fisher公司); 生物安全柜等。
1.3 方法
1.3.1 引物和探针的设计
通过NCBI(https://www.ncbi.nlm.nih.gov/)数据库查询HPV B19 3类基因型代表性的5株序列(GenBank: M13178; AY582162; AY044266; NC_004295; AY582153), 运用在线工具MAFFT(https://www.ebi.ac.uk/Tools/msa/mafft/)比对NS1区序列,选取保守区序列设计引物和探针。见表 1。
表 1 HPV B19实时荧光定量PCR检测的引物及探针名称 序列(5′→ 3′) 位置 长度 扩增片段 B19F CAGATGCCCTCCACCCA 1907~1923 17 202 bp B19R GGGCTTCCGACAAATGATTC 2089~2108 20 B19P VIC-TCCCCGGGACCAGTTCAG-BHQ1 2069~2086 18 1.3.2 制备质粒
按照病毒株M13178的序列,由上海生工生物合成引物扩增区的寡核苷酸序列,将该片段插入到pUC57载体中获得HPV B19质粒,质粒全长为2912 bp。将此质粒转化入大肠杆菌,过夜培养后提取质粒DNA。经凝胶电泳分析及Qubit核酸/蛋白质定量荧光计测定质粒DNA的质量和浓度,于-20 ℃保存备用。根据质粒DNA大小、浓度以及脱氧核苷酸碱基的平均分子量计算质粒DNA的拷贝数(1 ng≈3.18×108拷贝)。
1.3.3 质粒分子适用性鉴定
对质粒DNA分子进行PCR扩增,电泳分析及Sanger测序,并与病毒株M13178的序列进行序列比对。以104拷贝/μL的质粒DNA为模板,在StepOnePlus荧光定量PCR仪上优化荧光定量PCR反应体系的引物探针比例,每个组合设4个平行重复,共15组。按照10倍梯度稀释,将质粒分子DNA稀释至107、106、105、104、103和102拷贝/μL以及20拷贝/μL, 进行实时荧光PCR扩增,每个浓度梯度设3个平行重复,计算R2和反应效率(E), 制作标准曲线。反应效率E计算公式为E=10-1/K-1(K为标准曲线斜率)。以10拷贝/μL和1拷贝/μL质粒分子DNA为模板,扩增20次反应检测质粒分子用于确定实时荧光PCR检测的检测下限(LOQ)。
1.3.4 反复流产妇女外周血HPV B19的检测
使用定量PCR方法对34份排除了染色体核型异常以及弓形虫(Tox)、风疹病毒(RV)、CMV和HSV感染的反复流产孕妇外周血样本进行HPV B19检测。
1.3.5 特异性鉴定
应用阳性HSV 2型、CMV、GBS、HBV和EBV确定本研究方法的特异性,同时设置阴性、阳性对照(参考质粒及HPV B19阳性样本)。
2. 结果
2.1 荧光定量PCR反应体系优化
质粒DNA分子PCR扩增后电泳条带单一(图 1)。Sanger测序结果对表明,质粒DNA分子的序列与病毒株M13178的序列一致(图 2)。体系优化的15组反应中,引物/探针体积比为0.4~0.8 μL的4个重复CT值最小,扩增效率最高, 11组与该组比较差异有统计学意义,其中9组有显著差异,剩余3组无差异(图 3A)。因此,本研究中最优的引物/探针体积比为0.4~0.8 μL。最终反应体系为1×Probe qPCR Mix, 上下游10 μmol/L引物各0.4 μL, 10 μmol/L探针0.8 μL、1×ROX Reference Dye、模板2 μL、加无菌水至20 μL。实时荧光PCR扩增程序为95 ℃ 20 s; 95 ℃ 1 s、60 ℃ 20 s, 40个循环。
2.2 HBV B19通用核酸检测体系标准曲线的建立
以浓度分别为107、106、105、104、103、102拷贝/μL和20拷贝/μL质粒DNA分子构建相对标准曲线(图 3B)。各个浓度扩增的线性关系较好,阴性对照无扩增曲线,标准曲线的反应效率E为0.946, R2为0.996。
2.3 敏感性和特异性
质粒DNA浓度为10拷贝/μL的20次扩增均能被检出,质粒DNA浓度为1拷贝/μL无法扩增。结合标准曲线的结果表明,本研究建立的实时荧光检测方法的检测下限为10拷贝/μL, 定量下限为20拷贝/μL。本检测方法具有较高的敏感性。34份反复流产妇女外周血标本中检出HPV B19核酸阳性1例。阳性HSV 2型、CMV、GBS、HBV和EBV及阴性对照均无扩增反应,参考质粒及HPV B19阳性样本正常扩增(图 3C)。本检测方法具有较高的特异性。
3. 讨论
HPV B19感染可引起多种临床表现,其与被感染者的年龄和免疫状态相关。HPV B19感染率高,研究[7-9]表明孕期女性血清学阳性率可占47%~65%。此外,中国血液制品中HPV B19污染情况较为严重。武汉市无偿献血者血清中HPV B19DNA阳性率达20.9%[10]。相关研究[11]检测了来自中国3个地区的235份血浆中HPV B19 DNA, 结果表明, 71.91%的血浆存在HPV B19污染。因此, HPV B19的检测和筛查具有迫切性。
基于分子生物学特性, HPV B19检测方法主要针对其抗体和核酸,前者包括酶联免疫吸附测定(ELISA)试剂盒、免疫印迹法(Western blot)等对特异IgM、IgG抗体进行检测,后者包括普通PCR法、探针法、巢式RCR法和实时荧光定量PCR等。其他方法包括血清电子镜检查以及针对HPV B19抗原检测方法。目前,应用最广泛的为针对特异IgM、IgG抗体检测以及实时荧光定量PCR方法。
患者在感染HPV B19 5~10 d, 病毒快速复制,此时具有传染性,血清电子镜检查可呈现阳性; 然而,此时产生的IgM和IgG较少,且与已快速复制的病毒颗粒形成免疫复合物,故可能无法检出IgM和IgG, 可呈假阴性[12]。在HPV B19感染10~12 d后,检测IgM抗体可为阳性,并能持续数月。基于PCR技术的检测方法具有最长的窗口期,从HPV B19的感染初期就能检出。其中,实时定量PCR检测技术具有操作简便、高特异性和敏感性等优点,广泛应用于包括HPV B19在内的多种病原微生物的检测[13-14]。然而,定量PCR检测有假阳性可能,即检测的可能为裸露的病毒DNA, 而非具有致病性的病毒颗粒。研究[15]表明, HPV B19也可以通过涉及热敏补体因子C1q增强的抗体介导的内吞作用进入细胞。急性感染期伴病毒血症高水平的HPV B19能以低效率的形式进入其他类型细胞,并在细胞中持续存在,当这些细胞死亡时,裸露的HPV B19 DNA被释放进入血液循环。
本研究通过比对5株代表型HPV B19的NS1区域序列,针对保守区序列设计了引物探针,建立了HPV B19通用型实时荧光检测方法,该方法敏感性较高且特异性较强,可应用于HPV B19的检测和筛查,对于临床患者的辅助诊断、高危人群感染的监测以及保障输血安全具有重要意义。后续研究中将扩大检测量,并分析笔者所在地区育龄期反复流产女性与HPV B19感染的相关性; 建立可检测HPV B19完整病毒颗粒的荧光定量PCR方法,以减少假阳性的发生,同时可鉴别出为新近感染或慢性既往感染。
-
表 1 3组基本资料比较[n(%)](x±s)
M 指标 STEMI组(n=46) UA组(n=40) 对照组(n=40) P值 年龄/岁 67.7±12.5 67.6±9.5 63.1±10.2 0.327 性别 男 32 29 25 0.612 女 14 11 15 吸烟 26(56.5) 25(62.5) 30(75.0) 0.196 糖尿病 10(21.7) 5(12.5) 3(7.5) 0.158 低密度脂蛋白/(mmoL/L) 2.7±1.0 2.5±0.9 2.5±0.9 0.858 高密度脂蛋白/(mmol/L) 1.4±0.6 1.1±0.3 1.3±0.3 0.103 肌酐/(μmoL/L) 77.3±37.8 78.0±32.7 70.2±28.9 0.325 谷丙转氨酶/(U/L) 41.5 21 24.5 0.138 hs-CRR/(mmol/L) 9.67 2.72 0.86 < 0.05 hs-CRR: 超敏C反应蛋白。 -
[1] REYNOLDS K, GO A S, LEONG T K, et al. Trends in incidence of hospitalized acute myocardial infarction in the cardiovascular research network (CVRN)[J]. Am J Med, 2017, 130(3): 317-327. doi: 10.1016/j.amjmed.2016.09.014
[2] 胡盛寿, 高润霖, 刘力生, 等. 《中国心血管病报告2018》概要[J]. 中国循环杂志, 2019, 34(3): 209-220. doi: 10.3969/j.issn.1000-3614.2019.03.001 [3] CHEN Y, ZHANG L, LIU W X, et al. VEGF and SEMA4D have synergistic effects on the promotion of angiogenesis in epithelial ovarian cancer[J]. Cell Mol Biol Lett, 2018, 23: 2. doi: 10.1186/s11658-017-0058-9
[4] CHEN T, XU D Z, LI Q, et al. The regulation of Sema4D exodomain shedding by protein kinase A in platelets[J]. Platelets, 2016, 27(7): 673-679. doi: 10.3109/09537104.2016.1154141
[5] MALEKI K T, CORNILLET M, BJÖRKSTRÖM N K. Soluble SEMA4D/CD100: a novel immunoregulator in infectious and inflammatory diseases[J]. Clin Immunol, 2016, 163: 52-59. doi: 10.1016/j.clim.2015.12.012
[6] 匡龙, 赵良平, 尤涛, 等. 血清可溶性信号素4D水平与冠状动脉粥样硬化性心脏病发生的相关性研究[J]. 中国全科医学, 2015, 18(36): 4412-4415. doi: 10.3969/j.issn.1007-9572.2015.36.003 [7] 谢洪祥, 金家贵, 周鹏. 延期支架植入在高血栓负荷急性STEMI患者中的应用[J]. 成都医学院学报, 2017, 12(2): 228-231. https://www.cnki.com.cn/Article/CJFDTOTAL-CDYU201702025.htm [8] CHINESE SOCIETY OF CARDIOLOGY OF CHINESE MEDICAL ASSOCIATION, EDITORIAL BOARD OF CHINESE JOURNAL OF CARDIOLOGY. 2019 Chinese Society of Cardiology (CSC) guidelines for the diagnosis and management of patients with ST-segment elevation myocardial infarction[J]. Zhonghua Xin Xue Guan Bing Za Zhi, 2019, 47(10): 766-783. http://www.ncbi.nlm.nih.gov/pubmed/31648459
[9] KUKLINA E M. Receptor functions of semaphorin 4D[J]. Biochemistry Moscow, 2019, 84(9): 1021-1027. doi: 10.1134/S0006297919090049
[10] LABER A, GADERMAIER E, WALLWITZ J, et al. A high-sensitivity enzyme immunoassay for the quantification of soluble human semaphorin 4D in plasma[J]. Anal Biochem, 2019, 574: 15-22. doi: 10.1016/j.ab.2019.03.004
[11] MASTENBROEK T G, VAN GEFFEN J P, HEEMSKERK J W, et al. Acute and persistent platelet and coagulant activities in atherothrombosis[J]. J Thromb Haemost, 2015, 13(Suppl 1): S272-S280. http://smartsearch.nstl.gov.cn/paper_detail.html?id=9d1ca025bab208f92d52b9d2b79fcdeb
[12] KAWANO H, KOHNO Y, IZUMIDA S, et al. Rivaroxaban therapy resulting in the resolution of right atrial thrombosis resistant to ordinary control with warfarin in a patient with atrial fibrillation[J]. Intern Med, 2015, 54(6): 601-604. doi: 10.2169/internalmedicine.54.3003
[13] XIANG L, YOU T, CHEN J, et al. Serum soluble semaphorin 4D is associated with left atrial diameter in patients with atrial fibrillation[J]. Med Sci Monit, 2015, 21: 2912-2917. doi: 10.12659/MSM.895441
[14] HUANG J, WU S, CAO S, et al. Neutrophil-derived semaphorin 4D induces inflammatory cytokine production of endothelial cells via different plexin receptors in Kawasaki disease[J]. Biomed Res Int, 2020, 2020: 6663291. http://www.researchgate.net/publication/347679496_Neutrophil-Derived_Semaphorin_4D_Induces_Inflammatory_Cytokine_Production_of_Endothelial_Cells_via_Different_Plexin_Receptors_in_Kawasaki_Disease/download
[15] LEI J, FU Y, ZHUANG Y, et al. Sema4D aggravated LPS-induced injury via activation of the MAPK signaling pathway in ATDC5 chondrocytes[J]. Biomed Res Int, 2020, 2020: 8691534. http://www.researchgate.net/publication/340933019_Sema4D_Aggravated_LPS-Induced_Injury_via_Activation_of_the_MAPK_Signaling_Pathway_in_ATDC5_Chondrocytes
[16] KIM J M, LIN C J, STAVRE Z, et al. Osteoblast-osteoclast communication and bone homeostasis[J]. Cells, 2020, 9(9): 2073. doi: 10.3390/cells9092073
[17] LONTOS K, ADAMIK J, TSAGIANNI A, et al. The role of semaphorin 4D in bone remodeling and cancer metastasis[J]. Front Endocrinol: Lausanne, 2018, 9: 322. doi: 10.3389/fendo.2018.00322
[18] WU J H, LI Y N, CHEN A Q, et al. Inhibition of Sema4D/PlexinB1 signaling alleviates vascular dysfunction in diabetic retinopathy[J]. EMBO Mol Med, 2020, 12(2): e10154. doi: 10.15252/emmm.201810154
[19] CREA F, LIUZZO G. Pathogenesis of acute coronary syndromes[J]. J Am Coll Cardiol, 2013, 61(1): 1-11.
[20] DANESE E, MONTAGNANA M. An historical approach to the diagnostic biomarkers of acute coronary syndrome[J]. Ann Transl Med, 2016, 4(10): 194. doi: 10.21037/atm.2016.05.19
-
期刊类型引用(5)
1. 木国法,李旭,龚应玲. 白细胞介素-4、瘦素、趋化素与肥胖型哮喘患儿病情程度的关系及预测哮喘控制的价值. 实用临床医药杂志. 2025(03): 108-113 .  本站查看
本站查看
2. 杨洁. 儿保门诊小儿骨密度检测结果分析及干预. 婚育与健康. 2024(06): 97-99 .  百度学术
百度学术
3. 高诗宇,吴力群,马佳,李盼盼,路晨,聂力. 基于网络药理学和分子对接技术探讨缓哮六安煎治疗儿童支气管哮喘的作用机制. 现代中西医结合杂志. 2022(11): 1513-1520 .  百度学术
百度学术
4. 陈春娟,蔡剑英,刘凤林. 吸入性糖皮质激素长期低剂量应用对轻中度支气管哮喘儿童生长发育的影响分析. 贵州医药. 2022(10): 1574-1575 .  百度学术
百度学术
5. 安家,李霞,李虹霖,杜淑玲. 小儿咳嗽变异性哮喘患儿骨代谢指标水平及其临床意义. 系统医学. 2022(21): 1-5 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:




 苏公网安备 32100302010246号
苏公网安备 32100302010246号
