Changes of serum adropin, platelet activating factor and glial fibrillary acidic protein levels in patients with coronary heart disease complicating depression and their significance
-
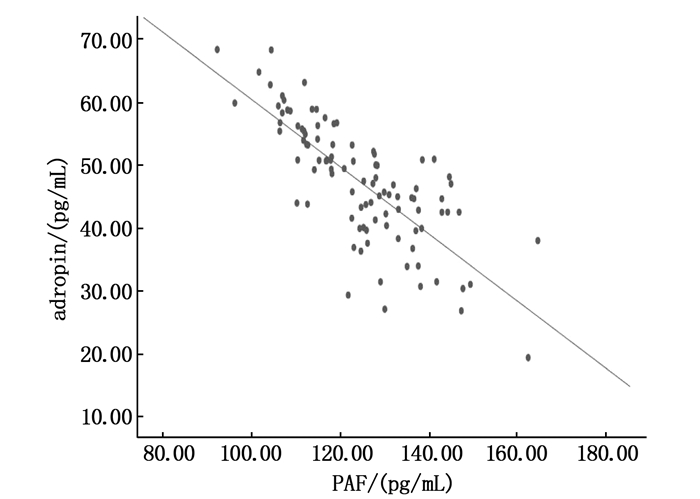
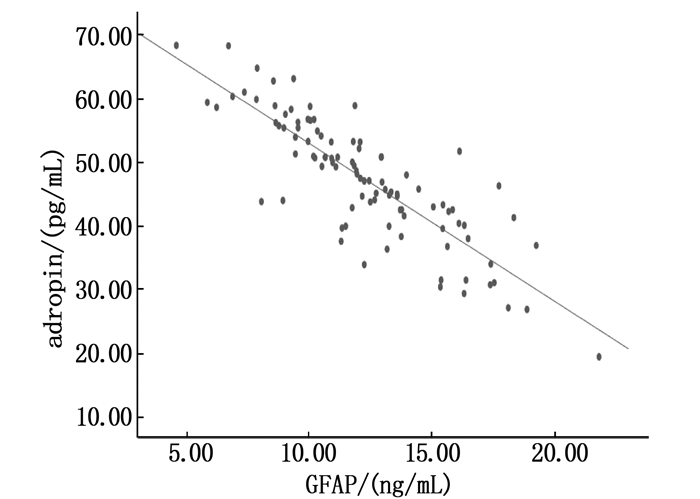
摘要:目的 探讨冠心病(CHD)合并抑郁症患者血清adropin、血小板活化因子(PAF)、胶质纤维酸性蛋白(GFAP)水平的变化及相关性。方法 选取163例CHD患者作为研究对象,根据汉密尔顿抑郁量表(HAMD)评分将其分为抑郁症组(HAMD评分≥18分)98例(轻度抑郁47例、中度抑郁31例、中度抑郁20例)和非抑郁症组(HAMD评分 < 18分)65例。采用酶联免疫吸附法(ELISA)检测患者血清adropin、PAF、GFAP水平,采用Pearson相关分析法分析CHD合并抑郁症患者血清adropin与PAF、GFAP水平的相关性;采用Logistic回归分析探讨CHD患者发生抑郁症的影响因素。结果 抑郁症组患者空腹血糖、PAF、GFAP水平高于非抑郁症组,血清adropin水平低于非抑郁症组,差异有统计学意义(P < 0.05);抑郁症组中,轻度、中度、重度抑郁患者的血清adropin水平逐渐降低,PAF、GFAP水平逐渐升高,差异有统计学意义(P < 0.05);Pearson相关分析显示,CHD合并抑郁症患者血清adropin水平与PAF、GFAP水平均呈负相关(r=-0.665、-0.643,P < 0.001);多因素Logistic回归分析显示,血清adropin < 49.36 pg/mL、PAF≥124.47 pg/mL、GFAP≥12.79 ng/mL是CHD患者并发抑郁症的独立危险因素(P < 0.05)。结论 随着抑郁程度的加重,CHD患者血清adropin水平降低,PAF、GFAP水平升高。血清adropin水平与PAF、GFAP水平均呈负相关,三者均是CHD患者并发抑郁症的独立影响因素。Abstract:Objective To investigate the changes and correlations of serum adropin, platelet activating factor (PAF) and glial fibrillary acidic protein (GFAP) in patients with coronary heart disease (CHD) and depression.Methods A total of 163 patients with CHD were selected as objects, the patients were divided into depression group (98 cases including 47 cases of mild depression, 31 cases of moderate depression and 20 cases of moderate depression, HAMD scored ≥ 18) and non-depression group (65 cases, HAMD scored < 18) according to Hamilton Depression Scale (HAMD) score. The levels of serum adropin, PAF and GFAP were detected by enzyme-linked immunosorbent assay (ELISA). Pearson method was used to analyze the correlations between serum adropin and PAF, GFAP levels in CHD patients with depression. Logistic regression analysis was used to analyze the influencing factors of depression in CHD patients.Results The levels of fasting blood glucose, PAF and GFAP in the depression group were higher than those in non-depression group, while the level of serum adropin was lower than that in the non-depressive group (P < 0.05). In the depression group, serum adropin levels in mild, moderate and severe depression patients gradually decreased, while PAF and GFAP levels gradually increased (P < 0.05). Pearson correlation analysis showed that serum adropin level was negatively correlated with PAF and GFAP levels in CHD patients with depression (r=-0.665, -0.643, P < 0.001); multivariate Logistic regression analysis showed that serum adropin level < 49.36 pg/mL, PAF level ≥ 124.47 pg/mL, GFAP level ≥ 12.79 ng/mL were the independent influencing factors of depression in CHD patients (P < 0.05).Conclusion With the aggravation of depression in patients with CHD, serum adropin level is decreased and levels of PAF and GFAP are increased. Serum adropin level is negatively correlated with PAF and GFAP levels, and all of them are independent influencing factors of depression in CHD patients.
-
胃癌的发病率在恶性肿瘤中居第4位,病死率居第2位,全球每年约有99万例新发病例,约73万例患者死亡[1]。中国2015年新发胃癌病例40.3万例,发病率为29.31/100 000[2], 多数患者就诊时已处于进展期,5年生存率低。化疗是胃癌的主要治疗手段之一,其中铂类药物是基线用药,常与其他化疗药物组成多种有效化疗方案,但是随着疗程进展,肿瘤细胞可出现耐药而导致化疗失败[3]。近年来,相关研究[4-5]发现多种耐药基因参与铂类药物化疗耐药过程。程序性死亡受体1(PD-1)是适应性和先天免疫应答的抑制剂,可抵抗肿瘤T细胞免疫,导致肿瘤免疫逃避[6]。PD-1异常表达与胃癌预后不良有关[7]。PD-1单核苷酸多态性(SNP)可引起PD-1基因异常表达和结构与功能异常,导致疾病的发生,相关报道[8]显示PD-1基因rs2227982、rs36084323、rs7421861多态性与食管胃交界处腺癌发病风险显著相关。但PD-1基因多态性与胃癌铂类药物化疗的药物反应是否存在关联尚不清楚,本研究检测了103例胃癌患者PD-1基因rs36084323、rs2227982、rs7421861位点多态性,并分析其与铂类药物化疗敏感性的关系,现报告如下。
1. 资料与方法
1.1 一般资料
本研究获得苏州科技城医院伦理委员会审核批准,选取2016年5月—2020年12月于本院住院治疗的胃癌患者作为研究对象。纳入标准: ①经组织病理学证实胃癌者; ②汉族患者; ③美国东部肿瘤协作组(ECOG)体力状况评分≤2分者; ④接受化疗,且化疗前血常规、肝肾功能正常者。排除标准: ①合并其他部位恶性肿瘤,严重心、肝、肾功能障碍者; ②有铂类化疗药物禁忌证者; ③既往接受手术、放化疗治疗者或采用非化疗方法治疗者; ④发生广泛远处转移或腹腔种植性转移,预计存活期不足5个月,恶病质、病情危重者; ⑤有认知功能障碍而无法沟通者; ⑥拒绝参与研究者。最终共纳入103例胃癌患者,男55例,女48例; 年龄52~73岁,平均(62.35±5.12)岁; 肿瘤直径2~5 cm, 平均(3.65±0.62)cm; 肿瘤部位为胃上部29例、胃中部42例、胃下部32例; 病理类型为腺癌62例,印戒细胞癌39例,其他2例; 分化程度为低度分化57例、高中度分化46例; TNM分期为ⅢA~ⅢB期51例、ⅢC~Ⅳ期52例。所有患者及其家属均对研究知情同意。
1.2 化疗方法及化疗反应评估
所有患者接受奥沙利铂联合替吉奥(SOX)方案或者紫杉醇脂质体联合顺铂、5-氟尿嘧啶(PCF)方案化疗。① SOX方案: 替吉奥胶囊(山东新时代药业有限公司,批号170913)口服,早晚各1次,剂量80 mg/m2(第1~14天),注射用奥沙利铂(江苏恒瑞医药有限公司,批号170811)130 mg/m2静脉滴注(第1天)。1个化疗周期为21 d, 连续化疗2个周期。② PCF方案: 注射用顺铂(齐鲁制药有限公司,批号170113) 20 mg/m2避光静脉滴注, 1次/d(第1~5天),注射用紫杉醇脂质体(南京绿叶制药有限公司,批号181205) 135 mg/m2静脉滴注(第1天),氟尿嘧啶注射液(天津金耀药业有限公司,批号170112)750 mg/m2静脉滴注(第1~5天)。1个化疗周期为21 d, 化疗2个周期。
治疗结束后,根据实体肿瘤疗效评价标准(RECIST)1.1版[9]进行影像学检查和疗效评价,疗效分为完全缓解(病灶完全消失)、部分缓解(病灶直径之和减少>30%)、稳定(病灶直径之和减少≤30%或增大 < 20%)、进展(病灶直径之和增大≥20%或出现新发病灶)。将完全缓解、部分缓解定义为化疗敏感(将此类患者纳入敏感组,共45例),稳定、进展定义为化疗抗拒(将此类患者纳入抗拒组,共58例)。
1.3 PD-1基因多态性检测
化疗结束后采集患者外周静脉血3 mL置于2%EDTA抗凝试管中,取100 μL血标本加入红细胞裂解液混匀,冰浴,离心(4 ℃,2 000转/min,离心半径10 cm,时间3 min)弃上清,加入5% Chelez 100 μL混匀, 56 ℃孵育20 min, 震荡10 s, 离心(4 ℃, 2 000转/min, 离心半径10 cm, 时间2 min), 应用核酸提取仪(美国贝克曼库尔特公司)及配套试剂提取DNA,选择波长260 nm和280 nm处的吸光度(A)比值(A260/280)在1.6~ 1.8, 浓度>50 ng/μL的DNA样品待检。GenBank数据库查找PD-1基因,采用Premier 5.0软件设计引物,引物序列由北京蓝博斯特生物技术有限公司设计。rs36084323: 上游引物5′-GCCATCCACAAGGTGGAAGCT-3′, 下游引物5′-CTCAACCCCACTCCCATTCTG-3′; rs2227982: 上游引物5′-GGACAGCTCAGGGTAAGCAG-3′, 下游引物5′-GCATACTCCGTCTGCTCAGG-3′; rs7421861: 上游引物5′-AAGGGGGTGAAGGCTCTTAG-3′, 下游引物5′-CTGGGGAGTCTGAGAGATGG-3′。
以提取DNA为模板进行聚合酶链反应(PCR)扩增反应,反应体系为25 μL,含有60 ng DNA,2.5 μL dNTPs(2 mmol/L), 反应条件为94 ℃预变性5 min, 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s, 35个循环, 72 ℃延伸5 min。取PCR扩增产物10 μL进行碱性磷酸酶处理后进行PCR反应, 37 ℃ 20 min, 85 ℃ 5 min, 4 ℃延伸。加入单碱基延伸反应液(包括HPLC用水0.6 μL, iPLEX Buffer Plus 0.2 μL, iPLEX Termination min 0.2 μL, Primer Mix 0.9 μL, iPLEX Enzyme 0.04 μL)进行PCR反应, 37 ℃ 20 min, 85 ℃ 5 min, 4 ℃延伸。树脂纯化10 min, 采用MassARRAY核酸质谱分析系统(美国Sequenom公司)对PD-1基因rs36084323、rs2227982、rs7421861位点多态性进行质谱检测。
1.4 统计学分析
采用SHEsis软件进行Hardy-Weinberg平衡检验, P>0.05为符合遗传平衡吻合度。采用SPSS 25.0统计学软件进行数据分析,基因型以[n(%)]表示,比较采用χ2检验,以比值比(OR)及95%置信区间(CI)描述风险度。采用Kolmogorov-Smirnov法检验计量资料拟合优度,符合正态分布以(x±s)表示,采用Student-t检验。采用Logistic回归分析探讨胃癌患者铂类药物化疗敏感性的影响因素。检验水准α=0.05, P < 0.05为差异有统计学意义。
2. 结果
2.1 基线资料
敏感组高中度分化者占比、ⅢA~ⅢB期者占比高于抗拒组,差异有统计学意义(P < 0.05); 2组其他基线资料(年龄、性别、肿瘤直径、病理类型、肿瘤部位、化疗方案)比较,差异无统计学意义(P>0.05)。见表 1。
表 1 2组患者基线资料比较(x±s)[n(%)]指标 敏感组(n=45) 抗拒组(n=58) χ2/t P 年龄/岁 62.27±5.15 62.41±5.03 0.139 0.890 性别 男 26(57.78) 29(50.00) 0.616 0.433 女 19(42.22) 29(50.00) 肿瘤直径/cm 3.51±0.63 3.76±0.71 1.861 0.066 病理类型 腺癌 29(64.44) 33(56.90) 0.705 0.703 印戒细胞癌 15(33.33) 24(41.38) 其他 1(2.23) 1(1.72) 肿瘤部位 胃癌合并淋巴结转移 14(31.11) 15(25.86) 1.640 0.440 胃癌合并腹腔转移 20(44.44) 22(37.93) 胃癌合并肝、肺等其他脏器转移 11(24.44) 21(36.21) TNM分期 ⅢA~ⅢB期 24(53.33) 17(29.31) 6.103 0.013 ⅢC~Ⅳ期 21(46.67) 41(70.69) 分化程度 低度分化 15(33.33) 42(72.41) 15.659 < 0.001 高中度分化 30(66.67) 16(27.59) 化疗方案 SOX方案 27(60.00) 30(51.72) 0.702 0.402 PCF方案 18(40.00) 28(48.28) 2.2 敏感组和抗拒组PD-1基因rs36084323、rs2227982、rs7421861位点多态性比较
2组rs36084323、rs2227982、rs7421861位点PD-1基因型频率分布均符合Hardy-Weinberg平衡定律(P=0.241、0.306、0.421), 具有群体代表性,可进行遗传学分析。敏感组与抗拒组rs36084323位点PD-1基因型、等位基因分布情况比较,差异无统计学意义(χ2=0.103、0.114, P=0.950、0.736); 2组rs2227982、rs7421861位点PD-1基因型、等位基因分布情况比较,差异有统计学意义(χ2=33.752、53.973、24.120、50.048, P < 0.001)。rs2227982位点TT基因型(OR=1.739, 95%CI为1.656~1.867)、CT基因型(OR=1.524, 95%CI为1.435~1.663)化疗敏感性较CC基因型提高, T等位基因化疗敏感性较C等位基因提高(OR=1.721, 95%CI为1.603~1.851), 差异有统计学意义(P < 0.05)。rs7421861位点TT基因型(OR=1.605, 95%CI为1.556~1.767)、CT基因型(OR=1.414, 95%CI为1.372~1.525)化疗敏感性较CC基因型降低, T等位基因化疗敏感性较C等位基因降低(OR=1.531, 95%CI为1.423~1.672), 差异有统计学意义(P < 0.05)。见图 1。
2.3 胃癌铂类药物化疗敏感性的影响因素分析
以胃癌患者铂类药物化疗结局为因变量(赋值: 0=抗拒, 1=敏感),以分化程度(赋值: 0=低度分化, 1=高中度分化)、TNM分期(赋值: 0=ⅢA~ⅢB期, 1=ⅢC~Ⅳ期)、PD-1基因rs2227982位点多态性(赋值: 0=CC基因型, 1= CT+TT)、PD-1基因rs7421861位点多态性(赋值: 0= TT基因型, 1= CT+CC)为自变量,建立Logistic回归模型。Logistic回归分析结果显示,分化程度、PD-1基因rs2227982位点多态性、PD-1基因rs7421861位点多态性与胃癌患者铂类药物化疗敏感性显著相关(P < 0.01), 见表 3。
表 3 影响胃癌铂类药物化疗敏感性的Logistic回归分析结果因素 β SE Waldχ2 OR(95%CI) P TNM分期 0.202 0.172 1.379 1.224(0.920~1.321) 0.623 分化程度 0.503 0.169 8.859 1.654(1.521~1.754) 0.003 PD-1基因rs2227982位点多态性 0.472 0.153 9.517 1.603(1.542~1.762) < 0.001 PD-1基因rs7421861位点多态性 0.436 0.148 8.679 1.547(1.462~1.669) 0.002 3. 讨论
铂类药物是抗瘤活性较强的广谱抗肿瘤药物,可通过进入癌细胞与DNA结合形成Pt-DNA, 导致交链和复制障碍,诱导细胞凋亡,发挥抗癌作用,是目前治疗胃癌的基础化疗药物。但由于个体之间存在遗传异质性,即便采用同种化疗方案和同样剂量,个体疗效和毒副作用的差异性也较大[10]。相关研究[11]发现,免疫检查点不仅与肿瘤形成有关,也与化疗个体异质性反应和化疗失败有关。
PD-1属于免疫球蛋白CD28/B7超家族,是一种具有负向免疫调节功能的免疫检查点抑制剂,在T细胞、B细胞、自然杀伤细胞、单核细胞及树突状细胞中广泛表达,在肿瘤特异性T细胞上高表达,通过与程序性死亡受体配体1(PD-L1)结合负性调控T细胞增殖分化,激活抗原特异性T细胞凋亡和抑制调节性T细胞凋亡,在抑制免疫应答和促进自身耐受性方面发挥着重要作用[12-13]。T细胞表面PD-1与PD-L1结合后, PD-1胞内段C端免疫受体酪氨酸转换基序发生磷酸化而被激活,磷酸化的C端免疫受体酪氨酸转换基序募集胞内Src同源区2含域磷酸酶-2(SHP-2)分子, SHP-2可抑制Toll样受体去磷酸化,同时抑制T淋巴细胞增殖分化,损伤T细胞效能,使T淋巴细胞功能“耗竭”,降低对肿瘤杀伤能力[14]。抑制PD-1和PD-L1可增强T细胞应答,介导抗肿瘤活性[15]。临床研究[16]显示, PD-1抑制剂联合化疗可提高复发或转移性鼻咽癌的客观缓解率。PD-1抑制剂联合阿帕替尼治疗晚期胃癌,可减轻阿帕替尼毒的副作用[17]。
PD-1基因位于人类染色体2q37.3, 存在多个突变位点,本研究选取与胃癌相关的常见突变位点s36084323、rs2227982、rs7421861[8]进行多态性分析,结果发现rs2227982、rs7421861位点多态性与胃癌患者铂类药物化疗敏感性有关。rs2227982 C/T多态性位于外显子5, 编码PD-1受体胞内氨基酸,参与信号转导和免疫调节通路。REN H T等[18]发现, rs2227982位点TT基因型、CT基因型相较于CC基因型可降低人表皮生长因子受体-2(Her-2)阳性乳腺癌的患病风险。但相关研究[19]结果显示, rs2227982位点TT基因型或CT基因型相较于CC基因型增加了胃贲门癌的患病风险。本研究发现, rs2227982位点TT基因型、CT基因型较CC基因型化疗敏感性高,提示携带T基因者的化疗反应性更高。分析原因, rs2227982位点C→T突变可使PD-1受体胞外域中的缬氨酸(Val)被丙氨酸(Ala)取代,影响PD-1基因序列、分子结合和功能,进而改变PD-1在免疫调节中的作用[8], 抑制其负向调控免疫反应的作用,导致抗肿瘤活性增强,促使对铂类化疗药物有更好的反应性。rs7421861 C/T多态性位于内含子1, 涉及顺式作用元件和反式作用因子相互作用,在PD-1基因启动、活性增加、基因表达中发挥着重要作用。rs7421861位点多态性与整体癌症风险增加[19], ZANG B等[20]研究显示rs7421861位点TT基因型食管癌患者血清PD-1水平高于TC基因型和CC基因型,生存率低于TC基因型和CC基因型。本研究结果显示, TT基因型、TC基因型较CC基因型患者具有更低的铂类化疗敏感性,说明rs7421861位点C→T变异可提高PD-1活性,进而抑制T细胞应答和抗肿瘤活性,导致化疗抗拒。本研究未发现rs36084323位点多态性与胃癌铂类药物化疗反应性的关系,赵万等[21]也指出rs36084323 A/G多态性与非小细胞肺癌患者铂类药物化疗敏感性无关。
综上所述, PD-1基因rs2227982、rs7421861位点多态性可能与胃癌患者铂类药物化疗敏感性有关, rs2227982位点携带T等位基因者有更高的化疗敏感性,rs7421861位点携带T等位基因者可能有更高的化疗抗拒性。本研究局限之处在于样本量偏少,仅检测了汉族居民的PD-1基因多态性,今后还需扩大样本范围和例数开展更加深入的研究。
-
表 1 2组患者一般资料及生化指标水平比较(x±s)[n(%)]
指标 抑郁症组(n=98) 非抑郁症组(n=65) 年龄/岁 51.87±4.12 52.39±4.41 性别 男 60(61.22) 42(64.62) 女 38(38.78) 23(35.38) BMI/(kg/m2) 23.19±1.27 23.26±1.06 高血压病史 65(66.33) 37(56.92) 糖尿病史 27(27.55) 16(24.62) 吸烟史 30(30.61) 17(26.15) 饮酒史 40(40.82) 25(38.46) 空腹血糖/(mmol/L) 7.34±1.69* 6.32±1.46 TC/(mmol/L) 4.27±1.04 4.56±1.20 TG/(mmol/L) 1.82±0.56 1.76±0.47 HDL-C/(mmol/L) 2.46±0.83 2.53±0.77 LDL-C/(mmol/L) 1.78±0.54 1.80±0.61 BMI: 体质量指数; TC: 总胆固醇; TG: 甘油三酯;
HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇。
与非抑郁症组比较, *P<0.05。表 2 2组血清adropin、PAF、GFAP水平比较(x±s)
组别 n adropin/(pg/mL) PAF/(pg/mL) GFAP/(ng/mL) 抑郁症组 98 49.36±9.62* 124.47±14.52* 12.79±3.16* 非抑郁症组 65 67.53±15.77 107.58±10.43 8.84±2.37 PAF: 血小板活化因子; GFAP: 胶质纤维酸性蛋白。与非抑郁症组比较, * P<0.05。 表 3 不同抑郁程度患者血清adropin、PAF、GFAP水平比较(x±s)
抑郁程度 n adropin/(pg/mL) PAF/(pg/mL) GFAP/(ng/mL) 轻度抑郁 47 56.17±10.22 116.58±10.69 10.23±3.14 中度抑郁 31 48.76±9.53* 125.84±10.51* 13.68±3.53* 重度抑郁 20 34.29±7.26*# 140.92±12.37*# 17.34±3.82*# PAF: 血小板活化因子; GFAP: 胶质纤维酸性蛋白。与轻度抑郁相比, * P<0.05; 与中度抑郁相比, #P<0.05。 表 4 CHD患者发生抑郁症的多因素分析
因素 β SE Wald χ2 P OR 95%CI adropin 0.880 0.244 12.996 <0.001 2.410 1.494~3.888 PAF 0.868 0.261 11.059 0.001 2.382 1.428~3.973 GFAP 0.861 0.284 9.186 0.002 2.365 1.355~4.126 PAF: 血小板活化因子; GFAP: 胶质纤维酸性蛋白。 -
[1] WANG J, JIA L, LI X, et al. New insights into the association between fibrinogen and coronary atherosclerotic plaque vulnerability: an intravascular optical coherence tomography study[J]. Cardiovasc Ther, 2019, 2019: 8563717. http://www.researchgate.net/publication/332152308_New_Insights_into_the_Association_between_Fibrinogen_and_Coronary_Atherosclerotic_Plaque_Vulnerability_An_Intravascular_Optical_Coherence_Tomography_Study
[2] THEOHARIDES T C, ANTONOPOULOU S, DEMOPOULOS C A. Coronavirus 2019, microthromboses, and platelet activating factor[J]. Clin Ther, 2020, 42(10): 1850-1852. doi: 10.1016/j.clinthera.2020.08.006
[3] LIU G, GENG J. Glial fibrillary acidic protein as a prognostic marker of acute ischemic stroke[J]. Hum Exp Toxicol, 2018, 37(10): 1048-1053. doi: 10.1177/0960327117751236
[4] WAGNER M, GELBRICH G, KIRCHER J, et al. Secondary prevention in younger vs. older coronary heart disease patients-insights from the German subset of the EUROASPIRE IV survey[J]. Int J Behav Med, 2018, 25(3): 283-293. doi: 10.1007/s12529-017-9691-y
[5] WEINREB S J, PIANELLI A J, TANGA S R, et al. Risk factors for development of obesity in an ethnically diverse CHD population[J]. Cardiol Young, 2019, 29(2): 123-127. doi: 10.1017/S1047951118001889
[6] MARCZUK N, CECERSKA-HERYCE, JESIONOWSKA A, et al. Adropin-physiological and pathophysiological role[J]. Postepy Hig Med Dosw: Online, 2016, 70(0): 981-988. http://www.researchgate.net/profile/Natalia_Marczuk2/publication/308665171_Adropin_physiological_and_pathophysiological_role/links/594cd2900f7e9ba1ec4d35c2/Adropin-physiological-and-pathophysiological-role.pdf
[7] WU L, FANG J, YUAN X, et al. Adropin reduces hypoxia/reoxygenation-induced myocardial injury via the reperfusion injury salvage kinase pathway[J]. Exp Ther Med, 2019, 18(5): 3307-3314. http://www.researchgate.net/publication/335402908_Adropin_reduces_hypoxiareoxygenation-induced_myocardial_injury_via_the_reperfusion_injury_salvage_kinase_pathway
[8] TOSCANO E C, SILVA B C, VICTORIA E C, et al. Platelet-activating factor receptor (PAFR) plays a crucial role in experimental global cerebral ischemia and reperfusion[J]. Brain Res Bull, 2016, 124: 55-61. doi: 10.1016/j.brainresbull.2016.03.022
[9] HAN W, ZHANG C, WANG H, et al. Alterations of irisin, adropin, preptin and BDNF concentrations in coronary heart disease patients comorbid with depression[J]. Ann Transl Med, 2019, 7(14): 298. doi: 10.21037/atm.2019.05.77
[10] HALARIS A. Inflammation-associated co-morbidity between depression and cardiovascular disease[J]. Curr Top Behav Neurosci, 2017, 31: 45-70. http://www.researchgate.net/profile/Angelos_Halaris/publication/309816830_Inflammation-Associated_Co-morbidity_Between_Depression_and_Cardiovascular_Disease/links/5acf4a734585154f3f460faf/Inflammation-Associated-Co-morbidity-Between-Depression-and-Cardiovascular-Disease.pdf
[11] ZHENG G H, XIONG S Q, CHEN H Y, et al. Association of platelet-activating factor receptor gene rs5938(G/T) and rs313152(T/C) polymorphisms with coronary heart disease and blood stasis syndrome in a Chinese Han population[J]. Chin J Integr Med, 2017, 23(12): 893-900. doi: 10.1007/s11655-017-2802-4
[12] TRAN T V, PARK S J, SHIN E J, et al. Blockade of platelet-activating factor receptor attenuates abnormal behaviors induced by phencyclidine in mice through down-regulation of NF-κB[J]. Brain Res Bull, 2018, 137: 71-78. doi: 10.1016/j.brainresbull.2017.11.004
[13] ABDELHAK A, HUSS A, KASSUBEK J, et al. Serum GFAP as a biomarker for disease severity in multiple sclerosis[J]. Sci Rep, 2018, 8(1): 14798. doi: 10.1038/s41598-018-33158-8
[14] MEYER J H. Neuroprogression and immune activation in major depressive disorder[J]. Mod Trends Pharmacopsychiatry, 2017, 31: 27-36. http://europepmc.org/abstract/MED/28738332
[15] FULLANA M N, RUIZ-BRONCHAL E, FERRÉS-COY A, et al. Regionally selective knockdown of astroglial glutamate transporters in infralimbic cortex induces a depressive phenotype in mice[J]. Glia, 2019, 67(6): 1122-1137. doi: 10.1002/glia.23593
[16] 李涛, 胡晓科, 范超望, 等. 首发性抑郁症患者血清GFAP、NSE、Hcy水平与认知功能的关系[J]. 检验医学与临床, 2017, 14(24): 3601-3604. doi: 10.3969/j.issn.1672-9455.2017.24.013




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
