Effects of lncRNA PAX8-AS1 on apoptosis of myocardial cells after acute myocardial infarction in mice
-
摘要:目的 观察lncRNA PAX8-AS1对小鼠急性心肌梗死(AMI)后心肌细胞凋亡的调控影响。方法 通过左冠状动脉前降支结扎构建AMI模型小鼠。取AMI模型构建成功的雄性小鼠64只,随机选择48只小鼠,于术后0、1、2、3、4、5 d各处死8只小鼠,作为AMI组。小鼠选择方式同AMI组,并采取与AMI小鼠相同的手术方式,但不进行左冠状动脉前降支结扎,于术后0、1、2、3、4、5 d各处死8只小鼠,作为Sham组。Sham组中剩余小鼠随机分为Sham+Ad-shCon组(8只)、Sham+Ad-shPAX8-AS1组(8只);AMI组中小鼠随机分为AMI+Ad-shCon组(8只)、AMI+Ad-shPAX8-AS1组(8只)。采用实时荧光定量聚合酶链反应(RT-qPCR)检测AMI组和Sham组小鼠术后心肌组织中PAX8-AS1水平变化。采用红四氮唑(TTC)染色法检测Sham+Ad-shCon组、Sham+Ad-shPAX8-AS1组、AMI+Ad-shCon组、AMI+Ad-shPAX8-AS1组小鼠梗死面积(IS)/危险区域(ARR);采用TUNEL染色法检测小鼠心肌细胞凋亡水平;采用逆转录-聚合酶链式反应(RT-PCR)、免疫组化及蛋白质印迹法检测小鼠心肌组织PAX8-AS1(RT-PCR)、B淋巴细胞瘤-2相关x蛋白(Bax)、B淋巴细胞瘤-2基因(Bcl-2)及裂解的半胱天冬酶-3(cleaved-caspase3)表达水平。结果 AMI组小鼠PAX8-AS1表达水平随着AMI术后时间的延长而增加,在术后第3天其PAX8-AS1表达水平达到最高值,并高于Sham组,差异有统计学意义(P < 0.05)。与Sham+Ad-shCon组比较,Sham+Ad-shPAX8-AS1组PAX8-AS1表达下调,差异有统计学意义(P < 0.05),AMI+Ad-shCon组及AMI+Ad-shPAX8-AS1组PAX8-AS1、IS/ARR、心肌细胞的凋亡指数、Bax及cleaved-caspase3均上调,Bcl-2下调,差异有统计学意义(P < 0.05)。与AMI+Ad-shCon组比较,AMI+Ad-shPAX8-AS1组PAX8-AS1、IS/ARR、心肌细胞的凋亡指数、Bax及cleaved-caspase3下调,Bcl-2上调,差异有统计学意义(P < 0.05)。结论 PAX8-AS1在AMI心肌组织中呈高表达,PAX8-AS1低表达可减少梗死面积,抑制心肌细胞凋亡,其作用可能与调节凋亡蛋白有关。
-
关键词:
- lncRNA PAX8-AS1 /
- 急性心肌梗死小鼠 /
- Tunel染色 /
- 心肌细胞凋亡
Abstract:Objective To observe the regulatory effect of lncRNA PAX8-AS1 on cardiomyocyte apoptosis after acute myocardial infarction (AMI) in mice.Methods AMI model mice were established by ligation of the anterior descending branch of the left coronary artery. A total of 64 male mice successfully established by AMI model were selected, 48 mice were randomly selected, and every 8 mice were sacrificed at 0, 1, 2, 3, 4 and 5 d after operation, respectively(AMI group). The selection method of mice in Sham group was the same as that of AMI group, and the operations were the same as that of AMI mice, but they didn't perform ligation of the anterior descending branch of left coronary artery. Every 8 mice were sacrificed at 0, 1, 2, 3, 4 and 5 d after operation, respectively. The remaining mice in the Sham group were randomly divided into Sham+Ad-shCon group (8 mice) and Sham+Ad-shPAX8-AS1 group (8 mice); mice in the AMI group were randomly divided into AMI+Ad-shCon group (8 mice) and AMI+Ad-shPAX8-AS1 group (8 mice). Real-time fluorescence quantitative polymerase chain reaction (RT-qPCR) was used to detect the changes of PAX8-AS1 level in myocardial tissue of the AMI group and Sham group after operation. The infarct size (IS)/risk area (ARR) of mice in the Sham+Ad-shCon group, Sham+Ad-shPAX8-AS1 group, AMI+Ad-shCon group and AMI+Ad-shPAX8-AS1 group were detected by red tetrazolium (TTC) staining; the apoptosis level of mouse cardiomyocytes was detected by TUNEL staining, and the expression levels of PAX8-AS1, B lymphocyte tumor-2 associated x protein (Bax), B lymphocyte tumor-2 gene (Bcl-2) and lytic caspase-3 (cleaved-caspase3) in mouse myocardium were detected by reverse transcription-polymerase chain reaction (RT-PCR), immunohistochemistry and western blotting.Results The expression level of PAX8-AS1 in the AMI group increased with the prolongation of time after AMI, and reached the highest level on the 3rd day after operation, which was higher than that in the Sham group, and the difference was statistically significant (P < 0.05). Compared with Sham+Ad-shCon group, the expression of PAX8-AS1 in Sham+Ad-shPAX8-AS1 group decreased significantly (P < 0.05), PAX8-AS1, IS/ARR, cardiomyocyte apoptosis index, Bax and cleaved-caspase3 were up-regulated and Bcl-2 was down-regulated in AMI+Ad-shCon group and AMI+Ad-shPAX8-AS1 group, the differences were statistically significant (P < 0.05). Compared with AMI+Ad-shCon group, PAX8-AS1, IS/ARR, cardiomyocyte apoptosis index, Bax and cleaved-caspase3 were down-regulated and Bcl-2 was up-regulated in the AMI+Ad-shPAX8-AS1 group, and the differences were statistically significant (P < 0.05).Conclusion PAX8-AS1 is highly expressed in AMI myocardium, and low expression of PAX8-AS1 can reduce infarct size and inhibit myocardial apoptosis, which may be related to apoptotic protein regulation. -
保护心肌细胞免受缺血损伤是治疗急性心肌梗死(AMI)的重要策略[1], 随着分子生物学的不断发展, AMI的靶向治疗已成为学者关注的焦点[2]。研究[3]发现,相比于心绞痛患者, AMI患者血浆中lncRNA表达谱存在显著差异,以PAX8反义RNA 1(PAX8-AS1)等表达较为突出。还有研究[4]表明PAX8-AS1-N(PAX8-AS1的一种转录本)可通过与miR-17-5p相结合,上调miR-17-5p相关靶基因,降低细胞活力,抑制细胞周期进展,诱导乳腺癌细胞凋亡。基于此,本研究推测PAX8-AS1可能对AMI的心肌细胞凋亡起到一定调控作用,参与AMI的发生发展。然而,现阶段有关PAX8-AS1在AMI进展中的作用及其机制尚不明确。本研究检测了AMI小鼠PAX8-AS1的表达水平,利用体内敲减实验探究PAX8-AS1对AMI小鼠心肌细胞凋亡的调控影响,现报告如下。
1. 材料与方法
1.1 动物与试剂
1.1.1 实验动物
SPF级雄性C57BL/6J小鼠130只, 20~25 g, 购自北京维通利华实验动物技术有限公司,动物生产许可证号: No. 11400700309252: 饲养条件: 标准饲料及环境进行喂养(昼夜周期交替),保持通风,适应性饲养1周。本试验遵循本院实验动物伦理委员会标准实施,且受其监督。
1.1.2 试剂及器材
Image-Pro Plus 6.0系统购于美国Media Cybernetics公司; 光学显微镜购于北京世纪科信科学仪器有限公司; 红四氮唑(TTC)染色试剂盒购于上海BestBio贝博生物公司; 末端脱氧核苷酸转移酶介导的dUTP镍端标记(TUNEL)凋亡试剂盒购于南京凯基公司; 激光扫描共焦显微镜购于日本OLYMPUS公司; 裂解的半胱天冬酶-3(Cleaved-caspase3)、B淋巴细胞瘤-2相关x蛋白(Bax)、B淋巴细胞瘤-2基因(Bcl-2)相关抗体均购于Proteintech公司: BCA试剂盒购于Abcam公司; RNA提取试剂盒购于美国英杰生命技术有限公司; PrimeScript RT试剂盒购于杭州联科美讯生物医药技术有限公司; SYBR® Premix Ex TaqTM Ⅱ试剂盒购于北京智杰方远科技有限公司; 逆转录试剂盒购于大连宝生物工程有限公司; PAX8-AS1、U6引物由Takara公司设计; 蛋白提取试剂盒均于自北京索莱宝科技有限公司。
1.2 模型构建
AMI模型构建,参照相关文献[5]并进行细微调整: 用1%戊巴比妥钠50 mg/kg腹腔麻醉小鼠,固定后进行局部备皮消毒,气管插管,再与小动物呼吸机连接,呼吸稳定后,打开胸腔,使心脏暴露,以左心耳下缘水平线位置作为标志,在线下缘2 mm位置用8-0 Prolene缝线从右向左对小鼠冠状动脉前降支进行缓慢结扎,结扎后显示左心室前壁颜色由鲜红变成暗紫直至苍白,心电图ST段抬高,表明左冠状动脉前降支结扎及模型构建成功,然后对胸部皮下组织及皮肤逐层缝合,待小鼠恢复自主呼吸后,将呼吸机撤除,将气管插管拔出。
1.3 动物分组及观察指标
1.3.1 观察小鼠AMI术后不同时间点心肌组织中PAX8-AS1的表达变化
取雄性C57BL/6J小鼠64只,在其中随机选择48只小鼠,采取与AMI小鼠相同的手术方式,但不进行左冠状动脉前降支结扎,于术后0、1、2、3、4、5 d各处死8只小鼠,并通过实时荧光定量逆转录聚合酶链反应(RT-qPCR)试验检测小鼠AMI心肌组织PAX8-AS1表达情况,作为Sham组。取AMI模型构建成功的雄性C57BL/6J小鼠64只,随机选择48只小鼠,于术后0、1、2、3、4、5 d各处死8只小鼠,并通过RT-qPCR试验检测小鼠AMI心肌组织PAX8-AS1表达情况,作为AMI组。
1.3.2 观察PAX8-AS1对AMI小鼠心肌细胞凋亡的诱导作用
Sham组中剩余的16只小鼠随机分为Sham+Ad-shCon组(8只, Sham术前7 d于小鼠心肌内多点注射100 μL[10]的PAX8-AS1的阴性对照载体shCon)、Sham+Ad-shPAX8-AS1组(8只, Sham术前7 d于小鼠心肌内注射100 μL腺病毒载体shPAX8-AS1); AMI组中剩余的16只小鼠随机分为AMI+Ad-shCon组(8只, AMI术前7 d于小鼠心肌内注射100 μL PAX8-AS1的阴性对照载体shCon)、AMI+Ad-shPAX8-AS1组(8只, AMI术前7 d于小鼠心肌内注射100 μL腺病毒载体shPAX8-AS1)。术后3 d给予过量戊巴比妥钠处死小鼠,摘取心脏,一部分在4%多聚甲醛溶液中固定,用于红四氮唑(TTC)染色、TUNEL染色; 一部分保存于-80 ℃条件下,用于相关mRNA、蛋白的检测。
1.3.3 TTC染色
取出在4%多聚甲醛中固定的各组心脏左心室标本,平行于房室沟,沿心底向心尖切成5片,通过TTC染色法测定危险区域(AAR)和梗死面积(IS), 用滤纸将心脏切片周围的伊文氏蓝液体吸除干净。将心脏切片置于37 ℃的含有1% TTC磷酸盐缓冲液中,避光孵育0.5 h, 再平铺于载玻片上,轧平,在4%多聚甲醛固定48 h, 将染好的切片按照顺序防置,用Image-Pro Plus 6.0对切片进行拍照, ARR为白加红色区域, IS为白色区域,计算小鼠IS/ARR。
1.3.4 TUNEL染色
取于4%多聚甲醛中固定的心肌组织,参照TUNEL凋亡试剂盒说明书操作步骤,检测心肌组织中的凋亡心肌细胞,于激光扫描共焦显微镜下观察,心肌凋亡细胞呈荧光绿。对每张切片随机选择3个视野,计算心肌细胞的调亡指数。凋亡指数=心肌细胞凋亡数/总细胞数×100%。
1.3.5 逆转录-聚合酶链式反应(RT-PCR)检测
① 提取组织中总RNA。其中PAX8-AS1以U6为内参。对RNA浓度、纯度定量,将RNA逆转录成cDNA。行RT-PCR操作,反应体系为50 μL。PAX8-AS1反应条件设定为: 预变性94 ℃ 10 min, 变性95 ℃ 15 s, 退火60 ℃ 60 s, 延伸72 ℃ 1 min, 40个循环。通过2-ΔΔCt法计算PAX8-AS1的相对转录水平。②引物序列。PAX8-AS1正向引物: 5′-AGACGGTCCAGATTCCAC-3′, 反向引物: 5′-AAGCCACATTCACAGAGGG-3′; U6正向引物: 5′-CTCGCTTCGGCAGCACA-3′, 反向引物: 5′-AACGCTTCACGAATTTGCGT-3′。
1.3.6 免疫组化
取于4%多聚甲醛中固定的心肌组织,常规石蜡包埋切片,于60 ℃温箱放置1 h, 脱蜡脱水,在3%双氧水中37 ℃孵育30 min, 磷酸盐缓冲液冲洗,于0.01 mol/L枸橼酸缓冲液中放置20 min(95 ℃),冷却至室温,冲洗,封闭, 37 ℃ 10 min。添加一抗,包括Bax(浓度1∶200)、Bcl-2(浓度1∶250)及cleaved-caspase3(浓度1∶200), 4 ℃过夜,冲洗。滴加相应二抗,室温孵育30 min, 显色复染及封片。计算阳性细胞表达率=阳性细胞数量/细胞总数×100%, 阳性细胞判定标准[6]为细胞核及细胞质内可见黄色或棕黄色颗粒。
1.3.7 蛋白质印迹法(Western blot)检测
对各组织中总蛋白进行提取和定量,在实施聚丙烯酰胺凝胶电泳将蛋白分离后,予以聚偏二氟乙烯转膜,封闭1 h, 孵育一抗(均1∶1 000稀释),包括Bax、Bcl-2及cleaved-caspase3和GAPDH, 4 ℃孵育过夜。漂洗一抗后加0.2 μg/mL山羊抗兔二抗孵育1 h,洗膜、显影成像。以GAPDH作为内参,经Image J软件对蛋白条带灰度值进行统计分析。蛋白表达水平以灰度值/GAPDH条带灰度值来表示。
1.4 统计学分析
使用SPSS 24.0及Prism 6.0软件处理数据,计量资料以(x±s)表示,多组之间比较采取单因素方差分析,两两比较采取LSD-t检验。P < 0.05为差异有统计学意义。
2. 结果
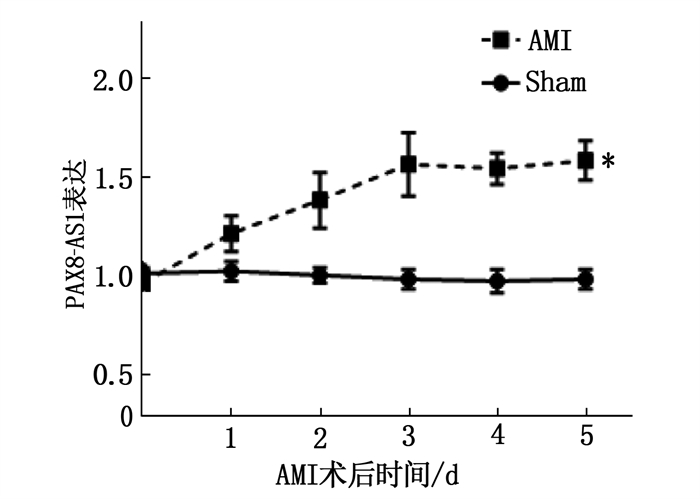
2.1 AMI组和Sham组小鼠术后心肌组织中PAX8-AS1的变化情况
AMI组小鼠中, PAX8-AS1表达水平随着AMI术后时间的延长而增加,在术后第3天其PAX8-AS1表达水平达到最高值,并高于Sham组,差异有统计学意义(P < 0.05), 随后PAX8-AS1表达水平不明显,差异无统计学意义(P>0.05)。Sham组小鼠术后PAX8-AS1水平变化不明显,差异无统计学意义(P >0.05)。见图 1。
2.2 各组小鼠心肌组织PAX8-AS1表达的比较
与Sham+Ad-shCon组PAX8-AS1表达(1.02±0.02)比较, Sham+Ad-shPAX8-AS1组(0.67±0.04)下调,差异有统计学意义(P < 0.05); AMI+Ad-shCon组(1.69±0.14)及AMI+Ad-shPAX8-AS1组(1.25±0.08) PAX8-AS1表达均上调(P < 0.05)。与AMI+Ad-shCon组比较,AMI+Ad-shPAX8-AS1组PAX8-AS1表达下调,差异有统计学意义(P < 0.05)。
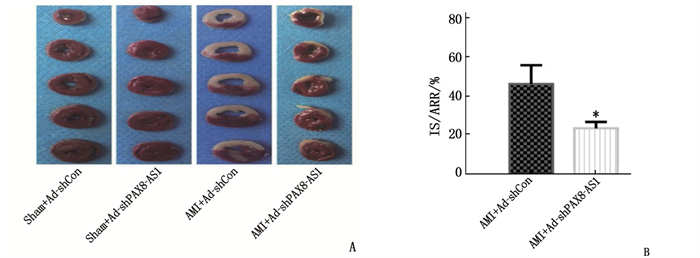
2.3 各组小鼠心肌组织梗死面积的比较
与Sham+Ad-shCon组比较,Sham+Ad-shPAX8-AS1组IS/ARR无明显变化,差异无统计学意义(P>0.05); AMI+Ad-shCon组及AMI+Ad-shPAX8-AS1组IS/ARR均增大,差异有统计学意义(P < 0.05)。与AMI+Ad-shCon组比较, AMI+Ad-shPAX8-AS1组IS/ARR减小,差异有统计学意义(P < 0.05)。见图 2。
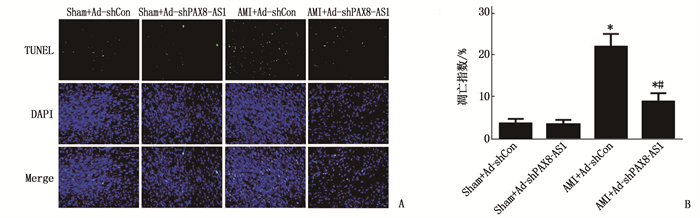
2.4 各组小鼠心肌细胞凋亡情况
与Sham+Ad-shCon组比较, Sham+Ad-shPAX8-AS1组心肌细胞的凋亡指数无明显变化,差异无统计学意义(P>0.05); AMI+Ad-shCon组及AMI+Ad-shPAX8-AS1组心肌细胞的凋亡指数均增大,差异有统计学意义(P < 0.05)。与AMI+Ad-shCon组比较,AMI+Ad-shPAX8-AS1组心肌细胞的凋亡指数减小,差异有统计学意义(P < 0.05)。见图 3。
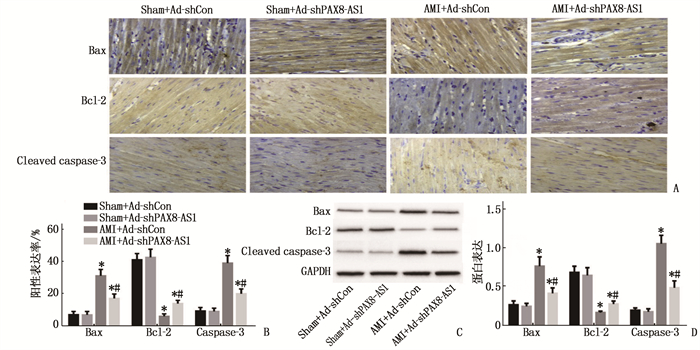
2.5 各组小鼠心肌组织凋亡相关蛋白表达情况
与Sham+Ad-shCon组比较, Sham+Ad-shPAX8-AS1组Bax、Bcl-2及cleaved-caspase3阳性表达率及蛋白水平无明显变化,差异无统计学意义(P>0.05); AMI+Ad-shCon组及AMI+Ad-shPAX8-AS1组Bax及cleaved-caspase3阳性表达率及蛋白水平上调, Bcl-2阳性表达率及蛋白水平下调,差异有统计学意义(P < 0.05)。与AMI+Ad-shCon组比较, AMI+Ad-shPAX8-AS1组Bax及cleaved-caspase3阳性表达率及蛋白水平下调, Bcl-2阳性表达率及蛋白水平上调,差异无统计学意义(P < 0.05)。见图 4。
3. 讨论
AMI是由冠状动脉急性、持续缺血缺氧造成心肌细胞凋亡,严重可导致患者AMI后心力衰竭,危及其生命安全[1]。因此, AMI后心肌细胞凋亡机制的进一步研究,对该病的治疗及预后改善具有重要意义。长链非编码RNA(lncRNAs)属于长度超过200个核苷酸的转录本,虽然蛋白编码潜能低,但可通过转录或转录后调控机制对编码基因的表达进行调控,进而影响下游基因的表达,参与一系列关键的生理、病理过程[7]。
PAX8-AS1分布于PAX8上游的2q13染色体上[8]。PAX8-AS1是PAX8的潜在调控因子[9]。吴漪皓等[10]研究报道ALK3/Pax8通路可能通过调节细胞衰老、细胞凋亡参与心脏的发育机制。侯彬等[15]研究发现PAX8-AS1在鼻咽癌组织和相关细胞株中均异常表达,上调PAX8-AS1可影响下游相关信号通路的活化,抑制鼻咽癌细胞的增殖和侵袭。YU X等[4]研究表明PAX8-AS1-N(PAX8-AS1的一种转录本)可通过与miR-17-5p结合,上调miR-17-5p靶基因的表达,如磷酸酶和张力蛋白同系物基因、细胞周期素依赖性激酶抑制因子1A,降低细胞活力,抑制细胞周期进展,诱导乳腺癌细胞凋亡。LU Y等[3]研究表明,与心绞痛患者相比,AMI患者血液lncRNA表达谱存在显著表达差异, PAX8-AS1呈高表达水平。因此,本研究推测PAX8-AS1可能通过调节其下游因子的表达,影响心肌细胞的凋亡,参与AMI的发生发展。
本研究发现, AMI组小鼠术后PAX8-AS1表达水平随着时间的延长而增高,在术后第3天其PAX8-AS1表达水平达到最高值,并高于Sham组,随后PAX8-AS1表达水平不明显,而Sham组小鼠术后PAX8-AS1表达水平变化不明显。提示PAX8-AS1水平的升高与AMI的发生发展密切相关,并取其最高值的术后时间作为后续研究的观察时间点。基于此,本研究利用PAX8-AS1敲减实验,沉默PAX8-AS1表达,将构建的慢病毒载体转染至小鼠中,以AMI术后第3天作为实验的观测点,以进一步明确PAX8-AS1低表达对小鼠AMI后心肌细胞凋亡的影响。本研究结果显示,与Sham+Ad-shCon组比较, Sham+Ad-shPAX8-AS1组PAX8-AS1表达下调, AMI+Ad-shCon组及AMI+Ad-shPAX8-AS1组PAX8-AS1均上调。与AMI+Ad-shCon组比较, AMI+Ad-shPAX8-AS1组PAX8-AS1表达下调。说明本研究PAX8-AS1敲减实验成功。此外,本研究梗死面积结果显示,与Sham+Ad-shCon组比较,Sham+Ad-shPAX8-AS1组IS/ARR无明显变化, AMI+Ad-shCon组及AMI+Ad-shPAX8-AS1组IS/ARR均增大。与AMI+Ad-shCon组比较, AMI+Ad-shPAX8-AS1组IS/ARR减小。提示PAX8-AS1在AMI心肌组织中表达下调可有效减少心肌梗死面积,推测PAX8-AS1低表达是治疗AMI的潜在靶标。分析原因可能与PAX8-AS1低表达通过不同的途径调控下游基因和蛋白的表达,进而抑制AMI的心肌细胞凋亡有关[4]。
细胞凋亡是机体正常细胞受到生理或病理刺激后,使DNA内切酶被激活,由基因控制的细胞自发性死亡过程,包括细胞凋亡、心肌缺血或梗死,抑制心肌细胞凋亡和坏死对改善AMI具有积极作用[12]。现阶段研究较为成熟的心肌细胞凋亡途径主要为死亡受体途径及线粒体途径,均可诱导天冬氨酸特异性半胱氨酸蛋白酶家族的活化,使细胞底物裂解及细胞凋亡; 其中cleaved-caspase3所在的激活途径是凋亡启动的早期事件; 由细胞内应激触发的线粒体途径可导致Bax/Bcl-2依赖的线粒体外膜渗透性转运道开放,易和凋亡蛋白酶激活因子1形成凋亡体,促进胱天蛋白酶9活化,进而激活下游效应分子诱导细胞凋亡[13-14]。因此, Bax、Bcl-2及cleaved-caspase3常作为评估心肌细胞凋亡的典型凋亡标志物。本研究发现,与Sham+Ad-shCon组比较,AMI+Ad-shCon组及AMI+Ad-shPAX8-AS1组凋亡指数、Bax及cleaved-caspase3阳性表达率及蛋白水平上调, Bcl-2阳性表达率及蛋白水平下调。且AMI+Ad-shPAX8-AS1组Bax及cleaved-caspase3凋亡指数、阳性表达率及蛋白水平低于AMI+Ad-shCon组, Bcl-2阳性表达率及蛋白水平高于AMI+Ad-shCon组。证明了PAX8-AS1在AMI心肌组织中表达下调可通过调控凋亡相关蛋白表达,起到抑制小鼠心肌细胞凋亡的作用。分析原因可能是PAX8-AS1低表达可通过抑制miR-17-5p靶基因的表达,如磷酸酶和张力蛋白同系物基因(PTEN), 来减少心肌细胞的凋亡[4], 如WANG J Z等[15]研究表明过表达PTEN可通过调节PI3K/Akt和JAK/STAT信号转导通路来诱导心肌细胞凋亡,而其低表达对心肌凋亡具有抑制作用。
综上所述, PAX8-AS1在AMI心肌组织中呈高表达, PAX8-AS1低表达可减少梗死面积,抑制心肌细胞凋亡,其作用原因可能与调节凋亡蛋白有关,本研究对开展AMI的诊疗具有重要价值和意义。
-
-
[1] DEFILIPPIS A P, CHAPMAN A R, MILLS N L, et al. Assessment and treatment of patients with type 2 myocardial infarction and acute nonischemic myocardial injury[J]. Circulation, 2019, 140(20): 1661-1678. doi: 10.1161/CIRCULATIONAHA.119.040631
[2] 汤亚东, 赵玉娟. miRNA在急性心肌梗死及治疗中的研究进展[J]. 中国循证心血管医学杂志, 2020, 12(9): 1150-1152. doi: 10.3969/j.issn.1674-4055.2020.09.35 [3] LU Y, MENG X, WANG L, et al. Analysis of long non-coding RNA expression profiles identifies functional lncRNAs associated with the progression of acute coronary syndromes[J]. Exp Ther Med, 2018, 15(2): 1376-1384. http://www.onacademic.com/detail/journal_1000040212873510_1bb0.html
[4] YU X, CAO Y, TANG L, et al. Baicalein inhibits breast cancer growth via activating a novel isoform of the long noncoding RNA PAX8-AS1-N[J]. J Cell Biochem, 2018, 119(8): 6842-6856. doi: 10.1002/jcb.26881
[5] UNSÖLD B, KAUL A, SBROGGIÒ M, et al. Melusin protects from cardiac rupture and improves functional remodelling after myocardial infarction[J]. Cardiovasc Res, 2014, 101(1): 97-107. doi: 10.1093/cvr/cvt235
[6] XUE X, LUO L B. LncRNA HIF1A-AS1 contributes to ventricular remodeling after myocardial ischemia/reperfusion injury by adsorption of microRNA-204 to regulating SOCS2 expression[J]. Cell Cycle, 2019, 18(19): 2465-2480. doi: 10.1080/15384101.2019.1648960
[7] HOMBACH S, KRETZ M. Non-coding RNAs: classification, biology and functioning[J]. Adv Exp Med Biol, 2016, 937: 3-17. http://europepmc.org/abstract/MED/27573892
[8] LANG D, POWELL S K, PLUMMER R S, et al. PAX genes: roles in development, pathophysiology, and cancer[J]. Biochem Pharmacol, 2007, 73(1): 1-14. doi: 10.1016/j.bcp.2006.06.024
[9] NICA A C, DERMITZAKIS E T. Expression quantitative trait loci: present and future[J]. Philos Trans R Soc Lond B Biol Sci, 2013, 368(1620): 20120362. doi: 10.1098/rstb.2012.0362
[10] 吴漪皓. Pax8基因在调节小鼠心肌细胞生长与衰老中的作用研究[D]. 温州: 温州医科大学, 2016. [11] 侯彬, 黄维平, 尹中普, 等. lncRNA PAX8-AS1对鼻咽癌细胞的增殖和侵袭的影响及作用机制[J]. 广东医学, 2020, 41(15): 1533-1537. https://www.cnki.com.cn/Article/CJFDTOTAL-GAYX202015005.htm [12] 余丽霞, 王键. miRNA调控心肌梗死后心肌细胞凋亡的研究进展[J]. 心脏杂志, 2019, 31(2): 227-231. https://www.cnki.com.cn/Article/CJFDTOTAL-XGNZ201902025.htm [13] MANASA K L, SAIFI M A, TANGELLA Y, et al. Synthesis of substituted cinnamido linked quinazolinone congeners as potential anticancer agents via mitochondrial dependent intrinsic apoptotic pathway[J]. Anticancer Agents Med Chem, 2019, 19(16): 1935-1948. http://www.ingentaconnect.com/contentone/ben/acamc/2019/00000019/00000016/art00005
[14] 韩笑, 郭浩, 杨斌, 等. 丹红滴丸调节bcl-2/bax-cyt-C-caspase-3抑制心肌缺血再灌注大鼠心肌细胞凋亡[J]. 中药药理与临床, 2020, 36(3): 154-158. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYYL202003029.htm [15] WANG J Z, FENG Q L, LIANG D K, et al. MiRNA-26a inhibits myocardial infarction-induced apoptosis by targeting PTEN via JAK/STAT pathways[J]. Cells Dev, 2021, 165: 203661. doi: 10.1016/j.cdev.2021.203661
-
期刊类型引用(1)
1. 王广法,王成东,王艳玲,张硕,李蒙蒙. 长链非编码RNA BDNF-AS和FBXW7在伴冲动暴力行为精神分裂症中的表达及作用. 精神医学杂志. 2022(06): 630-633 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号