Quantitative analyses of cardiac CT plain scan versus CT angiography in assessing epicardial fat volume
-
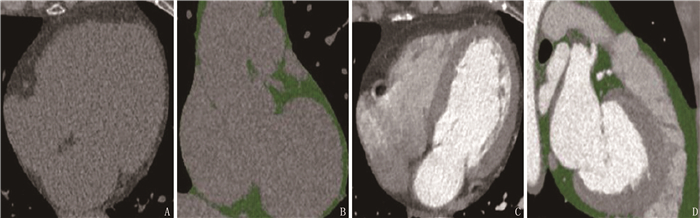
摘要:目的 比较心脏CT平扫与心脏CT血管造影(CTA)定量分析测定心外膜脂肪体积的临床效果。方法 选取170例冠心病患者为研究对象,患者均同期接受心脏CT平扫与CTA检查,将原始图像上传工作站,基于最佳R-R间期相位重建患者心脏影像,自动勾勒心包轮廓,提取心外膜脂肪组织信息,应用容积增强工具测量并计算脂肪容积,操作由放射影像科2名资深医师采用双盲法完成,比较观察指标水平,分析CT平扫与CTA测定心外膜脂肪体积结果的一致性。结果 CT平扫测定心外膜脂肪体积为(99.59±43.14) cm2, CTA测定心外膜脂肪体积为(94.05±45.70) cm3, 差异无统计学意义(P>0.05)。线性回归分析显示, 2名医师CT平扫与CTA测定心外膜脂肪体积结果的一致性呈显著正相关(RA2=0.942, RB2=0.947)。Bland-Altman分析显示, CT平扫与CTA测定心外膜脂肪体积的重复系数误差分别为9.45(95%CI 7.83~10.62) cm3和7.68(95%CI 6.71~7.93)cm3。CT平扫的组内相关系数为0.95(95%CI 0.94~0.96), CTA的组内相关系数为0.96(95%CI 0.95~0.97), 两者具有较好一致性。结论 心脏CT平扫与CTA均可用于心外膜脂肪体积评估, 两者定量分析结果的一致性较好,临床可根据患者实际情况酌情选用。Abstract:Objective To compare the clinical effect of quantitative analysis of CT plain scan and CT angiography (CTA) in assessing epicardial fat volume.Methods A total of 170 patients with coronary heart disease were selected as study objects, and underwent cardiac CT plain scan and CTA examination at the same period. After uploading the original images to the workstation, patients' heart images were reconstructed based on optimal R-R interphase, and outline of the pericardium was automatically drawn. Epicardial adipose tissue was extracted; volume enhancement tools were used to measure and calculate fat volume; the operation was performed by two senior radiographic physicians using double blind methods. CT plain scan and CTA were used to determine the consistency of measured results of epicardial fat volume.Results Volume of epicardial fat measured by CT was (99.59±43.14) cm2, and was (94.05±45.70) cm3 by CTA, the difference was not statistically significant (P>0.05). Linear regression analysis showed that there was a significant positive correlation between consistency of CT plain scan and that of epicardial fat volume CTA determined by two physicians (RA2=0.942, RB2=0.947). Bland-Altman analysis showed that the repetition coefficient errors of CT scan and CTA were 9.45(95%CI, 7.83 to 10.62) cm3 and 7.68 (95%CI, 6.71 to 7.93) cm3, respectively. The correlation coefficient in CT plain scan group was 0.95(95%CI, 0.94 to 0.96), and was 0.96(95%CI, 0.95 to 0.97) in the CTA group, and they had good consistency.Conclusion Both cardiac CT flat scan and CTA can be used to evaluate the fat volume of the external cardiac membrane, and they both have good consistency in quantitative analysis results, therefore they can be selected according to the actual situations.
-
Keywords:
- heart /
- volume of epicardial fat /
- plain CT scan /
- CT angiography /
- quantitative analysis
-
近年来,随着居民膳食结构、生活方式的变化,结肠癌的发病率逐年增高,且发病年龄趋向低龄化[1]。结肠癌的早期预防和并发症诊治成为热门话题,多数结肠癌患者围术期或化疗期间不可避免地会出现一些并发症,可导致患者难以耐受甚至终止治疗[2-5]。相关研究[6-10]发现,结肠癌术后相关并发症的出现与肠道微生态的失调息息相关,这为结肠癌治疗期间并发症的早期诊治提供了新思路。KOTZAMPASSI K等[11]通过调整肠道菌群中的益生菌占比来降低相关并发症发生率,取得了一定成效。相关研究[12-15]显示,服用益生菌在治疗或预防肠道炎性疾病时有一定作用,化疗期间肠道益生菌占比增加亦可降低肠道并发症的发生率。然而,临床对于结肠癌患者围术期及化疗期间是否应该全程应用益生菌制剂尚无定论。本研究探讨了围术期及化疗期全程肠道微生态干预对结肠癌患者术后及化疗期间并发症的影响,现报告如下。
1. 资料与方法
1.1 一般资料
选取2020年8月—2021年3月丹东市中心医院收治的79例结肠癌患者作为研究对象。纳入标准: ①符合《中国结肠癌诊疗规范(2020年版)》[16]中的结肠癌诊断标准,经结肠镜、肠镜下取病理组织检查示结肠癌,且经CT/MRI检查确认无远处转移者; ②病理分期为Ⅱb~Ⅲb期者; ③首次确诊结肠癌且此前未接受相关治疗者; ④对本研究知情同意且签署相关知情同意文件者。排除标准: ①术前有放化疗史者; ②术前并发其他肠道疾病或恶性肿瘤者; ③术前服用与此次治疗无关的其他抗生素、激素、免疫抑制剂或其他肠道益生菌制剂者; ④术前合并机械性肠梗阻、肠粘连或肠穿孔者; ⑤存在自身免疫性疾病或营养不良者; ⑥合并心、肝、肾功能严重障碍和糖尿病等代谢性疾病者。依据是否在围术期及化疗期全程应用双歧杆菌三联活菌片,将患者分为干预组40例和对照组39例。干预组患者年龄44~78岁,病程2~11个月; 对照组患者年龄45~79岁,病程3~11个月。2组患者性别、年龄、病程、病变部位、肿瘤直径、病理分期、组织学类型比较,差异均无统计学意义(P>0.05), 见表 1。
表 1 2组一般资料比较(x±s)[n(%)]指标 干预组(n=40) 对照组(n=39) χ2/t/u P 性别 男 26(65.00) 22(56.41) 0.611 0.434 女 14(35.00) 17(43.59) 年龄/岁 59.48±8.33 58.79±8.23 23.013 0.519 病程/月 5.55±2.26 5.09±2.06 4.729 0.857 病变部位 横结肠 16(40.00) 15(38.46) 0.104 0.949 左半结肠 13(32.50) 14(35.90) 乙状结肠 11(27.50) 10(25.64) 肿瘤直径 < 3 cm 12(30.00) 10(25.64) 0.419 0.675 3~5 cm 17(42.50) 17(43.59) > 5 cm 11(27.50) 12(30.77) 病理分期 Ⅱb期 9(22.50) 11(28.21) 0.429 0.668 Ⅲa期 20(50.00) 18(46.15) Ⅲb期 11(27.50) 10(25.64) 组织学类型 腺癌 35(87.50) 36(92.31) 0.668 0.716 黏液腺癌 4(10.00) 2(5.13) 未分化癌 1(2.50) 1(2.56) 1.2 方法
1.2.1 治疗方法
① 对照组患者常规行结肠癌根治术及术后化疗,术前3 d开始口服甲硝唑(0.2 g/次、3次/d)。术前3 d行常规肠道准备,即进食少渣饮食或半流质饮食,术前1 d进食流质饮食,术前晚将复方聚乙二醇电解质散(舒泰清)溶于2 000 mL水中于2 h内口服,肠道准备不佳者行肠道清洁灌肠,术前12 h禁食,手术方式为结肠癌根治术。术后进行常规化疗,化疗方案[17]为mFOLFOX, 即奥沙利铂100 mg/m2静脉滴注且于2 h内输注完毕(第1天),亚叶酸钙400 mg/m2静脉滴注且于2 h内输注完毕(第1天),氟尿嘧啶400 mg/m2静脉推注(第1天),随后以2 400 mg/m2持续滴注46 h, 每2周重复1次, 2次为1个疗程。②干预组在对照组治疗基础上给予口服双歧杆菌三联活菌片(金双歧), 1.0 mg/片, 3次/d, 患者于术前5 d开始口服,术后及化疗期间均规律服用。
1.2.2 血清指标检测方法
取患者晨起空腹静脉血3 mL, 室温凝固,离心(转速3 500转/min, 离心半径8 cm, 离心时间10 min), 分离后取上层清液,置于-80 ℃的恒温箱内等待检测。采用酶联免疫法检测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、C反应蛋白(CRP)水平,试剂盒由河北艾驰生物科技有限公司提供。
1.3 观察指标
① 比较2组患者术后胃肠功能恢复情况(术后排气时间、排便时间)。②比较2组患者术后2周粘连性肠梗阻、肺部炎症性感染、吻合口瘘、切口感染等并发症的发生率。③比较2组患者化疗期间并发症的发生率,包括腹胀、腹泻、恶心呕吐和食欲下降。④比较2组患者术前、术后1周、化疗期间的血清炎症反应指标水平,包括IL-6、TNF-α和CRP。
1.4 统计学处理
采用SPSS 22.0统计分析软件对本研究数据进行分析,计数资料以[n(%)]表示,组间比较采用χ2检验; 等级资料采用Ridit检验; 符合正态分布的计量类型资料以(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验。P < 0.05表示差异有统计学意义。
2. 结果
2.1 术后胃肠功能恢复情况比较
干预组术后排气时间、排便时间均早于对照组,差异有统计学意义(P < 0.05)。见表 2。
表 2 2组患者术后排气时间、排便时间比较(x±s)d 组别 n 术后排气时间 术后排便时间 对照组 39 3.79±0.70 5.51±1.37 干预组 40 2.92±1.16* 4.54±1.61* 与对照组比较, * P < 0.05。 2.2 术后2周内并发症发生情况比较
干预组术后2周的并发症总发生率低于对照组,差异有统计学意义(P < 0.05)。见表 3。
表 3 2组患者术后2周并发症发生情况比较[n(%)]并发症 对照组(n=39) 干预组(n=40) 粘连性肠梗阻 5(12.82) 2(5.00) 肺部感染 2(5.13) 0 吻合口瘘 2(5.13) 1(2.50) 切口感染 3(7.69) 1(2.50) 合计 12(30.77) 4(10.00)* 与对照组比较, * P < 0.05。 2.3 化疗期间各项并发症发生情况
干预组患者化疗期间恶心呕吐、食欲下降、腹胀、腹泻的发生率均低于对照组,差异有统计学意义(P < 0.05)。见表 4。
表 4 2组患者术后化疗期间并发症发生情况比较[n(%)]组别 n 恶心呕吐 食欲下降 腹胀 腹泻 对照组 39 27(69.23) 21(53.85) 15(38.46) 22(56.41) 干预组 40 15(37.50)* 8(20.00)* 3(7.50)* 8(20.00) * 与对照组比较, * P < 0.05。 2.4 血清炎症反应指标水平
术后1周时, 2组IL-6、TNF-α和CRP水平均高于术前,差异有统计学意义(P < 0.05); 化疗期间, 2组IL-6、TNF-α和CRP水平均低于术后1周时,差异有统计学意义(P < 0.05); 术后1周和化疗期间,干预组IL-6、TNF-α和CRP水平均低于对照组,差异有统计学意义(P < 0.05)。见表 5。
表 5 2组血清炎症反应指标水平比较(x±s)组别 时点 IL-6/(pg/mL) TNF-α/(pg/mL) CRP/(mg/L) 对照组(n=39) 术前 11.05±1.47 4.65±0.58 7.80±1.48 术后1周 18.48±2.76* 6.51±0.94* 14.95±2.40* 化疗期间 10.19±1.39# 4.68±0.90# 6.62±1.42# 干预组(n=40) 术前 10.78±1.13 4.29±0.57 7.68±1.51 术后1周 13.23±2.85*△ 5.26±0.72*△ 13.12±2.87*△ 化疗期间 8.00±1.07#△ 3.31±0.73#△ 5.90±1.52#△ IL-6: 白细胞介素-6; TNF-α: 肿瘤坏死因子-α; CRP: C反应蛋白。与术前比较, * P < 0.05;
与术后1周比较, # P < 0.05; 与对照组比较, △ P < 0.05。3. 讨论
随着宏基因组学及肠道微生物学等相关学科的进一步发展,人们发现肠道微生态的变化与结肠癌的发生发展以及疾病的转归息息相关。相关研究[18-20]报道,结肠癌患者肠道菌群中的某些细菌占比较健康成人显著降低,如乳酸杆菌、双歧杆菌等,而另一些机会致病菌占比较健康成人有所增加,如大肠埃希菌、乳球菌、链球菌和脆弱拟杆菌等。肠道微生态失衡有利于肿瘤细胞的生长,具体致病机制可能与基因突变有关[21-22], 大肠杆菌产生的细菌素能引起DNA及染色体的不稳定,具核梭杆菌及粪肠球菌可以通过促进微卫星不稳定性(MSI)使DNA丧失修复功能,进而导致基因突变和肿瘤的发生; 此外,肠道细菌可通过对Wnt/β-catenin信号通路产生影响促进肿瘤细胞增殖,亦可以诱导产生炎症因子、抑制免疫导致肿瘤进一步发展。结肠癌手术带来的应激和创伤不可避免地会使患者肠道微生态失衡,即肠道内益生菌(如双歧杆菌、乳酸杆菌等)数量减少,致病菌(如大肠杆菌、肠球菌等)占比增加,因此,维护肠道微生态平衡在疾病的转归过程中不可小觑。益生菌可直接影响肠道微生物群的发育和稳定、抑制病原体定植,术前应用双歧杆菌制剂的患者术后肠道内益生菌占比显著高于未用双歧杆菌干预的患者; 益生菌还可通过营养作用影响肠上皮黏膜屏障,提升机体对外界应激性变化的耐受能力,并且在刺激免疫系统特异性和非特异性成分等方面也具有良好的作用[13, 23-24]。
本研究结果显示,干预组患者根治术后排气时间和排便时间均早于对照组,差异有统计学意义(P < 0.05), 表明双歧杆菌三联活菌片对根治术后患者早期胃肠功能恢复有益; 干预组患者术后并发症总发生率和化疗期间各并发症发生率均低于对照组,差异有统计学意义(P < 0.05), 表明结肠癌患者围术期及化疗期间全程服用双歧杆菌三联活菌片能够有效降低相关并发症的发生率。患者全程应用双歧杆菌治疗不仅可抑制肠道致病菌生长,纠正结肠癌根治手术及术后化疗所致肠道菌群失调,有利于肠道维持正常蠕动,而且可对患者肠道正常生理功能起到保护和支持作用,故干预组患者化疗期间各并发症发生率显著低于对照组,与张艺璇等[25]研究结论一致。EWASCHUK J B等[26]通过动物实验方法证实,双歧杆菌产生的代谢物一方面可降低肠腔内物质的通透性,另一方面其产生的烟酸具有促进杯状细胞黏液分泌、促进肠上皮修复、维护肠道屏障功能的作用; 双歧杆菌及其代谢产物还可作为配体与Toll样受体相结合,激活机体炎症因子核因子-κB(NF-κB), 有利于术后肠道功能恢复,降低术后及化疗期间恶心呕吐、食欲下降、腹胀、腹泻等相关并发症的发生率。
结肠癌根治术会使机体发生应激反应,化疗的毒副作用会使患者免疫细胞出现损伤,进而导致机体免疫力降低[27]。本研究结果显示,干预组患者手术后及化疗期间TNF-α、IL-6、CRP水平低于对照组,差异有统计学意义(P < 0.05), 可见结肠癌患者围术期及化疗期间全程应用双歧杆菌三联活菌片能够抑制机体炎症反应,改善机体微生态平衡,调节人体免疫功能。益生菌制剂的应用可以减轻肠道内黏膜产生的微炎症性反应,调节细胞促炎性因子的活性程度,调控机体内活性氧含量,从根源上抑制炎症反应进一步发生与发展。IIDA N等[28]研究证实,肠道菌群可影响化疗疗效,益生菌分泌的两大类免疫因子均可以维护肠道微生态平衡的稳定,抑制肠道有害细菌生长,在一定程度上还可防止肠道定植菌群移位,减少机会致病菌的致病机会,增强机体免疫治疗的疗效。
综上所述,结肠癌患者围术期及术后化疗期间全程服用双歧杆菌三联活菌片,不仅可纠正肠道菌群失调,维持肠道的正常生理功能,促进结肠癌根治术后患者胃肠道功能早期恢复,还可提高机体对手术及化疗等应激反应的耐受能力,有利于调节机体免疫反应,抑制炎症的发生发展,降低结肠癌术后及化疗期间并发症的发生率。
-
表 1 CT平扫与CTA测定心外膜脂肪体积结果比较(x±s)
cm3 方法 n 医师A测量结果 医师B测量结果 测量结果平均值 CT平扫 170 98.42±39.66 100.75±42.82 99.59±43.14 CTA 170 92.77±41.08 95.34±43.75 94.05±45.70 CTA: CT血管造影。 -
[1] NAGAYAMA Y, NAKAMURA N, ITATANI R, et al. Epicardial fat volume measured on nongated chest CT is a predictor of coronary artery disease[J]. Eur Radiol, 2019, 29(7): 3638-3646. doi: 10.1007/s00330-019-06079-x
[2] 马爱珍, 陈殿森, 徐志宾, 等. 应用320排低剂量CT测量心外膜脂肪体积与冠心病的相关性分析[J]. 临床放射学杂志, 2019, 38(11): 2066-2070. http://www.cnki.com.cn/Article/CJFDTotal-LCFS201911014.htm [3] 高志红, 冯晓阳, 孙锋, 等. 心外膜脂肪体积与冠心病及再发不良心血管事件的相关性研究[J]. 中国循证心血管医学杂志, 2020, 12(10): 1223-1226, 1230. doi: 10.3969/j.issn.1674-4055.2020.10.16 [4] 张雪松, 刘斌, 杜丹丹. 多层螺旋CT评估2型糖尿病患者心外膜脂肪体积与冠状动脉粥样硬化的相关性[J]. 医学研究生学报, 2020, 33(6): 627-632. [5] 谢美艳, 牛玉军. 应用多层螺旋CT分析冠心病心外膜脂肪体积与左心室功能的相关性[J]. 解放军医学院学报, 2015, 36(11): 1081-1084, 1092. doi: 10.3969/j.issn.2095-5227.2015.11.006 [6] 刘正兵, 王璟, 李建华, 等. 单位体表面积心外膜脂肪体积与冠心病危险性及血管重构的关系研究[J]. 医学研究生学报, 2018, 31(3): 300-303. https://www.cnki.com.cn/Article/CJFDTOTAL-JLYB201803016.htm [7] LAZAROS G, ANTONOPOULOS A S, OIKONOMOU E K, et al. Prognostic implications of epicardial fat volume quantification in acute pericarditis[J]. Eur J Clin Invest, 2017, 47(2): 129-136. doi: 10.1111/eci.12711
[8] 吴汉, 李晓岗, 孙玉, 等. 心外膜脂肪CT影像参数与冠心病严重程度相关性研究[J]. 临床军医杂志, 2020, 48(8): 903-905, 909. [9] 朱莹, 刘艳萍, 李建华, 等. 单位体表面积心外膜脂肪体积与冠状动脉狭窄程度的关系研究[J]. 中西医结合心脑血管病杂志, 2020, 18(18): 3065-3067. doi: 10.12102/j.issn.1672-1349.2020.18.032 [10] 柴亚欣, 牛玉军, 陈大鹏. CT对心外膜脂肪体积与升主动脉弹性的相关性[J]. 中国医学影像学杂志, 2017, 25(7): 525-529. doi: 10.3969/j.issn.1005-5185.2017.07.012 [11] 吴玉辉, 张惠英. 冠状动脉CT血管造影检查中心外膜脂肪及心周脂肪在诊断冠状动脉支架再狭窄中的研究[J]. 中国医学装备, 2017, 14(1): 45-47, 48. doi: 10.3969/J.ISSN.1672-8270.2017.01.015 [12] 刘刚, 江玲, 孙伟. 多层螺旋CT血管造影对颅内缺血性改变颈动脉粥样硬化斑块形态特征的评估价值[J]. 实用临床医药杂志, 2021, 25(17): 52-56. doi: 10.7619/jcmp.20212617 [13] 赵童童, 李涛, 尚进伟, 等. 多层螺旋CT和冠状动脉造影评估冠心病诊断及经皮冠状动脉介入治疗术后评估支架内再狭窄研究[J]. 中国医学装备, 2022, 19(1): 77-81. [14] 程凯, 查云飞, 胡磊, 等. 心脏CT平扫与CTA定量分析心外膜脂肪体积对比研究[J]. CT理论与应用研究, 2019, 28(5): 585-591. https://www.cnki.com.cn/Article/CJFDTOTAL-CTLL201905013.htm




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号