Application progress of nanotechnology in tumorimmunotherapy of CAR-T chimeric antigenreceptor-modified T
-
摘要: 肿瘤免疫治疗主要通过解除免疫抑制作用与增强免疫应答反应来实现对其有效治疗。纳米技术能够提高免疫刺激分子的聚集度与作用力,在完成局部免疫调节的基础上有效治疗癌症。嵌合抗原受体T细胞(CAR-T)是肿瘤免疫治疗中的一种有力手段,能够对肿瘤患者的T细胞进行转化处理,令其成为可表达嵌合肿瘤细胞表面抗原受体的CAR-T细胞,随后将相应的CAR-T细胞回输至肿瘤患者体内,并通过特异性识别、杀伤肿瘤细胞的方式,有效杀灭肿瘤病毒。将纳米技术应用至CAR-T肿瘤免疫治疗中,有望提高肿瘤免疫治疗的疗效与安全性。本文就纳米技术在CAR-T肿瘤免疫治疗中的应用进展进行综述。Abstract: Tumor immunotherapy is mainly through lifting immunosuppression and enhancing immune response to achieve effective treatment. Nanotechnology can improve the aggregation degree and force of immune-stimulating molecules and effectively treat cancer on the basis of completing local immune regulation. The chimeric antigen receptor-modified T (CAR-T) is a powerful means in tumor immunotherapy, it can carry on the transformation of T cells in patients with tumor treatment, become CAR-T cells expressing chimeric tumor cell surface antigen receptors. Afterwards, the corresponding CAR-T cells were back to the body of cancer patients, and the tumor virus was effectively killed by specific recognition and killing tumor cells. The application of nanotechnology in CAR-T tumor immunotherapy is expected to improve the efficacy and safety of tumor immunotherapy. This paper reviewed the application of nanotechnology in the tumors immunotherapy of CAR-T.
-
Keywords:
- nanotechnology /
- chimeric antigen receptor-modified T /
- tumor /
- immunotherapy /
- immune response
-
肿瘤作为一种致死率极高的恶性疾病,对人们的健康造成了极大的威胁,当前治疗肿瘤的医疗手段主要包含放射治疗、化学药物治疗、手术治疗,但其疗效具有一定的局限性,肿瘤仍然存在转移或复发的可能性[1]。目前,嵌合抗原受体T细胞(CAR-T)疗法逐渐成为肿瘤免疫治疗中最为有效的新型手段[2]。CAR-T细胞可在基因转导的作用下表达出嵌合抗原受体(CAR), 进而精准识别肿瘤抗原,迅速达到杀伤肿瘤细胞的目的[3]。将纳米技术应用至CAR-T中,可促进患者自身T淋巴细胞快速实现基因改造,提高其对癌细胞的攻击能力。结合纳米技术的CAR-T能够使T淋巴细胞表达出特定的CAR结构域,用以实现对靶抗原与靶细胞的识别与杀伤[4]。鉴于此,本文将纳米技术与CAR-T肿瘤免疫治疗进行有机的结合,探究纳米技术在CAR-T肿瘤免疫治疗中的应用发展及前景。
1. CAR-T肿瘤免疫治疗机制分析
1.1 CAR的组成结构
早在20世纪90年代, CAR的概念就已被提出,经过多年来不断探索,基于CAR的基因修饰自体T细胞免疫治疗药品成功在美国批准上市,为大量复发性急性B淋巴细胞白血病患者提供了较好的临床疗效。位于细胞表面用作表达人工合成基因膜蛋白CAR的T淋巴细胞,即CAR-T细胞,相关研究[5]对其结构与应用进行了探究,成功提出其面临的挑战与应用前景。在CAR的结构中,主要囊括3个组成成分,分别为跨膜区、细胞内信号肽区、细胞外抗原结合区。跨膜区的主要构成元素为CD3、CD4、CD28, 其中存在单链可变片段与铰链区,前者作用在于克服主要组织进行相容性复合时所受到的限制,后者则可对肿瘤相关抗原的选择起到有力的促进作用。细胞内信号肽区能够实现信号的转导。细胞外抗原结合区的作用最为关键,能够对靶细胞外表上覆盖的特异性抗原进行有效识别。CAR能够结合肿瘤相关抗原,进而形成相应的活化信号,最终促进CAR-T实现活化并发挥其效用。CAR-T完成活化后能够大量释放出与CAR相关的杀伤因子、增殖因子、细胞因子。
1.2 CAR-T细胞活化与作用机制
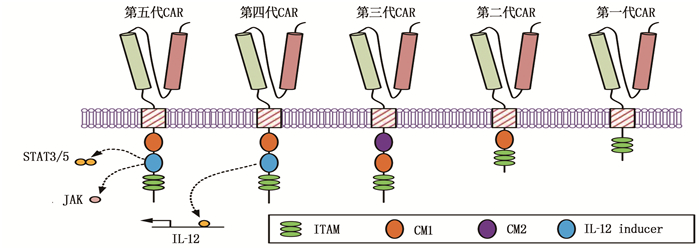
作为一种新型生物免疫治疗方法, CAR-T在血液肿瘤的临床治疗中具有显著疗效,相关学者[6]对CAR-T细胞的结构与功能进行了探究,验证了该种疗法的优势。研究人员[7]针对CAR-T在临床应用中暴露出的载体安全性等问题,通过优化CAR结构中的胞外抗原结合区的方式,加大对肿瘤细胞的免疫监视力度,有效控制毒副作用。要使T细胞表现出准确的免疫应答,首先需要令其接受活化处理,并转换为细胞毒性T淋巴细胞。在CAR的组成结构中,细胞外抗原结合区可凭借其效应T细胞的细胞毒作用,来促进T细胞的活化。与T细胞的活化机制相似, CAR-T的活化为一种双信号途径,即T细胞受体与CD28可以同时作用,二者分别与位于抗原提呈细胞中的抗原肽、共刺激分子等进行结合,进而使得T细胞被成功激活为细胞毒性T淋巴细胞。在早期的CAR中,仅存在3对免疫受体酪氨酸活化基序,且共刺激分子第二信号较少,会导致T细胞在与抗原结合之后难以持续进行增殖,造成较差的抗肿瘤效果。因此需要在第一代CAR的结构基础上,进行不断的优化处理,五代CAR结构见图 1。
据图 1可知,向第一代CAR中添加第二信号分子的CD28, 或是添加共刺激分子,可获取到第二代CAR, 可显著延长CAR-T细胞在体内的存活时间; 在第二代CAR中加入共刺激结构域,则得到第三代CAR, 能够使白细胞介素2不足的不利影响降至最低,促进T细胞的增殖与活化; 为了降低毒副作用的影响,需要在第三代CAR的基础上再次进行优化,获取到第四代CAR, 能够有效抗击肿瘤细胞; 第五代CAR, 即通用型CAR, 其结构与第二代CAR较为类似,区别在于添加了部分共刺激域,能够实现对其他信号通路的激活。针对部分免疫活性极差的患者,第五代CAR能够促进其进行自体CAR-T细胞治疗,提高其临床疗效。
2. 基于纳米技术的新型肿瘤免疫治疗方式
2.1 改进ACT的免疫治疗
传统过继细胞疗法(ACT)需要对相关免疫细胞进行分离,并对其进行离体处理,最后再将其重新输回至患者体内。通过注射纳米聚合物或支架的方式,可建构一个定制化、模式化的局部微环境,进而在原位生产相应的免疫信号、肿瘤抗原、共定位炎症因子。由于部分肿瘤微环境中具有一定的免疫抑制性,因此ACT的疗效会受到较大的影响,添加纳米聚合物或支架只针对实体瘤存在效果,无法对血液恶性肿瘤进行有效的治疗。ACT在肿瘤治疗过程中存在一定的局限性,有学者[8]针对该问题进行了细致的探讨,并分析了CAR-T细胞在肿瘤治疗中的应用效果与弊端,旨在提升其临床疗效。鉴于此,纳米技术的重要性愈加凸显,利用纳米技术能够在不植入ACT支架的条件下,完成对血液T细胞的调节,该种方式即改进ACT疗法。改进ACT主要包含4个步骤,其一为对药物、配体-抗体片段、单克隆抗体等进行打包处理,并将其附着于纳米颗粒上; 其二为将相应的纳米颗粒与T细胞表面进行连接; 其三为持续性提供类自分泌刺激信号给相关细胞,旨在最大化地防止转移T细胞的功能与活力降低; 其四为通过引发全身免疫调节的形式,来杀伤或消除位于远端的肿瘤细胞,并提高改进ACT的抗淋巴瘤效果。
2.2 递送酶免疫治疗
当前用作患者体内酶递送的载体主要为4种类型,即细胞因子、抗原、寡核苷酸、递送小分子。除此以外,纳米颗粒也可应用于酶的递送中。鉴于肿瘤免疫治疗药物在患者体内进行递送时受到一定因素的限制,部分学者将肿瘤组织及其细胞的微环境特征作为研究基础,设计了融合纳米技术的微环境递送系统,成功提高了抗肿瘤药物的递送效率与临床疗效[9]。在术后感染期间存在一道防线,即中性粒细胞,保证该细胞的活性可有效规避术后感染的风险。中性粒细胞胞外陷阱作为一种特殊的脱氧核糖核酸(DNA)结构,能够在血管内形成的过程中对循环肿瘤细胞进行隐蔽处理,进而导致肿瘤迅速发生转移,最终导致恶性肿瘤或癌症的发生。对该胞外陷阱进行有力的控制极为必要,因此利用包载中性粒细胞弹性蛋白酶的纳米颗粒完成酶的递送,能够对胞外陷阱实现有效的催化降解,从根本上抑制肿瘤出现转移等其他恶化现象。
2.3 癌症联合免疫治疗
治疗癌症的主要手段在杀伤恶性肿瘤细胞的过程中,往往会对人体正常细胞造成一定的损害,更有甚者会导致残留的恶性肿瘤细胞经由伤患处流入血液循环中,最终使得患者的预后较差。除此以外,单一免疫治疗模式在治疗实体瘤时,其疗效具有一定的局限性。基于此,采用纳米颗粒来进行癌症联合免疫治疗,有助于实现协同增效。纳米颗粒中囊括的免疫调节剂可最大化降低患者全身毒性,促进免疫刺激分子产生作用,且促进全身免疫细胞产生抗肿瘤免疫反应,最终达到防止恶性肿瘤细胞转移与癌症复发的目的。结合纳米技术的癌症联合免疫治疗,对抗癌效果的提升有着显著的促进作用。传统放疗产生的促炎性因子会加速免疫细胞对抗原的吞噬与呈递,诱导产生肿瘤特异性免疫反应与抗肿瘤免疫应答。纳米颗粒可吸附相关的特异性抗原,随后被人体内的吞噬细胞进行特异性识别与捕获,增强对恶性肿瘤细胞的免疫治疗效果。
在体内研究中,对患黑色素瘤的小鼠进行实验,首先对受试小鼠的原发病灶进行放疗处理,再向其注射吸附着抗原的纳米颗粒。经过一段时间的恢复后,该批小鼠的临床疗效显著增强,且其生存期大大延长。90 d后对该批小鼠接种黑色素瘤细胞,发现其并不会重新生长出新的肿瘤,这表明应用纳米技术进行治疗能够对防止肿瘤的复发起到关键性的作用。
3. 纳米技术在CAR-T肿瘤免疫治疗中的临床应用
3.1 纳米技术联合CAR-T在恶性淋巴瘤和血液肿瘤中的应用
科研人员[10]认为在免疫治疗的基础上融入纳米技术,可有效避免抗原等物质出现降解,能显著提高位于恶性肿瘤部位中的免疫刺激分子的富集度,实现预防全身免疫毒性的目的。联合纳米技术的CAR-T细胞可构建一个慢病毒表达载体,并完成一个完整的CAR-T细胞扩增体系的培养。临床研究[11-12]表明,纳米技术联合CAR-T能够针对复发性极强的小儿急性淋巴细胞白血病起到较好的缓解与治疗效果。B细胞非霍奇金淋巴瘤作为一种罕见的恶性肿瘤疾病,其致死率极高,化疗手段可对其实现一定的病情控制。然而该种方式无法对其他恶性肿瘤疾病取得较好的疗效,如转化型淋巴瘤、双重打击淋巴瘤等,若患者具有较高的早期复发风险,化疗也无法起到显著的控制作用[13-14]。联合纳米技术的CAR-T可对预后较差的B细胞恶性肿瘤患者进行有效的治疗,通过CAR-T细胞重定向免疫的治疗手段,在临床实验中取得较好的效果。26例接受纳米技术联合CAR-T细胞免疫治疗的B细胞恶性肿瘤患者,在完成阶段性的治疗后均获得了较好的疗效,提示该实验提出的治疗手段可行,但在进行治疗前充足的准备、治疗过程中积极的护理配合、治疗后相关并发症的处理等均会对B细胞恶性肿瘤患者的康复造成一定的影响[15]。
白血病作为一种骨髓造血干细胞恶性克隆性增殖的造血系统肿瘤性疾病,具有较高的致死率,这是由于在该种疾病的治疗过程中,化疗耐药与复发的现象频发。大多数应用于化疗的药物均会导致机体出现一定的不良反应,如严重的组织急性坏死等症状,故而进一步加大化疗力度,无法促进患者康复[16-17]。纳米技术联合CAR-T细胞免疫治疗的方式,可极大地改善该种现象,可在治疗过程中精确地筛选出最佳靶抗原,显著降低CAR-T细胞的耐药性,进而令白血病患者的缓解率得到大幅提高,实现对治疗后各类不良反应的有效控制[18]。针对急性淋巴细胞白血病进行治疗时,摒弃传统的化疗方式,选择纳米技术联合CAR-T细胞免疫治疗,可从根本上解决耐药患者体内存在过大肿瘤负荷的问题,令患者的病情得到明显的缓解,并改善其预后疗效[19]。纳米技术联合CAR-T在白血病的治疗中,具有广阔的应用前景。
3.2 纳米技术联合CAR-T在其他恶性肿瘤中的应用
据前述内容可知,在纳米技术的作用下, CAR-T细胞可发挥出较强的特异性与个体性,能够针对性地治疗淋巴瘤与白血病。不仅如此,在其他恶性肿瘤疾病中,该种治疗手段也可作为临床治疗的有效策略,如卵巢癌[20]。相关研究[20]表明,对人体外周血中的单核细胞进行感染处理,进而可制备出具有稳定表达的CAR-T细胞,结合纳米技术应用蛋白质印迹法或免疫组织化学法,可对卵巢癌患者的肿瘤样本进行检测,还能评估纳米技术联合CAR-T对卵巢癌细胞的杀伤能力与清除能力。纳米技术联合CAR-T细胞免疫治疗能够针对卵巢癌细胞进行特异性的识别与杀灭,从根本上防止癌细胞转移,避免肿瘤持续性生长。在实体瘤治疗过程中, CAR-T细胞疗法并未被纳入临床实验中,然而该种疗法已在相关动物模型实验中取得了一定的进展。相关学者[21]应用纳米技术将溶瘤病毒与CAR-T细胞进行有机的结合,对小鼠异种胶质瘤肿瘤模型进行临床医学实验,大幅提升了其抗肿瘤效果与生存率,并突破了CAR-T细胞在实体瘤治疗中的单一性限制。据受试小鼠体内肿瘤生长指标显示,纳米技术联合CAR-T能够促进其产生大量的自然杀伤受体,进而加速各类细胞因子的分泌,最终使得恶性肿瘤细胞得到完全溶解。临床实验[22]表明,除卵巢癌以外,肝癌、肺癌、神经胶质瘤等恶性肿瘤疾病,均可在纳米技术联合CAR-T细胞免疫治疗的作用下,得到有效的控制,该方式的抗肿瘤效果极为显著。
4. 结论与展望
诸多临床实验结果显示, CAR-T细胞免疫治疗可对血液系统中的恶性肿瘤取得较好的疗效,但该种治疗手段对实体瘤进行治疗时,其疗效仍然受到了一定的限制。在整个治疗过程中,肿瘤微环境的免疫抑制、恶性肿瘤抗原逃逸、治疗后的各类不良反应,均会对CAR-T细胞免疫治疗的疗效造成影响。鉴于此,提高CAR-T细胞的靶向性与抗肿瘤效果,是肿瘤免疫治疗的核心,且从根本上提高CAR-T细胞的多功能性与特异性识别能力,可显著改善患者预后。
纳米技术在CAR-T肿瘤免疫治疗中具有较好的应用进展与广阔的应用前景,在未来的研究中,将深入探讨基因工程改造时利用纳米技术联合CAR-T细胞免疫治疗的合理性与安全性。由于3D打印再生技术在医学领域中的应用愈加广泛,因此利用相应的纳米器件可为肿瘤免疫治疗提供一定的辅助力量。联合纳米技术的肿瘤免疫工程,可促进特定细胞因子、免疫细胞及其基质的定位准确度的提升,进而使相应的纳米支架或纳米载体应用至人体各级淋巴结构中。
-
[1] 王帅亮, 朱华, 杨志. T细胞核医学分子成像策略在CAR-T免疫治疗中的应用[J]. 中华核医学与分子影像杂志, 2021, 41(3): 175-179. doi: 10.3760/cma.j.cn321828-20200227-00072 [2] 黎华丽, 郑勇斌. 结直肠癌中CAR-T细胞免疫治疗的研究现状及展望[J]. 中华实验外科杂志, 2021, 38(2): 205-209. doi: 10.3760/cma.j.cn421213-20200610-01204 [3] 杨坤, 陈谦学. 嵌合抗原受体T细胞治疗胶质母细胞瘤的进展[J]. 中国临床神经外科杂志, 2021, 26(6): 477-479. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGLC202106026.htm [4] 姜凤婷, 郑眉, 周旭, 等. 基于不同靶点及治疗策略的嵌合抗原受体T细胞疗法在实体瘤中应用的研究进展[J]. 中国生物制品学杂志, 2021, 34(6): 745-750. https://www.cnki.com.cn/Article/CJFDTOTAL-SWZP202106022.htm [5] 任凯丽. CAR-T免疫治疗的研究进展[J]. 科学技术创新, 2019(22): 44-45. doi: 10.3969/j.issn.1673-1328.2019.22.026 [6] 赵婷, 任慧萍. CAR-T细胞疗法—一颗肿瘤界冉起的新星[J]. 养生保健指南, 2017, 16(019): 208-209. [7] 陈绍丰. CAR-T细胞治疗肿瘤临床应用的挑战及对策[J]. 中国肿瘤生物治疗杂志, 2019, 26(7): 802-809. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLSW201907014.htm [8] 魏运雄. 嵌合抗原受体基因修饰T细胞免疫疗法在肿瘤治疗中的进展与挑战[J]. 中国肿瘤生物治疗杂志, 2019, 26(8): 904-909. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLSW201908012.htm [9] 候博, 王当歌, 高晶, 等. 微环境激活型纳米递药系统用于肿瘤免疫治疗的研究进展[J]. 药学学报, 2019, 54(10): 1802-1809. https://www.cnki.com.cn/Article/CJFDTOTAL-YXXB201910012.htm [10] 张妮丝, 周一鸣, 戴志飞. 利用纳米技术提高癌症免疫治疗效果的研究进展[J]. 科学通报, 2018, 63(Z1): 535-546. https://www.cnki.com.cn/Article/CJFDTOTAL-KXTB2018Z1006.htm [11] 孟月生, 乔田奎. 嵌合抗原受体基因修饰T淋巴细胞治疗肺癌的研究进展和挑战[J]. 中国肿瘤生物治疗杂志, 2021, 28(4): 392-397. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLSW202104012.htm [12] ARNHEIM K. Vierfachregime, antikörper und CAR-T-zelltherapien[J]. Onkologische Welt, 2021, 12(1): 14-16. doi: 10.1055/a-1345-4969
[13] KIM G B, ARAGON-SANABRIA V, RANDOLPH L, et al. High-affinity mutant Interleukin-13 targeted CAR T cells enhance delivery of clickable biodegradable fluorescent nanoparticles to glioblastoma[J]. Bioact Mater, 2020, 5(3): 624-635. doi: 10.1016/j.bioactmat.2020.04.011
[14] LI X, BERAHOVICH R, ZHOU H, et al. PLAP-CAR T cells mediate high specific cytotoxicity against colon cancer cells[J]. Front Biosci (Landmark Ed), 2020, 25: 1765-1786. doi: 10.2741/4877
[15] AI H, YIN Q S, WANG Q, et al. Safety and efficacy of patients with refractory B-lymphoblastic leukemia treated with anti-CD19 CAR-T cell bridging to allogeneic hematopoietic stem cell transplantation[J]. Zhonghua Xueyexue Zazhi, 2020, 41(3): 239-244. http://www.researchgate.net/publication/340846074_Safety_and_efficacy_of_patients_with_refractory_B-lymphoblastic_leukemia_treated_with_anti-CD19_CAR-T_cell_bridging_to_allogeneic_hematopoietic_stem_cell_transplantation
[16] WANG J S. Progress and trend of CAR-T and PD-1 blockade in the treatment of acute myeloid leukemia: review[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2020, 28(3): 1069-1074. http://www.researchgate.net/publication/342336378_Progress_and_Trend_of_CAR-T_and_PD-1_Blockade_in_the_Treatment_of_Acute_Myeloid_Leukemia--Review
[17] ZAYTSEV D V, ZAIKOVA E K, GOLOVKIN A S, et al. Granulocyte-macrophage colony-stimulating factor and CAR-T technology for solid tumors in experiment[J]. Клиническая Онкогематология, 2020, 13(2): 115-122. http://www.researchgate.net/publication/346804715_Granulocyte-Macrophage_Colony-Stimulating_Factor_and_CAR-T_Technology_for_Solid_Tumors_in_Experiment
[18] BARUCHEL A, MICHEL G. New indications of CAR-T cells in hematological malignancies of children, adolescents and young adults[J]. Hématologie, 2021, 27(3): 132-141.
[19] KARWICKA K, WAWER J, CZABAK O, et al. Innowacyjna terapia CAR-T w leczeniu nowotworów hematologicznych—wybrane aspekty genetyczne i immunologiczne[J]. Hematologia, 2020, 11(3): 166-182. doi: 10.5603/Hem.a2020.0025
[20] LEVCHUK K A, BELOTSERKOVSKAYA E V, POZDNYAKOV D Y, et al. CAR T-cell therapy with NKG2D chimeric antigen receptor in relapsed/refractory acute myeloid leukemia and myelodysplastic syndrome[J]. Клиническая Онкогематология, 2021, 14(1): 138-148. http://www.researchgate.net/publication/350614282_CAR_T-Cell_Therapy_with_NKG2D_Chimeric_Antigen_Receptor_in_Relapsed_Refractory_Acute_Myeloid_Leukemia_and_Myelodysplastic_Syndrome
[21] WING A, FAJARDO C A, POSEY A D Jr, et al. Improving CART-cell therapy of solid tumors with oncolytic virus-driven production of a bispecific T-cell engager[J]. Cancer Immunol Res, 2018, 6(5): 605-616. doi: 10.1158/2326-6066.CIR-17-0314
[22] LI H L, YANG C, CHENG H R, et al. CAR-T cells for Colorectal Cancer: Target-selection and strategies for improved activity and safety[J]. J Cancer, 2021, 12(6): 1804-1814. doi: 10.7150/jca.50509




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号