A nomogram model for early lymph node metastasis of differentiated thyroid carcinoma on basis of thyroglobulin and antibody quantification
-
摘要:目的 探讨甲状腺球蛋白(Tg)和抗体定量与分化型甲状腺癌(DTC)早期淋巴结转移的关系并构建定量列线图模型。方法 选取86例甲状腺癌根治术患者作为研究对象,术前超声检查发现颈区可疑淋巴结转移113枚,术后病理证实阳性74枚(57例患者,纳入阳性淋巴结组)、阴性39枚(29例患者,纳入阴性淋巴结组)。比较2组超声定量评分、细针穿刺细胞学检查(FNA-C)结果和穿刺针洗脱液中甲状腺球蛋白(FNA-Tg)、BRAF基因突变、血清Tg、甲状腺球蛋白抗体(TgAb)、甲状腺激素情况。结果 2组性别、年龄、肿瘤分期、分化级别、病理类型、超声定量评分、BRAF基因突变阳性率、血清Tg水平、甲状腺激素水平比较,差异无统计学意义(P>0.05)。阳性淋巴结组FNA-C阳性率、FNA-Tg水平、血清TgAb水平高于阴性淋巴结组,差异有统计学意义(P < 0.05)。多因素Logistic回归分析显示,FNA-C阳性、FNA-Tg≥25 μg/L和血清TgAb≥500 U/mL是淋巴结转移阳性的预测因子(P < 0.05)。受试者工作特征曲线显示,超声定量评分、FNA-C、FNA-Tg和列线图模型预测淋巴结转移阳性的曲线下面积分别为0.689、0.754、0.795和0.856(P < 0.05)。结论 FNA-C和FNA-Tg是术前诊断DTC淋巴结转移的重要依据。通过大样本数据构建的列线图模型对淋巴结转移阳性有较好的预测效能,可帮助医生术前准确快速地判断淋巴结转移情况,且克服了单独FNA-C或FNA-Tg的诊断不足,具有较强的实践性。Abstract:Objective To investigate the relationships between the quantification of thyroglobulin(Tg), quantitative antibody and early lymph node metastasis in differentiated thyroid carcinoma (DTC), and construct a quantitative nomogram model.Methods A total of 86 patients who underwent radical thyroidectomy were chosen as research objects, 113 lymph nodes with suspicious metastases in the neck area were detected by ultrasonography before operation, including 74 positive(57 patients, positive lymph node group) nodes and 39 negative(29 patients, negative lymph node group) nodes confirmed by pathology after operation. The ultrasonic quantitative score of lymph nodes, fine needle aspiration cytology (FNA-C), fine needle aspiration thyroglobulin (FNA-Tg) and BRAF gene mutation in puncture needle eluent, serum Tg, thyroglobulin antibody (TgAb) and thyroid hormones were compared.Results There were no differences of gender, age, tumor stage, differentiation grade and pathological type, quantitative ultrasound score, positive rate of BRAF gene mutation, serum Tg and thyroid hormone levels (P>0.05). FNA-C positive rate, FNA-Tg and serum TgAb levels in the positive lymph node group were significantly higher than those in the negative lymph node group (P < 0.05). Multivariate Logistic regression analysis showed that positive for FNA-C, FNA-Tg≥25 μg/L and serum TgAb≥500 U/mL were predictors of positive lymph node metastasis (P < 0.05). Receiver operating curve showed that the area under the curve of ultrasound quantitative score, FNA-C, FNA-Tg and nomogram model for predicting positive lymph node metastasis were 0.689, 0.754, 0.795 and 0.856, respectively (P < 0.05).Conclusion FNA-C and FNA-Tg are important basis in diagnosing DTC lymph node metastasis before operation. The nomogram model constructed by large sample data has good predictive efficiency for positive lymph node metastasis. The nomogram model can help doctors accurately and quickly judge metastatic lymph nodes before operation, and overcome the diagnosis deficiency of FNA-C or FNA-Tg alone, and has strong practicability.
-
分化型甲状腺癌(DTC)是甲状腺癌的主要病理类型之一,主要治疗方法为根治性切除手术。DTC早期可发生颈部淋巴结转移,这是术后微残留和早期局部复发的主要因素,也是降低患者术后生存率的重要原因[1]。超声检查是甲状腺癌早期筛查、诊断、肿瘤临床分期、制订手术方案以及预后随访的首要选择,术前超声检查能够识别可疑淋巴结转移,并引导细针穿刺做进一步的病理诊断[2]。细针穿刺细胞学检查(FNA-C)具有较高的特异性,但敏感性较差[3]。穿刺针洗脱液中甲状腺球蛋白(FNA-Tg)被证实有较高的敏感性,欧洲甲状腺癌诊治共识和美国甲状腺学会DTC诊治指南均推荐将FNA-C联合FNA-Tg用于诊断淋巴结转移[4-5]。但不同研究中心提供的FNA-Tg诊断参考范围不同[6], 且影响FNA-Tg诊断效能的因素也较多,如血清甲状腺球蛋白(Tg)、甲状腺球蛋白抗体(TgAb)、甲状腺激素水平和穿刺技术、检测方法等[7]。本研究探讨Tg和TgAb与DTC早期淋巴结转移的关系并构建定量列线图模型,现报告如下。
1. 对象与方法
1.1 研究对象
前瞻性选择2020年3月—2021年9月承德医学院附属医院收治的86例甲状腺癌根治术患者作为研究对象,其中男49例,女37例,年龄45~77岁,平均(53.6±9.5)岁。纳入标准: ①年龄>18岁者; ②符合甲状腺癌病理诊断,临床分期为Ⅰ期~Ⅱa期者; ③超声图像清晰,顺利完成细针穿刺和FNA-C、FNA-Tg等检测者; ④签署手术知情同意书,临床资料完整者。排除标准: ①合并甲状腺功能亢进或减退、自身免疫性甲状腺炎者; ②既往有颈部外伤、手术、放化疗史者; ③淋巴结直径较小,细针穿刺难度大或失败,穿刺针洗脱液标本污染者; ④有严重基础疾病,如心、肺、肝、肾功能障碍者; ⑤妊娠期、哺乳期女性。本研究获得承德医学院附属医院医学伦理委员会批准。
1.2 研究方法
术前行常规超声检查,86例患者颈区共发现113枚可疑淋巴结转移,术后病理证实阳性74枚(57例患者,纳入阳性淋巴结组)、阴性39枚(29例患者,纳入阴性淋巴结组)。比较2组性别、年龄、肿瘤分期、分化级别、病理类型、超声定量评分、FNA-C、FNA-Tg、BRAF基因突变情况和血清Tg、TgAb、甲状腺激素[三碘甲状腺原氨酸(T3)、甲状腺素(T4)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)和促甲状腺素(TSH)]水平。
超声检查采用G310047017型号彩色多普勒超声诊断仪(日本日立公司Ascendus系列),探头频率5~13 MHz。超声定量评分[8]: ①淋巴结呈圆形,短轴与长径比值接近1; ②淋巴结门回声消失,皮髓质分界不清; ③淋巴结内微钙化、部分囊性变或呈高回声; ④异常血流分布。每项赋值1分,总分4分。于超声引导下以22G注射器针头穿刺可疑淋巴结,负压抽吸病灶组织3~5次,重复穿刺进针2~3次,获取足量样本用于诊断。FNA-C阳性标准[9]: 出现核沟、核内假包涵体、毛玻璃样核、多核巨细胞及砂粒体等。结果由2位经验丰富的病理科医师独立阅片得出。FNA-Tg检测采用电化学发光免疫分析法,试剂购自德国罗氏公司,按照说明书步骤进行操作,试剂批间和批内变异度小于10%, 试剂灵敏度为0.1 μg/L。BRAF基因检测试剂盒购自厦门艾德生物公司,根据试剂提示步骤进行操作,主要流程为取穿刺细胞溶液,裂解后提取DNA分子,配置PCR反应体系和设置恰当的反应参数,结束后由自带软件计算电泳循环数(△Ct值),判断BRAF V600E位点突变。采用化学发光法检测血清各指标水平,检测仪器及试剂购自美国Sigma公司,按照说明书步骤进行操作。
1.3 统计学分析
采用SPSS 20.0统计软件分析数据,计量资料以(x±s)表示,组间比较采用独立样本t检验,计数资料以[n(%)]表示,比较采用χ2检验。采用多因素Logistic回归分析以逐步后退法筛选预测因子,采用R软件程序包构建列线图模型,采用受试者工作特征(ROC)曲线计算曲线下面积(AUC)。P < 0.05为差异有统计学意义。
2. 结果
2.1 临床资料比较
2组性别、年龄、肿瘤分期、分化级别、病理类型、超声定量评分、BRAF基因突变阳性率和血清Tg、甲状腺激素(T3、T4、FT3、FT4和TSH)水平比较,差异无统计学意义(P>0.05)。阳性淋巴结组FNA-C阳性率、FNA-Tg水平、血清TgAb水平均高于阴性淋巴结组,差异有统计学意义(P < 0.05)。见表 1。
表 1 阳性淋巴结组与阴性淋巴结组的临床资料比较(x±s)[n(%)]指标 阴性淋巴结组(n=29) 阳性淋巴结组(n=57) t/χ2 P 性别 男 20(69.0) 29(50.9) 2.565 0.109 女 9(31.0) 28(49.1) 年龄/岁 52.7±8.4 54.9±10.1 0.769 0.234 肿瘤TNM分期 Ⅰ期 15(51.7) 26(45.6) 0.288 0.592 Ⅱa期 14(48.3) 31(54.4) 分化级别 中高分化 19(65.5) 27(47.4) 2.545 0.111 低分化 10(34.5) 30(52.6) 病理类型 乳头状癌 21(72.4) 36(63.2) 0.777 0.678 滤泡状癌 5(17.2) 14(24.6) 髓样癌 3(10.4) 7(12.2) 超声定量评分/分 2.5±0.3 2.7±0.5 0.856 0.142 FNA-C阳性 20(51.3) 55(74.3) 6.075 0.014 BRAF基因突变阳性 13(33.3) 29(39.2) 0.375 0.540 FNA-Tg/(μg/L) 18.9±6.7 35.6±10.2 11.235 < 0.001 血清Tg/(μg/L) 75.6±14.9 80.1±15.6 0.956 0.124 血清TgAb/(U/mL) 359.6±102.4 756.8±168.9 25.634 < 0.001 T3/(nmol/L) 1.6±0.3 1.7±0.4 0.456 0.632 T4/(nmol/L) 112.3±23.5 116.4±25.6 1.023 0.198 FT3/(pmol/L) 3.7±0.5 3.9±0.6 0.659 0.235 FT4/(pmol/L) 15.9±3.2 16.6±3.5 0.895 0.202 TSH/(μIU/L) 2.5±0.3 2.7±0.4 0.765 0.312 除超声定量评分、FNA-C阳性、BRAF基因突变阳性、FNA-Tg以本组淋巴结枚数计算以外,其他指标以本组患者例数计算。FNA-C: 细针穿刺细胞学检查; FNA-Tg: 穿刺针洗脱液中甲状腺球蛋白; Tg: 甲状腺球蛋白; TgAb: 甲状腺球蛋白抗体; T3: 三碘甲状腺原氨酸; T4: 甲状腺素; FT3: 游离三碘甲状腺原氨酸; FT4: 游离甲状腺素; TSH: 促甲状腺素。 2.2 淋巴结转移阳性的Logistic回归分析
多因素Logistic回归分析显示, FNA-C阳性、FNA-Tg≥25 μg/L和血清TgAb≥500 U/mL是淋巴结转移阳性的预测因子(P < 0.05)。见表 2。
表 2 淋巴结转移阳性的Logistic回归分析因素 β Wald P OR 95%CI FNA-C阳性 0.801 14.236 < 0.001 2.652 2.301~2.954 FNA-Tg≥25 μg/L 0.585 8.062 < 0.001 2.302 2.001~2.565 TgAb≥500 U/mL 0.356 5.548 0.009 1.569 1.232~1.859 常数项 -0.056 3.658 0.022 - - FNA-C: 细针穿刺细胞学检查; FNA-Tg: 穿刺针洗脱液中甲状腺球蛋白; TgAb: 甲状腺球蛋白抗体。 2.3 淋巴结转移阳性的列线图模型
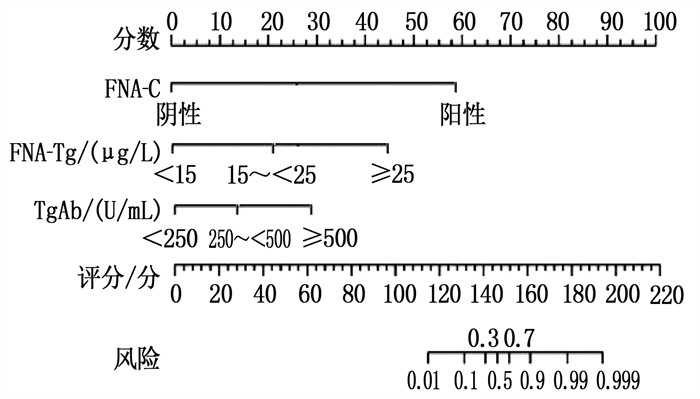
根据Logistic回归分析筛选出的主要预测因子及其对应赋值,应用R软件构建可视化的列线图模型,见图 1。
2.4 淋巴结转移阳性的ROC曲线分析
ROC曲线显示,超声定量评分、FNA-C、FNA-Tg和列线图模型预测淋巴结转移阳性的AUC分别为0.689、0.754、0.795和0.856(P < 0.05)。见表 3。
表 3 淋巴结转移阳性的ROC曲线分析指标 AUC 95%CI P 敏感性/% 特异性/% 超声定量评分 0.689 0.633~0.789 0.015 70.5 63.6 FNA-C 0.754 0.699~0.812 0.009 80.6 74.5 FNA-Tg 0.795 0.721~0.854 0.001 73.3 85.0 列线图模型 0.856 0.801~0.910 < 0.001 85.6 95.0 FNA-C: 细针穿刺细胞学检查; FNA-Tg: 穿刺针洗脱液中甲状腺球蛋白。 3. 讨论
术前准确判断淋巴结转移情况对选择恰当的外科术式、确定合理的手术切除范围和是否进行颈区淋巴结清扫、评估复发风险均具有十分重要的临床意义[10]。FNA-C是判断淋巴结转移阳性必不可少的检查,但其易受穿刺技术、取样质量、淋巴结囊性变等因素的影响,总体敏感度为55%~80%[5], 因此还需寻找其他敏感度更佳的检查技术,以提高淋巴结转移阳性的诊断率。Tg主要由甲状腺滤泡上皮细胞合成并释放到甲状腺滤泡腔内,随着甲状腺癌细胞的淋巴结转移,阳性淋巴结内也会表达Tg, 具有较强的组织特异性[11], 这是本研究推荐FNA-Tg检测的理论依据。
本研究中,超声检查识别出的可疑淋巴结转移的阳性率为65.5%(74/113), 目前常规超声检查仍然是诊断甲状腺癌和筛查淋巴结转移的首选方法, FNA-C则能进一步提高诊断准确性,常作为手术切除病理诊断的替代选择[12]。本研究发现,2组性别、年龄、肿瘤分期、分化级别、病理类型、超声定量评分、BRAF基因突变阳性率及血清Tg、甲状腺激素水平比较,差异无统计学意义(P>0.05), 但阳性淋巴结组FNA-C阳性率、FNA-Tg水平、血清TgAb水平均高于阴性淋巴结组,差异有统计学意义(P < 0.05),提示单纯根据肿瘤病理特征往往无法判断淋巴结转移是否阳性。本研究对转移淋巴结的征象进行定量评分,但也未能提高诊断的阳性率。无论是肿瘤原发灶还是转移淋巴结,内部分子的功能学改变往往早于结构形态学改变,这是FNA-C、FNA-Tg和BRAF基因检测的主要依据[13]。报道[14]显示, BRAF基因V600E突变较常见,是丝裂原活化蛋白激酶信号通路的主要转录基因。研究[15]证实, BRAF基因突变是DTC发生的重要分子机制。陈荣荣等[16]指出, FNA-Tg对甲状腺癌患者超声疑似颈部转移淋巴结的诊断效能高于FNA-C和BRAF基因。但本研究发现,BRAF基因突变尚不能作为转移淋巴结阳性的判断依据,考虑与患者肿瘤分期、取样标本以及检测技术等有关。
甲状腺癌患者血清Tg表达往往升高,手术切除肿瘤病灶后Tg水平可逐渐降低,可能影响淋巴结内Tg含量[17]。姚礼等[18]研究发现,甲状腺癌颈侧区淋巴结清扫术后甲状腺激素、TgAb和Tg水平均发生明显改变。研究[19]指出,血清Tg和甲状腺激素(尤其是TSH)可能影响FNA-Tg对转移淋巴结阳性的诊断效能。本研究也发现,阳性淋巴结组患者血清TgAb水平显著高于阴性淋巴结组患者。多因素Logistic回归分析显示,FNA-C阳性、FNA-Tg≥25 μg/L和血清TgAb≥500 U/mL是淋巴结转移阳性的预测因子(P < 0.05)。研究[20]认为, FNA-Tg诊断淋巴结转移阳性的敏感性高于FNA-C, 特异性与FNA-C基本相当,两者联合可提高诊断敏感性、特异性和准确性。本研究认为, FNA-C、FNA-Tg和血清TgAb是影响淋巴结转移阳性诊断的主要因素,并由此构建了可视化的列线图模型,可帮助临床医生术前快速计算淋巴结转移阳性的风险评分,且操作简单。
ROC曲线显示,超声定量评分、FNA-C、FNA-Tg和列线图模型预测淋巴结转移阳性的AUC分别为0.689、0.754、0.795和0.856, 提示列线图模型对淋巴结转移阳性的预测效能最高,有较好的应用价值。本研究开发的列线图模型不仅简单实用,可帮助医生术前准确快速地判断淋巴结转移情况,而且克服了单独FNA-C或FNA-Tg的诊断不足,具有较强的实践性。本研究存在一定局限性,如纳入患者的肿瘤临床分期可能影响淋巴结转移的阳性率,且样本量相对较小,故该列线图模型能否在临床中推广应用还有待开展更大样本量的研究加以验证。
综上所述, FNA-C和FNA-Tg是术前诊断DTC淋巴结转移的重要依据,通过大样本数据构建的列线图模型对淋巴结转移阳性有较好的预测效能。
-
表 1 阳性淋巴结组与阴性淋巴结组的临床资料比较(x±s)[n(%)]
指标 阴性淋巴结组(n=29) 阳性淋巴结组(n=57) t/χ2 P 性别 男 20(69.0) 29(50.9) 2.565 0.109 女 9(31.0) 28(49.1) 年龄/岁 52.7±8.4 54.9±10.1 0.769 0.234 肿瘤TNM分期 Ⅰ期 15(51.7) 26(45.6) 0.288 0.592 Ⅱa期 14(48.3) 31(54.4) 分化级别 中高分化 19(65.5) 27(47.4) 2.545 0.111 低分化 10(34.5) 30(52.6) 病理类型 乳头状癌 21(72.4) 36(63.2) 0.777 0.678 滤泡状癌 5(17.2) 14(24.6) 髓样癌 3(10.4) 7(12.2) 超声定量评分/分 2.5±0.3 2.7±0.5 0.856 0.142 FNA-C阳性 20(51.3) 55(74.3) 6.075 0.014 BRAF基因突变阳性 13(33.3) 29(39.2) 0.375 0.540 FNA-Tg/(μg/L) 18.9±6.7 35.6±10.2 11.235 < 0.001 血清Tg/(μg/L) 75.6±14.9 80.1±15.6 0.956 0.124 血清TgAb/(U/mL) 359.6±102.4 756.8±168.9 25.634 < 0.001 T3/(nmol/L) 1.6±0.3 1.7±0.4 0.456 0.632 T4/(nmol/L) 112.3±23.5 116.4±25.6 1.023 0.198 FT3/(pmol/L) 3.7±0.5 3.9±0.6 0.659 0.235 FT4/(pmol/L) 15.9±3.2 16.6±3.5 0.895 0.202 TSH/(μIU/L) 2.5±0.3 2.7±0.4 0.765 0.312 除超声定量评分、FNA-C阳性、BRAF基因突变阳性、FNA-Tg以本组淋巴结枚数计算以外,其他指标以本组患者例数计算。FNA-C: 细针穿刺细胞学检查; FNA-Tg: 穿刺针洗脱液中甲状腺球蛋白; Tg: 甲状腺球蛋白; TgAb: 甲状腺球蛋白抗体; T3: 三碘甲状腺原氨酸; T4: 甲状腺素; FT3: 游离三碘甲状腺原氨酸; FT4: 游离甲状腺素; TSH: 促甲状腺素。 表 2 淋巴结转移阳性的Logistic回归分析
因素 β Wald P OR 95%CI FNA-C阳性 0.801 14.236 < 0.001 2.652 2.301~2.954 FNA-Tg≥25 μg/L 0.585 8.062 < 0.001 2.302 2.001~2.565 TgAb≥500 U/mL 0.356 5.548 0.009 1.569 1.232~1.859 常数项 -0.056 3.658 0.022 - - FNA-C: 细针穿刺细胞学检查; FNA-Tg: 穿刺针洗脱液中甲状腺球蛋白; TgAb: 甲状腺球蛋白抗体。 表 3 淋巴结转移阳性的ROC曲线分析
指标 AUC 95%CI P 敏感性/% 特异性/% 超声定量评分 0.689 0.633~0.789 0.015 70.5 63.6 FNA-C 0.754 0.699~0.812 0.009 80.6 74.5 FNA-Tg 0.795 0.721~0.854 0.001 73.3 85.0 列线图模型 0.856 0.801~0.910 < 0.001 85.6 95.0 FNA-C: 细针穿刺细胞学检查; FNA-Tg: 穿刺针洗脱液中甲状腺球蛋白。 -
[1] ZHOU L, LI Q, CHEN S, et al. Synergic effects of histology subtype, lymph node metastasis, and distant metastasis on prognosis in differentiated thyroid carcinoma using the SEER database[J]. Gland Surg, 2020, 9(4): 907-918. doi: 10.21037/gs-20-273
[2] 张贵英. 超声检查对甲状腺微小乳头状癌的诊断价值[J]. 中国基层医药, 2020, 27(4): 479-481. doi: 10.3760/cma.j.issn.1008-6706.2020.04.021 [3] 王刚, 谢丽娟, 张明菊. 超声引导下颈淋巴结穿刺联合血清TSH、SIL-2R水平检测与甲状腺癌患者颈部淋巴结转移及疾病严重程度的关系[J]. 河北医科大学学报, 2020, 41(4): 436-439. doi: 10.3969/j.issn.1007-3205.2020.04.015 [4] XU Y, WU D, WU W, et al. Diagnostic value of cytology, thyroglobulin, and combination of them in fine-needle aspiration of metastatic lymph nodes in patients with differentiated thyroid cancer: a systematic review and network meta-analysis[J]. Medicine: Baltimore, 2019, 98(45): e17859. doi: 10.1097/MD.0000000000017859
[5] WANG T X, SONG Y T, XU G H, et al. Fine-needle aspiration for the diagnosis of lymph node metastasis in papillary thyroid carcinoma[J]. Chin J Otorhinolaryngol Head Neck Surg, 2019, 54(1): 23-27.
[6] DUVAL M A D S, ZANELLA A B, CRISTO A P, et al. Impact of serum TSH and anti-thyroglobulin antibody levels on lymph node fine-needle aspiration thyroglobulin measurements in differentiated thyroid cancer patients[J]. Eur Thyroid J, 2017, 6(6): 292-297. doi: 10.1159/000479682
[7] 赵晓伟, 关海霞, 孙辉. 颈部淋巴结细针穿刺针洗脱液甲状腺球蛋白测定临床应用进展与困惑[J]. 中国实用内科杂志, 2016, 36(1): 37-40. https://www.cnki.com.cn/Article/CJFDTOTAL-SYNK201601009.htm [8] 张丽, 管玲, 陆云, 等. 超声引导下甲状腺结节细针穿刺活检的临床应用价值[J]. 西部中医药, 2016, 29(12): 129-131. doi: 10.3969/j.issn.1004-6852.2016.12.049 [9] TEMPESTA A, LIMONGELLI L, CAPODIFERRO S, et al. Fine-needle aspiration cytology in head and neck diagnosis[J]. Clin Case Rep, 2019, 7(3): 601-602. doi: 10.1002/ccr3.2041
[10] DETTMER M S, SCHMITT A, KOMMINOTH P, et al. Poorly differentiated thyroid carcinoma: an underdiagnosed entity[J]. Pathologe, 2020, 41(suppl 1): 1-8.
[11] RITTER A, MIZRACHI A, BACHAR G, et al. Detecting recurrence following lobectomy for thyroid cancer: role of thyroglobulin and thyroglobulin antibodies[J]. J Clin Endocrinol Metab, 2020, 105(6): e2145-e2151. doi: 10.1210/clinem/dgaa152
[12] 文斐, 孙圣荣, 肖和平, 等. 甲状腺微小乳头状癌颈淋巴结转移的影响因素分析[J]. 蚌埠医学院学报, 2017, 42(8): 1087-1091. https://www.cnki.com.cn/Article/CJFDTOTAL-BANG201708025.htm [13] 陈鹏, 宋长祥, 陆武, 等. 首次131Ⅰ治疗前监测甲状腺球蛋白预测分化型甲状腺癌转移的临床价值[J]. 中华内分泌代谢杂志, 2018, 34(2): 102-105. doi: 10.3760/cma.j.issn.1000-6699.2018.02.003 [14] 张玉洁, 刘宝国, 赵治艳, 等. 甲状腺乳头状癌中BRAF基因突变与中央区淋巴结转移的关系及临床意义[J]. 北京大学学报: 医学版, 2016, 48(3): 502-506. doi: 10.3969/j.issn.1671-167X.2016.03.022 [15] 黄美玲, 李永平, 凌瑞. BRAFV600E基因突变与乳头状甲状腺癌淋巴结转移相关性的meta分析[J]. 中国肿瘤, 2017, 26(2): 145-151. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHLU201702020.htm [16] 陈荣荣, 王兴田, 陈大伟, 等. 对比细针穿刺细胞学检查、测定穿刺洗脱液甲状腺球蛋白及BRAF基因诊断甲状腺乳头状癌颈部淋巴结转移的效能[J]. 中国医学影像技术, 2019, 35(12): 1828-1832. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXX201912023.htm [17] 汪佳慧, 高力, 寿金朵, 等. 术前细针穿刺洗脱液甲状腺球蛋白在诊断甲状腺乳头状癌淋巴结转移中的应用及影响因素[J]. 中国肿瘤临床, 2018, 45(22): 1142-1146. doi: 10.3969/j.issn.1000-8179.2018.22.969 [18] 姚礼, 严轶群, 汪加宽, 等. 甲状腺癌颈侧区淋巴结清扫术后甲状腺功能、甲状腺球蛋白抗体、甲状腺球蛋白的变化[J]. 实用临床医药杂志, 2018, 22(7): 60-62, 66. doi: 10.7619/jcmp.201807016 [19] 马飞国, 王红军. 甲状腺乳头状癌颈侧区淋巴结转移与血清促甲状腺激素的相关关系研究[J]. 中华普外科手术学杂志: 电子版, 2015, 9(6): 59-60. doi: 10.3877/cma.j.issn.1674-3946.2015.06.150 [20] 范若鑫, 李竹瑶, 卢秀波. 穿刺洗脱液甲状腺球蛋白浓度对儿童甲状腺乳头状癌颈侧区淋巴结转移的诊断价值[J]. 郑州大学学报: 医学版, 2020, 55(5): 697-700. https://www.cnki.com.cn/Article/CJFDTOTAL-HNYK202005025.htm -
期刊类型引用(7)
1. 田明明,陈志峰,郑向欣,杨鹏,朱小朝. 腔镜与传统开放式甲状腺切除术对分化型甲状腺癌的疗效比较. 中国现代普通外科进展. 2024(09): 738-741 .  百度学术
百度学术
2. 王依莹,孔伟,刘庆华,邢浩,尹峰燕,刘新悦,何倩,邢薇佳. 术前血清甲状腺球蛋白检测对甲状腺乳头状癌颈部淋巴结转移的预测价值分析. 实用肿瘤学杂志. 2023(01): 52-57 .  百度学术
百度学术
3. 林素芳,丁超,孙文聪,汲冬冬. 血清甲状腺球蛋白水平与分化型甲状腺癌患者临床病理特征的相关性及对术后转移的诊断价值. 实用癌症杂志. 2023(07): 1078-1081 .  百度学术
百度学术
4. 王宁,刘金彪,乔楠. 分化型甲状腺癌患者喉前淋巴结转移影响因素分析及预测模型的构建与验证. 临床心身疾病杂志. 2023(04): 15-20 .  百度学术
百度学术
5. 独海玲. 血清甲状腺球蛋白及抗体联合降钙素原检测对甲状腺癌患者的诊断价值. 系统医学. 2023(10): 42-45 .  百度学术
百度学术
6. 谢磊,柴凡,鲍刚,彭仕娇,陈尧权,代武宏,张帆. 血清Tg、TgAb对甲状腺癌根治术联合~(131)I治疗后随访期间复发/转移的评估价值. 中国现代医学杂志. 2023(19): 74-79 .  百度学术
百度学术
7. 焦海霞. MMP-9、TSGF、TG在甲状腺癌中的表达及与超声血流参数的相关性. 中国现代医药杂志. 2022(06): 63-65 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号