Mechanism of homocysteine on expression of cathepsin V and inflammatory factors in human coronary artery endothelial cells
-
摘要:目的 分析体外不同浓度同型半胱氨酸(Hcy)介导蛋白激酶C(PKC)/丝裂原活化蛋白激酶(MAPK)/信号转导及转录激活因子1(STAT1)信号通路对人冠状动脉内皮细胞(HCAECs)中组织蛋白酶V(CTSV)和炎症因子表达的影响机制。方法 实验分为4组,即对照组(生理盐水)、低浓度组(Hcy 1 mmol/L)、中浓度组(Hcy 5 mmol/L)和高浓度组(Hcy 10 mmol/L), 4组不同溶液分别与HCAECs共培养72 h。采用四氮唑蓝盐化合物(MTS)法检测细胞活力,采用蛋白质印迹法(Western blot)检测PKC、MAPK、STAT1和CTSV相对表达量,采用酶联免疫吸附试验(ELISA)法检测炎症因子[血管内皮细胞生长因子受体-1(VEGFR-1)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)]表达水平。结果 与对照组、低浓度组相比,中浓度组、高浓度组细胞活力升高, PKC、MAPK、STAT1和CTSV相对表达量增加, VEGFR-1、TNF-α和IL-1β表达水平升高,差异有统计学意义(P<0.05); 高浓度组PKC、MAPK、STAT1、CTSV相对表达量和VEGFR-1、TNF-α、IL-1β表达水平及细胞活力均高于中浓度组,差异有统计学意义(P<0.05); 对照组与低浓度组各指标比较,差异无统计学意义(P>0.05)。结论 Hcy水平升高可激活HCAECs中PKC/MAPK/STAT1信号通路影响CTSV和炎症因子表达,且呈浓度依赖性。Hcy高表达与川崎病导致冠状动脉损伤有关,为疾病的临床干预提供了重要靶点。
-
关键词:
- 人冠状动脉内皮细胞 /
- 同型半胱氨酸 /
- 蛋白激酶C/丝裂原活化蛋白激酶/信号转导及转录激活因子1信号通路 /
- 组织蛋白酶V /
- 炎症因子
Abstract:Objective To analyze the influences of different concentrations of homocysteine (Hcy) mediated protein kinase C (PKC)/mitogen-activated protein kinase (MAPK)/signal transducer in vitro and activator of transcription 1 (STAT1) signaling pathway on the expression of cathepsin V (CTSV) and inflammatory factors in human coronary endothelial cells (HCAECs).Methods The experiment was divided into four groupscontrol group (normal saline), low-concentration (Hcy 1 mmol/L), medium-concentration (5 mmol/L) and high-concentration (10 mmol/L) groups. They were co-cultured with HCAECs at four concentrations for 72 hours. The cell viability was detected by May-Thurner syndrome (MTS), the relative expression of PKC, MAPK, STAT1 and CTSV were detected by western blot, and inflammatory factors including vascular endothelial growth factor receptor-1 (VEGFR-1), tumor necrosis factor-α(TNF-α) and interleukin-1 β (IL-1 β) were detected by enzyme-linked immunosorbent assay.Results Compared with the control group and low-concentration group, the cell viability was increased, relative expression of PKC, MAPK, STAT1 and CTSV were increased, the expression levels of VEGFR-1, TNF- α and IL-1 β were significantly increased in the medium and high-concentration group(P<0.05). The relative expression of PKC, MAPK, STAT1 and CTSV, the expression levels of VEGFR-1, TNF-α and IL-1 β and the cell viability in the high-concentration group were significantly higher than those in the medium-concentration group (P<0.05), while there were no differences between the control group and the low-concentration group in above indicators (P>0.05).Conclusion The increase of Hcy concentration can activate PKC/MAPK/STAT1 signal pathway in HCAECs and affect the expression of CTSV and inflammatory factors with a concentration-dependent manner. High expression of Hcy is closely related to coronary artery injury caused by Kawasaki disease, which provides an important target for clinical intervention. -
川崎病是临床较常见的一类自身免疫性疾病, 病理特征以全身弥漫性血管炎为主,主要损伤冠状动脉[1]。研究[2]表明,川崎病伴冠状动脉损伤的成人和儿童患者外周循环静脉血中同型半胱氨酸(Hcy)水平显著高于川崎病不伴冠状动脉损伤患者或健康对照者。Hcy水平升高可上调血管黏附细胞分子-1、单核细胞趋化蛋白-1、白细胞介素(IL)-8和IL-6等的表达,广泛参与血管炎症反应[3]。Hcy水平升高已被证实是动脉粥样硬化性心血管疾病的独立预测因子[4], 故推测Hcy可能参与川崎病继发冠状动脉损伤的发生。心血管疾病患者血清组织蛋白酶水平与炎症因子表达水平呈正相关[5], 组织蛋白酶V(CTSV)是组织蛋白酶家族成员之一,能够促进内皮细胞释放多种炎症因子,诱导病灶部位的炎症反应紊乱[6]。活化的蛋白激酶C(PKC)可激活下游的属于丝裂原活化蛋白激酶(MAPK)家族的ERK、p38、JNK信号通路,实现细胞内信号传递[7]。激活的MAPK在细胞生长、增殖、分化、凋亡等多种生理、病理功能的调控中发挥着重要作用[8]。信号转导及转录激活因子1(STAT1)位于多条信号通路的终末阶段,是调控细胞内信号通路活化强度的枢纽分子,也是MAPK通路下游的关键点[9]。本研究分析体外不同浓度Hcy介导PKC/MAPK/STAT1信号通路对人冠状动脉内皮细胞(HCAECs)中CTSV和炎症因子表达的影响机制,现报告如下。
1. 材料与方法
1.1 细胞来源和培养
HCAECs购自上海弘顺生物有限公司,在含10%胎牛血清的完全培养基中贴壁培养,待细胞铺满培养瓶底面80%以后,胰蛋白酶消化细胞终止培养,然后以1∶3比例传代培养。选择对数生长期细胞用磷酸盐缓冲液重悬细胞浓度为1×106/L, 进行分组实验。
1.2 主要试剂和仪器
Hcy冻干粉试剂购自美国Sigma公司,纯度大于85%; 完全培养基购自美国R&D公司,四氮唑蓝盐化合物(MTS)试剂盒购自江苏碧云天科技有限公司,蛋白裂解液和二喹啉甲酸(BCA)蛋白定量试剂盒购自北京中杉金桥生物有限公司,鼠抗人PKC/MAPK/STAT1、CTSV和GAPDH抗体一抗购自美国Sigma公司,对应兔抗鼠抗体二抗购自美国Sigma公司,酶联免疫吸附试验(ELISA)试剂盒购自美国Invitrogen公司。96孔培养板购自美国Applied Biosystems公司,酶标仪购自美国Bio-Rad公司,蛋白电泳仪购自美国Santa Cruz公司。
1.3 方法
1.3.1 实验分组
>实验分为4组,即对照组(空白对照)、低浓度组(Hcy 1 mmol/L)、中浓度组(Hcy 5 mmol/L)和高浓度组(Hcy 10 mmol/L)组。对照组用等体积生理盐水,另3组用Hcy冻干粉与生理盐水混合配成不同浓度溶液,分别与HCAECs在含10%胎牛血清的完全培养基, 37 ℃、5%CO2饱和湿度培养箱中共培养72 h。每组设置6个复孔,结果取平均值。
1.3.2 MTS法检测细胞活力
将各组HCAECs接种于96孔培养板中共培养72 h后,根据MTS试剂盒说明书进行操作,在酶标仪上测定490 nm波长处的光密度(OD)值代表细胞活力。
1.3.3 蛋白质印迹法(Western blot)检测PKC、MAPK、STAT1和CTSV表达量
各组HCAECs培养72 h后加入细胞裂解液,充分震荡后提取细胞中总蛋白分子,根据蛋白定量试剂盒提示检测蛋白浓度和纯度,符合要求后采用内参GAPDH进行剂量标准化。取30 μg样本总蛋白和等量标准蛋白,经8%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,将分离区带电转移至聚偏氟乙烯(PVDF)膜; 依次加入鼠抗人PKC/MAPK/STAT1、CTSV和GAPDH抗体一抗(工作浓度为1∶2 000)静置过夜,洗涤后加入兔抗鼠多克隆抗体二抗(工作浓度为1∶500)室温下孵育4 h, 洗涤后加入ECL显色剂。结果扫描保存,采用Lab Works 4.5凝胶成像软件(美国Invitrogen公司)行半定量分析,结果以目标蛋白与内参蛋白的电泳条带灰度值的比值表示。
1.3.4 ELISA法检测炎症因子水平
各组HCAECs培养72 h后以2 500×g离心10 min, 取上清液,根据对应试剂ELISA试剂盒提示进行检测,绘制浓度曲线。
1.4 统计学分析
采用SPSS 20.0统计学软件处理数据,计量资料以(x±s)表示,多组间比较采用单因素ANOVA分析,两两组间比较采用LSD-t检验, P<0.05为差异有统计学意义。
2. 结果
2.1 细胞活力比较
中浓度组、高浓度组细胞活力高于对照组、低浓度组,高浓度组细胞活力高于中浓度组,差异有统计学意义(P<0.05), 对照组与低浓度组细胞活力比较,差异无统计学意义(P>0.05), 见表 1。
表 1 各组细胞活力比较(x±s)组别 n 细胞活力(OD490 nm) 对照组 6 0.523±0.165 低浓度组 6 0.598±0.201 中浓度组 6 0.758±0.265*# 高浓度组 6 0.901±0.354*#△ OD490 nm: 490 nm波长处的光密度值。
与对照组比较, *P<0.05; 与低浓度组比较, #P<0.05; 与中浓度组比较, △P<0.05。2.2 PKC、MAPK、STAT1和CTSV表达量比较
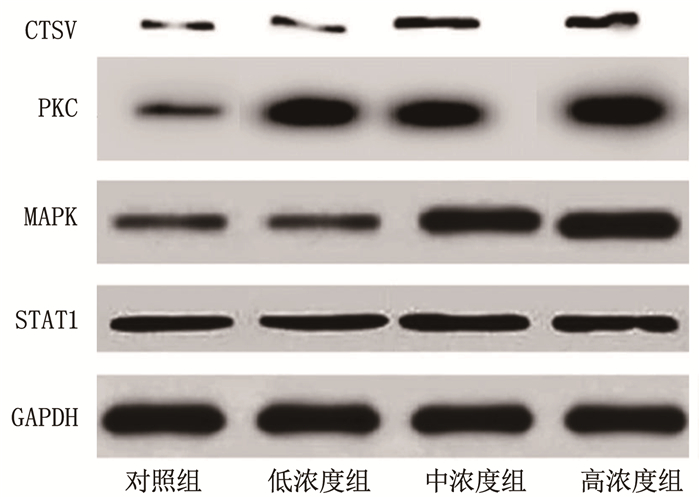
中浓度组、高浓度组PKC、MAPK、STAT1、CTSV相对表达量高于对照组、低浓度组,且高浓度组高于中浓度组,差异有统计学意义(P<0.05); 对照组PKC、MAPK、STAT1、CTSV相对表达量与低浓度组比较,差异无统计学意义(P>0.05)。见图 1、表 2。
表 2 各组PKC、MAPK、STAT1和CTSV相对表达量比较(x±s)组别 n PKC MAPK STAT1 CTSV 对照组 6 0.201±0.113 0.323±0.165 0.396±0.176 0.125±0.067 低浓度组 6 0.256±0.137 0.355±0.178 0.421±0.200 0.146±0.098 中浓度组 6 0.489±0.221*# 0.501±0.236*# 0.656±0.298*# 0.358±0.102*# 高浓度组 6 0.568±0.257*#△ 0.754±0.298*#△ 0.814±0.310*#△ 0.524±0.168*#△ PKC: 蛋白激酶C; MAPK: 丝裂原活化蛋白激酶; STAT1: 信号转导及转录激活因子1; CTSV: 组织蛋白酶V。
与对照组比较, *P<0.05; 与低浓度组比较, #P<0.05; 与中浓度组比较, △P<0.05。2.3 炎症因子表达水平比较
中浓度组、高浓度组VEGFR-1、TNF-α、IL-1β表达水平高于对照组、低浓度组,且高浓度组高于中浓度组,差异有统计学意义(P<0.05); 对照组炎症因子表达水平与低浓度组比较,差异无统计学意义(P>0.05)。见表 3。
表 3 各组炎症因子表达水平比较(x±s)i Table 3. mmol/L组别 n VEGFR-1 TNF-α IL-1β 对照组 6 0.065±0.022 0.120±0.069 0.165±0.088 低浓度组 6 0.078±0.039 0.134±0.078 0.196±0.093 中浓度组 6 0.212±0.097*# 0.398±0.154*# 0.301±0.123*# 高浓度组 6 0.385±0.121*#△ 0.495±0.256*#△ 0.562±0.289*#△ VEGFR-1: 血管内皮细胞生长因子受体-1; TNF-α: 肿瘤坏死因子-α; IL-1β: 白细胞介素-1β。
与对照组比较, *P<0.05; 与低浓度组比较, #P<0.05; 与中浓度组比较, △P<0.05。3. 讨论
杨蕊华等[10]报道,川崎病患儿血清Hcy、C反应蛋白和纤维蛋白原水平与冠状动脉损伤密切相关。虽然川崎病的发病机制尚未完全阐明,但临床已确认机体的炎症和免疫功能紊乱与川崎病的发生密不可分[11]。冠状动脉是川崎病的重要损伤部位,以内皮细胞功能障碍为主,释放和诱导大量炎症介质与炎症细胞聚集[12]。既往研究[13-14]证实,高Hcy血症是心脑血管疾病的主要危险因素之一,且与冠状动脉损伤程度一致,其主要机制是影响糖脂和氨基酸代谢,导致内皮细胞功能障碍,诱导形成粥样硬化性斑块[15]。但川崎病继发冠状动脉损伤以炎症为主,缺少导致管腔狭窄的粥样斑块,故尚不清楚Hcy是否在其中扮演重要角色。本研究假设Hcy可诱导川崎病继发冠状动脉损伤,采用体外细胞实验方法探讨不同浓度Hcy在川崎病中的作用机制。
本研究发现,中浓度组、高浓度组细胞活力高于对照组、低浓度组,高浓度组高于中浓度组,差异有统计学意义(P<0.05), 而对照组与低浓度组细胞活力差异无统计学意义(P>0.05), 提示高浓度Hcy可激活HCAECs, HCAECs活力增高表示细胞损伤风险加大。DEHARO P等[16]指出, Hcy与冠心病患者血浆腺苷A2A受体(A2AR)的产生及细胞中A2AR和环磷酸腺苷的产生呈负相关,而A2AR的产生和功能降低会阻碍冠状动脉血流并促进炎症,这可能支持冠状动脉损伤性疾病的发病。进一步发现,中浓度组、高浓度组PKC、MAPK、STAT1和CTSV相对表达量高于对照组、低浓度组,且高浓度组高于中浓度组,差异有统计学意义(P<0.05), 对照组与低浓度组差异无统计学意义(P>0.05), 提示高浓度Hcy可激活PKC/MAPK/STAT1信号通路和诱导CTSV蛋白表达,参与冠状动脉的损伤。组织蛋白酶C在冠状动脉组织中的表达上调可能促进TNF-α表达,从而影响冠心病的发生和发展[17], 但CTSV与冠状动脉损伤发生的关系还不明确。CTSV的主要功能是水解多种蛋白酶,主要在中性粒细胞、淋巴细胞和肥大细胞等溶酶体中表达,生理功能是激活促炎性颗粒相关的丝氨酸蛋白酶,从而促进炎症反应[18]。齐双辉等[19]指出,人参皂苷Rb1能够激活蛋白酪氨酸激酶2/STAT3信号通路,进而减轻川崎病小鼠的心肌损伤。LI S M等[20]研究发现,川崎病患儿血清和HCAECs中有148个蛋白的磷酸化程度不同,富含MAPK、VEGFR、表皮生长因子受体(EGFR)、血管生成素受体等。
本研究结果显示,中浓度组、高浓度组VEGFR-1、TNF-α、IL-1β水平高于对照组、低浓度组,且高浓度组高于中浓度组,差异有统计学意义(P<0.05), 对照组与低浓度组差异无统计学意义(P>0.05), 提示高浓度Hcy能够诱导更多的炎症因子表达,参与冠状动脉的损伤。顾勇等[21]指出,miRNA-145可能通过调节VEGF的表达参与川崎病的发病,且与冠脉损伤的发生相关。血管内皮生长因子(VEGF)与VEGFR-1特异性结合,在诱导内皮细胞功能障碍中发挥重要作用[22]。TNF-α和IL-1β是主要的促炎介质,也是诱导瀑布样炎症级联反应的核心分子,能够诱导更多的炎症细胞和炎症介质释放[23-24]。
综上所述, Hcy浓度升高可激活HCAECs中PKC/MAPK/STAT1信号通路影响CTSV和炎症因子的表达,且呈浓度依赖性。Hcy表达升高与冠状动脉损伤性疾病密切相关,故Hcy有望成为临床干预川崎病伴冠状动脉损伤的重要靶点。未来可通过人体临床研究和动物模型探讨Hcy在川崎病伴冠状动脉损伤患者和动物模型中的表达,以及Hcy与PKC/MAPK/STAT1信号通路、CTSV、炎症因子之间的关系,为临床靶向干预提供强有力的理论依据。
-
表 1 各组细胞活力比较(x±s)
组别 n 细胞活力(OD490 nm) 对照组 6 0.523±0.165 低浓度组 6 0.598±0.201 中浓度组 6 0.758±0.265*# 高浓度组 6 0.901±0.354*#△ OD490 nm: 490 nm波长处的光密度值。
与对照组比较, *P<0.05; 与低浓度组比较, #P<0.05; 与中浓度组比较, △P<0.05。表 2 各组PKC、MAPK、STAT1和CTSV相对表达量比较(x±s)
组别 n PKC MAPK STAT1 CTSV 对照组 6 0.201±0.113 0.323±0.165 0.396±0.176 0.125±0.067 低浓度组 6 0.256±0.137 0.355±0.178 0.421±0.200 0.146±0.098 中浓度组 6 0.489±0.221*# 0.501±0.236*# 0.656±0.298*# 0.358±0.102*# 高浓度组 6 0.568±0.257*#△ 0.754±0.298*#△ 0.814±0.310*#△ 0.524±0.168*#△ PKC: 蛋白激酶C; MAPK: 丝裂原活化蛋白激酶; STAT1: 信号转导及转录激活因子1; CTSV: 组织蛋白酶V。
与对照组比较, *P<0.05; 与低浓度组比较, #P<0.05; 与中浓度组比较, △P<0.05。表 3 各组炎症因子表达水平比较(x±s)
i Table 3 mmol/L
组别 n VEGFR-1 TNF-α IL-1β 对照组 6 0.065±0.022 0.120±0.069 0.165±0.088 低浓度组 6 0.078±0.039 0.134±0.078 0.196±0.093 中浓度组 6 0.212±0.097*# 0.398±0.154*# 0.301±0.123*# 高浓度组 6 0.385±0.121*#△ 0.495±0.256*#△ 0.562±0.289*#△ VEGFR-1: 血管内皮细胞生长因子受体-1; TNF-α: 肿瘤坏死因子-α; IL-1β: 白细胞介素-1β。
与对照组比较, *P<0.05; 与低浓度组比较, #P<0.05; 与中浓度组比较, △P<0.05。 -
[1] 杨福宝, 刘佼佼. 超声心动图与心电图诊断川崎病冠状动脉损害的价值分析[J]. 实用临床医药杂志, 2020, 24(6): 47-50. doi: 10.7619/jcmp.202006013 [2] KAPLAN P, TATARKOVA Z, SIVONOVA M K, et al. Homocysteine and mitochondria in cardiovascular and cerebrovascular systems[J]. Int J Mol Sci, 2020, 21(20): 7698. doi: 10.3390/ijms21207698
[3] DJURIC D, JAKOVLJEVIC V, ZIVKOVIC V, et al. Homocysteine and homocysteine-related compounds: an overview of the roles in the pathology of the cardiovascular and nervous systems[J]. Can J Physiol Pharmacol, 2018, 96(10): 991-1003. doi: 10.1139/cjpp-2018-0112
[4] DE OLIVEIRA LEITE L, COSTA DIAS PITANGUEIRA J, FERREIRA DAMASCENA N, et al. Homocysteine levels and cardiovascular risk factors in children and adolescents: systematic review and meta-analysis[J]. Nutr Rev, 2020, 79(9): 1067-1078.
[5] 侯建, 闫涛, 马灿丽, 等. 溶栓治疗时间对急性ST段抬高型心肌梗死患者血清炎性因子、组织蛋白酶、结缔组织生长因子及左室射血分数的影响[J]. 中国基层医药, 2021, 28(9): 1296-1302. doi: 10.3760/cma.issn1008-6706.2021.09.004 [6] YANG W, ZHU Z, LI L, et al. Silencing of Ac45 simultaneously inhibits osteoclast-mediated bone resorption and attenuates dendritic cell-mediated inflammation through impairing acidification and cathepsin K secretion[J]. Infect Immun, 2020, 89(1): e0043620. doi: 10.1128/IAI.00436-20
[7] WANG Z, YOO Y J, DE LA TORRE R, et al. Inverse correlation of TRIM32 and protein kinase C ζ in T helper type 2-biased inflammation[J]. J Invest Dermatol, 2021, 141(5): 1297-1307. e3. doi: 10.1016/j.jid.2020.09.021
[8] 于沛霞, 薄立军, 黄立宁, 等. p38MAPK/MMP-9信号通路对新生大鼠脑缺氧缺血损伤的影响[J]. 河北医科大学学报, 2017, 38(9): 1063-1067. doi: 10.3969/j.issn.1007-3205.2017.09.017 [9] NAJM A, MASSON F M, PREUSS P, et al. microRNA-17-5p reduces inflammation and bone erosions in mice with collagen-induced arthritis and directly targets the JAK/STAT pathway in rheumatoid arthritis fibroblast-like synoviocytes[J]. Arthritis Rheumatol, 2020, 72(12): 2030-2039. doi: 10.1002/art.41441
[10] 杨蕊华, 李亚蕊, 崔涛, 等. 川崎病患儿同型半胱氨酸C反应蛋白纤维蛋白原水平与冠状动脉损伤的关系及临床意义[J]. 中国药物与临床, 2020, 20(15): 2567-2568. https://www.cnki.com.cn/Article/CJFDTOTAL-YWLC202015041.htm [11] 高广川, 魏春艳, 况建华. 川崎病患儿急性期免疫及炎症相关指标变化及其与预后的关系[J]. 实用临床医药杂志, 2021, 25(14): 24-27. doi: 10.7619/jcmp.20210984 [12] QIU H, JIA C, WANG Z, et al. Prognosis and risk factors of coronary artery lesions before immunoglobulin therapy in children with Kawasaki disease[J]. Balkan Med J, 2020, 37(6): 324-329.
[13] 魏灵祯. 同型半胱氨酸/超敏C反应蛋白与心脑血管疾病的关系[J]. 西部中医药, 2018, 31(10): 150-152. doi: 10.3969/j.issn.1004-6852.2018.10.051 [14] CHEN S, LUAN H, HE J, et al. The relationships of serum homocysteine levels and traditional lipid indicators with disease activity and coronary artery involvement in Takayasu arteritis[J]. Immunol Res, 2020, 68(6): 405-413. doi: 10.1007/s12026-020-09157-1
[15] AHMAD A, CORBAN M T, TOYA T, et al. Coronary microvascular endothelial dysfunction in patients with angina and nonobstructive coronary artery disease is associated with elevated serum homocysteine levels[J]. J Am Heart Assoc, 2020, 9(19): e017746.
[16] DEHARO P, MARLINGE M, GUIOL C, et al. Homocysteine concentration and adenosine A2A receptor production by peripheral blood mononuclear cells in coronary artery disease patients[J]. J Cell Mol Med, 2020, 24(16): 8942-8949. doi: 10.1111/jcmm.15527
[17] 张琼, 万昌武, 于燕妮, 等. 组织蛋白酶C和肿瘤坏死因子α在人冠脉组织中的表达及其与冠心病的相关性研究[J]. 中国病理生理杂志, 2020, 36(12): 2133-2138. doi: 10.3969/j.issn.1000-4718.2020.12.003 [18] LENG Y, CHEN R, CHEN R, et al. HMGB1 mediates homocysteine-induced endothelial cells pyroptosis via cathepsin V-dependent pathway[J]. Biochem Biophys Res Commun, 2020, 532(4): 640-646. doi: 10.1016/j.bbrc.2020.08.091
[19] 齐双辉, 张敬莹, 肖锋, 等. 人参皂苷Rb1激活蛋白酪氨酸激酶2/信号传导及转录激活蛋白3通路减轻川崎病小鼠心肌损伤[J]. 中国小儿急救医学, 2021, 28(3): 209-214. doi: 10.3760/cma.j.issn.1673-4912.2021.03.010 [20] LI S M, LIU W T, YANG F, et al. Phosphorylated proteomics analysis of human coronary artery endothelial cells stimulated by Kawasaki disease patients serum[J]. BMC Cardiovasc Disord, 2019, 19(1): 21. doi: 10.1186/s12872-018-0982-2
[21] 顾勇, 窦常胜, 邰海服. miRNA-145、VEGF与川崎病患儿冠脉损伤关系的初步研究[J]. 医学理论与实践, 2019, 32(10): 1472-1474. [22] HUANG J, ZHANG S. Overexpressed neuropilin-1 in endothelial cells promotes endothelial permeability through interaction with ANGPTL4 and VEGF in Kawasaki disease[J]. Mediators Inflamm, 2021, 2021: 9914071.
[23] 余淋, 陈明群, 徐敏. 川崎病并发冠脉损伤患儿血清PAI-1水平对血管内皮细胞活力的影响[J]. 河北医学, 2018, 24(11): 1761-1765. doi: 10.3969/j.issn.1006-6233.2018.11.001 [24] 侯秋英, 沈方方, 朱雯, 等. 川崎病患儿血清降钙素原、超敏C反应蛋白及淋巴细胞亚群CD19+CD23+检测的临床意义[J]. 中国基层医药, 2016, 23(3): 361-364. doi: 10.3760/cma.j.issn.1008-6706.2016.03.011 -
期刊类型引用(3)
1. 潘志琼,李智宁. 心肌梗死患者同型半胱氨酸水平与短期心脏血管不良事件的关系研究. 心血管病防治知识. 2024(04): 15-18 .  百度学术
百度学术
2. 黄姗. 马来酸依那普利片联合叶酸片治疗H型高血压的效果及对血管内皮功能的影响. 大医生. 2023(15): 64-66 .  百度学术
百度学术
3. 余聪聪,许炳,尤巧英. 同型半胱氨酸与2型糖尿病心血管自主神经病变关系的研究进展. 临床医学研究与实践. 2023(34): 194-198 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号