Predictive effect of emotional repair on success of smoking cessation in schizophrenic patients
-
摘要:目的
探讨元情绪对精神分裂症患者戒烟成功的预测作用。
方法对173例男性精神分裂症戒烟者进行12个月的随访,记录患者戒烟复吸时间。采用特质元情绪量表(TMMS)、Cohens感知压力量表(PSS-10)和尼古丁依赖量表(FTND)分别评估戒烟者的元情绪、感知的压力水平和尼古丁依赖程度。
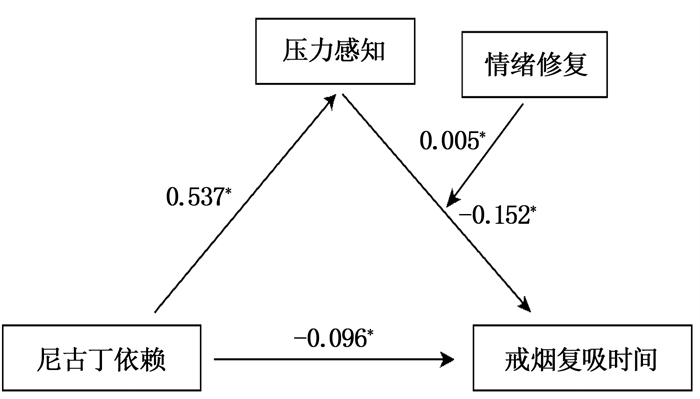
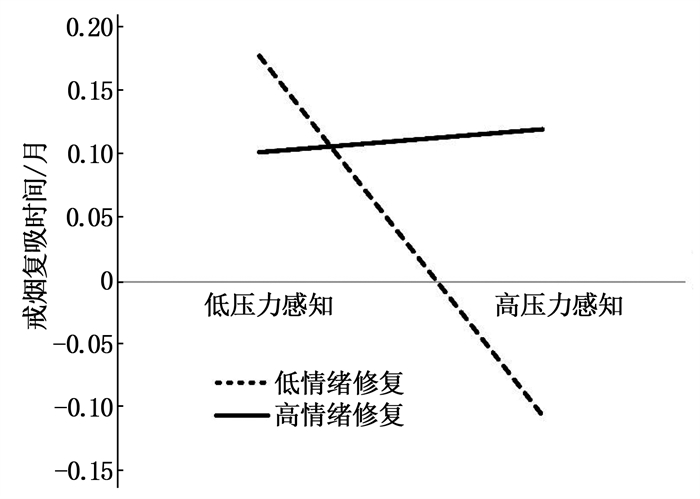
结果中介分析显示,尼古丁依赖不仅能够直接预测戒烟复吸时间,还能通过压力感知的中介作用预测复吸时间,直接效应(0.161)、中介效应(0.031)分别占总效应(0.192)的83.85%、16.15%。调节分析显示,压力感知与情绪修复的乘积项对戒烟复吸时间的预测作用显著(β=0.005, t=1.979, P=0.049)。情绪修复水平较低患者的压力感知对戒烟复吸时间具有显著的负向预测作用(β=-0.293, t=-3.087, P=0.002); 压力感知对情绪修复水平较高的患者戒烟复吸时间无预测作用(β=0.010, t=0.084, P=0.933)。
结论情绪修复能调控个体对压力感知的影响,减轻了尼古丁依赖对戒烟复吸时间的间接影响。加入元情绪训练有助于改善精神分裂症患者戒烟的预后。
-
关键词:
- 精神分裂症 /
- 戒烟 /
- 元情绪 /
- 压力感知 /
- 尼古丁依赖: 情绪修复
Abstract:ObjectiveTo explore the predictive effect of meta-emotion on success of smoking cessation in schizophrenic patients.
MethodsA total of 173 men with schizophrenia who quit smoking were followed up for 12 months, and the time of re-smoking after quitting was recorded. Meta-emotion, perceived stress and nicotine dependence were assessed by Trait Meta-Mood Scale (TMMS), Cohens Perceived Stress Scale (PSS-10) and Fagerstrom Test for Nicotine Dependence (FTND).
ResultsMediating analysis showed that nicotine dependence could not only predicted the time to relapse directly, but also predicted the time to relapse through the mediating effect of stress perception. Direct effect (0.161) and intermediate effect (0.031) accounted for 83.85% and 16.15% of the total effect (0.192), respectively. Regulatory analysis showed that the product of stress perception and emotional repair had a significant predictive effects on the time of cessation and relapse (β=0.005, t=1.979, P=0.049). The stress perception of patients with low level of emotional repair had a significant negative predictive effect on the time of re-smoking after quitting (β=-0.293, t=-3.087, P=0.002). Stress perception had no predictive effect on the time of re-smoking after cessation in patients with high level of emotional repair (β=0.010, t=0.084, P=0.933).
ConclusionEmotional repair ability regulates the influence of stress perception and alleviates the indirect effect of nicotine dependence on the time of re-smoking after quitting. The addition of meta-emotional training can improve the prognosis of patients with schizophrenia who quit smoking.
-
2019年12月,新型冠状病毒肺炎(COVID-19)(以下简称新冠肺炎)疫情在湖北省武汉市爆发,其病原体被命名为严重急性呼吸综合征冠状病毒2(SARS-CoV-2)(以下简称新冠病毒)。新冠肺炎患者的主要临床表现为严重程度不等的呼吸道症状,轻者为无症状的亚临床感染或仅有轻微上呼吸道症状,重者则出现肺炎,甚至发展为急性呼吸窘迫综合征(ARDS)。然而,除肺部症状以外,新冠肺炎患者还可出现其他器官系统受损表现,心血管系统即其中之一。新冠肺炎患者心血管系统受损的最常见表现为伴有血浆肌钙蛋白升高的心肌损伤,可见于8%~12%的新冠肺炎患者[1-2]。亦有小部分患者出现急性心力衰竭的表现[3-4]。新冠肺炎患者的心血管系统受损情况与其预后紧密相关,相关研究[5-7]表明,合并心血管系统损伤症状的新冠肺炎患者的其他并发症发病率以及病死率均明显升高。国内一项纳入44 672例新冠肺炎患者的研究结果表明,有心血管系统并发症的患者病死率约为10.5%, 而新冠肺炎患者的总体病死率为2.4%[8]。因此,新冠肺炎患者的心血管系统损伤值得临床医生高度关注,而进一步加深对新冠病毒损伤心血管系统的理解对于新冠肺炎患者的诊治有着重要意义。现将新冠肺炎患者心血管系统损伤的可能机制、临床表现等方面的研究进展综述如下,并提出对有心血管系统并发症的新冠肺炎患者的治疗建议。
1. 新冠病毒概述
新冠病毒属于冠状病毒科,是一类有包膜、非节段性的单股正链RNA病毒[9]。冠状病毒科包括多种不同的病毒,目前已知其中有7种可以感染人类。7种病毒中,人冠状病毒(HCoV)-229E、HCoV-NL63、HCoV-OC43和HcoV-HKU1会引起自限性的流行性感冒,中东呼吸综合征冠状病毒(MERS-CoV)和严重急性呼吸综合征冠状病毒(SARS-CoV)分别引起过中东呼吸综合征疫情和非典型性肺炎疫情[10-11], 而SARS-CoV-2则是当前流行的新冠肺炎疫情的病原体[12]。
冠状病毒通过其包膜表面的同源三聚体棘突糖蛋白与目标蛋白表面的受体结合,启动一系列级联反应,入侵宿主细胞。近期研究[13-16]表明, SARS-CoV-2识别的受体与SARS-CoV相同,均为血管紧张素转换酶2(ACE2)。在SARS-CoV-2入侵宿主细胞的过程中,跨膜丝氨酸蛋白酶2(TMPRSS2)也起到了辅助作用[17]。与SARS-CoV相比, SARS-CoV-2对ACE2的亲和力明显更强[18-19], 这可能也是后者传染性更强的原因[20]。
2. 新冠病毒感染引起心肌损伤的机制
新冠病毒引起心肌损伤的具体病理生理机制并未完全明确,目前研究人员已提出了多种可能机制,然而其中哪种损伤机制占主导地位仍需进一步研究。
2.1 病毒直接入侵心肌细胞引起损伤
作为新冠病毒识别的靶点, ACE2在多种组织器官中均有表达,如Ⅱ型肺泡细胞、心肌细胞、血管内皮细胞、消化道细胞、骨髓等[21]。心肌细胞表达的ACE2受体则成为新冠病毒直接入侵损伤心肌的基础。
ESCHER F等[22]对104例出现心力衰竭症状及疑似心肌炎的新冠肺炎患者进行心内膜活检(EMBs),并应用逆转录-聚合酶链反应(RT-PCR)技术检测新冠病毒基因组,最终证实其中有5例标本含有新冠病毒基因组。此外多项研究[23-25]报道,对死于新冠肺炎的患者进行尸检后发现,部分患者心肌中有较高的新冠病毒载量,进一步证明新冠病毒对心肌有较高的趋向性,且可直接侵犯心肌细胞。
2.2 微小血栓的形成导致心肌损伤
心脏微循环内微小血栓的形成可能是导致重症新冠肺炎患者心肌损伤的原因之一。重度感染通常是诱发弥散性血管内凝血(DIC)的重要原因, TANG N等[26]研究表明,死于新冠肺炎的患者凝血指标异常十分常见,尤其是血浆D-二聚体以及纤维蛋白降解产物水平显著升高,且超过70%的新冠肺炎死亡患者达到了DIC的诊断标准。DIC发生时,血管内皮损伤以及机体内存在的大量炎症因子如白细胞介素-6(IL-6)、肿瘤坏死因子α(TNF-α)等,促进血管内皮释放大量组织因子,造成血液处于高凝状态,心脏微循环内微小血栓广泛生成,从而导致心肌损伤。
2.3 重度感染诱发心肌梗死致心肌损伤
严重的病毒感染可能会使患者发生急性冠状动脉综合征的风险增加,造成心肌损伤[27]。已有研究[28]证实流感病毒感染与急性冠状动脉综合征的发生明显相关,且注射流感疫苗可使主要的心血管不良事件的发生率降低36%[29]。另一项流行病学研究[30]显示,因肺炎住院的患者心血管不良事件(包括心肌梗死)发生率明显上升。由此可以推测,急性冠状动脉综合征同样可能是导致新冠肺炎患者心肌损伤的重要原因。
严重系统性的病毒感染导致急性冠状动脉综合征的机制有多种。首先,急性病毒感染会引起机体免疫反应,使得血管内细胞因子及炎症介质水平激增,可导致局限性的血管炎症,且动脉粥样硬化斑块内炎症水平更为明显[31]。炎症反应是导致冠状动脉粥样硬化病情进展以及斑块破裂的重要机制[32]。同时,在严重病毒感染的状态下,冠状动脉血管内皮功能受损,可能会导致血管床收缩,从而促进急性冠状动脉综合征的发生[33]。
2.4 氧气供需失衡导致心肌损伤
严重的病毒感染可导致机体代谢需求增加,而心功能储备不能满足其需求。同时,肺炎导致肺通气、肺换气效率下降,血液中氧含量下降,进一步加重了心脏的负担,引起心肌损伤[34]。
2.5 炎症因子风暴导致心肌损伤
新冠病毒入侵人体后,病毒微粒在呼吸道黏膜大量增殖扩散的同时,也侵犯了全身其他器官的细胞,可能引起炎症因子风暴,从而导致免疫损伤[35]。据报道,相当大比例的新冠肺炎死亡患者出现了转氨酶、乳酸脱氢酶、肌酸激酶、D-二聚体、血清铁蛋白、白细胞介素-6水平升高和凝血酶原时间延长,总体说明促炎介质水平显著升高。相关研究[5, 36]强调, Th1细胞与Th2细胞反应失衡导致的细胞因子风暴可能是导致心肌损伤的原因之一。病毒感染释放的炎症因子可能促进冠状动脉血流量、心肌氧供、冠状动脉斑块稳定性下降以及微血栓形成,从而促进心肌损伤。
3. 新冠肺炎患者心血管系统受损表现
多项临床研究[37-38]结果表明,相当部分的新冠肺炎患者出现了心血管系统受累表现,包括心肌损伤、心律失常、心肌炎、心力衰竭等。
3.1 心肌损伤
新冠病毒感染可引起患者心肌损伤,表现为心肌生物标志物升高(目前大多数文献对于“心脏生物标志物升高”的定义为其数值超过参考上限的第99百分位数),且心肌标志物升高程度与病情严重程度以及患者病死率有相关性[5, 39-40]。研究[1, 6]报道, 19%~28%的新冠肺炎住院患者肌钙蛋白T(TnT)水平上升,标志着心肌损伤。在合并心血管基础疾病的新冠肺炎患者中,心肌生物标志物升高者占比(55%)更高[41]。在武汉市首批41例新冠肺炎患者中,5例发生新冠病毒相关性心肌损伤,其中4例被送入重症监护室(ICU)进行治疗,一定程度上表明心肌损伤可以加重病情。另一项纳入138例患者的研究[42]结果表明,在ICU接受治疗的新冠肺炎患者心肌损伤生物标志物水平明显升高。
GUO T等[6]研究显示, TnT升高的新冠肺炎患者的病死率(59.6%)显著高于TnT未升高患者的病死率(8.9%)。既存在基础心血管疾病也存在TnT水平升高的患者,其病死率最高(69.44%), 生存期最短。值得注意的是, 13.2%(16例)新冠肺炎患者并无心血管系统基础疾病,但出现了TnT水平升高现象,这更直接地证明了新冠病毒对心肌的损伤作用。
3.2 心律失常与心脏骤停
心律失常与心脏骤停也是新冠肺炎患者较为常见的心血管系统表现。WANG D等[42]研究显示,在138例新冠肺炎住院患者中, 16.7%的患者出现了心律失常,需进入ICU治疗的患者心律失常发生率(44.4%)显著高于非ICU治疗患者(6.9%)。肌钙蛋白水平升高患者发生心律失常的概率(11.52%)高于肌钙蛋白水平正常者(5.2%)[6]。新冠肺炎患者的心律失常症状可能由新冠病毒感染机体引起的代谢紊乱、缺氧或炎性应激导致。
3.3 心力衰竭
心力衰竭是新冠肺炎患者常见心血管系统并发症之一,在多项研究中被提及。一项发表于新冠肺炎疫情初期的临床研究[39]显示,191例新冠肺炎患者中有44例(23%)患者出现心力衰竭,死亡患者中出现心力衰竭者占52%(28例)。另一项研究[43]统计了21例因病情严重被收入ICU治疗的新冠肺炎患者的临床资料,其中9例(42.9%)患者出现了充血性心力衰竭的表现。
4. 对合并心血管系统并发症的新冠肺炎患者的治疗建议
治疗新冠肺炎患者的重点在于控制其肺炎进展,然而当患者出现心血管系统并发症时,还应高度关注其心血管系统状况,并采取更为积极的治疗措施。治疗新冠肺炎可考虑抗病毒治疗、免疫治疗等措施,对于病情进展快速、炎症反应过度激活的患者可给予糖皮质激素治疗,对于低氧血氧、呼吸困难的患者给予吸氧、无创或有创呼吸支持治疗,对于休克患者给予循环支持疗法,对于继发感染的患者及时给予抗生素治疗,对于合并严重肾功能损伤的患者给予连续性肾替代治疗等。对于出现心血管系统并发症的新冠肺炎患者的具体治疗建议如下。
4.1 对出现心血管系统并发症的患者进行分诊
合并心血管系统并发症(如心肌损伤)或存在心血管系统基础疾病的新冠肺炎患者具有明显更高的病死率。因此,医生有必要对此类患者进行分诊并予以优先治疗,并根据患者实际情况选用更为积极的治疗策略。治疗过程中,医护人员还应密切监测此类患者的心脏指标如心肌酶、氨基末端脑钠肽前体(NT-proBNP)等以及心电图,从而对可能出现的不良情况进行及时响应与干预。
4.2 避免药源性心肌损伤
新冠肺炎患者治疗期间的药物相关心脏损害是值得关注的一个问题。《新型冠状病毒肺炎诊疗方案(试行第八版)》中推荐的几种抗病毒药物如磷酸氯喹、阿比多尔、利巴韦林等,均有造成心血管系统不良反应(如心律失常等)的可能[44]。此外,多药合用时,药物之间可能出现相互作用,对机体产生毒害作用,如磷酸氯喹在与可致心律失常的药物合用时,有造成尖端扭转型室性心动过速的风险。因此,治疗新冠肺炎患者应当加强药学监护,保证患者用药安全[45]。
4.3 及时进行生命支持治疗
生命支持治疗是危重型患者各项治疗措施的重中之重,危重型患者应尽早进行生命支持治疗。伴有心肌损伤的患者如存在呼吸功能障碍,均推荐尽早给予呼吸支持治疗。呼吸机辅助通气可改善肺功能,降低患者劳力负荷和心脏做功。药物治疗无效的急性心力衰竭或心源性休克患者可短期(数天至数周)应用体外膜肺氧合(ECMO)进行治疗[46]。
5. 小结
综上所述,新冠病毒感染可导致部分患者出现包括心肌损伤、心律失常等在内的心血管系统损伤表现,其具体机制仍需进一步研究明确。合并心血管系统并发症的新冠肺炎患者预后明显更差,病死率升高,因此临床应高度重视此类患者,密切监测其重要体征,并采取更为积极的治疗措施。
-
表 1 年龄、受教育程度及TMMS、PSS-10和FTND描述性统计和相关性分析
项目 均数 标准差 年龄 受教育程度 FTND PSS-10 TMMS-A TMMS-C TMMS-R 年龄 49.70 10.00 1 — — — — — — 受教育程度 9.65 3.61 0.112 1 — — — — — FTND 6.03 2.43 -0.071 -0.066 1 — — — — PSS-10 18.00 7.58 -0.075 0.001 0.158* 1 — — — TMMS-A 23.60 6.44 -0.085 0.071 0.068 0.252** 1 — — TMMS-C 27.12 6.12 -0.114 -0.079 -0.050 -0.104 0.240** 1 — TMMS-R 26.48 6.28 -0.034 -0.083 -0.214** -0.184* 0.006 0.420** 1 戒烟复吸时间 3.57 1.56 0.112 0.148 -0.191* -0.209** -0.049 0.173* 0.136 FTND: 尼古丁依赖性量表; PSS-10: cohens感知压力量表; TMMS-A: 情绪关注; TMMS-C: 情绪清晰度; TMMS-R: 情绪修复。
*P < 0.05, **P < 0.01。表 2 压力感知的中介模型检验
回归方程(n=173) 拟合指标 回归系数显著性 结果变量 预测变量 R R2 F β t 戒烟复吸时间 年龄 0.233 0.054 3.236* 0.050 0.661 受教育程度 0.024 0.100 1.316 尼古丁依赖 -0.192 -2.556* 压力感知 年龄 0.182 0.033 1.932* -0.059 -0.774 受教育程度 0.023 0.015 0.200 尼古丁依赖 0.172 2.264* 戒烟复吸时间 年龄 0.293 0.086 3.948** 0.039 0.526 受教育程度 0.004 0.102 1.371 压力感知 -0.181 -2.410* 尼古丁依赖 -0.161 -2.140* *P < 0.05, **P < 0.01。 表 3 有调节的中介模型检验
回归方程(n=173) 拟合指标 回归系数显著性 结果变量 预测变量 R R2 F β t 压力感知 年龄 0.172 0.030 5.230* -0.045 -0.774 受教育程度 0.023 0.032 0.200 尼古丁依赖 0.537 2.264* 戒烟复吸时间 年龄 0.337 0.114 3.545** 0.005 0.472 受教育程度 0.002 0.042 1.310 尼古丁依赖 -0.096 -1.983* 压力感知 -0.152 -2.475* 情绪修复 -0.062 -1.350 压力感知×情绪修复 0.005 1.979* * P < 0.05, * * P < 0.01。 -
[1] CHEN J H, CHEN R R, XIANG S Y, et al. Cigarette smoking and schizophrenia: Mendelian randomisation study[J]. Br J Psychiatry, 2021, 218(2): 98-103. doi: 10.1192/bjp.2020.116
[2] BUHELT L, PISINGER C, ANDREASEN A. Smoking and stress in the general population in Denmark[J]. Tob Prev Cessation, 2021, 7(4): 1-9.
[3] PECKHAM E, ALLGAR V, CROSLAND S, et al. Investigating smoking and nicotine dependence among people with severe mental illness during the COVID-19 pandemic: analysis of linked data from a UK Closing the Gap cohort[J]. BJPsych Open, 2021, 7(3): e86. doi: 10.1192/bjo.2021.45
[4] LANE T. Emotional intelligence[J]. Ann R Coll Surg Engl, 2019, 101(1): 1. doi: 10.1308/rcsann.2018.0209
[5] MEGÍAS-ROBLES A, PEREA-BAENA J M, FERNÁNDEZ-BERROCAL P. The protective role of emotional intelligence in smoking relapse during a 12-month follow-up smoking cessation intervention[J]. PLoS One, 2020, 15(6): e0234301. doi: 10.1371/journal.pone.0234301
[6] LIMONERO J T, TOMÁS-SÁBADO J, FERNÁNDEZ-CASTRO J. Perceived emotional intelligence and its relation to tobacco and Cannabis use among university students[J]. Psicothema, 2006, 18: 95-100.
[7] 葛网平, 戴萍. 长期住院精神分裂症患者戒烟管理的跨理论模型研究[J]. 实用临床医药杂志, 2022, 26(11): 71-75. doi: 10.7619/jcmp.20214739 [8] DANG D L, ZHANG M X, LEONG K K H, et al. The predictive value of emotional intelligence for Internet gaming disorder: a 1-year longitudinal study[J]. Int J Environ Res Public Heal, 2019, 16(15): 2762. doi: 10.3390/ijerph16152762
[9] LEITE K P, MARTINS F, TREVIZOL A P, et al. A critical literature review on emotional intelligence in addiction[J]. Trends Psychiatry Psychother, 2019, 41(1): 87-93. doi: 10.1590/2237-6089-2018-0002
[10] MIZERA S, JASTRZEBSKA K, CYGANEK T, et al. The relation between emotional intelligence and Internet addiction in Katowice high school students[J]. Psychiatr Danub, 2019, 31(Suppl 3): 568-573.
[11] KUN B, DEMETROVICS Z. Emotional intelligence and addictions: a systematic review[J]. Subst Use Misuse, 2010, 45(7/8): 1131-1160.
-
期刊类型引用(1)
1. 张佳琦,刘国华,黄建安. 新型冠状病毒奥密克戎变异株的研究进展. 实用临床医药杂志. 2022(19): 143-148 .  本站查看
本站查看
其他类型引用(2)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号