CT and positron emission tomography/computed tomography using (18)F-fluorodeoxyglucose findings in 21 patients with pulmonary mucosa-associated lymphoidtissue lymphoma
-
摘要:目的
探讨肺黏膜相关淋巴组织(MALT)淋巴瘤的CT和18F-氟代脱氧葡萄糖(18F-FDG)正电子发射计算机断层显像(PET)-CT的影像学表现。
方法回顾性分析经病理结果证实的21例肺MALT淋巴瘤患者的CT及PET-CT影像学资料,并通过Logistic回归分析探讨18F-FDG亲和力与影像学表现的相关性。
结果21例患者中,共发现60个肺部病灶,其中22个实变样病灶,28个结节或肿块样病灶和10个磨玻璃样病灶。12例为单发病灶,9例为多发病灶,多发病灶患者中,双侧病灶7例,单侧病灶2例。18F-FDG PET-CT显示,60个病灶中45个为高代谢病灶,15个为低代谢病灶。Logistic回归分析发现,18F-FDG亲和力与病灶形态及病灶直径相关(P<0.01)。
结论肺MALT淋巴瘤影像学表现多样,可为结节或肿块型、肺炎型及磨玻璃型,多为亲和18F-FDG的肿瘤,且18F-FDG亲和力与肿瘤直径及形态相关。
-
关键词:
- 肺黏膜相关淋巴组织淋巴瘤 /
- CT /
- 18F-氟代脱氧葡萄糖 /
- 正电子发射计算机断层显像 /
- 相关性 /
- 亲和力 /
- 病灶
Abstract:ObjectiveTo investigate imaging manifestations of CT and positron emission tomography/computed tomography (PET)-CT using (18)F-fluorodeoxyglucose (18F-FDG) in pulmonary mucosa-associated lymphoid tissue (MALT) lymphoma.
MethodsCT and PET-CT imaging findings of 21 patients with pulmonary MALT lymphoma confirmed by pathological results were retrospectively analyzed, and the correlation between affinity of 18F-FDG and imaging findings was analyzed by Logistic regression analysis.
ResultsA total of 60 pulmonary lesions were found in 21 patients, including 22 consolidation-like lesions, 28 nodular or mass-like lesions, and 10 ground-glass lesions. A total of 12 cases were single lesions and 9 cases were multiple lesions. Among the patients with multiple lesions, 7 cases were bilateral and 2 cases were unilateral lesions. 18F-FDG PET-CT showed that 45 of the 60 lesions were hypermetabolic lesions and 15 were hypometabolic lesions. Logistic regression analysis showed that 18F-FDG affinity was correlated with morphology and diameter of lesions (P<0.01).
ConclusionThe imaging manifestations of pulmonary MALT lymphoma are diverse, including nodular or mass type, pneumonic type and ground glass type. Most of them have 18F-FDG affinity that is related to tumor diameter and morphology.
-
肺原发性非霍奇金淋巴瘤是一种非常罕见的疾病,仅占所有恶性淋巴瘤的0.4%, 其中最常见的亚型是黏膜相关淋巴组织(MALT)淋巴瘤[1-2]。MALT淋巴瘤也称为结外边缘区B细胞淋巴瘤,起源于B细胞的MALT边缘区,可能来自MALT, 除了胃肠道以外[3], 肺是最常见的受累器官之一[4]。肺MALT淋巴瘤是一种源于支气管相关淋巴组织的疾病,被认为与长期暴露于多种抗原刺激有关,如吸烟、炎症或自身免疫性疾病,导致负责病原体清除的黏膜B淋巴细胞不受控制地增殖,即连续复制导致DNA错误,其中一些具有促进复制和抗凋亡的作用,从而导致肿瘤细胞的增殖。肺MALT淋巴瘤罕见,因此目前临床对该病的误诊率较高[5]。本研究回顾性分析21例经病理证实的肺MALT淋巴瘤患者的CT和正电子发射计算机断层显像(PET)-CT的影像学表现,以期提高对该病的认识。
1. 资料与方法
1.1 一般资料
选取2016年1月—2020年12月江苏省人民医院经病理结果证实的21例肺MALT淋巴瘤患者为研究对象,其中手术切除3例,纤维支气管镜活检8例, CT引导下经皮肺穿刺10例。患者年龄33~78岁,平均(56.8±11.2)岁; 男12例,女9例; 临床分期为Ⅰ期11例, Ⅱ期4例, Ⅳ期6例; 病灶位置为单侧14例,双侧7例; 病灶单发12例,多发9例。所有患者治疗前均接受胸部CT平扫及18F-氟代脱氧葡萄糖(18F-PDG) PET-CT检查。21例患者一般资料比较,差异无统计学意义(P>0.05)。
1.2 扫描方法
18F-FDG PET-CT扫描: 采用德国Siemens Biograph 16HR PET-CT扫描仪对患者进行扫描。使用的显像剂为18F-FDG, 放射性化学纯度>95%, 由美国GE trace型回旋加速器生产,并通过自动合成模块自动合成。注药前,所有患者均空腹6 h以上,保证空腹血糖≤7.0 mmol/L, 静脉注射放射性同位素18F-FDG, 注射剂量为3.70~5.55 MBq/kg, 1 h后行PET-CT检查。
CT扫描条件为层厚5 mm, 准直1.5 mm, 管电流140 mA, 管电压120 kV。PET扫描范围包括颅顶至双侧腹股沟,采集6~7个窗位,每个窗位采集2 min。CT数据衰减校正后,迭代重建PET图像,层厚5 mm, 最终获得PET、CT、PET-CT融合图像的横断、矢状、冠状面。
所有扫描图像均由2位经验丰富的放射科医生进行回顾性审查。描述MALT淋巴瘤的形态学特征包括偏侧性、定位、数量、直径、是否合并支气管扩张、淋巴结是否肿大、是否有胸腔积液以及淋巴瘤细胞代谢特点等。
1.3 统计学分析
所有的统计数据均采用SPSS 22.0软件进行分析。计量资料的描述采用平均值±标准差、最小值和最大值,计数资料采用率表示。采用Logistic回归分析评估18F-FDG亲和力与其他临床、病理及CT特征的相关性, P<0.05表示与该变量独立相关。
2. 结果
2.1 CT特征
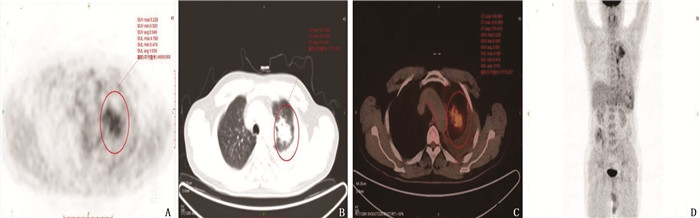
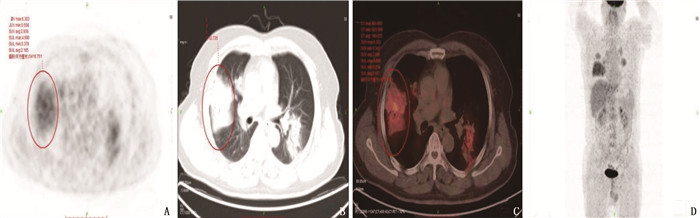
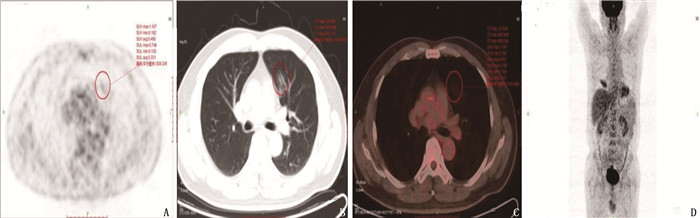
21例肺MALT淋巴瘤患者中,共发现60个肺部病灶,其中22个(36.7%)为肺炎实变型病灶(见图 1), 28个(46.7%)为肿块或结节型病灶(见图 2), 10个(16.7%)为磨玻璃型病灶(见图 3)。18个(30.0%)病灶合并空气支气管征, 17个(28.3%)病灶出现支气管扩张, 6个(10.0%)病灶有空洞, 2个(3.3%)病灶有钙化灶。其中, 12例患者病灶为单发(57.1%), 9例患者病灶为多发(42.9%)。9例多发病灶患者中, 2例病灶分布在单侧, 7例病灶分布在为双侧。4例患者伴胸腔积液(19.0%), 4例患者纵隔淋巴结肿大(19.0%)。60个病灶位置分布: 39个病灶位于右肺(65.0%), 其中18个位于右肺上叶, 9个位于右肺中叶, 12个位于右肺下叶; 21个病灶分布在左肺(35.0%), 其中14个病灶位于左肺上叶, 7个病灶位于左肺下叶。肿瘤直径为10.2~105.4 mm, 平均直径为(40.7±8.9) mm。
2.2 PET-CT特征
21例患者PET-CT扫描结果显示, 60个病灶中, 45个为亲和18F-FDG病灶(75.0%), 且为高代谢病变,其中结节或肿块型病灶23个(图 1), 实变型病灶2个(图 2), 磨玻璃样病灶20个; 病灶直径为(49.0±4.1) mm; 病灶位于右肺上叶11个,右肺中叶9个,右肺下叶10个,左肺上叶11个,左肺下叶4个; 14个病灶有空气支气管征, 6个病灶有空洞, 14个病灶伴支气管扩张。15个病灶显示为低代谢病灶(25.0%), 其中结节或肿块型病灶5个,实变型病灶8个,磨玻璃样病灶2个(图 3); 病灶直径为(15.7±1.1) mm; 病灶位于右肺上叶7个,右肺下叶2个,左肺上叶3个,左肺下叶3个; 4个病灶有空气支气管征, 3个病灶伴支气管扩张,见表 1。Logistic回归分析发现, 18F-FDG亲和力与病灶形态(P=0.002)及病灶直径相关(P<0.001)。
表 1 60个病灶的PTE-CT影像学表现(x±s)[n(%)]影像学表现 分类 PET-CT阳性(n=45) PET-CT阴性(n=15) P 病灶形态 结节或肿块型 23(51.1) 5(33.3) 0.002 实变型 2(4.4) 8(53.3) 磨玻璃样 20(44.4) 2(13.3) 病灶直径/mm 49.0±4.1 15.7±1.1 <0.001 病灶位置 右肺上叶 11(24.4) 7(46.7) 0.160 右肺中叶 9(20.0) 0 右肺下叶 10(22.2) 2(13.3) 左肺上叶 11(24.4) 3(20.0) 左肺下叶 4(8.9) 3(20.0) 空气支气管征 有 14(31.1) 4(26.7) 0.745 无 31(68.9) 11(73.3) 空洞 有 6(13.3) 0 0.136 无 39(86.7) 15(100.0) 支气管扩张 有 14(31.1) 3(20.0) 0.412 无 31(68.9) 12(80.0) 3. 讨论
肺MALT淋巴瘤是一种罕见结外低度恶性小B细胞淋巴瘤,起源于支气管相关淋巴组织[6], 是肺部非霍奇金淋巴瘤最常见的亚型[7]。肺MALT淋巴瘤好发于中老年,患者病程一般较长(2~5年),发展极为缓慢,1/3~1/2的患者无临床症状,或伴有咳嗽、咳痰、痰中带血、发热、胸痛、胸闷等一般症状,且实验室检查缺乏特异性[8]。本研究中,患者中位年龄为56岁,单病灶12例(57.1%), 多发病灶9例(42.9%), 单侧14例(66.7%), 双侧7例(33.3%), 说明肺MALT淋巴瘤可单发或多发,影像表现多样,缺乏特异性,与以往文献[9-10]结论相符。
研究[11-12]显示,肿瘤生长方式与形态相关。①支气管血管周围淋巴瘤细胞浸润和扩散主要沿着支气管血管周围淋巴窦,易导致支气管血管周围组织增厚,形成结节或肿块,表现为支气管或胸膜下区域附近的肺间质中的单个或多个界限清楚或界限不清的类圆形结节和肿块。②支气管黏膜下淋巴瘤细胞损伤支气管基底膜和上皮,在管腔内形成结节状肿块,导致管腔变形、狭窄甚至堵塞,肺实变、肺不张或阻塞性肺炎样改变,表现为界限不清的斑片状渗出性病变和(或)实性肿块[13]。③当淋巴瘤细胞浸润支气管周围间质时,所产生的病变表现为从门向外延伸的弥散性细或粗的网状或小网状结节性结构或毛玻璃样结构支气管血管束增厚和扭曲的变化,最常见的是伴随空气支气管征和支气管扩张[13], 而空洞、钙化、肺囊性病变和胸腔积液不太常见。本研究发现, 60个病灶中, 28个病灶(46.7%)为结节肿块型, 22个病灶(36.7%)为肺炎实变型, 10个病灶(16.7%)为磨玻璃型。18个病灶(30.0%)出现支气管充气征, 17个病灶(28.3%)出现支气管扩张,且通常出现在实变区,只有6个病灶(10.0%)出现空洞。21例患者中, 4例(19.0%) 患者出现胸腔积液, 4例(19.0%)例患者伴纵隔淋巴结肿大,与前期文献报道基本一致。
Logistic分析发现, PET-CT检查中, 18F-FDG亲和力与病灶形态(P=0.002)及病灶的直径相关(P<0.001)。文献[14]提出,肺MALT淋巴瘤多为亲18F-FDG病灶,病灶直径是影响亲18F-FDG亲和力的唯一因素。肺MALT淋巴瘤在CT上可显示出多种类型的肺异常,有结节、肿块型、肺炎型、毛玻璃型等多种表现类型,认为病灶形态和病灶直径将会影响18F-FDG的亲和力,可能是由于不同的形态代表病变发展的不同阶段。
本研究有一定局限性,病例数相对较少,且是回顾性研究,入组患者可能有一定偏差。但是结合病灶形态学、直径、18F-FDG代谢情况以及临床表现综合评定可明显提高其诊断率。
-
表 1 60个病灶的PTE-CT影像学表现(x±s)[n(%)]
影像学表现 分类 PET-CT阳性(n=45) PET-CT阴性(n=15) P 病灶形态 结节或肿块型 23(51.1) 5(33.3) 0.002 实变型 2(4.4) 8(53.3) 磨玻璃样 20(44.4) 2(13.3) 病灶直径/mm 49.0±4.1 15.7±1.1 <0.001 病灶位置 右肺上叶 11(24.4) 7(46.7) 0.160 右肺中叶 9(20.0) 0 右肺下叶 10(22.2) 2(13.3) 左肺上叶 11(24.4) 3(20.0) 左肺下叶 4(8.9) 3(20.0) 空气支气管征 有 14(31.1) 4(26.7) 0.745 无 31(68.9) 11(73.3) 空洞 有 6(13.3) 0 0.136 无 39(86.7) 15(100.0) 支气管扩张 有 14(31.1) 3(20.0) 0.412 无 31(68.9) 12(80.0) -
[1] JHAVERI K, DIMAS D J, VAKIL A, et al. Primary pulmonary involvement in mucosa-associated lymphoid tissue lymphoma[J]. Cureus, 2019, 11(7): e5110.
[2] 高珂梦, 丁重阳, 孙晋, 等. 原发性肺黏膜相关淋巴组织淋巴瘤的18F-FDG PET/CT影像学表现[J]. 国际放射医学核医学杂志, 2019, 43(2): 140-144. doi: 10.3760/cma.j.issn.1673-4114.2019.02.008 [3] 徐芬. 以胃肠道症状为首发表现的非霍奇金淋巴瘤3例误诊分析[J]. 实用临床医药杂志, 2008, 12(13): 86-87. doi: 10.3969/j.issn.1672-2353.2008.12.044 [4] HARRIS N L, JAFFE E S, DIEBOLD J, et al. The World Health Organization classification of hematological malignancies report of the Clinical Advisory Committee Meeting, Airlie House, Virginia, November 1997[J]. Mod Pathol, 2000, 13(2): 193-207. doi: 10.1038/modpathol.3880035
[5] MIYAZAKI S, HACHIYA K, NARA Y, et al. Pulmonary mucosa-associated lymphoid tissue lymphoma mimicking lung cancer[J]. Clin Case Rep, 2019, 7(8): 1615-1616. doi: 10.1002/ccr3.2276
[6] NAKAMURA D, KOBAYASHI N, MIYAZAWA M, et al. Pulmonary metastasis with coexisting pulmonary mucosa-associated lymphoid tissue (MALT) lymphoma 20 years after endometrioid adenocarcinoma surgery: a case report[J]. Thorac Cancer, 2021, 12(3): 402-406. doi: 10.1111/1759-7714.13776
[7] 陈来荣, 俞同福. 肺黏膜相关淋巴组织淋巴瘤的CT表现[J]. 医学影像学杂志, 2016, 26(1): 130-132. https://www.cnki.com.cn/Article/CJFDTOTAL-XYXZ201601044.htm [8] WANG L, YE G, LIU Z, et al. Clinical characteristics, diagnosis, treatment, and prognostic factors of pulmonary mucosa-associated lymphoid tissue-derived lymphoma[J]. Cancer Med, 2019, 8(18): 7660-7668. doi: 10.1002/cam4.2683
[9] BI W L, ZHAO S, WU C C, et al. Pulmonary mucosa-associated lymphoid tissue lymphoma: CT findings and pathological basis[J]. J Surg Oncol, 2021, 123(5): 1336-1344. doi: 10.1002/jso.26403
[10] 陈利军, 韩月东, 张明. 肺黏膜相关淋巴组织淋巴瘤的CT表现[J]. 肿瘤影像学, 2021, 30(3): 191-194. https://www.cnki.com.cn/Article/CJFDTOTAL-YXYX202103009.htm [11] YAMASAKI M, TAKENAKA T, MATSUMOTO N, et al. Primary pulmonary collision tumor comprising squamous cell carcinoma and mucosa-associated lymphoid tissue lymphoma[J]. Lung Cancer Amsterdam Neth, 2019, 129: 107-109. doi: 10.1016/j.lungcan.2018.12.019
[12] 朱小云, 单飞, 邢伟, 等. 肺黏膜相关淋巴组织淋巴瘤的CT表现[J]. 临床放射学杂志, 2014, 33(3): 456-459. https://www.cnki.com.cn/Article/CJFDTOTAL-LCFS201403041.htm [13] CHEN Y N, CHEN A P, JIANG H L, et al. HRCT in primary pulmonary lymphoma: can CT imaging phenotypes differentiate histological subtypes between mucosa-associated lymphoid tissue (MALT) lymphoma and non-MALT lymphoma[J]. J Thorac Dis, 2018, 10(11): 6040-6049. doi: 10.21037/jtd.2018.10.63
[14] ZHAO J, WANG H Q. Correlation between 18F-FDG PET/CT semiquantitative parameters and Ki-67 expression in pulmonary mucosa-associated lymphoid tissue lymphoma[J]. J Med Imaging Radiat Oncol, 2021, 65(2): 188-194. doi: 10.1111/1754-9485.13146
-
期刊类型引用(4)
1. 郏振功,訾刚,刘林,胡永全. 基线~(18)F-FDG PET/CT代谢参数对侵袭性非霍奇金淋巴瘤的治疗反应和预后的作用. 蚌埠医学院学报. 2024(07): 905-908+912 .  百度学术
百度学术
2. 姜专基,刘鸿雁,尚建军,魏昌晟,魏嘉阳,梁艳. ~(99m)Tc-PHY SPET-CT断层显像联合亚甲蓝在cN+乳腺癌新辅助化疗后ARM操作中的应用价值. 甘肃医药. 2024(10): 923-926+946 .  百度学术
百度学术
3. 朱晓琴,张明. 肺黏膜相关淋巴组织淋巴瘤的影像特征分析. 临床肺科杂志. 2024(12): 1871-1875 .  百度学术
百度学术
4. 李杰,时贻林,李志磊. 氟代脱氧葡萄糖正电子发射断层扫描CT全身显像对喉癌病灶或淋巴结转移诊断效能的影响. 实用医学影像杂志. 2023(02): 113-116 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
