Effect of EZH2 knockout on podocyte injury and JAK2/STAT3 signaling pathway in mice with focal segmental glomerulosclerosis
-
摘要:目的
探讨EZH2基因敲除对局灶节段性肾小球硬化(FSGS)模型小鼠肾脏足细胞损伤和JAK2/STAT3信号通路的影响。
方法将60只Cas9小鼠随机分为EZH2敲除组和EZH2未敲除组,每组30只。EZH2敲除组小鼠肾静脉注射重组腺病毒(AAV9-sgRNA-EZH2),EZH2未敲除组小鼠肾静脉注射磷酸盐缓冲液(PBS),且2组小鼠均单次尾静脉注射阿霉素,分别建立EZH2敲除FSGS模型和EZH2未敲除FSGS模型。采用苏木素-伊红(HE)染色法观察2组小鼠肾组织病理变化;采用双重免疫荧光染色法观察2组小鼠足细胞nephrin、podocin表达情况;采用TUNEL法检测2组小鼠足细胞凋亡指数;采用免疫印迹(Western blot)法检测2组小鼠肾组织JAK2、STAT3蛋白表达水平。
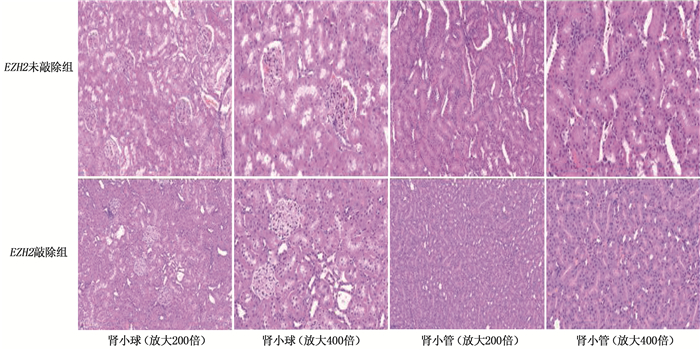
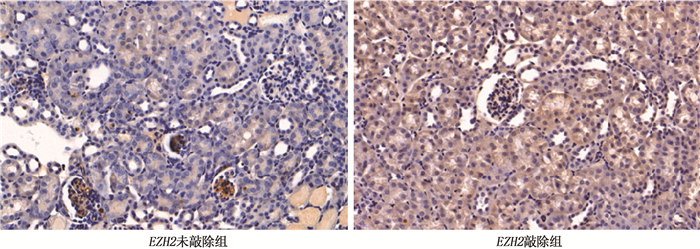
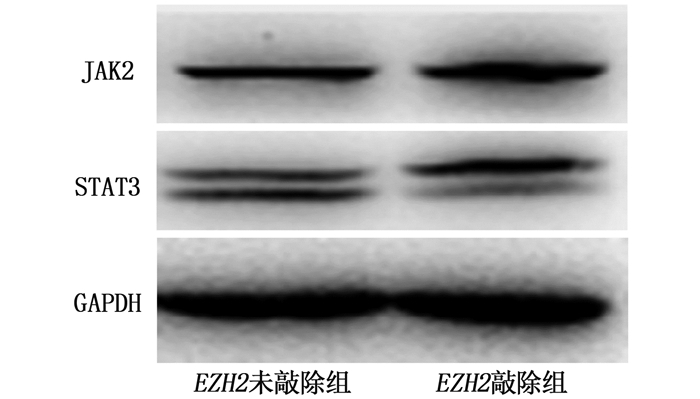
结果与EZH2未敲除组FSGS小鼠相比,EZH2敲除组FSGS小鼠肾小球病变更严重,足突广泛融合,肾小球基底膜明显增厚,系膜基质增多,毛细血管闭塞。与EZH2未敲除组FSGS小鼠相比,EZH2敲除组FSGS小鼠足细胞nephrin、podocin表达减少,差异有统计学意义(P < 0.01)。EZH2敲除组足细胞凋亡指数为(40.94±2.13)%,高于EZH2未敲除组的(21.23±3.30)%,差异有统计学意义(P < 0.01)。EZH2敲除组FSGS小鼠JAK2、STAT3蛋白表达水平依次为(2.67±0.41)、(2.37±0.53),分别高于EZH2未敲除组的(1.72±0.31)、(1.70±0.48),差异有统计学意义(P < 0.01)。
结论EZH2基因敲除可能参与JAK2/STAT3信号通路的激活,并加重FSGS小鼠肾脏足细胞损伤。
-
关键词:
- EZH2基因 /
- 局灶节段性肾小球硬化 /
- JAK2/STAT3信号通路 /
- 足细胞 /
- 基因敲除
Abstract:ObjectiveTo explore effect of EZH2 knockout on podocyte injury and JAK2/STAT3 signaling pathway in mice model with focal segmental glomerulosclerosis(FSGS).
MethodsSixty Cas9 mice were randomly divided into EZH2 knockout group(n=30) and the EZH2 non-knockout group (n=30). Mice in EZH2 knockout group were intravenously injected with recombinant adenovirus (AAV9-sgRNA-EZH2), those in the EZH2 non-knockout group were intravenously injected with phosphate buffered solution (PBS). Mice in the two groups were injected with doxorubicin once through tail vein to establish EZH2 knockout FSGS model and EZH2 non-knockout FSGS model, respectively. The renal tissue pathological changes were observed by hematoxylin and eosin (HE) staining. The nephrin and podocin expressions were observed by double immunofluorescence. Podocyte apoptosis index was detected by TUNEL. The JAK2 and STAT3 protein expressions were detected by western blot method.
ResultsCompared with mice in the EZH2 non-knockout group, the mice had more serious glomerular pathological changes, widely fused foot processes, significantly thickened glomerular basement membrane, increased mesangial matrix and blocked capillaries. Compared with FSGS mice in the EZH2 non-knockout group, the expressions of nephrin and podocin in podocytes of FSGS mice in the EZH2 knockout group were decreased (P < 0.01). The apoptosis index of podocytic cells in the EZH2 knockout group was (40.94±2.13)%, which was higher than (21.23±3.30)% in the EZH2 non-knockout group (P < 0.01). The protein expression levels of JAK2 and STAT3 in the EZH2 knockout group were (2.67±0.41) and (2.37±0.53) respectively, which were higher than (1.72±0.31) and (1.70±0.48) in the EZH2 non-knockout group (P < 0.01).
ConclusionEZH2 gene knockout may be involved in the activation of JAK2/STAT3 signaling pathway and aggravate renal podocyte injury in FSGS mice.
-
急性白血病(AL)是儿童最常见的血液肿瘤疾病,随着对儿童AL认知的不断加深及化疗方案的不断改善,儿童AL预后极大改善[1-2]。AL具有起病急、化疗强度高等特点,儿童AL死亡率仍很高。本研究总结2015年1月—2019年12月徐州医科大学附属医院收治的53例在院死亡AL患儿的临床资料,探讨AL患儿死亡危险因素,现报告如下。
1. 资料与方法
1.1 一般资料
回顾性分析2015年1月—2019年12月本院151例AL患儿的临床资料,其中死亡53例。所有患儿均经白血病骨髓细胞形态学、免疫分型等明确诊断,符合AL诊断标准[3]。依据FAB分型标准将患儿分为急性淋巴细胞白血病(ALL)和急性髓系白血病(AML)。依据死亡时间将患儿分为早期死亡组(确诊后30 d内死亡)和非早期死亡组。早期死亡组23例,男15例,女8例,年龄(4.03±4.10)岁, ALL 14例, AML 9例; 非早期死亡组30例,男23例,女7例,年龄(6.37±4.24)岁, ALL 24例, AML 6例。2组患儿性别、年龄及FAB分型比较,差异无统计学意义(P>0.05)。排除院外死亡、与本院化疗方案不同而致死亡等患儿。所有死亡病例均经科内讨论。本研究经徐州医科大学附属医院医学伦理委员会审查批准。
1.2 实验室检查
早期死亡组初诊外周血白细胞计数(WBC)为(1.7~775.5)×109 /L, 其中WBC < 100.0×109/L者9例, WBC≥100.0×109/L者14例; 血清乳酸脱氢酶(LDH)水平为220.0~14 831.0 U/L, 其中21例患儿高于正常水平; 血清铁蛋白(SF)水平为106.8~17 388.0 U/L, 其中14例患儿高于正常水平。非早期死亡组初诊外周血WBC为(0.7~507.9)×109/L, 其中WBC < 100.0×109/L者24例, ≥100.0×109/L者6例; 血清LDH水平为218.0~12 470.0 U/L, 其中20例患儿高于正常水平; 血清SF水平为100.8~8 900.0 U/L, 其中21例患儿高于正常水平。
1.3 治疗方案
ALL患儿按照CCCG-ALL-2015方案化疗, AML患儿按CCLG-2015-AML方案化疗。目前, CCCG-ALL-2015和CCLG-2015-AML正处在多中心研究总结阶段,还未形成指南或诊疗建议。化疗过程中给予伏立康唑或泊沙康唑预防真菌感染,出现粒细胞缺乏症伴发热时,在病原菌未明确前积极给予第4代头孢或碳青霉烯类抗感染治疗,病原菌明确后依据药敏实验用药。
1.4 统计学处理
采用SPSS 22.0软件进行数据分析,计量资料以(x±s)表示,比较采用t检验; 计数资料以[n(%)]表示,比较采用χ2检验。患儿死亡因素进行Logistic回归分析, P < 0.05为差异有统计学意义。
2. 结果
2.1 2组患儿死亡情况比较
151例AL患儿中死亡53例,其中早期死亡组死亡23例(43.40%), 包括ALL 14例(60.87%)和AML 9例(39.13%); 非早期死亡组死亡30例(56.60%), 包括ALL 24例(80.00%)和AML 6例(20.00%)。2组患儿死亡情况比较,差异无统计学意义(χ2=2.35, P=0.13)。非早期死亡组中难治性AL 2例(6.67%), 完全缓解AL 4例(13.33%), 复发AL 24例(80.00%)。
2.2 2组死亡原因分析
早期死亡组以多器官功能障碍综合征(MODS)和感染为主要死亡原因; 非早期死亡组以感染和出血为主要死亡原因, 2组死亡原因差异有统计学意义(P < 0.05), 见表 1。15例因出血死亡的AL患儿中, 1例为消化道出血,其他均为颅内出血。
表 1 2组患儿死亡原因比较[n(%)]死亡原因 早期死亡组
(n=23)非早期死亡组
(n=30)感染 6(26.09) 16(53.33)* 感染伴出血 2(8.70) 2(6.67) 出血 4(17.39) 7(23.33) 多器官功能障碍综合征 10(43.48) 3(16.67)* 弥散性血管内凝血 1(4.35) 2(6.67) 与早期死亡组比较, *P < 0.05。 2.3 感染死亡病因分布
细菌性败血症是2组患儿感染死亡的主要原因,但2组差异无统计学意义(P>0.05)。10例因细菌性败血症死亡的AL患儿中,早期死亡组3例,其中1例为金黄色葡萄球菌, 2例为大肠埃希菌; 非早期死亡组7例,其中4例大肠埃希菌, 1例铜绿假单胞菌和嗜麦芽寡养单胞菌, 1例铜绿假单胞菌, 1例为肺炎克雷伯菌。见表 2。
表 2 AL死亡患儿感染性疾病分布感染疾病 早期死亡组(n=8) 非早期死亡(n=18) 细菌性败血症 3(37.50) 7(38.89) 真菌感染 2(25.00) 4(22.22) 肺炎 1(12.50) 3(16.67) 肠炎 1(12.50) 2(11.11) 不详 1(12.50) 2(11.11) 2.4 死亡相关因素分析
对性别、外周WBC、血清LDH、血清SF、年龄分组及FAB分型等可能影响患儿死亡单位因素进行量化,采用χ2检验对上述指标进行单因素方差分析,将具有统计学意义的指标如年龄、外周WBC、血清LDH作为自变量,生存与否作为因变量,进行Logistic回归分析,结果显示,年龄 < 1岁、外周WBC≥100.90×109/L、血清LDH≥240.0 U/L为儿童AL死亡的高危因素(P < 0.05), 见表 3。
表 3 儿童AL死亡病例可能危险因素Logistic回归分析结果变量 B SE Wald Exp(B) P 年龄 -0.207 0.096 4.588 0.813 0.032 外周WBC -1.557 0.584 7.106 0.211 0.005 血清LDH 0.001 0.001 5.263 1.000 0.022 B: 回归系统; SE: 系数的标准误; Wald: 卡方值; Exp(B): 相对危险度; WBC: 白细胞计数; LDH: 乳酸脱氢酶。 3. 讨论
许凤玲等[4]报道,早期死亡为儿童AL死亡主要时期,而本研究中两组死亡情况比较差异无统计学意义(P>0.05), 与文献报道不一致。分析其原因可能为: ①近年来人们更加注重支持治疗,在初始诱导治疗阶段积极防治MODS、感染及出血等; ②非早期死亡组复发死亡病例24例(80%), 占大多数,其中复发后放弃和化疗缓解后因经济原因不能行骨髓移植致再次复发死亡达到54.17%(13/24)。
曾星[5]报道感染和出血是导致AL患儿死亡的2个主要因素,与本研究非早期死亡组死亡原因一致,而本研究早期死亡组MODS导致的死亡率高于非早期死亡组,差异有统计学意义(P < 0.05), 是导致早期死亡的主要原因。早期死亡组的23例患儿中, WBC≥100.0×109/L者共14例, 9例在治疗初期发生了MODS, 考虑与高白细胞淤滞症有关。高WBC白血病具有发病急、病情进展迅速等特点,早期易并发肾功能衰竭、高钾血症、肺出血而危及生命,病死率高,是导致AL死亡的高危因素[6]。对于高WBC白血病患儿,早期大剂量水化、防治高尿酸血症、维持酸碱平衡、纠正电解质紊乱、发生肾衰竭时及时行血液透析治疗等可以降低AL患儿早期死亡率[7]。
感染是造成AL患儿死亡的主要原因[8]。本研究结果显示,细菌性败血症是2组患儿感染死亡的主要原因,但组间差异无统计学意义(P>0.05), 与文献[9]报道相一致。分析10例细菌性败血症致死患儿的病原菌发现,革兰氏阴性菌9例,革兰氏阳性菌1例,以革兰氏阴性菌为主,且主要为大肠埃希菌感染,与闫晨华等[10]报道一致。NEWELL L F等[11]研究显示,近年来侵袭性真菌感染死亡率呈上升趋势,与本研究结果不一致,分析原因可能与化疗过程中应用伏立康唑或泊沙康唑预防性抗真菌治疗等有关。
浙江省登记了2000—2009年AL发病与死亡情况并分析指出, 1岁以下是AL死亡高峰年龄段,与本研究结果相一致[12]。婴儿白血病为特殊白血病类型,具有年龄小、抵抗力差、肿瘤负荷重、初诊时疾病进展快、易复发、死亡率高等特点,文献[13]报道其5年无事件生存率(EFS)为23%~51%, 明显低于其他ALL患儿5年EFS的85%。AL患儿因肿瘤细胞分泌LDH及肿瘤细胞坏死时LDH释放入血等因素,导致外周血中LDH升高[14]。LDH水平越高,肿瘤负荷越重,病情进展越快,复发率及死亡率就越高[15], 回归分析显示血清LDH是儿童AL死亡的危险因素。杨希茹等[16]研究显示,血清LDH可作为疾病进展、疗效评价及预后评估的重要参考指标。
综上所述,本研究中儿童AL早期死亡以MODS和感染为主,而非早期死亡以感染和出血为主。细菌性败血症为感染死亡的主要原因,且以革兰氏阴性菌感染为主。婴儿白血病、高WBC及血清高LDH水平是AL患儿死亡的高危因素。
-
表 1 2组FSGS小鼠生化指标水平比较(x±s)
指标 EZH2未敲除组(n=30) EZH2敲除组(n=30) 24 h尿蛋白定量/mg 241.87±31.21 386.65±42.30** BUN/(mmol/L) 13.08±3.08 19.54±3.22** Cr/(μmol/L) 73.50±8.96 96.48±9.32** ALT/(U/L) 41.10±3.91 42.59±7.07 AST/(U/L) 38.35±7.30 40.84±5.41 BUN: 尿素氮; Cr: 肌酐; ALT: 丙氨酸氨基转移酶; AST: 天门冬氨酸氨基转移酶。与EZH2未敲除组比较, **P < 0.01。 表 2 2组FSGS小鼠足细胞JAK2、STAT3蛋白表达水平比较(x±s)
指标 EZH2未敲除组(n=30) EZH2敲除组(n=30) JAK2蛋白 1.72±0.31 2.67±0.41** STAT3蛋白 1.70±0.48 2.37±0.53** 与EZH2未敲除组比较, **P < 0.01。 -
[1] HO J, NG K H, ROSEN S, et al. Podocyte-specific loss of functional microRNAs leads to rapid glomerular and tubular injury[J]. J Am Soc Nephrol, 2008, 19(11): 2069-2075.
[2] 王惠, 何方方, 张春. 足细胞损伤机制研究进展[J]. 中国中西医结合肾病杂志, 2008, 9(11): 1018-1021. doi: 10.3969/j.issn.1009-587X.2008.11.030 [3] LIEBISCH M, WOLF G. AGE-induced suppression of EZH2 mediates injury of podocytes by reducing H3K27me3[J]. Am J Nephrol, 2020, 51(9): 676-692. doi: 10.1159/000510140
[4] SUN G D, CUI W P, GUO Q Y, et al. Histone lysine methylation in diabetic nephropathy[J]. J Diabetes Res, 2014, 2014: 654148.
[5] PACE J, PALADUGU P, DAS B, et al. Targeting STAT3 signaling in kidney disease[J]. Am J Physiol Renal Physiol, 2019, 316(6): F1151-F1161. doi: 10.1152/ajprenal.00034.2019
[6] 邹杰锋, 许云鹏, 张燕子, 等. JAK2/STAT3信号通路在局灶节段性肾小球硬化足细胞损伤中的作用及机制[J]. 中华临床医师杂志: 电子版, 2021, 15(9): 683-690. doi: 10.3877/cma.j.issn.1674-0785.2021.09.008 [7] YANG J W, DETTMAR A K, KRONBICHLER A, et al. Recent advances of animal model of focal segmental glomerulosclerosis[J]. Clin Exp Nephrol, 2018, 22(4): 752-763. doi: 10.1007/s10157-018-1552-8
[8] LIU X, CAO W, QI J, et al. Leonurine ameliorates adriamycin-induced podocyte injury via suppression of oxidative stress[J]. Free Radic Res, 2018, 52(9): 952-960.
[9] 林乔轩, 马屹茕, 丁国华. 表观遗传学与糖尿病肾脏病[J]. 中华肾脏病杂志, 2020, 36(1): 58-62. doi: 10.3760/cma.j.issn.1001-7097.2020.01.013 [10] HONG W, ZHANG G, LU H, et al. Epithelial and interstitial Notch1 activity contributes to the myofibroblastic phenotype and fibrosis[J]. Cell Commun Signal, 2019, 17(1): 145. doi: 10.1186/s12964-019-0455-y
[11] MAJUMDER S, THIEME K, BATCHU S N, et al. Shifts in podocyte histone H3K27me3 regulate mouse and human glomerular disease[J]. J Clin Invest, 2018, 128(1): 483-499.
[12] SIDDIQI F S, MAJUMDER S, THAI K, et al. The histone methyltransferase enzyme enhancer of zeste homolog 2 protects against podocyte oxidative stress and renal injury in diabetes[J]. J Am Soc Nephrol, 2016, 27(7): 2021-2034.
[13] ZHANG L, WANG Y, MA J, et al. Exogenous MSCs ameliorate hypoxia/reoxygenation injury in renal tubular epithelial cells through JAK/STAT signaling pathway-mediated regulation of HMGB1[J]. Am J Transl Res, 2017, 9(5): 2412-2420.
[14] 曹宇, 王保兴. JAK/STAT通路在肾脏疾病发病中的作用[J]. 中华临床医师杂志: 电子版, 2017, 11(1): 114-118. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLYD201701024.htm [15] 袁树珍, 隋晓露, 顾凤娟, 等. 组蛋白H3K27me3介导JAK2/STAT3信号通路对足细胞损伤的调控机制[J]. 医学理论与实践, 2021, 34(17): 2929-2933, 2945. https://www.cnki.com.cn/Article/CJFDTOTAL-YXLL202117001.htm -
期刊类型引用(4)
1. 郝玉青,孙宇,王巧改. 血清同型半胱氨酸、乳酸脱氢酶、白细胞介素-17水平在急性白血病中的变化及意义. 实用临床医药杂志. 2024(15): 115-119 .  本站查看
本站查看
2. 世淑兰,邱丽娟,奎莉越,苏敏,周百灵,李荣杰,孙建明. IL-6、IL-10、hs-CRP及PCT在儿童急性淋巴细胞白血病合并感染中的诊断价值. 昆明医科大学学报. 2023(01): 104-108 .  百度学术
百度学术
3. 刘炎炎. 酪氨酸激酶抑制剂治疗慢性粒细胞白血病的疗效分析. 山东医学高等专科学校学报. 2023(01): 3-5 .  百度学术
百度学术
4. 韦楠,江傲霜,马典庆,汪俭,屈丽君,陈天平. 52例儿童急性淋巴细胞白血病诱导期合并败血症临床分析. 医学研究杂志. 2022(04): 50-53 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载:


 苏公网安备 32100302010246号
苏公网安备 32100302010246号
