Analysis of differentially expressed genes and drug targets based on preoperative and postoperative muscle tissue of obese patients with Roux-en-Y gastric bypass
-
摘要:目的
分析Roux-en-Y胃旁路术(RYGB)对肥胖症患者肌肉组织基因表达的影响, 探讨肥胖症的潜在治疗靶点。
方法筛选GEO数据库,下载GSE161643数据集,获得RYGB术后肥胖症患者肌肉组织的差异表达基因,进行富集分析和免疫细胞浸润分析,构建靶点-化合物相互作用网络,筛选出关键靶点,并利用CMap数据库寻找可治疗肥胖症的潜在候选药物。
结果本研究共筛选出RYGB术后肌肉组织差异表达基因74个,其中上调基因30个、下调基因44个。基因集富集分析结果提示,GSE161643数据集富集于mRNA加工、RNA剪接、mRNA加工的调控、RNA剪接的调控等8个GO功能。京都基因与基因组百科全书(KEGG)富集分析显示,GSE161643数据集富集于单纯疱疹病毒1型感染通路。RYGB术后,肌肉组织样本的基质成分评分、免疫成分评分与RYGB术前比较,差异均无统计学意义(P>0.05)。靶点-化合物相互作用网络共筛选出10个关键靶点,分别为UBC、CDK1、ERBB2、CDK2、CHEK2、CDC25A、ERBB3、SHC1、CHEK1和BTRC。CMap数据库共筛选出共同作用于UBC、CDK1、ERBB2的小分子化合物9个,分别为氯吡格雷、BNTX、香豆素、左氧氟沙星、SID-26681509、依折麦布、异丁香酚、渥曼青霉素和PSB-06126。
结论与RYGB术前相比,肥胖症患者RYGB术后的肌肉组织基因表达存在显著差异,这些差异可能成为治疗肥胖症的潜在药物靶点。
Abstract:ObjectiveTo analyze effect of expression of muscle tissue of obese patients with Roux-en-Y gastric bypass(RYGB), and to explore potential therapeutic targets for obesity.
MethodsThe dataset GSE16164 was downloaded from the Gene Expression Omnibus (GEO) database, thereby obtaining differentially expressed genes in muscle tissue of obese patients after RYGB. Gene ontology (GO) and Kyoto encyclopedia of genes and genomes (KEGG) were performed to analyze biological functions and pathways. Enrichment analysis and immune cell infiltration analysis were performed to construct target-compound interaction network, key targets were screened out, and potential drug candidates for obesity treatment were found out by using CMap database.
ResultsThere were 74 differentially expressed genes screened in the dataset GSE16164, including 30 up-regulated genes and 44 down-regulated genes. The gene enrichment analysis showed that dataset GSE16164 was mainly involved in 8 gene ontology functions, such as mRNA processing, RNA splicing, regulation of mRNA processing, regulation of RNA splicing, and so forth. KEGG pathway enrichment suggestedthat the dataset GSE161643 was enriched in pathway of herpes simplex virus 1 infection. There were no significant differences in the matrix component score and immune component score of muscle tissue samples after RYGB operation compared with that before RYGB (P>0.05). A total of 10 key targets were screened by target-compound interaction network, including UBC, CDK1, ERBB2, CDK2, CHEK2, CDC25A, ERBB3, SHC1, CHEK1 and BTRC. A total of 9 small molecular compounds targeted on UBC, CDK1, and ERBB2 were screened out in CMap database, which were clopidogrel, BNTX, cymarin, levofloxacin, SID-26681509, ezetimibe, isoeugenol, wortmannin, and PSB-06126.
ConclusionThere are significant differences in gene expressions of skeletal muscle tissue of obese patients with RYGB postoperatively compared with before RYGB operation. These differences maybe serve as potential pharmacological targets for the therapeutic agents of obesity.
-
Keywords:
- obesity /
- Roux-en-Y gastric bypass /
- muscle tissue /
- differentially expressed genes /
- bioinformatics /
- drug targets
-
肥胖症是一种代谢疾病,可导致患者出现严重的健康问题,其已逐渐成为全球范围内公共卫生领域的研究焦点[1-2]。减重代谢外科手术在欧美国家已被广泛应用于肥胖及相关并发症的治疗中,但其在中国的应用仍处于发展阶段[3]。目前,全腹腔镜胃旁路术(TLGBP)被认为是治疗伴2型糖尿病的肥胖患者的标准术式[4-5]。相关研究[6-7]显示, Roux-en-Y胃旁路术(RYGB)不仅可减轻患者体质量,而且可改善其代谢紊乱。另有研究[8]显示,人体的主要代谢场所之一是骨骼肌,其代谢受损与肥胖症诱发的胰岛素抵抗等代谢异常关系密切。本研究探讨RYGB对肥胖症患者肌肉组织基因表达的影响,分析差异表达基因及其生物学功能,并进行药物靶点预测,以期探寻肥胖症的潜在治疗药物。
1. 资料与方法
1.1 RYGB相关基因芯片数据来源
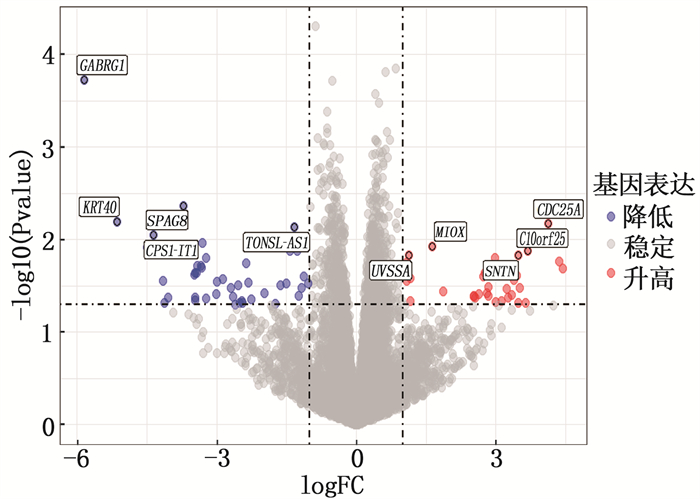
基因芯片数据来源于GEO数据库(https://www.ncbi.nlm.nih.gov/geo/), 检索策略为: Roux-en-Y[All Fields] AND “Homo sapiens”[porgn]。纳入RYGB术前和术后肌肉组织样本[样本总量>10例,术前和术后均有体质量指数(BMI)信息]的RNA表达数据集,并排除样本接受体外培养等处理的数据集。经筛选, GSE161643数据集符合研究标准,其包含RYGB术前和术后患者肌肉组织样本、表达数据和实验平台等信息。通过R软件和GEO query、limma等数据包筛选差异表达基因,以P < 0.05且logFC>1或logFC <-1作为筛选条件。
1.2 基因集富集分析
以“msigdb.v7.4.entrez.gmt”为预设基因集,对纳入数据集进行分析,计算标准化富集评分(NES)后降序排列,根据基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析结果取校正P < 0.05且q < 0.05的基因集。
1.3 免疫细胞浸润分析
利用CIBERSORT算法进行免疫细胞浸润分析,通过计算获得标准化基因表达数据,分析免疫细胞的比例。评估并比较每个样本的免疫成分评分和基质成分评分,评分越高表示对应组分在微环境中的比例越高。
1.4 靶点-化合物相互作用分析
利用STITCH数据库(http://stitch.embl.de/)构建靶点-化合物相互作用网络,寻找靶点和化合物之间的相互作用关系,然后下载相互作用的信息文件,并通过Cytoscape软件(版本号3.8.1)打开,利用“Network Analyzer”插件分析药物作用的关键靶点,筛选degree大于3且排名前10位的蛋白作为关键靶点。
1.5 关联性图谱(CMap)分析
CMap(https://clue.io/query)是活性化合物或药物相关基因表达谱数据库,能够利用生物信息学工具分析和挖掘药物、基因和疾病之间的联系。通过touchstone(https://clue.io/touchstone)将差异表达基因与化合物的参考表达谱进行比较,得到与肥胖相关的小分子化合物或药物,然后通过Venn图筛选出共同作用于肥胖的候选药物。
1.6 统计学分析
采用limma数据包中的Student′s t检验方法筛选RYGB术前和术后肌肉组织的差异表达基因,筛选标准为|logFC|>1且P < 0.05。免疫差异采用Student′s t检验比较。所有数据使用R软件(版本4.0.2)进行统计分析, P < 0.05为差异有统计学意义。GO通路和KEGG分析选择差异具有统计学意义(P < 0.05)的信号转导通路。
2. 结果
2.1 RYGB手术对肥胖症患者肌肉组织基因表达的影响
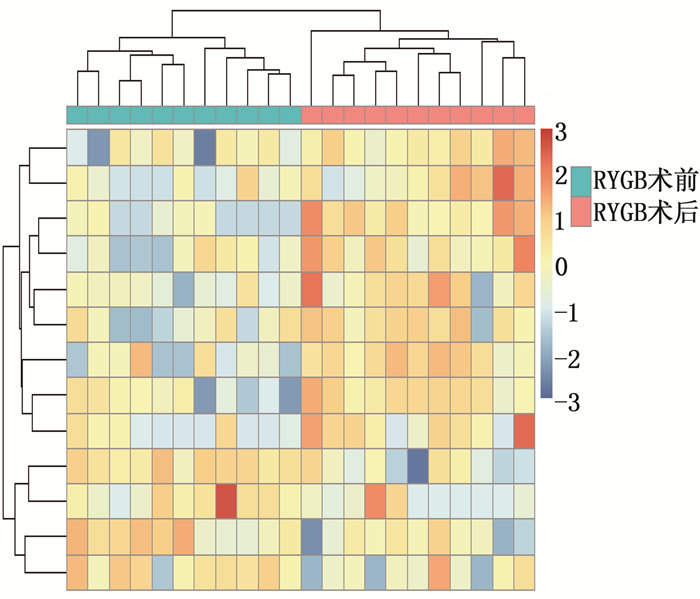
筛选GEO数据库中RYGB术前和RYGB术后配对的肌肉组织样本,对GSE161643数据集的表达谱数据(共纳入病例22例,包括RYGB术前病例、RYGB术后病例各11例)进行生物信息学分析。全部基因和差异基因的分布情况通过绘制火山图(图 1)进行展示,差异表达基因在样本中的表达通过绘制热图(图 2)进行呈现。分析结果显示, RYGB术后肌肉组织的基因表达谱与RYGB术前存在显著差异,共筛选出差异表达基因74个,其中表达上调基因30个、表达下调基因44个。
2.2 RYGB术后肥胖症患者肌肉组织基因的基因集富集分析
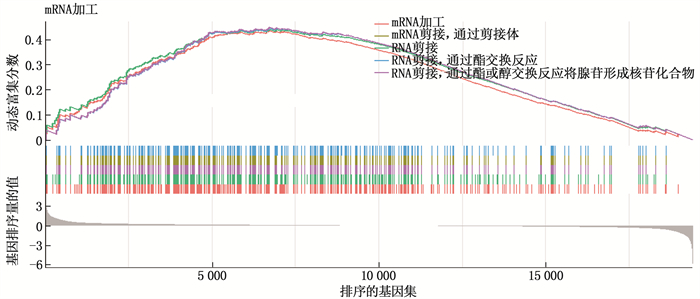
芯片数据集的基因集富集分析结果提示, GSE161643数据集富集于8个GO功能,分别为GO∶0006397、GO∶0008380、GO∶0000377、GO∶0000398、GO∶0000375、GO∶0050684、GO∶0005681、GO∶0043484, 主要围绕mRNA加工、RNA剪接、mRNA加工的调控、RNA剪接的调控等过程。GO功能富集的前5个生物过程的可视化结果见图 3, 分别为: ① mRNA加工; ② mRNA剪接,通过剪接体; ③ RNA剪接; ④ RNA剪接,通过酯交换反应; ⑤ RNA剪接,通过酯或醇交换反应将腺苷形成核苷化合物。KEGG通路富集分析结果显示, GSE161643数据集富集于hsa05168(单纯疱疹病毒1型感染),富集评分442, q=0.025 9。
2.3 RYGB术前和术后肌肉组织基因的免疫细胞浸润分析
应用ESTIMATE分别计算RYGB术前和RYGB术后的肌肉组织样本中基质细胞和免疫细胞的比例,并生成基质成分评分和免疫成分评分。分析结果显示, RYGB术后肌肉组织的基质成分评分、免疫成分评分与RYGB术前比较,差异均无统计学意义(P>0.05), 见图 4。
2.4 STITCH靶点-化合物网络
利用STITCH数据库分析与基因靶点相互作用的化学成分,将上述基于GSE161643数据集筛选出来的差异表达基因导入STITCH数据库,构建相互作用网络。该网络共有25个蛋白靶点,但没有找到与网络关联的化合物,见图 5。利用Cytscape软件对构建的相互作用网络进行分析,共筛选出关键靶点10个,分别为UBC、CDK1、ERBB2、CDK2、CHEK2、CDC25A、ERBB3、SHC1、CHEK1和BTRC。
2.5 CMAP药物靶点筛选
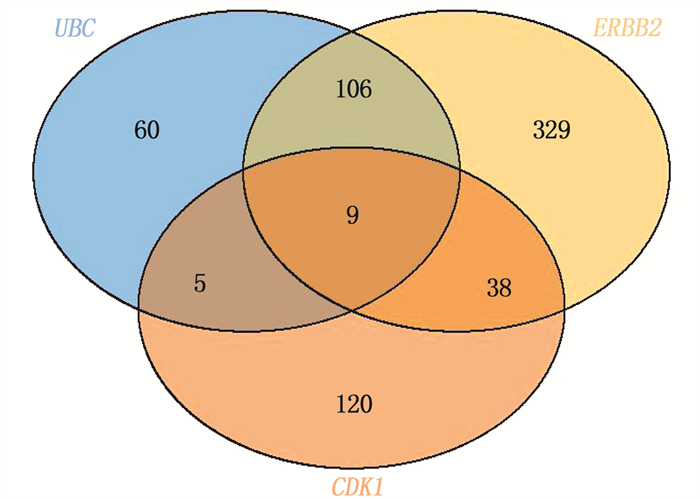
利用CMap数据库筛选出关键靶点基因,寻找治疗肥胖症的潜在候选小分子化合物。选择排名前3位的关键靶点基因,即UBC、CDK1、ERBB2, 输入CMap的touchstone(https://clue.io/touchstone), 比对关键靶点基因谱与CMap中的参照基因表达谱,得到相关的小分子化合物。应用Venn图筛选出共同作用于UBC、CDK1、ERBB2的9个小分子化合物,分别为氯吡格雷、BNTX、香豆素、左氧氟沙星、SID-26681509、依折麦布、异丁香酚、渥曼青霉素和PSB-06126,这些化合物可能成为候选治疗药物,见图 6、表 1。
表 1 共同作用于UBC、CDK1、ERBB2的小分子化合物序号 预测分数 名称 类型 靶点 1 98.33 氯吡格雷 嘌呤受体拮抗剂 P2RY12, CYP2B6, CYP2C19, CYP3A5 2 96.30 BNTX 阿片类受体拮抗剂 OPRD1, OPRK1, OPRM1 3 94.36 香豆素 ATP酶抑制剂 ATP1A1 4 89.09 左氧氟沙星 细菌DNA回旋酶抑制剂 TOP2A 5 89.05 SID-26681509 胰蛋白酶抑制剂 CTSL 6 81.01 依泽米贝 NPC1L1蛋白拮抗剂 NPC1L1, ANPEP, SOAT1 7 81.00 异丁香酚 一氧化氮生成抑制剂 — 8 80.99 渥曼青霉素 PI3K抑制剂 PIK3CA, PIK3CG, PLK1, ATM, ATR, MTOR, PI4KA, PI4KB, PIK3CD, PIK3R1, PLK3, PRKDC 9 80.82 PSB-06126 NTPD酶抑制剂 ENTPD3 3. 讨论
肥胖症是一种慢性病,其所引起的糖尿病、心血管疾病、高血压病等伴随疾病已成为全球范围内严重的公共卫生问题[9-10]。相较于节食、运动和药物治疗等保守治疗方法,外科减重手术能更有效且持久地降低肥胖患者的体质量,改善糖代谢,减少肥胖相关并发症[11]。WITTGROVE A C等[12]于1994年报道了全腹腔镜下RYGB术式,目前该术式已经成为减重代谢外科中最被认可的术式之一,但其改善代谢的机制尚未阐明。本研究对RYGB手术前后肌肉组织的基因表达数据进行深入挖掘,共筛选出差异表达基因74个,其中上调基因30个、下调基因44个,这些差异表达基因富集于8个GO功能,包括mRNA加工、RNA剪接、mRNA加工的调控、RNA剪接的调控等过程; KEGG通路富集分析显示, GSE161643数据集富集于hsa05168(单纯疱疹病毒1型感染); 构建靶点-化合物相互作用网络,分析后共筛选出10个关键靶点; 进一步筛选针对关键基因的小分子化合物,共得到9个小分子化合物,可作为治疗肥胖症的候选药物。
骨骼肌是人体的主要代谢场所之一,其代谢受损与肥胖症诱发的胰岛素抵抗等代谢异常关系密切,而骨骼肌胰岛素抵抗被认为是肥胖和2型糖尿病的一个重要特征[8]。减重手术后骨骼肌中某些基因或蛋白质的表达会发生变化, GASTALDI G等[13]发现, RYGB术后肌肉组织的PGC1A表达上调,进而刺激MFN2表达,且多因素分析显示MFN2表达与胰岛素敏感性改善相关。LEICHMAN J G等[14]研究了RYGB术和胃绑带术后肌肉代谢和心脏的变化,发现SCD、PDK4表达水平在术后早期下降,第3、9个月时SCD、PDK4转录水平显著降低,而PPARα及其调控的基因(MACD、CPT1、UCP3)在手术后期表达下降,同时血浆游离脂肪酸浓度下降,手术后第9个月时胰岛素敏感性恢复,血浆瘦素降低,心脏超声显示左心室舒张障碍恢复正常。ALBERS P H等[15]发现,在RYGB术后12个月,骨骼肌中GLUT4蛋白表达增加,胰岛素信号分子(如胰岛素受体Akt和TBC1D4)磷酸化增强,糖原合酶活性改善。TAMBOLI R A等[16]发现,减重手术后6、12个月骨骼肌炎症相关基因(ANKRD1、CDR1、CH25H、CXCL2、CX3CR1、IL8、LBP、NFIL3、SELE、SOCS3、TNFAIP3和ZFP36)表达降低,且IL6、CCL2的表达在术后所有时点均下降。相关研究[17]发现,肥胖和RYGB对骨骼肌蛋白质组有动态影响, 260种蛋白质在肥胖者中表达显著减少,135种蛋白质表达显著增加, RYGB术后, 49种蛋白质恢复至正常水平。KEGG通路分析显示,富集于核糖体途径以及胰岛素信号蛋白(包括MAP激酶和GLUT定位的蛋白质)的丰度增加和正常化。本研究结果显示,表达上调基因30个、表达下调基因44个,与其他文献报道的基因并不完全一致,提示存在个体和人种差异。此外,富集分析结果提示,生物学功能主要围绕mRNA加工、RNA剪接、mRNA加工的调控、RNA剪接的调控等过程,而KEGG富集于单纯疱疹病毒1型感染。
本研究结果提示, CDK1、UBC和ERBB2是肥胖代谢过程中的关键靶点基因。相关研究[18]称CDK1-SIRT3-CPT2级联能够调节人体内有害脂肪棕榈酸的代谢,该过程通过增强线粒体代谢稳态实现,由CDK1介导SIRT3磷酸化,而SIRT3磷酸化使CPT2脱乙酰化和二聚化,以增强脂肪酸氧化。SHANG W T等[19]报道,UBC基因参与脂肪生成相关PPAR信号通路。在结构上,ERBB2、ERBB3是与ERBB1或ERBB4相关的共同受体,相关研究[20]报道神经调节因子-1(NRG-1)与ERBB3或ERBB4结合,介导ERBB2受体的活化,进一步激活部分ERKl/2和/或P13K/Akt通路。
药物治疗是除改变生活方式和减重手术以外的一种有潜力的重要疗法,本研究分析了针对相应靶点的潜在药物。文献检索结果显示,氯吡格雷能否治疗肥胖症尚无直接的研究结果,有学者研究了一种可以阻止细胞色素P4508B1作用的减肥药,而氯吡格雷前体药物也通过肝脏细胞色素P450酶系统进行代谢[11]。肥胖症是氯吡格雷治疗效果的分层因素, BMI显著影响CYP2C19基因与氯吡格雷-阿司匹林治疗效果之间的相关性[21]。基于小鼠模型的研究[22]发现,由于与白细胞介素-1(IL-1)受体信号相关的前药生物活性降低,氯吡格雷的抗血小板作用可能在糖尿病患者中受损。氯吡格雷为经典的抗血小板药物,但相关临床研究并未提供用药后BMI变化数据。
脂肪生成和代谢也被认为是肥胖症的潜在治疗靶点。载脂蛋白A-Ⅰ是高密度脂蛋白颗粒的主要蛋白,而香豆素分子结构的类似天然化合物可能有助于增加载脂蛋白A-Ⅰ转录的分子成份[23]。依折米贝通过AMPK-mTORC1途径下调脂质生成相关基因,减少脂质积累,还通过阻滞细胞周期在G0/G1期,抑制脂肪细胞增殖,阻止有丝分裂克隆扩增[24]。依折米贝治疗可诱导脂肪细胞中的抗炎细胞因子和脂肪酸氧化,降低血清游离脂肪酸水平,减小内脏脂肪中脂肪细胞大小,并部分改善血糖指数[25]。脂肪组织通过上调PI3K/Akt通路分子来影响内脏前脂肪细胞/脂肪细胞中的胰岛素信号传导[26]。PI3K抑制剂渥曼青霉素被细胞实验证明可以降低p-Akt、p-FoxO1和PPARγ2的表达,从而抑制人脂肪来源间充质干细胞(hADSC)的脂肪生成[26]。
肠道菌群在肥胖的发生发展过程中发挥重要作用。一项分析依泽米贝对新疆地区超重和肥胖伴血脂异常患者肠道微生物群影响的研究[27]结果显示,梭状芽孢杆菌和毛螺菌在依泽米贝干预2周后与总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)均呈负相关,提示其作为潜在的微生物靶点在改善肥胖患者糖脂代谢中的作用。除了受药物影响外,肠道菌群还受幽门螺杆菌(Hp)的影响,而后者会引发代谢紊乱[28]。研究[29]显示,根除Hp治疗可改善脂代谢和肠道菌群。减重手术切除了部分胃底,可减少Hp感染所致的食欲调节激素[30], 而质子泵抑制剂也可产生根治Hp的效果。左氧氟沙星联合阿莫西林、质子泵抑制剂的治疗方案,根除Hp的效果与一线治疗方案(质子泵抑制剂、铋、甲硝唑、四环素)类似[31]。因此,左氧氟沙星可能通过根除Hp而间接参与肥胖症的治疗。
本研究存在一些局限性: ①本研究以GEO公共芯片数据为分析基础,信号通路以及药物预测结果还需通过临床样本和实验加以验证; ②氯吡格雷在心脑血管领域已有很多临床试验项目,部分项目包括用药前的BMI数据,但均未关注用药后的BMI数据,未来应关注氯吡格雷相关大型临床研究项目的用药后BMI数据; ③本研究所用开放数据库的病例源自西方人群,肥胖症的一些影响因素例如遗传、表观遗传、肠道菌群、生活习惯和经济状况等可能与东方人群存在差异。
综上所述,与RYGB术前相比,肥胖症患者RYGB术后的肌肉组织基因表达存在显著差异,这些差异可能成为治疗肥胖症的潜在药物靶点。肥胖症疾病过程中的一些关键靶点基因,可为治疗药物的研究提供参考依据,但这些基因的临床价值还需进一步结合临床病例加以验证,从而为安全有效地治疗肥胖症提供新思路。
-
表 1 共同作用于UBC、CDK1、ERBB2的小分子化合物
序号 预测分数 名称 类型 靶点 1 98.33 氯吡格雷 嘌呤受体拮抗剂 P2RY12, CYP2B6, CYP2C19, CYP3A5 2 96.30 BNTX 阿片类受体拮抗剂 OPRD1, OPRK1, OPRM1 3 94.36 香豆素 ATP酶抑制剂 ATP1A1 4 89.09 左氧氟沙星 细菌DNA回旋酶抑制剂 TOP2A 5 89.05 SID-26681509 胰蛋白酶抑制剂 CTSL 6 81.01 依泽米贝 NPC1L1蛋白拮抗剂 NPC1L1, ANPEP, SOAT1 7 81.00 异丁香酚 一氧化氮生成抑制剂 — 8 80.99 渥曼青霉素 PI3K抑制剂 PIK3CA, PIK3CG, PLK1, ATM, ATR, MTOR, PI4KA, PI4KB, PIK3CD, PIK3R1, PLK3, PRKDC 9 80.82 PSB-06126 NTPD酶抑制剂 ENTPD3 -
[1] PUHL R, SUH Y. Health consequences of weight Stigma: implications for obesity prevention and treatment[J]. Curr Obes Rep, 2015, 4(2): 182-190. doi: 10.1007/s13679-015-0153-z
[2] 陈玉, 周铃, 徐耀初, 等. 肥胖与糖尿病患病关系的调查研究[J]. 江苏临床医学杂志, 2000, 4(2): 110-112. https://www.cnki.com.cn/Article/CJFDTOTAL-XYZL200002012.htm [3] 李梦伊, 刘洋, 赵象文, 等. 大华北减重与代谢手术临床资料数据库2019年度报告[J]. 中国实用外科杂志, 2020, 40(4): 418-425. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGWK202004018.htm [4] 杨景哥, 王存川, 胡友主, 等. 腹腔镜Roux-en-Y胃旁路手术治疗肥胖症和2型糖尿病[J]. 中华胃肠外科杂志, 2010, 13(8): 594-597. doi: 10.3760/cma.j.issn.1671-0274.2010.08.014 [5] 焦宇文, 汤黎明, 钱峻, 等. 腹腔镜袖状胃切除对肥胖患者炎症因子水平的影响[J]. 实用临床医药杂志, 2018, 22(22): 103-104, 107. doi: 10.7619/jcmp.201822034 [6] MADSEN L R, BAGGESEN L M, RICHELSEN B, et al. Effect of Roux-en-Y gastric bypass surgery on diabetes remission and complications in individuals with type 2 diabetes: a Danish population-based matched cohort study[J]. Diabetologia, 2019, 62(4): 611-620. doi: 10.1007/s00125-019-4816-2
[7] 闫文貌, 靖长友, 李有国, 等. 胃旁路术对2型糖尿病患者的三年疗效分析[J]. 中华腔镜外科杂志: 电子版, 2018, 11(5): 268-273. doi: 10.3877/cma.j.issn.1674-6899.2018.05.003 [8] COLETTA D K, MANDARINO L J. Mitochondrial dysfunction and insulin resistance from the outside in: extracellular matrix, the cytoskeleton, and mitochondria[J]. Am J Physiol Endocrinol Metab, 2011, 301(5): E749-E755. doi: 10.1152/ajpendo.00363.2011
[9] NG M, FLEMING T, ROBINSON M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2014, 384(9945): 766-781. doi: 10.1016/S0140-6736(14)60460-8
[10] NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016: a pooled analysis of 2416 population-based measurement studies in 128.9 million children, adolescents, and adults[J]. Lancet, 2017, 390(10113): 2627-2642. doi: 10.1016/S0140-6736(17)32129-3
[11] CHUNG E, OFFEI S D, JIA U T A, et al. A synthesis of a rationally designed inhibitor of cytochrome P450 8B1, a therapeutic target to treat obesity[J]. Steroids, 2022, 178: 108952. doi: 10.1016/j.steroids.2021.108952
[12] WITTGROVE A C, CLARK G W, TREMBLAY L J. Laparoscopic gastric bypass, roux-en-Y: preliminary report of five cases[J]. Obes Surg, 1994, 4(4): 353-357. doi: 10.1381/096089294765558331
[13] GASTALDI G, RUSSELL A, GOLAY A, et al. Upregulation of peroxisome proliferator-activated receptor gamma coactivator gene (PGC1A) during weight loss is related to insulin sensitivity but not to energy expenditure[J]. Diabetologia, 2007, 50(11): 2348-2355. doi: 10.1007/s00125-007-0782-1
[14] LEICHMAN J G, WILSON E B, SCARBOROUGH T, et al. Dramatic reversal of derangements in muscle metabolism and left ventricular function after bariatric surgery[J]. Am J Med, 2008, 121(11): 966-973. doi: 10.1016/j.amjmed.2008.06.033
[15] ALBERS P H, BOJSEN-MØLLER K N, DIRKSEN C, et al. Enhanced insulin signaling in human skeletal muscle and adipose tissue following gastric bypass surgery[J]. Am J Physiol Regul Integr Comp Physiol, 2015, 309(5): R510-R524. doi: 10.1152/ajpregu.00228.2014
[16] TAMBOLI R A, HAJRI T, JIANG A X, et al. Reduction in inflammatory gene expression in skeletal muscle from Roux-en-Y gastric bypass patients randomized to omentectomy[J]. PLoS One, 2011, 6(12): e28577. doi: 10.1371/journal.pone.0028577
[17] CAMPBELL L E, LANGLAIS P R, DAY S E, et al. Identification of novel changes in human skeletal muscle proteome after roux-en-Y gastric bypass surgery[J]. Diabetes, 2016, 65(9): 2724-2731. doi: 10.2337/db16-0004
[18] LIU L, XIE B W, FAN M, et al. Low-level saturated fatty acid palmitate benefits liver cells by boosting mitochondrial metabolism via CDK1-SIRT3-CPT2 cascade[J]. Dev Cell, 2020, 52(2): 196-209, e9. doi: 10.1016/j.devcel.2019.11.012
[19] SHANG W T, SI X, ZHOU Z K, et al. Wheat bran with enriched gamma-aminobutyric acid attenuates glucose intolerance and hyperinsulinemia induced by a high-fat diet[J]. Food Funct, 2018, 9(5): 2820-2828. doi: 10.1039/C8FO00331A
[20] FULLER S J, SIVARAJAH K, SUGDEN P H. ErbB receptors, their ligands, and the consequences of their activation and inhibition in the myocardium[J]. J Mol Cell Cardiol, 2008, 44(5): 831-854. doi: 10.1016/j.yjmcc.2008.02.278
[21] MO J L, CHEN Z M, XU J, et al. Efficacy of clopidogrel-aspirin therapy for stroke does not exist in C YP2C19 loss-of-function allele noncarriers with overweight/obesity[J]. Stroke, 2020, 51(1): 224-231. doi: 10.1161/STROKEAHA.119.026845
[22] SUN Y F, VENUGOPAL J, GUO C A, et al. Clopidogrel resistance in a murine model of diet-induced obesity is mediated by the interleukin-1 receptor and overcome with DT-678[J]. Arterioscler Thromb Vasc Biol, 2020, 40(6): 1533-1542. doi: 10.1161/ATVBAHA.120.314146
[23] YAO H W, GU J K, SHAN Y Q, et al. Type 2 diabetes mellitus decreases systemic exposure of clopidogrel active metabolite through upregulation of P-glycoprotein in rats[J]. Biochem Pharmacol, 2020, 180: 114142. doi: 10.1016/j.bcp.2020.114142
[24] LEE Y S, PARK J S, LEE D H, et al. Ezetimibe ameliorates lipid accumulation during adipogenesis by regulating the AMPK-mTORC1 pathway[J]. FASEB J, 2020, 34(1): 898-911. doi: 10.1096/fj.201901569R
[25] CHO Y, KIM R H, PARK H, et al. Effect of ezetimibe on glucose metabolism and inflammatory markers in adipose tissue[J]. Biomedicines, 2020, 8(11): 512. doi: 10.3390/biomedicines8110512
[26] SWIDERSKA E, STRYCHARZ J, WRÓBLEWSKI A, et al. Chronic and intermittent hyperglycemia modulates expression of key molecules of PI3K/AKT pathway in differentiating human visceral adipocytes[J]. Int J Mol Sci, 2021, 22(14): 7712. doi: 10.3390/ijms22147712
[27] JIN J, CHENG R Y, REN Y, et al. Distinctive gut microbiota in patients with overweight and obesity with dyslipidemia and its responses to long-term orlistat and ezetimibe intervention: a randomized controlled open-label trial[J]. Front Pharmacol, 2021, 12: 732541. doi: 10.3389/fphar.2021.732541
[28] DE BRITO B B, DA SILVA F A F, SOARES A S, et al. Pathogenesis and clinical management of Helicobacter pylori gastric infection[J]. World J Gastroenterol, 2019, 25(37): 5578-5589. doi: 10.3748/wjg.v25.i37.5578
[29] MARTÍN-NÙÑEZ G M, CORNEJO-PAREJA I, ROCA-RODRÍGUEZ M, et al. H. pylori eradication treatment causes alterations in the gut microbiota and blood lipid levels[J]. Front Med (Lausanne), 2020, 7: 417.
[30] GUTIÉRREZ-REPISO C, MORENO-INDIAS I, MARTÍN-NÙÑEZ G M, et al. Influence of factors altering gastric microbiota on bariatric surgery metabolic outcomes[J]. Microbiol Spectr, 2021, 9(3): e0053521. doi: 10.1128/Spectrum.00535-21
[31] ANG T L, LIM K W, ANG D, et al. Clinical audit of current Helicobacter pylori treatment outcomes in Singapore[J]. Singapore Med J, 2021: 2021Sep21.




 下载:
下载:


 苏公网安备 32100302010246号
苏公网安备 32100302010246号