Predictive value of galectin-3 in patients with atrial fibrillation complicated with obstructive sleep apnea
-
摘要:目的
探讨血清半乳糖凝集素-3(Gal-3)水平对心房颤动(简称房颤)患者合并阻塞性睡眠呼吸暂停(OSA)的预测价值。
方法选取在心内科住院的88例房颤患者,根据多导睡眠监测(PSG)结果分为房颤组[呼吸暂停低通气指数(AHI) < 5次/h]20例和房颤合并OSA组(AHI≥5次/h)68例,另选取同期呼吸科经PSG检查确诊OSA的19例患者设为单纯OSA组,并选取同期体检中心的80例健康体检者设为健康对照组。比较4组研究对象的临床资料、血清Gal-3水平; 采用二元Logistic回归分析探讨房颤患者合并OSA的影响因素; 绘制受试者工作特征(ROC)曲线,评价血清Gal-3水平对房颤患者合并OSA的预测价值。
结果房颤合并OSA组、房颤组、单纯OSA组血清Gal-3水平高于健康对照组,且房颤合并OSA组血清Gal-3水平高于房颤组、单纯OSA组,差异有统计学意义(P < 0.05)。二元Logistic回归分析显示,血清Gal-3水平为房颤患者合并OSA的独立影响因素(OR=1.547, 95%CI: 1.063~2.251, P= 0.023)。血清Gal-3水平预测房颤患者合并OSA的曲线下面积为0.779(95%CI: 1.063~2.251, P=0.023), 最佳截断值为9.49 ng/mL(敏感度82.9%, 特异度64.3%)。
结论血清Gal-3水平与OSA促进房颤的发生和发展相关,血清Gal-3水平升高可能对房颤患者合并OSA具有一定预测价值。
Abstract:ObjectiveTo investigate the predictive value of level of galectin-3 (Gal-3) in patients with atrial fibrillation complicated with obstructive sleep apnea (OSA).
MethodsA total of 88 atrial fibrillation inpatients in department of cardiology were selected. According to the results of polysomnography (PSG), the patients were divided into atrial fibrillation group [apnea hypopnea index (AHI) < 5 times/h, n=20]and atrial fibrillation combined with OSA group (AHI≥5 times/h, n=68). In addition, 19 patients with OSA confirmed by PSG examination in respiratory department during the same period were selected as OSA alone group, and 80 healthy subjects in physical examination center during the same period were selected as healthy control group. Clinical data and serum Gal-3 levels were compared among the four groups. The influencing factors of OSA in AF patients were analyzed by binary Logistic regression. The receiver operating characteristic (ROC) curve was drawn to evaluate the value of serum Gal-3 level in predicting OSA in patients with atrial fibrillation.
ResultsThe levels of serum Gal-3 in the atrial fibrillation combined with OSA group, atrial fibrillation group and OSA alone group were significantly higher than those in the healthy control group, and the level of serum Gal-3 in the atrial fibrillation combined with OSA group was significantly higher than that in the atrial fibrillation group and OSA alone group (P < 0.05). Binary Logistic regression analysis showed that serum Gal-3 level was one of independent influencing factors for AF patients complicating with OSA (OR=1.547; 95%CI, 1.063 to 2.251; P= 0.023). The area under curve of serum Gal-3 for predicting in AF patients complicating with OSA was 0.779 (95%CI, 1.063 to 2.251; P= 0.023), and the optimal cut-off value was 9.49 ng/mL (with sensitivity of 82.9%, specificity of 64.3%).
ConclusionThe level of serum GAL-3 is related to the occurrence and development of AF promoted by OSA. The increased level of serum GAL-3 may have a certain predictive value for AF patients with OSA.
-
Keywords:
- atrial fibrillation /
- obstructive sleep apnea /
- galectin-3 /
- myocardial fibrosis /
- predictive value
-
心房颤动(简称房颤)是一种室上性快速心律失常,伴有不协调的心房电激活,可致心房收缩无序,是成年人最常见的心律失常之一,其引起的脑栓塞、心力衰竭等并发症严重威胁患者的生命健康,给患者家庭及社会带来了巨大负担[1]。房颤的发生发展与高血压、糖尿病、心力衰竭、冠心病、慢性肾脏病、肥胖和阻塞性睡眠呼吸暂停(OSA)等有关,对危险因素进行早期干预可减少房颤的发生[2-3]。OSA是一种在世界范围内高度流行的疾病,其特征是睡眠期间上呼吸道反复出现部分(阻塞性低通气)或完全(阻塞性呼吸暂停)塌陷[4-5], 从而导致间歇性缺氧。研究[6-7]表明,房颤患者的OSA发病率可达60%~90%。OSA促进房颤发生发展的机制尚不清楚,但已知心肌纤维化在房颤的发生发展中起着重要的作用。半乳糖凝集素-3(Gal-3)是炎症、心肌纤维化的生物标志物,与房颤关系密切,且研究[8]发现OSA患者的血清Gal-3水平显著升高。本研究探讨血清Gal-3水平对房颤患者合并OSA的预测价值,现报告如下。
1. 对象与方法
1.1 研究对象
选取2021年5月—2022年1月在扬州大学附属医院心内科住院的88例房颤患者,根据多导睡眠监测(PSG)结果分为房颤组[呼吸暂停低通气指数(AHI) < 5次/h]20例和房颤合并OSA组(AHI≥5次/h)68例,并根据房颤类型将房颤合并OSA组患者分为阵发性房颤组33例和持续性房颤组35例。房颤的诊断参照《诊断学(第九版)》, OSA的诊断参照2018年《成人阻塞性睡眠呼吸暂停基层诊疗指南》。另选取同期呼吸科经PSG检查确诊OSA的19例患者设为单纯OSA组,并选取同期体检中心的80例健康体检者设为健康对照组。本研究经医学伦理委员会审核批准(伦理号2021-YKL11-02-005), 所有研究对象均知情并签署知情同意书。纳入标准: 年龄18~90岁者。排除标准: ①心肌病、严重瓣膜病患者; ②半年内有心肌梗死史, 1个月内有心脏手术史患者; ③由原发性醛固酮增多症、库欣综合征、肾动脉狭窄、嗜铬细胞瘤等引起的继发性高血压者; ④甲状腺功能亢进、甲状腺功能减退者; ⑤严重肝、肾功能异常者; ⑥严重呼吸系统疾病及感染性疾病患者; ⑦恶性肿瘤晚期、严重结缔组织疾病患者; ⑧不愿配合研究者; ⑨非上气道阻塞性原因造成的呼吸暂停和(或)低通气者。
1.2 方法
1.2.1 资料收集
收集研究对象的年龄、性别、体质量指数(BMI)、体表面积(BSA)、房颤类型、吸烟史、饮酒史、疾病史等资料。BMI=体质量(kg)/身高(m)2; BSA=0.006×身高(cm)+0.013×体质量(kg)-0.153。收集患者的左房前后径(LAD)、左室舒张末期内径(LVEDd)、左室收缩末期内径(LVESd)、舒张期室间隔厚度(IVSDT)、左室后壁厚度(LVPWT)、左室射血分数(LVEF)等超声心动图指标数据。左房内径指数(LADI)=LAD/BSA; 左室质量(LVM)=0.8×1.04[(LVEDd+IVSDT+LVPWT)3-LVEDd3]+0.6; 左室质量指数(LVMI)=LVM/BSA。
1.2.2 PSG
用PSG仪器对患者进行整夜连续监测,睡眠监测时间不少于7 h, 监测当天患者禁饮浓茶、咖啡及酒等饮品,且禁服镇静催眠类药物。专业医师对PSG监测结果进行分析,并记录PSG指标,包括呼吸暂停低通气指数(AHI)、氧减指数(ODI)、最低血氧饱和度(LSaO2)、平均血氧饱和度(MSaO2)、血氧饱和度(SaO2) < 90%时间占全部睡眠时间的百分比(T90)等。
1.2.3 Gal-3水平检测
采集研究对象的晨起外周血,离心后取血清标本,于-80 ℃冰箱保存。采用双抗体夹心酶联免疫吸附(ELISA)法定量检测Gal-3水平, Human GAL3(Galectin 3)ELISA Kit试剂盒购自Elabscience公司。
1.3 统计学分析
使用SPSS 23.0统计学软件进行数据分析,满足正态分布的计量资料采用(x±s)表示, 2组间比较采用独立样本t检验,多组间比较采用单因素方差分析; 非正态分布的计量资料以[M(P25, P75)]表示,两独立样本间比较采用Mann-Whitney U检验,多个独立样本间比较采用Kruskal-Wallis U检验; 计数资料采用[n(%)]表示,组间比较采用χ2检验。采用二元Logistic回归分析探讨房颤患者合并OSA的影响因素。绘制受试者工作特征(ROC)曲线,评估血清Gal-3水平预测房颤患者合并OSA的敏感度和特异度。P < 0.05为差异有统计学意义。
2. 结果
2.1 4组一般资料、睡眠监测指标和血清Gal-3水平比较
房颤组、房颤合并OSA组、单纯OSA组、健康对照组间高血压病史、糖尿病史比较,差异有统计学意义(P < 0.05); 进一步两两比较,房颤合并OSA组有高血压病史者占比高于健康对照组,单纯OSA组有糖尿病史者占比高于健康对照组,差异有统计学意义(P < 0.05)。4组间年龄、男性占比、BMI、吸烟史、饮酒史比较,差异无统计学意义(P>0.05)。房颤合并OSA组持续性房颤者占比高于房颤组,但差异无统计学意义(P>0.05)。单纯OSA组、房颤合并OSA组AHI、ODI、T90均高于房颤组,单纯OSA组LSaO2低于房颤组,房颤合并OSA组MSaO2低于房颤组,差异有统计学意义(P < 0.05); 单纯OSA组、房颤组、房颤合并OSA组平均脉率比较,差异无统计学意义(P>0.05)。单纯OSA组、房颤组、房颤合并OSA组血清Gal-3水平高于健康对照组,且房颤合并OSA组血清Gal-3水平高于单纯OSA组、房颤组,差异有统计学意义(P < 0.05)。见表 1。
表 1 4组一般资料、睡眠监测指标和血清Gal-3水平比较(x±s)[n(%)][M(P25, P75)]指标 健康对照组(n=80) 单纯OSA组(n=19) 房颤组(n=20) 房颤合并OSA组(n=68) χ2/F P 年龄/岁 65.05±8.85 64.68±10.82 69.50±8.51 69.97±10.10 1.793 0.155 男性 44(55.00) 11(57.89) 8(40.00) 40(58.82) 2.284 0.516 BMI/(kg/m2) 25.63±2.89 26.96±2.74 25.48±2.12 25.77±3.26 0.907 0.442 吸烟史 22(27.50) 6(31.58) 8(40.00) 30(44.12) 4.755 0.191 饮酒史 18(22.50) 3 (15.79) 6(30.00) 22(32.35) 3.019 0.395 高血压病史 34(42.50) 14(73.68) 10(50.00) 54(79.41)* 23.179 < 0.001 糖尿病史 8(10.00) 7(36.84)* 2(10.00) 14(20.59) 8.768 0.027 持续性房颤 — — 7(35.00) 35(51.47) 1.680 0.195 AHI/(次/h) — 26.70(18.35, 37.15) 3.35(2.60, 4.30)# 21.60(10.90, 39.60)△ 25.265 < 0.001 ODI/(次/h) — 17.60(13.20, 27.90) 2.85(2.40, 5.20)# 22.20(7.70, 37.40)△ 16.497 < 0.001 LSaO2/% — 78.00(74.00, 82.00) 86.00(83.00, 86.00)# 83.00(78.00, 86.00) 11.383 0.003 MSaO2/% — 94.00(93.60, 95.00) 95.45(95.00, 96.60) 94.00(93.00, 95.10)△ 9.603 0.008 T90/% — 4.09(1.88, 8.81) 0.32(0.04, 0.67)# 1.70(0.20, 5.10) 11.516 0.003 平均脉率/(次/min) — 62.70(59.90, 68.50) 59.05(55.50, 61.70) 61.20(56.10, 72.00) 0.815 0.665 Gal-3/(ng/mL) 6.18±2.89 9.41±3.78* 8.97±3.29* 12.14±3.10*#△ 11.613 < 0.001 BMI: 体质量指数; AHI: 呼吸暂停低通气指数; ODI: 氧减指数; LSaO2: 最低血氧饱和度; MSaO2: 平均血氧饱和度;
T90: 血氧饱和度 < 90%时间占全部睡眠时间的百分比; Gal-3: 半乳糖凝集素-3。与健康对照组比较, *P < 0.05;
与单纯OSA组比较, #P < 0.05; 与房颤组比较, △P < 0.05。2.2 房颤组与房颤合并OSA组超声心动图指标比较
房颤合并OSA组LADI、LVMI均高于房颤组, LVEF低于房颤组,差异有统计学意义(P < 0.05); 2组在LVEDd、LVESd方面比较,差异无统计学意义(P>0.05)。见表 2。
表 2 房颤组与房颤合并OSA组超声心动图指标比较(x±s)指标 房颤组(n=20) 房颤合并OSA组(n=68) t P LADI 21.95±3.80 24.24±4.41 -2.014 0.048 LVEDd/mm 51.30±6.97 54.02±6.91 -1.479 0.144 LVESd/mm 33.60±8.10 36.36±7.72 -1.331 0.188 LVMI/(g/m2) 110.43±29.43 129.35±34.45 -2.096 0.040 LVEF/% 65.94±8.23 60.70±9.84 2.009 0.049 LADI: 左房内径指数; LVEDd: 左室舒张末期内径; LVESd: 左室收缩末期内径;
LVMI: 左室质量指数; LVEF: 左室射血分数。2.3 阵发性房颤组与持续性房颤组血清Gal-3水平和超声心动图指标比较
持续性房颤组血清Gal-3水平、LADI均高于阵发性房颤组,差异有统计学意义(P < 0.05); 2组在LVEDd、LVESd、LVMI、LVEF方面比较,差异无统计学意义(P>0.05)。见表 3。
表 3 阵发性房颤组与持续性房颤组血清Gal-3水平和超声心动图指标比较(x±s)指标 阵发性房颤组(n=33) 持续性房颤组(n=35) t P Gal-3/(ng/mL) 10.67±2.70 12.86±2.51 -2.451 0.020 LADI 22.76±3.45 25.50±4.79 -2.186 0.034 LVEDd/mm 51.81±4.60 55.77±8.19 -1.975 0.054 LVESd/mm 34.05±5.16 38.23±9.22 -1.855 0.070 LVMI/(g/m2) 122.87±30.67 134.80±37.08 -1.174 0.247 LVEF/% 62.07±9.54 59.60±10.53 0.826 0.413 Gal-3: 半乳糖凝集素-3; LADI: 左房内径指数; LVEDd: 左室舒张末期内径;
LVESd: 左室收缩末期内径; LVMI: 左室质量指数; LVEF: 左室射血分数。2.4 房颤患者合并OSA影响因素的二元Logistic回归分析
将单因素分析中差异具有统计学意义的指标纳入二元Logistic回归分析,结果显示,血清Gal-3水平是房颤人群合并OSA的独立影响因素(OR=1.547, 95%CI: 1.063~2.251, P=0.023), 见表 4。
表 4 房颤患者合并OSA影响因素的二元logistic回归分析因素 OR 95%CI P Gal-3 1.547 1.063~2.251 0.023 LADI 1.113 0.907~1.367 0.305 LVMI 0.981 0.954~1.008 0.170 LVEF 1.002 0.921~1.090 0.961 Gal-3: 半乳糖凝集素-3; LADI: 左房内径指数;
LVMI: 左室质量指数; LVEF: 左室射血分数。2.5 血清Gal-3水平对房颤患者合并OSA的预测价值
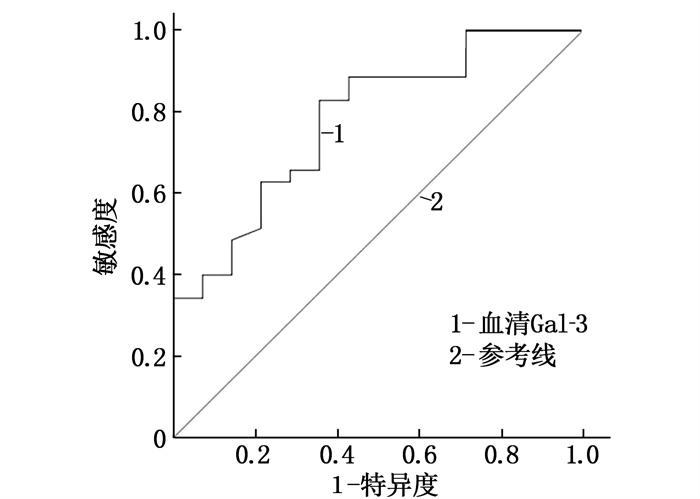
ROC曲线显示,血清Gal-3水平预测房颤患者合并OSA的曲线下面积为0.779(95%CI: 1.063~2.251, P=0.023), 最佳截断值为9.49 ng/mL(敏感度82.9%, 特异度64.3%), 见图 1。
3. 讨论
研究[9]表明, OSA是房颤的危险因素,可促进房颤的发生发展,因此,早期识别、诊断和治疗OSA对于房颤患者具有重要意义。KENDZERSKA T等[10]报道, OSA及其严重程度能有效预测房颤的5年发病率。此外, OSA已被证实会降低房颤患者抗心律失常药物、电复律及射频消融治疗的成功率[11]。相关研究[12]显示,对合并OSA患者进行适当的持续气道正压通气(CPAP)治疗可改善其房颤的节律控制。OSA导致房颤发生发展的机制复杂且尚未明确,但目前已知心房牵拉、神经内分泌激活和慢性疾病(高血压病、代谢综合征和肥胖病等)会使OSA患者出现进行性心房基质重构,这些与反复呼吸暂停相关的电生理变化,共同促进房颤的折返基础,使心房在睡眠期间产生复杂、动态的致心律失常基质[12]。部分房颤患者可能并不会表现出OSA症状,因此临床可考虑常规开展睡眠筛查[13]。本研究中部分房颤患者因无OSA症状而拒绝接受PSG检查,使得样本量偏少,今后还需扩大样本量进一步深入研究加以验证。
Gal-3与OSA关系密切,其通过促纤维化、炎症反应的作用,在房颤的发生发展中起重要作用[14-15]。Gal-3可分泌到血液或细胞外基质中,导致巨噬细胞和成纤维细胞增殖和纤维化的发展[16]。Gal-3在房颤进展中具有重要作用,并与心律失常患者的不良预后相关[17]。持续性房颤患者的血清Gal-3水平相较阵发性房颤患者显著升高,且血清Gal-3水平能独立预测射频消融后房颤的复发[18-19]。另外, CICCO S等[8]研究显示,血清Gal-3水平与OSA患者夜间呼吸指数和心脏重构具有直接关系,且OSA可能通过诱导炎症反应而促进心脏损伤的发生。PUSUROGLU H等[14]研究显示,重度OSA患者Gal-3水平显著高于轻中度OSA患者,且Gal-3水平与冠状动脉斑块、超敏C反应蛋白水平呈显著正相关。因此,本研究推测OSA可能通过间歇性低氧诱导炎症反应、心肌纤维化致心房重构而促进房颤的发生发展。
本研究中,房颤合并OSA组、房颤组、单纯OSA组血清Gal-3水平显著高于健康对照组,且房颤合并OSA组血清Gal-3水平显著高于房颤组、单纯OSA组,与IONIN V等[20]研究结果基本一致。进一步对房颤合并OSA组患者进行亚组分析后,本研究发现持续性房颤患者血清Gal-3水平显著高于阵发性房颤患者,提示血清Gal-3水平与房颤、OSA关系密切,且与OSA促进房颤发生和发展相关。本研究还发现,血清Gal-3水平是房颤患者合并OSA的独立影响因素,且血清Gal-3水平升高对房颤患者合并OSA具有一定的预测价值。本研究中,房颤合并OSA组血清Gal-3水平显著高于单纯OSA组,提示监测血清Gal-3水平可能有助于OSA患者房颤的早期发现,特别是阵发性房颤。由此进一步证实, OSA可能通过炎症反应、促纤维化而促进房颤的发生发展。
综上所述,血清Gal-3水平与OSA促进房颤发生发展相关,且血清Gal-3水平升高对房颤患者合并OSA具有一定的预测价值。Gal-3作为一种潜在的生物标志物,或可在房颤合并OSA患者的早期发现及治疗方面发挥重要作用。
-
表 1 4组一般资料、睡眠监测指标和血清Gal-3水平比较(x±s)[n(%)][M(P25, P75)]
指标 健康对照组(n=80) 单纯OSA组(n=19) 房颤组(n=20) 房颤合并OSA组(n=68) χ2/F P 年龄/岁 65.05±8.85 64.68±10.82 69.50±8.51 69.97±10.10 1.793 0.155 男性 44(55.00) 11(57.89) 8(40.00) 40(58.82) 2.284 0.516 BMI/(kg/m2) 25.63±2.89 26.96±2.74 25.48±2.12 25.77±3.26 0.907 0.442 吸烟史 22(27.50) 6(31.58) 8(40.00) 30(44.12) 4.755 0.191 饮酒史 18(22.50) 3 (15.79) 6(30.00) 22(32.35) 3.019 0.395 高血压病史 34(42.50) 14(73.68) 10(50.00) 54(79.41)* 23.179 < 0.001 糖尿病史 8(10.00) 7(36.84)* 2(10.00) 14(20.59) 8.768 0.027 持续性房颤 — — 7(35.00) 35(51.47) 1.680 0.195 AHI/(次/h) — 26.70(18.35, 37.15) 3.35(2.60, 4.30)# 21.60(10.90, 39.60)△ 25.265 < 0.001 ODI/(次/h) — 17.60(13.20, 27.90) 2.85(2.40, 5.20)# 22.20(7.70, 37.40)△ 16.497 < 0.001 LSaO2/% — 78.00(74.00, 82.00) 86.00(83.00, 86.00)# 83.00(78.00, 86.00) 11.383 0.003 MSaO2/% — 94.00(93.60, 95.00) 95.45(95.00, 96.60) 94.00(93.00, 95.10)△ 9.603 0.008 T90/% — 4.09(1.88, 8.81) 0.32(0.04, 0.67)# 1.70(0.20, 5.10) 11.516 0.003 平均脉率/(次/min) — 62.70(59.90, 68.50) 59.05(55.50, 61.70) 61.20(56.10, 72.00) 0.815 0.665 Gal-3/(ng/mL) 6.18±2.89 9.41±3.78* 8.97±3.29* 12.14±3.10*#△ 11.613 < 0.001 BMI: 体质量指数; AHI: 呼吸暂停低通气指数; ODI: 氧减指数; LSaO2: 最低血氧饱和度; MSaO2: 平均血氧饱和度;
T90: 血氧饱和度 < 90%时间占全部睡眠时间的百分比; Gal-3: 半乳糖凝集素-3。与健康对照组比较, *P < 0.05;
与单纯OSA组比较, #P < 0.05; 与房颤组比较, △P < 0.05。表 2 房颤组与房颤合并OSA组超声心动图指标比较(x±s)
指标 房颤组(n=20) 房颤合并OSA组(n=68) t P LADI 21.95±3.80 24.24±4.41 -2.014 0.048 LVEDd/mm 51.30±6.97 54.02±6.91 -1.479 0.144 LVESd/mm 33.60±8.10 36.36±7.72 -1.331 0.188 LVMI/(g/m2) 110.43±29.43 129.35±34.45 -2.096 0.040 LVEF/% 65.94±8.23 60.70±9.84 2.009 0.049 LADI: 左房内径指数; LVEDd: 左室舒张末期内径; LVESd: 左室收缩末期内径;
LVMI: 左室质量指数; LVEF: 左室射血分数。表 3 阵发性房颤组与持续性房颤组血清Gal-3水平和超声心动图指标比较(x±s)
指标 阵发性房颤组(n=33) 持续性房颤组(n=35) t P Gal-3/(ng/mL) 10.67±2.70 12.86±2.51 -2.451 0.020 LADI 22.76±3.45 25.50±4.79 -2.186 0.034 LVEDd/mm 51.81±4.60 55.77±8.19 -1.975 0.054 LVESd/mm 34.05±5.16 38.23±9.22 -1.855 0.070 LVMI/(g/m2) 122.87±30.67 134.80±37.08 -1.174 0.247 LVEF/% 62.07±9.54 59.60±10.53 0.826 0.413 Gal-3: 半乳糖凝集素-3; LADI: 左房内径指数; LVEDd: 左室舒张末期内径;
LVESd: 左室收缩末期内径; LVMI: 左室质量指数; LVEF: 左室射血分数。表 4 房颤患者合并OSA影响因素的二元logistic回归分析
因素 OR 95%CI P Gal-3 1.547 1.063~2.251 0.023 LADI 1.113 0.907~1.367 0.305 LVMI 0.981 0.954~1.008 0.170 LVEF 1.002 0.921~1.090 0.961 Gal-3: 半乳糖凝集素-3; LADI: 左房内径指数;
LVMI: 左室质量指数; LVEF: 左室射血分数。 -
[1] HINDRICKS G, POTPARA T, DAGRES N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): the Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC[J]. Eur Heart J, 2021, 42(5): 373-498. doi: 10.1093/eurheartj/ehaa612
[2] NALLIAH C J, SANDERS P, KALMAN J M. The impact of diet and lifestyle on atrial fibrillation[J]. Curr Cardiol Rep, 2018, 20(12): 137. doi: 10.1007/s11886-018-1082-8
[3] MAGNUSSEN C, NⅡRANEN T J, OJEDA F M, et al. Sex differences and similarities in atrial fibrillation epidemiology, risk factors, and mortality in community cohorts: results from the BiomarCaRE consortium (biomarker for cardiovascular risk assessment in Europe)[J]. Circulation, 2017, 136(17): 1588-1597. doi: 10.1161/CIRCULATIONAHA.117.028981
[4] LINZ D, LINZ B, HOHL M, et al. Atrial arrhythmogenesis in obstructive sleep apnea: therapeutic implications[J]. Sleep Med Rev, 2016, 26: 87-94. doi: 10.1016/j.smrv.2015.03.003
[5] BENJAFIELD A V, AYAS N T, EASTWOOD P R, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis[J]. Lancet Respir Med, 2019, 7(8): 687-698. doi: 10.1016/S2213-2600(19)30198-5
[6] KOHNO T, KIMURA T, FUKUNAGA K, et al. Prevalence and clinical characteristics of obstructive- and central-dominant sleep apnea in candidates of catheter ablation for atrial fibrillation in Japan[J]. Int J Cardiol, 2018, 260: 99-102. doi: 10.1016/j.ijcard.2018.01.103
[7] TANAKA N, TANAKA K, HIRAO Y, et al. Home sleep apnea test to screen patients with atrial fibrillation for sleep apnea prior to catheter ablation[J]. Circ J, 2021, 85(3): 252-260. doi: 10.1253/circj.CJ-20-0782
[8] CICCO S, CASTELLANA G, MARRA L, et al. Galectin-3 and neutrophil-to-lymphocyte ratio are indicative of heart remodelling and disease severity in patients with obstructive sleep apnoea[J]. Sleep Med, 2021, 82: 117-124. doi: 10.1016/j.sleep.2021.03.039
[9] BEN HALIMA M, SAMMOUD K, BEN AMAR J, et al. Prevalence and predictors of sleep apnea in atrial fibrillation patients[J]. Tunis Med, 2020, 98(12): 1031-1038.
[10] KENDZERSKA T, GERSHON A S, ATZEMA C, et al. Sleep apnea increases the risk of new hospitalized atrial fibrillation: a historical cohort study[J]. Chest, 2018, 154(6): 1330-1339. doi: 10.1016/j.chest.2018.08.1075
[11] GOUDIS C A, KETIKOGLOU D G. Obstructive sleep and atrial fibrillation: Pathophysiological mechanisms and therapeutic implications[J]. Int J Cardiol, 2017, 230: 293-300. doi: 10.1016/j.ijcard.2016.12.120
[12] LINZ D, MCEVOY R D, COWIE M R, et al. Associations of obstructive sleep apnea with atrial fibrillation and continuous positive airway pressure treatment: a review[J]. JAMA Cardiol, 2018, 3(6): 532-540. doi: 10.1001/jamacardio.2018.0095
[13] CHUNG F, ABDULLAH H R, LIAO P. STOP-Bang questionnaire: a practical approach to screen for obstructive sleep apnea[J]. Chest, 2016, 149(3): 631-638. doi: 10.1378/chest.15-0903
[14] PUSUROGLU H, SOMUNCU U, BOLAT I, et al. Galectin-3 is associated with coronary plaque burden and obstructive sleep apnoea syndrome severity[J]. Kardiol Pol, 2017, 75(4): 351-359. doi: 10.5603/KP.a2016.0185
[15] SINGH M, HANIS C L, REDLINE S, et al. Sleep apnea and galectin-3: possible sex-specific relationship[J]. Sleep Breath, 2019, 23(4): 1107-1114. doi: 10.1007/s11325-019-01788-5
[16] 李问渠, 覃小娟, 张丽, 等. 半乳糖凝集素-3致心肌纤维化机制的研究进展[J]. 临床心血管病杂志, 2020, 36(12): 1079-1082. https://www.cnki.com.cn/Article/CJFDTOTAL-LCXB202012003.htm [17] ZHONG X, QIAN X Q, CHEN G P, et al. The role of galectin-3 in heart failure and cardiovascular disease[J]. Clin Exp Pharmacol Physiol, 2019, 46(3): 197-203. doi: 10.1111/1440-1681.13048
[18] TAKEMOTO Y, RAMIREZ R J, YOKOKAWA M, et al. Galectin-3 regulates atrial fibrillation remodeling and predicts catheter ablation outcomes[J]. JACC Basic Transl Sci, 2016, 1(3): 143-154. doi: 10.1016/j.jacbts.2016.03.003
[19] FASHANU O E, NORBY F L, AGUILAR D, et al. Galectin-3 and incidence of atrial fibrillation: the Atherosclerosis Risk in Communities (ARIC) study[J]. Am Heart J, 2017, 192: 19-25. doi: 10.1016/j.ahj.2017.07.001
[20] IONIN V, FILATOVA A, SKURIDIN D, et al. Obstructive sleep apnea, galectin-3 and atrial fibrillation in patients with obesity and hypertension[J]. J Hypertens, 2019, 37: E41-E41.
-
期刊类型引用(0)
其他类型引用(2)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
