Effect of Jianpi Qufeng Decoction on intestinal flora in patients with atopic dermatitis
-
摘要:目的
探讨健脾祛风汤对特应性皮炎(AD)患者肠道菌群的影响。
方法选取30例AD儿童患者为治疗组(治疗前简称TB组,治疗后简称TA组),予口服健脾祛风汤合并外涂尿素乳膏,治疗6周; 选取27例健康儿童作为健康对照组(N组)。治疗组于治疗前后采集粪便样品, N组无干预直接采集粪便样品。治疗前后进行SCORAD评分并进行临床疗效评价; 应用Illumina Miseq测序平台对研究对象粪便细菌的16SrRNA基因V3~V4区进行高通量测序; 采用Wilcoxon秩和检验进行物种丰度差异分析。
结果健脾祛风汤治疗AD的总有效率为96.67%, 治疗后SCORAD评分降低,差异有统计学意义(P < 0.001)。肠道菌群分析显示,在门水平,治疗后厚壁菌门(Firmicutes)丰度呈升高趋势,拟杆菌门(Bacteroidetes)丰度呈下降趋势,但差异无统计学意义(P>0.05)。在属水平,厚壁菌门下Blautia丰度呈升高趋势,差异有统计学意义(P < 0.05); 拟杆菌门下Bacteroides丰度呈现降低趋势,但差异无统计学意义(P>0.05)。在种水平,厚壁菌门下unclassified_g_Faecalibacterium、unclassified_g_ [Eubacterium]_rectale_group、Ruminococcus_sp. _5_1_39BFAA丰度呈现升高趋势,拟杆菌门下Bacteroides_vulgatus_ATCC_8482、Bacteroides_Xylanisolvens_g_Bacteroides、Bacteroides_uniformis丰度呈现降低趋势,但差异均无统计学意义(P>0.05)。
结论健脾祛风汤对AD的治疗作用可能与厚壁菌门及拟杆菌门物种丰度的变化有关。
Abstract:ObjectiveTo investigate the effect of Jianpi Qufeng Decoction on intestinal flora in patients with atopic dermatitis (AD).
MethodsA total of 30 AD children were selected as treatment group (abbreviated as TB group before treatment, TA group after treatment). They were orally taken Jianpi Qufeng Decoction combined with external application of urea cream for 6 weeks. Twenty-seven healthy children were selected as healthy control group (N group). Fecal samples were collected before and after treatment in the treatment group and in the N group without intervention. SCORAD score and clinical efficacy were evaluated before and after treatment; Illumina Miseq sequencing platform was used to perform high-throughput sequencing of V3 to V4 region of 16SrRNA gene of fecal bacteria; Wilcoxon rank sum test was used to analyze differences in species abundance.
ResultsThe total effective rate of Jianpi Qufeng Decoction in the treatment of AD was 96.67%, and the SCORAD score was significantly decreased after treatment (P < 0.001). Intestinal microbiota analysis showed that at the phylum level, the abundance of Firmicutes increased and the abundance of Bacteroidetes decreased after treatment, but the difference was not statistically significant (P>0.05). At the genus level, the abundance of Blautia showed an increasing trend (P < 0.05); the abundance of Bacteroides showed a decreasing trend, but the difference was not statistically significant (P>0.05). At species level, under the phylum of Firmicutes, the abundance of unclassified_g_Faecalibacterium, unclassified_g_[Eubacterium]_rectale_group, Ruminococcus_sp._5_1_39BFAA showedincreasing trend, under the phylum of Bacteroidetes, the abundance of Bacteroides_vulgatus_ATCC_8482, Bacteroides_Xylanisolvens_g_Bacteroides, Bacteroides_uniformis showed decreasing trend, but the differences were not statistically significant (P>0.05).
ConclusionThe effect of Jianpi Qufeng Decoction in treating AD may be related to the changes in the abundance of Firmicutes and Bacteroidetes.
-
Keywords:
- atopic dermatitis /
- intestinal flora /
- Jianpi Qufeng Decoction /
- 16SrRNA sequencing
-
特应性皮炎(AD)是一种机体免疫失衡导致的慢性炎症性皮肤病[1], 中医学称其为“四弯风”。研究[2]证实,肠道菌群可以通过免疫、代谢和神经内分泌途径参与AD的发病,而中药则可以通过调节肠道菌群来治疗AD[3]。本课题组前期研究[4]显示,健脾祛风汤治疗脾虚型AD总有效率为82.11%。本研究探讨健脾祛风汤对AD患者肠道菌群的影响,以阐明其可能治疗机制。
1. 资料与方法
1.1 一般资料
本研究共纳入57例志愿者。将2015年4月—2017年4月在上海市嘉定区中医医院皮肤科门诊就诊的30例AD患者纳入治疗组(治疗前简称TB组,治疗后简称TA组),其中男18例,女12例; 平均年龄8.6岁。将27例健康儿童纳入健康对照组(简称N组),其中男17例,女10例,平均年龄8.0岁,均来自上海市嘉定区城中路小学和普通小学。2组入选者年龄、性别比较,差异均无统计学意义(P>0.05)。本研究获得医院医学伦理委员会批准,且研究对象及家长或监护人均知情同意。
治疗组纳入标准: ①符合WILLIAMS HC[5]诊断AD标准者; ② 6~12岁儿童; ③参照欧洲AD特别工作组确定的SCORAD系统[6], 病情严重度分级属轻、中度者; ④参照《中药新药临床研究指导原则(2002年)》[7], 符合湿疮脾虚证者(主症: 皮肤瘙痒,皮损以丘疹或丘疱疹为主,皮肤色暗淡或有鳞屑,少许渗出;次症: 食少乏力,腹胀便溏,小便清长或微黄); ⑤病程1年以上,每年缓解期≤3个月者; ⑥同意服用中药并签署知情同意书(监护人签字)者。排除标准: ①患有其他皮肤疾病者; ②近2个月内服过糖皮质激素或近2周内外用过此类药品者; ③近2个月内系统使用其他有效治疗药物者; ④在参加或入选前4周内,曾参加过其他药物临床试验者; ⑤心、肝、肾等脏器严重异常者; ⑥精神疾病、残疾、智力障碍者; ⑦近2周患腹泻等肠道疾病或使用抗生素者; ⑧近2周服用含益生菌等微生物制剂者; ⑨对已知试验药物过敏者; ⑩有可能无法完成本研究全过程者。健康对照组纳入标准: 6~12岁健康儿童。排除标准: ①近2周患腹泻等肠道疾病或使用抗生素者; ②近2周服用含益生菌等微生物制剂者。
1.2 方法
1.2.1 治疗方法
治疗组口服健脾祛风汤(炒白术15 g、白茯苓10 g、荷叶10 g、炒白芍10 g、升麻6 g、炒枳壳6 g、荆芥10 g、防风10 g、徐长卿12 g、白鲜皮15 g、黄芩12 g、苦参10 g、地黄10 g、甘草6 g), 水煎内服,1剂/d, 100 mL/次, 2次/d, 由本院中药煎药室制备; 同时外涂尿素乳膏(浙江康恩贝制药股份有限公司,国药准字H33022524), 使用时先用温水清洗患处,轻轻擦干后,将药物均匀涂于患处, 2次/d; 皮损渗出较重者,予生理盐水湿敷患处。共计观察6周。
1.2.2 样本采集
治疗组在治疗前后采集粪便,健康对照组仅在纳入研究时采集粪便。将粪便放在粪便收集盒中,要求避免尿液、灰尘等污染,选取中段无污染的部分,粪便标本量>1 g。标本采集后标记姓名,并进行编号,标记后存储于-20 ℃冰箱,干冰运送至上海美吉生物医药科技有限公司进行检测。
1.2.3 主要仪器及试剂
IlluminaMiseq型MISEQ测序仪购自美国Illumina公司; DNA抽提试剂盒购自美国Omega Bio-Tek公司; TruSeqTM DNA SamplePrepKit型Illumina MiSeq platform购自美国Illumina公司。
1.2.4 DNA提取及聚合酶链反应(PCR)扩增
根据E.Z.N.A.®soil试剂盒说明书进行总DNA抽提, DNA浓度和纯度利用NanoDrop 2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量; 用338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)引物对16S rDNA V3~V4可变区进行PCR扩增。
1.2.5 Illumina MiSeq测序及分析
应用上海美吉生物医药科技有限公司Illumina MiSeq测序平台对研究对象粪便细菌的16SrRNA基因V3~V4区进行高通量测序及分析。
1.3 观察指标
主要疗效评价指标: 采用欧洲特应性皮炎研究组(ETFAD)提出的评分标准(SCORAD评分)进行评估。
临床疗效评价标准: 参照《中药新药临床研究指导原则》中的疗效标准进行评定。有效率=(治疗前SCORAD分值-治疗后SCORAD分值)/治疗前SCORAD分值×100%。痊愈: 皮损全部消退,瘙痒症状消失,有效率≥90%; 显效: 皮损大部分消退,瘙痒明显减轻,有效率为60%~ < 90%; 进步: 皮损部分消退,瘙痒症状有所改善,有效率为20%~ < 60%; 无效: 皮损消退不明显,瘙痒未见减轻,或临床症状恶化,有效率 < 20%。总有效率=(痊愈+显效+进步)/总例数×100%。
1.4 统计学分析
应用SPSS 22.0软件进行统计分析,以P=0.05为检验标准。计量资料采用t检验,若不符合正态分布,采用秩和检验。借助I-Sanger生物信息云平台(http://www.i-sanger.com), 应用R的stats包和python的scipy包进行分析。选择2组丰度排名前15的门、属、种分别比较物种差异,采用Wilcoxon秩和检验, P < 0.05为差异有统计学意义; 通过计算物种之间的斯皮尔曼等级相关系数,构建物种相关性网络,借助Networkx网络分析工具包进行单因素相关性网络分析。
2. 结果
2.1 中药干预临床疗效及SCORAD评分结果
治疗组共纳入30例符合标准的患者,其中痊愈0例、显效18例、进步11例、无效1例,总有效率为96.67%。治疗后SCORAD评分(18.02±1.63)分,低于治疗前的(42.23±1.42)分,差异有统计学意义(P < 0.001)。
2.2 样本信息统计
治疗组共采集60个粪便样本,其中8个样本经检测不合格予以剔除,最终保留52个合格样本; 健康对照组共采集27个合格样本; 2组总计采集79个合格粪便样本。对样本物种注释分类后, 79个样本共获得1个域, 20个门, 36个纲, 60个目, 98个科, 262个属, 472个种, 643个可操作分类单元(OTU)。
2.3 物种组成分析
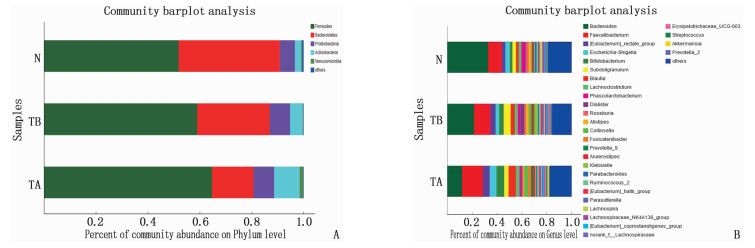
通过在门、属水平物种组成分析发现: TB组、TA组与N组肠道菌群组成主要为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)共5门,各组间相同门、属水平物种丰度比较存在一定差异,主要表现为TA组较TB组厚壁菌门、属水平物种丰度升高,以及拟杆菌门、属水平物种丰度降低,提示健脾祛风汤治疗后肠道菌群丰度发生变化,见图 1。
2.4 治疗前后门、属、种水平重要物种丰度比较
2.4.1 治疗前后门水平物种丰度比较
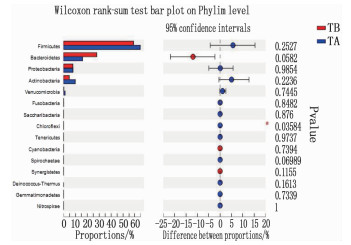
治疗后厚壁菌门(Firmicutes)呈升高趋势,拟杆菌门(Bacteroidetes)呈降低趋势,但差异无统计学意义(P>0.05); 与TB组比较,绿屈挠菌门(Chloroflexi)治疗后丰度增加,差异有统计学意义(P < 0.05), 见表 1、图 2。
表 1 治疗前后门水平物种丰度比较(x±s)% 门水平物种 TB组(n= 26) TA组(n=26) N组(n=27) Firmicutes 59.02±18.68 64.70±17.78 51.88±16.40 Bacteroidetes 27.93±20.64 16.00±15.01 38.98±15.95 Proteobacteria 7.85±10.12 7.94±9.48 5.80±7.62 Actinobacteria 4.81±5.11 9.85±16.33 2.43±2.62 Verrucomicrobia 0.20±0.55 1.29±3.56 0.35±1.14 Fusobacteria 0.09±0.20 0.11±0.40 0.50±1.67 Saccharibacteria 0.03±0.03 0.03±0.04 0.02±0.02 Chloroflexi 0.02±0.05 0.03±0.09* 0.002±0.01 与TB组比较, *P < 0.05。 2.4.2 治疗前后属水平物种丰度比较
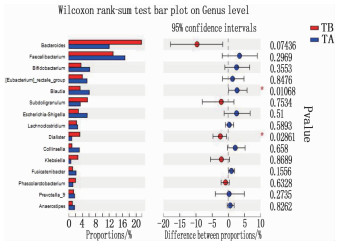
治疗后厚壁菌门下Faecalibacterium、[Eubacterium]_rectale_group、Blautia呈升高趋势。与TB组比较, Blautia丰度升高,差异有统计学意义(P < 0.05); 拟杆菌门下Bacteroides呈降低趋势,但差异无统计学意义(P>0.05), 见表 2、图 3。
表 2 治疗前后属水平物种丰度比较(x±s)% 属水平物种 TB组(n=26) TA组(n=26) N组(n=27) Bacteroides 21.67±17.88 12.04±11.81 33.14±15.73 Faecalibacterium 13.20±8.19 16.71±11.48 10.88±7.53 Bifidobacterium 3.63±4.38 6.23±9.56 2.06±2.57 [Eubacterium]_rectale_group 4.07±4.16 5.42±6.92 2.72±2.60 Blautia 3.37±4.20 6.11±6.27* 2.24±1.35 Subdoligranulum 5.57±12.69 3.43±4.18 2.82±5.03 Escherichia-Shigella 2.88±5.01 5.48±8.65 3.65±7.53 Lachnoclostridium 2.33±1.74 2.65±2.87 2.08±1.61 Dialister 3.31±5.03 0.89±2.00* 0.85±1.49 Collinsella 0.96±1.43 3.14±7.83 0.23±0.36 Klebsiella 2.72±8.51 0.62±1.25 0.36±1.03 与TB组比较, *P < 0.05。 2.4.3 治疗前后种水平物种丰度比较
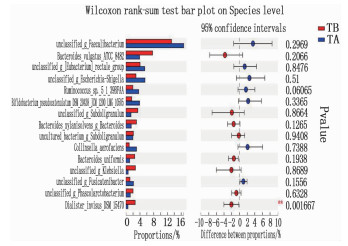
厚壁菌门下unclassified_g_Faecalibacterium、unclassified_g_[Eubacterium]_rectale_group、Ruminococcus_sp. _5_1_39BFAA呈升高趋势。排名靠后物种Dialister_invisus_DSM_15470呈降低趋势,差异有统计学意义(P < 0.01); 拟杆菌门下Bacteroides_vulgatus_ATCC_8482、Bacteroides_xylanisolvens_g_Bacteroides、Bacteroides_uniformis呈降低趋势,但差异均无统计学意义(P>0.05)。此外,致病菌unclassified_g_Klebsiella治疗后丰度降低,但差异无统计学意义(P>0.05)。见图 4、表 3。
表 3 治疗前后种水平物种丰度比较(x±s)% 种水平物种 TB组(n= 26) TA组(n=26) N组(n=27) unclassified_g_Faecalibacterium 13.20±8.19 16.71±11.48 10.88±7.53 Bacteroides_vulgatus_ATCC_8482 7.69±9.48 3.91±6.03 9.59±9.65 unclassified_g_[Eubacterium]_rectale_group 4.07±4.16 5.42±6.92 2.72±2.60 unclassified_g_Escherichia-Shigella 2.88±5.01 5.47±8.65 3.65±7.53 Ruminococcus_sp. _5_1_39BFAA 1.98±2.98 3.67±5.21 1.14±0.92 Bifidobacterium_pseudocatenulatum_DSM_20438_JCM_1200_LMG_10505 1.66±1.90 3.92±7.23 1.35±1.99 unclassified_g_Subdoligranulum 3.42±11.42 1.44±2.68 1.30±2.34 Bacteroides_xylanisolvens_g_Bacteroides 3.02±3.59 1.52±2.32 3.59±4.73 uncultured_bacterium_g_Subdoligranulum 2.15±3.41 1.99±2.66 1.52±3.84 Collinsella_aerofaciens 0.93±1.44 3.04±7.85 0.23±0.34 Bacteroides_uniformis 2.51±3.26 1.05±0.93 3.98±4.62 unclassified_g_Klebsiella 2.72±8.51 0.62±1.25 0.36±1.03 unclassified_g_Fusicatenibacter 1.15±1.22 2.17±2.24 0.84±0.82 unclassified_g_Phascolarctobacterium 2.04±2.90 1.24±1.67 2.73±2.92 Dialister_invisus_DSM_15470 2.66±4.94 0.57±1.72** 0.81±1.50 与TB组比较, **P < 0.01。 2.5 物种网络结构属性图及单因素相关性网络分析结果
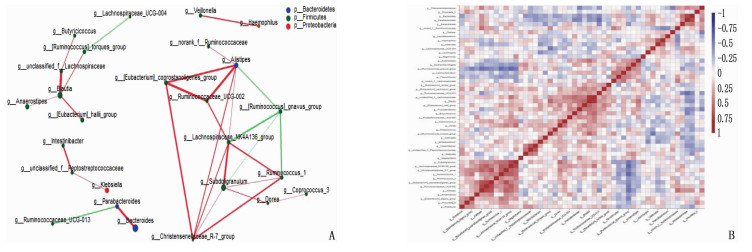
通过属、种水平网络结构属性图可以看出: AD患者肠道菌群不同属、种之间具有显著相互作用(绿色连线表示正相关,红色连线表示负相关,连线的粗细代表相关性系数的大小),见图 5A、图 6A。
物种相关性Heatmap图分析结果显示: 在属水平,重要物种厚壁菌门下Blautia与拟杆菌门下Bacteroides呈负相关(R=-0.41, P < 0.01), 见图 5B。在种水平,重要物种拟杆菌门下Bacteroides_vulgatus_ATCC_8482与Bacteroides_xylanisolvens_g_Bacteroides呈正相关(R=0.70, P < 0.001); 拟杆菌门下Bacteroides_uniformis与Bacteroides_vulgatus_ATCC_8482呈正相关(R=0.61, P < 0.001), 与厚壁菌门下Ruminococcus_sp. _5_1_39BFAA(R=-0.43, P < 0.001)、unclassified_g_Fusicatenibacter(R=-0.44, P < 0.001)呈负相关,见图 6B。提示菌群之间存在复杂的正、负相关作用,其中厚壁菌门与拟杆菌门下属菌群存在显著负相关。
3. 讨论
AD作为一种世界范围内常见的炎症性皮肤病,可发生于任何年龄,近年来,儿童AD的患病率呈上升趋势[8]。目前,关于AD的发病机制仍未完全阐明, Th1、Th2、Th17、Treg等细胞因子在AD的发生发展中为异质性且动态变化[9-10]。研究[11]证实,皮肤及肠道微生物可以通过多条途径参与AD的发病,而中药则可以通过调节肠道菌群治疗AD[3]。
人体内95%的微生物群存在于肠道,且主要集中在结肠,这些肠道微生物可以通过多条途径影响机体功能,当其发生变化时,可以导致疾病的发生[11]。研究[12]证实,人在5岁以后,其肠道微生物组的组成趋于相对稳定状态,故本研究选取6~12岁人群为研究对象; 此外,应用Illumina Miseq测序平台对研究对象粪便细菌的16SrRNA基因V3~V4区进行高通量测序检测肠道菌群[13]。双歧杆菌、链球菌、乳球菌和乳酸杆菌被认为是人类幼年时最丰富的细菌种类之一,而拟杆菌和厚壁菌则在成年期更为丰富[14]。本研究发现, TB组、TA组与N组肠道菌群组成中占优势的菌有厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门,与相关研究[15]结果相一致,提示整个实验过程中肠道菌群检测结果相对稳定,具有可比性。
肠道微生物群组成及其与宿主关系的失衡可能与过敏性疾病的发生有关。微生物群组成与特应性症状和(或)过敏之间存在关联,但无法确定哪些微生物与过敏性疾病的发生相关[16]。MELLI L C等[17]发现过敏性疾病肠道菌群表现为拟杆菌属(Bacteroides)丰度增加。PETERSEN E B M等[18]对PubMed中相关文章分析发现,所有研究主要集中在探讨AD患者肠道菌群中双歧杆菌、梭状芽孢杆菌、拟杆菌和乳酸杆菌等的变化情况,但报道结果不一,且具体作用机制仍未阐明。2018年本课题组在AD患者与健康人群肠道菌群差异研究中发现AD患者与健康人肠道菌群存在差异,推测拟杆菌可能在AD的发病中发挥重要作用[19]。此外,本课题组前期在进行AD患儿与正常儿童肠道菌群Network网络分析研究中还发现,拟杆菌门与厚壁菌门存在负相关作用[20]。近来, YE S Q等[21]研究发现, AD患者肠道菌群中Porphyromonadaceae、Blautia、Parabacteroides、Bacteroides ovatus、Bacteroides uniformis、Prevotellastercorea丰度增高, Clostridium and P. stercorea丰度降低; 推测Bacteroidaceae、Porphyromonadaceae可以区分AD患者与健康人。基于本课题组前期研究成果,结合已有研究报道,提示肠道菌群中拟杆菌及厚壁菌物种丰度变化参与AD的发病。本研究显示,治疗后拟杆菌及厚壁菌物种丰度在门、属、种不同水平发生变化,主要表现为拟杆菌门及其下属、种水平丰度呈现降低趋势,而厚壁菌门及其下属、种水平丰度呈现升高趋势;物种相关性分析显示,拟杆菌门及厚壁菌门相关属、种物种存在负相关,同时network网络研究显示拟杆菌门下Bacteroides_uniformis与Bacteroides_vulgatus_ATCC_8482发挥重要作用,提示拟杆菌门物种丰度降低具有重要意义。此外,有研究[22]认为Faecalibacteriumprausnitzii降低是AD诊断标记物。本研究中, Faecalibacterium[TB: (13.20±8.19), TA: (16.71±11.48)]及其下种unclassified_g_Faecalibacterium[TB: (13.2±8.19), TA: (16.71±11.48)]治疗后丰度增加明显,进一步验证了这一研究结果。
综上所述,健脾祛风汤的治疗作用可能与厚壁菌门及拟杆菌门物种丰度的变化相关。但本研究存在样本量相对不足,健康对照组的设定方法不够严谨等问题,今后将进一步完善,并深入开展以代谢组学为主的机制研究。
-
表 1 治疗前后门水平物种丰度比较(x±s)
% 门水平物种 TB组(n= 26) TA组(n=26) N组(n=27) Firmicutes 59.02±18.68 64.70±17.78 51.88±16.40 Bacteroidetes 27.93±20.64 16.00±15.01 38.98±15.95 Proteobacteria 7.85±10.12 7.94±9.48 5.80±7.62 Actinobacteria 4.81±5.11 9.85±16.33 2.43±2.62 Verrucomicrobia 0.20±0.55 1.29±3.56 0.35±1.14 Fusobacteria 0.09±0.20 0.11±0.40 0.50±1.67 Saccharibacteria 0.03±0.03 0.03±0.04 0.02±0.02 Chloroflexi 0.02±0.05 0.03±0.09* 0.002±0.01 与TB组比较, *P < 0.05。 表 2 治疗前后属水平物种丰度比较(x±s)
% 属水平物种 TB组(n=26) TA组(n=26) N组(n=27) Bacteroides 21.67±17.88 12.04±11.81 33.14±15.73 Faecalibacterium 13.20±8.19 16.71±11.48 10.88±7.53 Bifidobacterium 3.63±4.38 6.23±9.56 2.06±2.57 [Eubacterium]_rectale_group 4.07±4.16 5.42±6.92 2.72±2.60 Blautia 3.37±4.20 6.11±6.27* 2.24±1.35 Subdoligranulum 5.57±12.69 3.43±4.18 2.82±5.03 Escherichia-Shigella 2.88±5.01 5.48±8.65 3.65±7.53 Lachnoclostridium 2.33±1.74 2.65±2.87 2.08±1.61 Dialister 3.31±5.03 0.89±2.00* 0.85±1.49 Collinsella 0.96±1.43 3.14±7.83 0.23±0.36 Klebsiella 2.72±8.51 0.62±1.25 0.36±1.03 与TB组比较, *P < 0.05。 表 3 治疗前后种水平物种丰度比较(x±s)
% 种水平物种 TB组(n= 26) TA组(n=26) N组(n=27) unclassified_g_Faecalibacterium 13.20±8.19 16.71±11.48 10.88±7.53 Bacteroides_vulgatus_ATCC_8482 7.69±9.48 3.91±6.03 9.59±9.65 unclassified_g_[Eubacterium]_rectale_group 4.07±4.16 5.42±6.92 2.72±2.60 unclassified_g_Escherichia-Shigella 2.88±5.01 5.47±8.65 3.65±7.53 Ruminococcus_sp. _5_1_39BFAA 1.98±2.98 3.67±5.21 1.14±0.92 Bifidobacterium_pseudocatenulatum_DSM_20438_JCM_1200_LMG_10505 1.66±1.90 3.92±7.23 1.35±1.99 unclassified_g_Subdoligranulum 3.42±11.42 1.44±2.68 1.30±2.34 Bacteroides_xylanisolvens_g_Bacteroides 3.02±3.59 1.52±2.32 3.59±4.73 uncultured_bacterium_g_Subdoligranulum 2.15±3.41 1.99±2.66 1.52±3.84 Collinsella_aerofaciens 0.93±1.44 3.04±7.85 0.23±0.34 Bacteroides_uniformis 2.51±3.26 1.05±0.93 3.98±4.62 unclassified_g_Klebsiella 2.72±8.51 0.62±1.25 0.36±1.03 unclassified_g_Fusicatenibacter 1.15±1.22 2.17±2.24 0.84±0.82 unclassified_g_Phascolarctobacterium 2.04±2.90 1.24±1.67 2.73±2.92 Dialister_invisus_DSM_15470 2.66±4.94 0.57±1.72** 0.81±1.50 与TB组比较, **P < 0.01。 -
[1] KIM J, KIMB E, LEUNGD Y M. Pathophysiology of atopic dermatitis: clinical implications[J]. Allergy Asthma Proc, 2019, 40(2): 84-92. doi: 10.2500/aap.2019.40.4202
[2] 张杰, 郑晓草, 曹先伟. 特应性皮炎与肠道微生物组的相关性[J]. 中国麻风皮肤病杂志, 2020, 36(2): 122-125. https://www.cnki.com.cn/Article/CJFDTOTAL-MALA202002023.htm [3] 马欣, 王雪娇, 丁佩军, 等. 中医药调节肠道菌群治疗特应性皮炎研究进展[J]. 上海中医药杂志, 2017, 51(S1): 257-261. https://www.cnki.com.cn/Article/CJFDTOTAL-SHZZ2017S1068.htm [4] 彭勇, 李斌, 李锋, 等. 健脾祛风方治疗特应性皮炎95例临床观察[J]. 上海中医药大学学报, 2013, 27(3): 45-47. https://www.cnki.com.cn/Article/CJFDTOTAL-SHZD201303017.htm [5] WILLIAMS H C, BURNEY P G, HAY R J, et al. The U. K. Working Party's Diagnostic Criteria for Atopic Dermatitis. I. Derivation of a minimum set of discriminators for atopic dermatitis[J]. Br J Dermatol, 1994, 131(3): 383-396. doi: 10.1111/j.1365-2133.1994.tb08530.x
[6] No authors listed. Consensus Report of the European Task Force on Atopic Dermatitis. Severity scoring of atopic dermatitis: the SCORAD index[J]. Dermatology, 1993, 186(1): 23-31. doi: 10.1159/000247298
[7] 郑筱萸. 中药新药临床研究指导原则: 试行[M]. 北京: 中国医药科技出版社, 2002: 1-10. [8] CHEN L P, HUANG X Y, XIAO Y, et al. Prevalence and risk factors of atopic dermatitis, psoriasis, acne, and urticaria in China[J]. J Central South Univ Med Sci, 2020, 45(4): 449-455.
[9] 张帆. 辅助性T细胞与调节性T细胞平衡在特应性皮炎中的作用分析[J]. 辽宁医学杂志, 2021, 35(2): 63-66. https://www.cnki.com.cn/Article/CJFDTOTAL-LNYX202102024.htm [10] 王斌, 黄功华, 刘新光. DC介导的Th2细胞免疫紊乱在Th2细胞免疫紊乱相关过敏性疾病中的研究进展[J]. 医学综述, 2021, 27(10): 1873-1879. doi: 10.3969/j.issn.1006-2084.2021.10.001 [11] DUPONTH L, JIANGZ D, DUPONTA W, et al. Theintestinalmicrobiomeinhumanhealthanddisease[J]. Trans Am Clin Climatol Assoc, 2020, 131: 178-197.
[12] CHENG J, RINGEL-KULKA T, HEIKAMP-DE JONG I, et al. Discordant temporal development of bacterial Phyla and the emergence of core in the fecal microbiota of young children[J]. ISME J, 2016, 10(4): 1002-1014.
[13] RAPIN A, PATTARONI C, MARSLANDB J, et al. Microbiota analysis using an illuminaMiSeqplatform to sequence 16S rRNA genes[J]. CurrProtoc Mouse Biol, 2017, 7(2): 100-129.
[14] YATSUNENKO T, REYF E, MANARYM J, et al. Human gut microbiome viewed across age and geography[J]. Nature, 2012, 486(7402): 222-227.
[15] CRESCIG A, BAWDEN E. Gut microbiome: what we do and don't know[J]. Nutr Clin Pract, 2015, 30(6): 734-746.
[16] PENDERS J, STOBBERINGHE E, VANDEN BRANDTP A, et al. The role of the intestinal microbiota in the development of atopic disorders[J]. Allergy, 2007, 62(11): 1223-1236.
[17] MELLIL C, DO CARMO-RODRIGUESM S, ARAÙJO-FILHOH B, et al. Intestinal microbiota and allergic diseases: a systematic review[J]. AllergolImmunopathol (Madr), 2016, 44(2): 177-188.
[18] PETERSENE B M, SKOV L, THYSSENJ P, et al. Role of the gut microbiota in atopic dermatitis: asystematic review[J]. Acta DermVenereol, 2019, 99(1): 5-11.
[19] 罗瑞静, 刘杰, 彭勇, 等. 特应性皮炎患儿与正常儿童肠道菌群差异性研究[J]. 中华皮肤科杂志, 2019, 52(10): 767-770. [20] 罗瑞静. 特应性皮炎患儿与正常儿童肠道菌群Network网络分析[J]. 中国皮肤性病学杂志, 2021, 35(2): 143-147. https://www.cnki.com.cn/Article/CJFDTOTAL-ZBFX202102005.htm [21] YE S Q, YAN F G, WANG H Y, et al. Diversity analysis of gut microbiota between healthy controls and those with atopic dermatitis in a Chinese population[J]. J Dermatol, 2021, 48(2): 158-167.
[22] SONG H, YOO Y, HWANG J, et al. Faecalibacteriumprausnitzii sub species-level dysbiosis in the human gut microbiome underlying atopic dermatitis[J]. J Allergy Clin Immunol, 2016, 137(3): 852-860.
-
期刊类型引用(4)
1. 张宁,安月鹏,杨素清. 基于“肠-皮肤”轴探讨肠道菌群干预特应性皮炎的机制及中医药治疗进展. 中草药. 2025(04): 1404-1413 .  百度学术
百度学术
2. 罗瑞静,彭勇,王英杰,刘杰,姜珠倩,武宗琴. 四弯风汤治疗儿童特应性皮炎心火脾虚证的临床疗效研究. 世界临床药物. 2025(01): 50-54 .  百度学术
百度学术
3. 刘保红,张胤弢,李博,张楚懿,文越,赵天宇,李帆. 基于CiteSpace的皮肤病学领域肠道菌群研究热点和前沿分析. 中国微生态学杂志. 2024(05): 518-528 .  百度学术
百度学术
4. 李阳梅,冯霞,陈若曦,赵一丁. 基于肠-脑-皮轴探讨中医药治疗特应性皮炎的研究进展. 国际中医中药杂志. 2024(03): 405-409 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号