Mechanism of metformin combined with letrozole in improving progesterone sensitivity of endometrial carcinoma
-
摘要:目的
探讨二甲双胍联合来曲唑改善人子宫内膜癌裸鼠皮下移植肿瘤孕激素敏感性的机制。
方法将40只雌性裸鼠随机分为对照组和雌激素组,每组20只。雌激素组和对照组又随机分为4个亚组,即生理盐水组(生理盐水灌胃)、甲羟孕酮(MPA)组(MPA 100 mg/kg腹腔注射, 0.3 mL/只)、来曲唑联合MPA组(来曲唑7 mg/kg灌胃给药, 0.1 mL/只; MPA用法用量同MPA组)、二甲双胍联合来曲唑及MPA组(二甲双胍200 mg/kg灌胃给药, 0.1 mL/只; 来曲唑、MPA用法用量同来曲唑联合MPA组),每组5只。治疗期间,定期测量裸鼠体质量及肿瘤大小。实验完成后,检测裸鼠血清性激素; 取出移植癌细胞瘤,测定瘤体体积,并绘制瘤体增长速率图,从而分析药物对肿瘤细胞生长的抑制作用。采用免疫组化法检测肿瘤细胞中雌激素受体(ER)、孕激素受体(PR)、核因子E2相关因子2(Nrf2)、人源性长寿保障基因2(Lass2)的表达水平。
结果在雌激素组与对照组的各亚组中,二甲双胍联合来曲唑及MPA组裸鼠血清雌激素水平均低于MPA组,差异有统计学意义(P < 0.05)。雌激素组与对照组的各亚组裸鼠的体质量比较,差异无统计学意义(P>0.05)。在雌激素组中, MPA组、来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组对Ishikawa细胞移植瘤生长抑制率分别为48.25%、67.97%、75.43%, 均高于生理盐水组0%的肿瘤抑制率,差异均有统计学意义(P < 0.05)。在对照组中, MPA组、来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组对Ishikawa细胞移植瘤生长抑制率分别为49.46%、69.97%、75.96%, 均高于生理盐水组0%的肿瘤抑制率,差异有统计学意义(P < 0.05)。免疫组化结果显示,在雌激素组中,来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组中Nrf2、Lass2的表达低于生理盐水组,差异有统计学意义(P < 0.05); 在雌激素组与对照组间,采取相同治疗方式的亚组裸鼠移植瘤中的ER表达差异无统计学意义(P>0.05); 在雌激素组和对照组中,来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组的PR表达均高于生理盐水组,差异有统计学意义(P < 0.05)。
结论二甲双胍联合来曲唑可有效缓解人子宫内膜癌裸鼠移植瘤的孕激素耐药性,其机制可能与下调Nrf2/Lass2表达有关。
Abstract:ObjectiveTo explore the mechanism of metformin combined with letrozole in improving progesterone sensitivity of subcutaneously transplanted tumor in nude mice with human endometrial carcinoma.
MethodsForty female nude mice were randomly divided into control group and estrogen group, with 20 mice in each group. The estrogen group and the control group were randomly divided into normal saline group (intragastric administration with normal saline), medroxyprogesterone (MPA) group (intraperitoneal injection with 100 mg/kg MPA, 0.3 mL per mouse), letrozole plus MPA group (intragastric administration with 7 mg/kg letrozole, 0.1 mL per mouse, usage and dosage of MPA were the same as the MPA group), and metformin plus letrozole and MPA group (intragastric administration with 200 mg/kg metformin, 0.1 mL permouse, usage and dosage of letrozole and MPA were the same as letrozole plus MPA group), with 5 mice in each group. During the treatment, the body mass and tumor size of mice were measured regularly. After finishing the experiment, the serum sex hormones of mice were detected; the cytoma of transplanted cancer was taken out, the tumor volume was measured, and the graph of tumor growth rate was drawn to analyze the inhibitory effect of drugs on the growth of tumor cells. The expression levels of estrogen receptor (ER), progesterone receptor (PR), nuclear factor E2-related factor 2 (Nrf2) and homo sapiens longevity assurance homologue 2 (Lass2) in tumor cells were detected by immunohistochemistry.
ResultsIn each subgroup of estrogen group and control group, the serum estrogen level of mice in the metformin plus letrozole and MPA group was significantly lower than that in the MPA group (P < 0.05). There was no significant difference in body mass in subgroups between the estrogen group and the control group (P>0.05). The inhibited rates of the growth of transplanted tumor of Ishikawa cell in the estrogen group, the MPA group, the letrozole plus MPA group, the metformin plus letrozole and MPA group were 48.25%, 67.97% and 75.43%, respectively, which were significantly higher than the 0% of normal saline group (P < 0.05). In the control group, the inhibitory rates of the MPA group, the letrozole plus MPA group, the metformin plus letrozole and MPA group on the growth of transplanted tumor of Ishikawa cell were 49.46%, 69.97% and 75.96%, respectively, which were significantly higher than the 0% of the normal saline group (P < 0.05). Immunohistochemical results showed that in the estrogen group, the expressions of Nrf2/Lass2 in the letrozole plus MPA group as well as the metformin plus letrozole and MPA group were significantly lower than that in the normal saline group (P < 0.05); in both estrogen group and control group, there was no significant difference in ER expression of transplanted tumor between subgroups with the same therapeutic method (P>0.05); in both estrogen group and the control group, the PR expressions in the letrozole plus MPA group as well as metformin plus letrozole and MPA group were significantly higher than those in the normal saline group (P < 0.05).
ConclusionMetformin plus letrozole can effectively alleviate the progesterone resistance of transplanted tumor in mice with human endometrial carcinoma, and its mechanism may be related to the down-regulation of Nrf2/Lass2 expression.
-
Keywords:
- endometrial carcinoma /
- progesterone /
- sensitivity /
- letrozole /
- metformin /
- medroxyprogesterone /
- estrogen receptor /
- progesterone receptor
-
子宫内膜癌作为妇科常见的恶性肿瘤,其发病呈年轻化的趋势[1]。目前,临床上治疗子宫内膜癌主要采用手术联合术后辅助化疗[2]。对于年轻的、有生育要求的、晚期复发的以及不宜接受手术的子宫内膜癌患者,可采用孕激素保守治疗,即应用醋酸甲羟孕酮(MPA)治疗此类子宫内膜癌患者[3]。研究[3]发现孕激素结合孕激素受体(PR)可延缓DNA及RNA的复制,降低雌激素受体(ER)表达,进而减少子宫内膜癌细胞的增殖,促进细胞分化。然而,临床上仍有约30%的子宫内膜癌患者对孕激素治疗无反应,约47%的患者在首次孕激素治疗后复发或发展为孕激素抵抗[4]。本课题组前期细胞研究[5]结果表明,外源性雌激素作用后可显著上调子宫内膜癌细胞中核因子E2相关因子2/人源性长寿保障基因2(Nrf2/ Lass2 )的mRNA表达水平,且 Lass2 可介导Nrf2调控的子宫内膜癌孕激素治疗敏感性。本研究通过构建子宫内膜癌Ishikawa细胞裸鼠移植模型,采用动物实验证明 Lass2 介导Nrf2调控的子宫内膜癌孕激素敏感性的改善作用,为临床上应用来曲唑联合二甲双胍改善子宫内膜癌的孕激素耐药性提供更多的研究数据。
1. 材料与方法
1.1 实验材料
人子宫内膜癌Ishikawa细胞,储存于上海市第一人民医院妇产科研究室; Balb/c裸鼠40只,雌性, 6~8周龄,体质量20~24 g, 购自上海西普尔-必凯实验动物公司,由上海市第一人民医院动物中心喂养; 二甲双胍及MPA购自Sigma公司,二甲双胍、MPA均溶解于无菌的生理盐水中; ER、PR、Nrf2、Lass2单克隆抗体均购自Sigma公司。
1.2 细胞培养
常规复苏Ishikawa细胞,转移至含胎牛血清10%、青霉素100 U/L、链霉素100 U/L的DMEM-F12培养基中,而后迅速置于37 ℃、5%CO2、饱和湿度的培养箱内培养及传代,细胞贴壁生长,采集对数生长期的细胞用于后续的实验。
1.3 子宫内膜癌裸鼠移植瘤模型的建立和处理
1.3.1 建立子宫内膜癌裸鼠移植瘤模型
适应性饲养7 d后,将40只雌性裸鼠随机分为对照组和雌激素组,每组20只。雌激素组每只裸鼠接种后连续给予补佳乐0.05 mg(相当于人类剂量2 mg/d, 溶于2 mL生理盐水中),灌胃1次/d。7 d后, 2组裸鼠均接种Ishikawa细胞,取对数生长期的子宫内膜癌肿瘤细胞,经0.25%的胰蛋白酶分解后配制成107/mL的单细胞悬液,在无菌条件下于裸鼠右腋处进行皮下接种,每只裸鼠注射0.2 mL, 细胞计数约为2×106。注射7~10 d后,可见瘤体增长。
1.3.2 实验分组与处理
细胞接种后第14天,移植瘤的平均长径为0.5~1.0 cm。遵循肿瘤体积与裸鼠质量平衡的原则,将对照组和雌激素组的裸鼠再随机分为4组,每组5只,即生理盐水组、MPA组(MPA 100 mg/kg腹腔注射,每只裸鼠0.3 mL)、来曲唑联合MPA组(来曲唑7 mg/kg, 每只裸鼠0.1mL, MPA剂量及用法同MPA组)、二甲双胍联合来曲唑及MPA组(二甲双胍200 mg/kg灌胃给药,每只裸鼠0.1 mL, 其他药物用法同来曲唑联合MPA组)。二甲双胍和来曲唑均为灌胃给药, 1次/d, 共给药21次; MPA经腹腔注射给药,3次/周,共给药9次; 生理盐水组裸鼠给予等体积的生理盐水灌胃。
1.4 观察指标
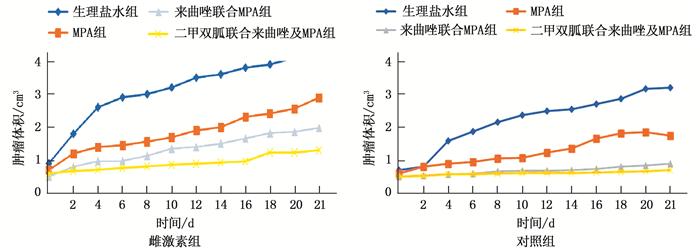
成瘤后,采用游标卡尺对裸鼠进行皮下肿瘤瘤体的长径a(cm)和短径b(cm)的测量并称重,观察裸鼠的行为。用药3周后,对成瘤裸鼠进行解剖,测量瘤体的体积,计算肿瘤抑制率。肿瘤体积(cm3)=a×b2×1/6×π。肿瘤抑制率=(对照组肿瘤体积-实验组肿瘤体积)/对照组肿瘤体积×100%。以各组移植瘤瘤体的平均体积作为纵轴,用药后的时间作为横轴,绘制肿瘤的生长曲线。
末次给药后30 min, 采取颈椎错位法处死裸鼠,经眼球采血,以3 000转/min离心15 min, 收集裸鼠血清,按照试剂盒说明书进行操作,采用酶联免疫夹心法检测裸鼠血清雌激素及雌激素水平。
1.5 免疫组化法检测肿瘤组织中ER、PR、Nrf2、Lass2的蛋白表达
采用免疫组化染色法,石蜡切片并常规脱蜡至水化,使用蒸馏水冲洗,而后PBS冲洗,配制1 L的柠檬酸修复液(一水合柠檬酸0.4 g和柠檬酸二钠3 g), 调整pH值为6.0; 将切片放入修复液,采用高压煮沸10 min, 使其自然状态下降至室内温度, PBS冲洗3次,抗原修复; 先用3%过氧化氢室温孵育10 min, 再行PBS冲洗,再用10%山羊血清室温封闭; 滴加适当稀释比例的一抗, 4 ℃孵育过夜(Nrf2抗体1∶ 100, Lass2抗体1∶ 200), 室温孵育1 h, PBS缓冲液洗涤,滴加二抗,室温孵育30 min, PBS洗涤,DAB显色,苏木紫复染,干燥封片。显微镜下观察并拍摄照片。随机抽取各亚组中3份裸鼠肿瘤标本,制成病理切片,并请病理科医生读片。
1.6 统计学处理
采用SPSS 23.0统计软件进行数据分析,计量资料采用(x±s)表示,比较采用独立样本t检验、单因素方差分析及LSD检验。计数资料的比较采用χ2检验。P < 0.05为差异有统计学意义。
2. 结果
2.1 各组裸鼠血清雌激素及孕激素比较
在雌激素组中,各亚组裸鼠用药后,二甲双胍联合来曲唑及MPA组裸鼠血清雌激素水平低于MPA组,差异有统计学意义(P < 0.05)。在对照组中,各亚组裸鼠用药后,二甲双胍联合来曲唑及MPA组裸鼠血清雌激素水平也低于MPA组,差异有统计学意义(P < 0.05)。雌激素组与对照组用药后裸鼠血清雌激素及孕激素比较,差异无统计学意义(P>0.05)。见表 1。
表 1 雌激素组与对照组中各亚组裸鼠用药后血清雌激素及孕激素比较(x±s)pmol/L 组别 亚组 雌激素 孕激素 雌激素组(n=20) 生理盐水组(n=5) 208.03±33.31 0.55±2.09 MPA组(n=5) 195.95±28.47 1.23±2.94 来曲唑联合MPA组(n=5) 160.34±32.84 0.93±1.16 二甲双胍联合来曲唑及MPA组(n=5) 135.88±26.35* 0.65±3.21 对照组(n=20) 生理盐水组(n=5) 258.43±27.86 0.65±1.59 MPA组(n=5) 148.02±29.12 1.44±3.04 来曲唑联合MPA组(n=5) 138.80±35.79 1.21±0.96 二甲双胍联合来曲唑及MPA组(n=5) 117.36±31.98* 0.90±2.06 与MPA组比较, *P < 0.05。 2.2 各亚组裸鼠移植瘤生长情况比较
从移植肿瘤开始,每天对移植部位进行观察发现,肿瘤局部发红,略有肿胀,肿瘤体积逐渐变大,肿瘤形状为圆形或卵形,质地坚硬。各亚组裸鼠在成瘤后,其前期运动状态无明显变化; 成瘤晚期时,因肿瘤体积逐渐增大,裸鼠的运动能力降低,但各亚组裸鼠的体质量比较,差异仍无统计学意义(P>0.05)。见表 2。
表 2 各亚组裸鼠用药前与用药后的体质量变化比较(x±s)g 组别 亚组 用药前体质量 用药后体质量 变化值 雌激素组(n=20) 生理盐水组(n=5) 22.12±2.18 22.58±2.86 0.40±2.19 MPA组(n=5) 21.75±2.47 21.08±2.12 -0.67±2.94 来曲唑联合MPA组(n=5) 22.34±2.84 21.80±2.79 -0.54±3.16 二甲双胍联合来曲唑及MPA组(n=5) 22.88±2.35 22.36±1.98 -0.52±4.21 对照组(n=20) 生理盐水组(n=5) 22.35±2.16 22.65±2.48 0.30±2.32 MPA组(n=5) 22.30±2.41 21.78±1.79 -0.52±2.15 来曲唑联合MPA组(n=5) 21.87±2.46 21.46±1.86 -0.41±1.87 二甲双胍联合来曲唑及MPA组(n=5) 22.07±1.76 22.38±2.92 0.31±2.97 2.3 来曲唑联合二甲双胍改善子宫内膜癌移植瘤孕激素敏感性
药物治疗21 d后,在雌激素组中, MPA组、来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组对Ishikawa细胞移植瘤生长抑制率分别为48.25%、67.97%、75.43%, 与生理盐水组0%的肿瘤抑制率比较,差异均有统计学意义(P < 0.05)。在对照组中, MPA组、来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组对Ishikawa细胞移植瘤生长抑制率分别为49.46%、69.97%、75.96%, 与生理盐水组0%的肿瘤抑制率比较,差异均有统计学意义(P < 0.05)。见表 3。
表 3 各亚组裸鼠移植瘤体积及肿瘤抑制率比较(x±s)组别 亚组 肿瘤体积/cm3 肿瘤抑制率/% 雌激素组(n=20) 生理盐水组(n=5) 3.76±2.34 0 MPA组(n=5) 1.96±1.04 48.25* 来曲唑联合MPA组(n=5) 1.23±0.93 67.97* 二甲双胍联合来曲唑及MPA组(n=5) 0.94±2.46 75.43* 对照组(n=20) 生理盐水组(n=5) 2.47±1.24 0 MPA组(n=5) 1.28±1.01 49.46* 来曲唑联合MPA组(n=5) 0.79±0.75 69.97* 二甲双胍联合来曲唑及MPA组(n=5) 0.63±0.82 75.96* 与生理盐水组比较, *P < 0.05。 肿瘤生长曲线显示,雌激素组与对照组中, MPA组、来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组的肿瘤生长曲线斜率均小于生理盐水组,其中二甲双胍联合来曲唑及MPA组肿瘤生长速度最慢。见图 1。
2.4 免疫组化分析各亚组裸鼠移植瘤中ER、PR、Nrf2、Lass2蛋白表达
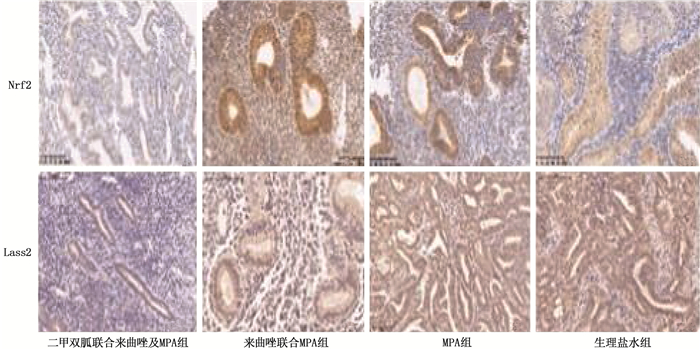
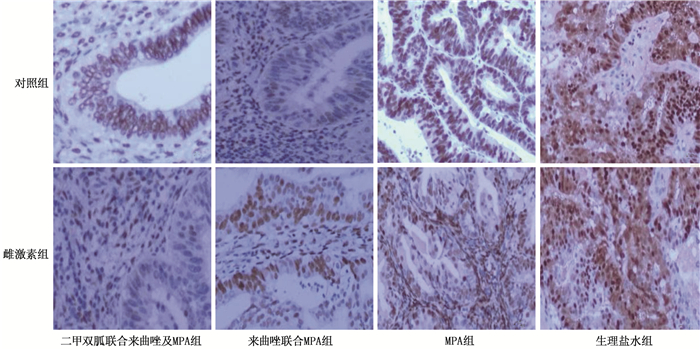
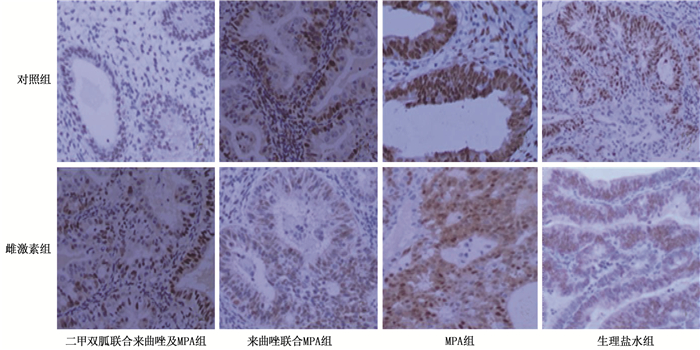
免疫组化结果显示,在雌激素组中,来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组中Nrf2、Lass2的表达低于生理盐水组,差异有统计学意义(P < 0.05), 见图 2。在雌激素组与对照组间,采取相同治疗方式的亚组裸鼠移植瘤中的ER表达差异无统计学意义(P>0.05), 见图 3。在雌激素组和对照组中,来曲唑联合MPA组、二甲双胍联合来曲唑及MPA组的PR表达均高于生理盐水组,差异有统计学意义(P < 0.05), 见图 4。
3. 讨论
按照美国国立综合癌症网络(NCCN)指南[6],子宫内膜癌的传统外科治疗方式为全子宫切除和双附件切除,并按临床分期进行盆腔淋巴结清扫联合腹主动脉旁淋巴结清扫。研究[7]显示,子宫内膜癌的中位发病年龄为63岁,其中约30%的患者在绝经前发病,而标准手术疗法不仅会导致年轻患者丧失生育能力,而且会使绝经前女性丧失卵巢内分泌功能,严重影响患者的生活质量。GARZON S等[8]研究表明,大剂量黄体酮可以作为早期子宫内膜癌的一种保守疗法,但临床中仍有约30%的患者对孕激素治疗不敏感。有关孕激素耐药的研究较多,多与ER、PR的不同表达以及对药物的敏感性有关[9-10], 而胰岛素抵抗、肥胖等也可能与女性生殖内分泌系统异常有关[11], 从而影响了肿瘤的发展及药物治疗。
FERGUSON S E等[12]提出了子宫内膜癌分型的概念,根据其与雌激素的关系,将子宫内膜癌分为雌激素依赖型和非雌激素依赖型。来曲唑属于芳香化酶抑制剂,可抑制人体内雌激素的分泌,还能有效阻止由雌激素诱发的癌细胞增殖。王巧莲等[13]研究表明,来曲唑可以明显抑制子宫内膜癌移植瘤的增长,但10 μg/d来曲唑的效果并不优于1 μg/d来曲唑的效果,考虑是小剂量的来曲唑便能阻断雌激素的产生[13]。本研究结果显示,来曲唑联合MPA组的肿瘤抑制率显著高于生理盐水组(P < 0.05)。Nrf2是抗氧化应激的主要调节因子,抗氧化反应原件(ARE)与其结合后,可正向调控抗氧化酶基因、Ⅱ相解毒酶基因及药物转运泵基因等众多下游基因网络的表达。CHEN N等[14]认为Nrf2具有抗氧化应激和细胞保护作用,并可保护肿瘤细胞免受免疫系统和抗肿瘤药物的氧化损害,并通过激活一系列的药物代谢和抗凋亡基因来实现对肿瘤细胞的放疗。本课题组前期研究[5]结果提示,与正常子宫内膜组织相比, Nrf2/Lass2在子宫内膜癌组织中呈高表达; 增殖测定表明Nrf2/Lass2的过度表达导致孕激素抗性; 相反的,敲低Lass2则会增加细胞凋亡并降低细胞活力。此外,二甲双胍可通过下调Nrf2/Lass2表达克服孕激素抵抗。
本研究结果显示,来曲唑联合二甲双胍及MPA、来曲唑联合MPA均可显著抑制孕激素敏感的Ishikawa细胞移植瘤的生长(P < 0.05); 免疫组织化学分析结果表明,来曲唑联合MPA治疗后肿瘤组织孕激素耐药相关因子Nrf2、Lass2在组织内的表达显著低于生理盐水组(P < 0.05)。研究[15]证明芳香化酶抑制剂阿那曲唑可以抑制局部雌激素合成,其可能通过抑制编码芳香化酶CYP19来实现,从而能够抑制子宫内膜癌的进展。有研究[16]表明,二甲双胍可以改善子宫内膜癌细胞对黄体酮的耐药性,其机制是通过增加PR-β蛋白的表达来改善耐药细胞对黄体酮的耐药性。本研究结果表明,二甲双胍联合来曲唑及MPA对孕激素敏感性Ishikawa细胞的增殖有显著的抑制作用(P < 0.05), 且肿瘤抑制率高于来曲唑联合MPA组(P>0.05)。本研究免疫组化结果显示,生理盐水组肿瘤组织中Nrf2/Lass2的阳性表达显著较少(P < 0.05), 与肿瘤生长减慢的趋势相同。Nrf2/Lass2在子宫内膜癌的耐药中起着重要的调节作用,作者认为其机制可能是来曲唑通过阻断裸鼠体内雌激素的合成而抑制子宫内膜癌肿瘤细胞的生长,同时来曲唑还能够降低体内雌激素的表达,降低肿瘤耐药相关因子Nrf2/Lass2的表达。
研究[17]认为PR阴性提示孕激素治疗预后较差。16%~34%的年轻患者存在免疫组化错配修复蛋白表达缺陷[18]。相较于正常错配修复蛋白表达的患者,错配修复蛋白表达缺失者对孕激素治疗的反应较差[19],这部分患者缺乏功能性PR的表达以及突变后肿瘤抑制基因缺失,进而导致孕激素无法介导细胞分化、沉默及凋亡。本研究结果表明,来曲唑联合二甲双胍及MPA对孕激素敏感性Ishikawa细胞的增殖有显著的抑制作用(P < 0.05), 推测来曲唑联合二甲双胍及MPA对PR阳性的患者更具治疗价值。
综上所述,来曲唑能够有效改善人子宫内膜癌裸鼠移植瘤的孕激素耐药性,二甲双胍可增强该反应。来曲唑联合二甲双胍通过参与雌激素与Nrf2及其下游 Lass2 基因表达及功能之间的反馈调节,减少了Nrf2/Lass2的表达,从而增强了孕激素的敏感性。
-
表 1 雌激素组与对照组中各亚组裸鼠用药后血清雌激素及孕激素比较(x±s)
pmol/L 组别 亚组 雌激素 孕激素 雌激素组(n=20) 生理盐水组(n=5) 208.03±33.31 0.55±2.09 MPA组(n=5) 195.95±28.47 1.23±2.94 来曲唑联合MPA组(n=5) 160.34±32.84 0.93±1.16 二甲双胍联合来曲唑及MPA组(n=5) 135.88±26.35* 0.65±3.21 对照组(n=20) 生理盐水组(n=5) 258.43±27.86 0.65±1.59 MPA组(n=5) 148.02±29.12 1.44±3.04 来曲唑联合MPA组(n=5) 138.80±35.79 1.21±0.96 二甲双胍联合来曲唑及MPA组(n=5) 117.36±31.98* 0.90±2.06 与MPA组比较, *P < 0.05。 表 2 各亚组裸鼠用药前与用药后的体质量变化比较(x±s)
g 组别 亚组 用药前体质量 用药后体质量 变化值 雌激素组(n=20) 生理盐水组(n=5) 22.12±2.18 22.58±2.86 0.40±2.19 MPA组(n=5) 21.75±2.47 21.08±2.12 -0.67±2.94 来曲唑联合MPA组(n=5) 22.34±2.84 21.80±2.79 -0.54±3.16 二甲双胍联合来曲唑及MPA组(n=5) 22.88±2.35 22.36±1.98 -0.52±4.21 对照组(n=20) 生理盐水组(n=5) 22.35±2.16 22.65±2.48 0.30±2.32 MPA组(n=5) 22.30±2.41 21.78±1.79 -0.52±2.15 来曲唑联合MPA组(n=5) 21.87±2.46 21.46±1.86 -0.41±1.87 二甲双胍联合来曲唑及MPA组(n=5) 22.07±1.76 22.38±2.92 0.31±2.97 表 3 各亚组裸鼠移植瘤体积及肿瘤抑制率比较(x±s)
组别 亚组 肿瘤体积/cm3 肿瘤抑制率/% 雌激素组(n=20) 生理盐水组(n=5) 3.76±2.34 0 MPA组(n=5) 1.96±1.04 48.25* 来曲唑联合MPA组(n=5) 1.23±0.93 67.97* 二甲双胍联合来曲唑及MPA组(n=5) 0.94±2.46 75.43* 对照组(n=20) 生理盐水组(n=5) 2.47±1.24 0 MPA组(n=5) 1.28±1.01 49.46* 来曲唑联合MPA组(n=5) 0.79±0.75 69.97* 二甲双胍联合来曲唑及MPA组(n=5) 0.63±0.82 75.96* 与生理盐水组比较, *P < 0.05。 -
[1] CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. doi: 10.3322/caac.21338
[2] HELPMAN L, PERRI T, LAVEE N, et al. Impact of adjuvant treatment on outcome in high-risk early-stage endometrial cancer: a retrospective three-center study[J]. Int J Gynecol Cancer, 2019, 29(1): 133-139. doi: 10.1136/ijgc-2018-000030
[3] YU M, YANG J X, WU M, et al. Fertility-preserving treatment in young women with well-differentiated endometrial carcinoma and severe atypical hyperplasia of endometrium[J]. Fertil Steril, 2009, 92(6): 2122-2124. doi: 10.1016/j.fertnstert.2009.06.013
[4] USHIJIMA K, YAHATA H, YOSHIKAWA H, et al. Multicenter phase Ⅱstudy of fertility-sparing treatment with medroxyprogesterone acetate for endometrial carcinoma and atypical hyperplasia in young women[J]. J Clin Oncol, 2007, 25(19): 2798-2803. doi: 10.1200/JCO.2006.08.8344
[5] YANG B, HU M Y, FU Y, et al. LASS2 mediates Nrf2-driven progestin resistance in endometrial cancer[J]. Am J Transl Res, 2021, 13(3): 1280-1289.
[6] KOH W J, ABU-RUSTUM N R, BEAN S, et al. Uterine neoplasms, version 1. 2018, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2018, 16(2): 170-199. doi: 10.6004/jnccn.2018.0006
[7] LORTET-TIEULENT J, FERLAY J, BRAY F, et al. International patterns and trends in endometrial cancer incidence, 1978-2013[J]. J Natl Cancer Inst, 2018, 110(4): 354-361. doi: 10.1093/jnci/djx214
[8] GARZON S, UCCELLA S, ZORZATO P C, et al. Fertility-sparing management for endometrial cancer: review of the literature[J]. Minerva Med, 2021, 112(1): 55-69.
[9] SAVARIS R F, GROLL J M, YOUNG S L, et al. Progesterone resistance in PCOS endometrium: a microarray analysis in clomiphene citrate-treated and artificial menstrual cycles[J]. J Clin Endocrinol Metab, 2011, 96(6): 1737-1746. doi: 10.1210/jc.2010-2600
[10] LI X, FENG Y, LIN J F, et al. Endometrial progesterone resistance and PCOS[J]. J Biomed Sci, 2014, 21: 2. doi: 10.1186/1423-0127-21-2
[11] JERZAK K J, DUSKA L, MACKAY H J. Endocrine therapy in endometrial cancer: an old dog with new tricks[J]. Gynecol Oncol, 2019, 153(1): 175-183. doi: 10.1016/j.ygyno.2018.12.018
[12] FERGUSON S E, OLSHEN A B, VIALE A, et al. Stratification of intermediate-risk endometrial cancer patients into groups at high risk or low risk for recurrence based on tumor gene expression profiles[J]. Clin Cancer Res, 2005, 11(6): 2252-2257. doi: 10.1158/1078-0432.CCR-04-1353
[13] 王巧莲, 梁元姣, 吴元赭, 等. 来曲唑对人子宫内膜癌裸鼠移植瘤生长抑制作用研究[J]. 中国实用妇科与产科杂志, 2008, 24(2): 146-148. doi: 10.3969/j.issn.1005-2216.2008.02.022 [14] CHEN N, YI X F, ABUSHAHIN N, et al. Nrf2 expression in endometrial serous carcinomas and its precancers[J]. Int J Clin Exp Pathol, 2010, 4(1): 85-96.
[15] ITO K, UTSUNOMIYA H, NⅡKURA H, et al. Inhibition of estrogen actions in human gynecological malignancies: new aspects of endocrine therapy for endometrial cancer and ovarian cancer[J]. Mol Cell Endocrinol, 2011, 340(2): 161-167. doi: 10.1016/j.mce.2010.11.023
[16] 牛艺洁, 史惠蓉, 谢娅. 二甲双胍对孕激素耐药的子宫内膜癌细胞的调节作用[J]. 中华妇产科杂志, 2016, 51(2): 135-140. doi: 10.3760/cma.j.issn.0529-567x.2016.02.010 [17] RUIZ M P, HUANG Y M, HOU J Y, et al. All-cause mortality in young women with endometrial cancer receiving progesterone therapy[J]. Am J Obstet Gynecol, 2017, 217(6): 669. e1-669669. e13. doi: 10.1016/j.ajog.2017.08.007
[18] HE Y, TAO X, HUANG F F, et al. Clinicopathologic features of endometrial cancer in Chinese patients younger than 50 years with a family history of cancer[J]. Medicine (Baltimore), 2018, 97(43): e12968.
[19] PARK J Y, SEONG S J, KIM T J, et al. Pregnancy outcomes after fertility-sparing management in young women with early endometrial cancer[J]. Obstet Gynecol, 2013, 121(1): 136-142.
-
期刊类型引用(2)
1. 郑莹莹,田晓予,霍礼娜. 早期子宫内膜癌药物治疗研究进展. 中国计划生育学杂志. 2024(03): 718-722 .  百度学术
百度学术
2. 赵子伟,翁瑜菁,张菊,周卫琴. 二甲双胍联合来曲唑片对PCOS患者的影响. 中外医学研究. 2024(28): 45-48 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号

