Value of 18F-FDG PET/CT Deauville score and ΔSUVmax in evaluating medium-term prognosis of patients with chemotherapy for diffuse large B-cell lymphoma
-
摘要:目的
探讨18氟-氟代脱氧葡萄糖正电子发射体层摄影技术/计算机体层摄影技术(18F-FDG PET/CT)显像Deauville评分和最大标准化摄取值的变化(ΔSUVmax)在弥漫性大B细胞淋巴瘤(DLBCL)化疗中期预后评估中的价值。
方法回顾性分析78例DLBCL患者化疗中期18F-FDG PET/CT图像资料。对ΔSUVmax、ΔSUVmax%进行受试者工作特征(ROC)曲线分析, 分别采用ΔSUVmax及ΔSUVmax%的最佳临界值、Deauville评分分组,并按免疫组化结果分为生发中心(GCB)型和非GCB型。进行Kaplan-Meier生存曲线和Cox回归分析,分析Deauville评分法和ΔSUVmax法的预后评估能力。
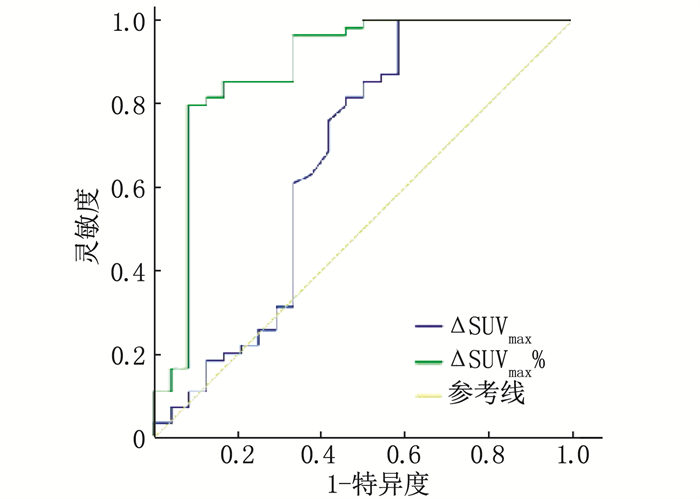
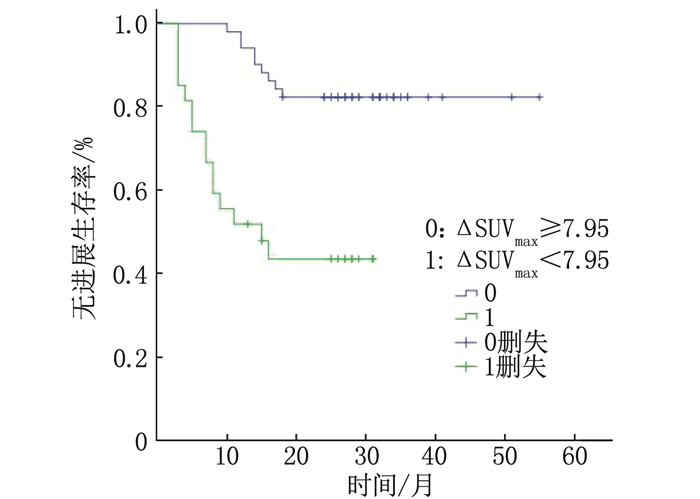
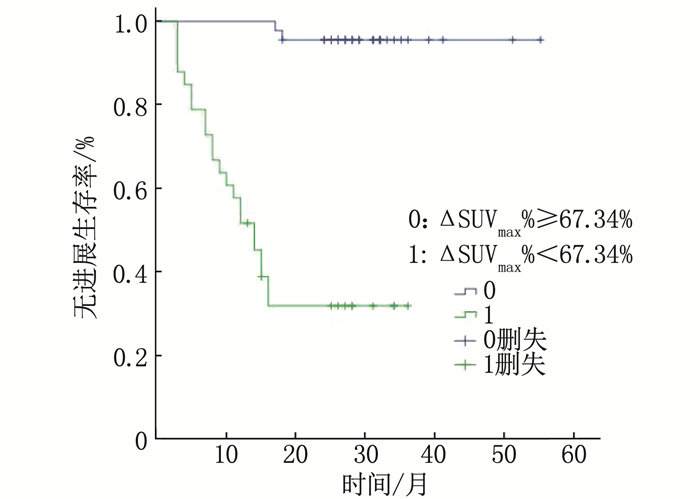
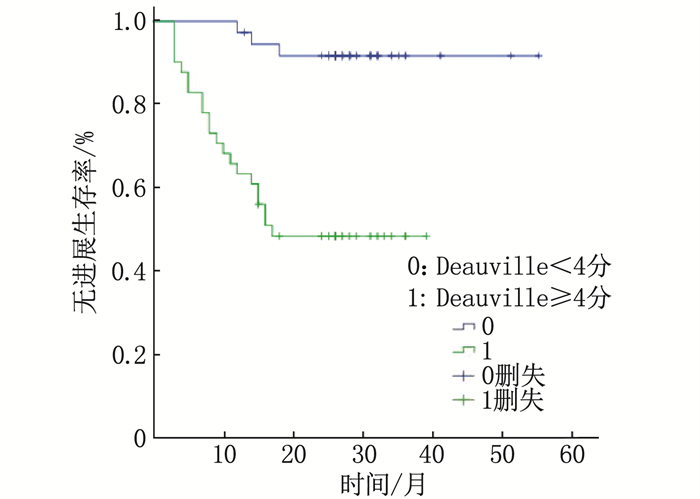
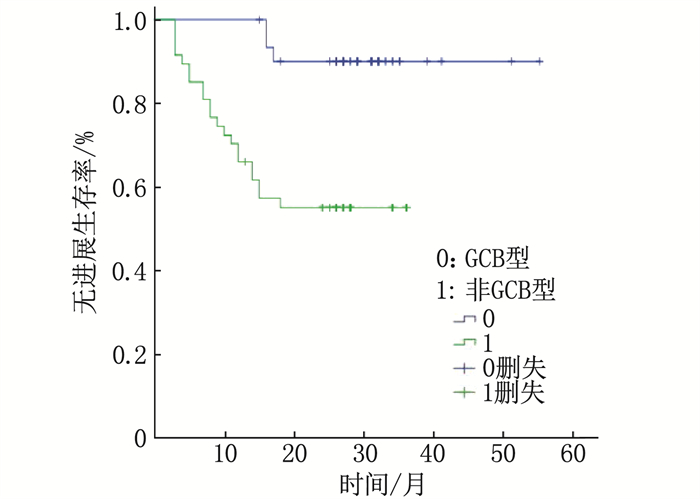
结果78例患者分为进展组24例和未进展组54例; 进展组ΔSUVmax均值为(3.42±9.90), 低于未进展组的(8.76±5.58), 差异有统计学意义(P < 0.05); 进展组中位数ΔSUVmax%为34.88%, 低于未进展组的78.16%, 差异有统计学意义(P < 0.01)。ΔSUVmax及ΔSUVmax%的曲线下面积(AUC)分别为0.667、0.882(P < 0.01), 分别以临界值7.95、67.34%分组, Kaplan-Meier分析显示2年无进展生存期(PFS)的差异有统计学意义(44.4%与82.4%, 33.3%与95.6%, P < 0.01)。Deauville < 4分(PET阴性)组的2年PFS为91.9%, 高于Deauville≥4分(PET阳性)组的48.8%, 差异有统计学意义(P < 0.01)。GCB型2年PFS为90.3%, 高于非GCB型的55.3%, 差异有统计学意义(P < 0.01)。Cox多因素分析显示ΔSUVmax%及免疫组化分型为独立预测因素(P < 0.01)。
结论Deauville评分法和ΔSUVmax法在DLBCL化疗中期预后评估中均有较高的价值, ΔSUVmax%及免疫组化分型为PFS的独立预测因素。
-
关键词:
- 弥漫性大B细胞淋巴瘤 /
- 18氟-氟代脱氧葡萄糖正电子发射体层摄影技术/计算机体层摄影技术 /
- 最大标准化摄取值 /
- 生发中心型 /
- 预后
Abstract:ObjectiveTo explore the value of 18 fluoro-fluorodeoxyglucose positron emission tomography/computer tomography (18F-FDG PET/CT) display Deauville score and change of max standardized uptake value (ΔSUVmax) in evaluating medium-term prognosis of patients with chemotherapy for diffuse large B-cell lymphoma (DLBCL).
MethodsThe 18F-FDG PET/CT images of 78 patients with DLBCL in the medium-term of chemotherapy were analyzed retrospectively. The receiver operating characteristic (ROC) curve was used to analyze the ΔSUVmax and ΔSUVmax%, the patients were divided into different groups according to optimal cut-off values of ΔSUVmax and ΔSUVmax% as well as Deauville score, and they were also divided into germinal center B-cell-like (GCB) type and non-GCB type. Kaplan-Meier survival curve and Cox regression analysis were performed to evaluate the ability of Deauville score and ΔSUVmax methods in prognosis.
ResultsA total of 78 patients were divided into progressive group with 24 cases and non-progressive group with 54 cases; the mean value of ΔSUVmax was (3.42±9.90) in the progressive group, which was significantly lower than (8.76±5.58) in the non-progressive group (P < 0.05); the median value of ΔSUVmax% in the progressive group was 34.88%, which was significantly lower than 78.16% in the non-progressive group (P < 0.01). The area under the curve (AUC) of ΔSUVmax and ΔSUVmax% was 0.667 and 0.882 respectively (P < 0.01), and taking the cut-off values of 7.95 and 67.34% respectively as the grouping criteria, the Kaplan-Meier analysis showed that there were significant differences in 2-year progression-free survival (PFS) between groups (44.4% versus 82.4%, 33.3% versus 95.6%, P < 0.01). The 2-year PFS of Deauville < 4 (PET negative) group was 91.9%, which was significantly higher than 48.8% of Deauville≥4 (PET positive) group (P < 0.01). The 2-year PFS of GCB type was 90.3%, which was significantly higher than 55.3% of non-GCB type (P < 0.01). Cox multivariate analysis showed that ΔSUVmax% and immunohistochemical typing were the independent predictors (P < 0.01).
ConclusionBoth Deauville score and ΔSUVmax methods have high values in the medium-term prognostic evaluation of chemotherapy for DLBCL, and ΔSUVmax% and immunohistochemical typing were the independent predictors for PFS.
-
目前,无痛胃镜中最常用的麻醉药物为丙泊酚,该药起效快,镇静效果好,但诱导期易发生低血压和呼吸抑制,且有明显注射痛[1]。瑞马唑仑作为新开发的一种超短效镇静药,具有起效快、维持时间短、恢复快、对呼吸与循环影响小和无注射痛等特点[2]。瑞马唑仑既保留了丙泊酚的优点,又摒弃了其不足,理论上可能更适用于无痛胃镜检查。本研究观察单纯应用瑞马唑仑在无痛胃镜检查中的镇静成功率、术中不良反应发生率和术后恢复情况,探讨单纯应用瑞马唑仑在无痛胃镜检查中的可行性,旨在为临床医师在无痛胃镜诊疗中合理应用瑞马唑仑提供理论依据,现报告如下。
1. 资料与方法
1.1 一般资料
选取2020年11月—2021年2月于扬州大学附属医院行无痛胃镜检查的350例患者作为研究对象,男169例、女181例。纳入标准: ①年龄18~64岁者; ②体质量指数(BMI)18~30 kg/m2者; ③美国麻醉医师协会(ASA)分级Ⅰ~Ⅱ级者。排除标准: ①对苯二氮卓类药物过敏,长期使用苯二氮卓类药物者; ②妊娠期或哺乳期妇女; ③ ASA分级Ⅲ级及以上者; ④近期有吸毒或酗酒史者; ⑤胃镜检查时间超过15 min或需行胃镜下治疗者。采用随机数字表法将患者分成7组,即瑞马唑仑0.30 mg/kg组(R1组)、瑞马唑仑0.35 mg/kg组(R2组)、瑞马唑仑0.40 mg/kg组(R3组)、瑞马唑仑0.45 mg/kg组(R4组)、瑞马唑仑0.50 mg/kg组(R5组)、瑞马唑仑0.55 mg/kg组(R6组)和丙泊酚2 mg/kg组(对照组)。本研究经扬州大学附属医院伦理委员会审查通过(2020-YKL10-25), 并获得患者知情同意。
1.2 麻醉方法
所有患者术前禁食12 h, 入室后开放静脉通路,监测血压、心电图及脉搏血氧饱和度(SpO2), 经鼻导管吸氧(5 L/min)。麻醉诱导时, R1组、R2组、R3组、R4组、R5组、R6组分别静脉注射瑞马唑仑(生产批号2019S00728)0.30、0.35、0.40、0.45、0.50、0.55 mg/kg, 对照组静脉注射丙泊酚(生产批号X19134A)2 mg/kg, 皆在1 min内注射完毕。给药后1 min测量患者血压,于血压测量完毕且改良警觉/镇静量表(MOAA/S)评分 < 3分时开始置入胃镜。单次给药后,若入镜过程中患者未发生或仅发生1级呛咳或体动反应视为镇静成功,发生2级及以上呛咳或体动反应视为镇静失败,镇静失败者追加30~50 mg丙泊酚补救。若术中患者收缩压下降幅度超过基础值的20%或低于90 mmHg, 静脉注射麻黄碱6 mg; 若心率(HR)低于50次/min, 静脉注射阿托品0.5 mg, SpO2 < 90%时给予托下颌或简易呼吸囊辅助通气处理。
1.3 观察指标
观察7组患者镇静成功率; 观察7组患者术中呛咳、体动、呃逆、低氧血症(SpO2 < 90%)和注射痛等不良反应的发生情况; 观察7组患者给药前和给药后1 min的平均动脉压(MAP)、心率(HR)及给药前后MAP、HR变化情况; 观察7组患者胃镜检查时间、苏醒时间(最后1次给药结束至MOAA/S评分为5分的时间)和离院时间(最后1次给药结束至患者离院的时间)。离院标准参照镇静/麻醉后离院评分量表[3], 评分>9分方可离院。
1.4 统计学分析
采用SPSS 25.0统计学软件进行数据分析,符合正态分布的计量资料以(x±s)表示,组间比较采用单因素方差分析,组内不同时点比较采用配对t检验,计数资料以[n(%)]表示,组间比较采用χ2检验, P < 0.05为差异有统计学意义。
2. 结果
2.1 一般资料比较
7组患者的性别、年龄、体质量、BMI比较,差异无统计学意义(P>0.05), 具有可比性,见表 1。
表 1 7组患者一般资料比较(x±s)[n(%)]组别 n 性别 年龄/岁 体质量/kg BMI/(kg/m2) 男 女 R1组 50 26(52.0) 24(48.0) 49.1±11.0 65.6±11.8 23.7±3.0 R2组 50 24(48.0) 26(52.0) 50.7±10.1 63.3±10.5 23.2±2.5 R3组 50 22(44.0) 28(56.0) 50.7±11.5 64.8±10.0 23.2±2.8 R4组 50 24(48.0) 26(52.0) 50.0±12.1 65.5±10.1 23.5±3.0 R5组 50 25(50.0) 25(50.0) 50.0±11.8 64.9±9.9 23.4±2.8 R6组 50 23(46.0) 27(54.0) 51.7±11.3 62.8±10.0 22.6±2.9 对照组 50 25(50.0) 25(50.0) 51.0±10.2 65.7±9.6 23.9±3.0 2.2 镇静成功率、不良反应发生率比较
R1组、R2组、R3组、R4组、R5组镇静成功率均低于对照组,差异有统计学意义(P < 0.05); R6组镇静成功率与对照组比较,差异无统计学意义(P>0.05)。R1组、R2组、R3组、R4组、R5组、R6组的呛咳、体动和呃逆发生率高于对照组,低氧血症和注射痛发生率低于对照组,差异有统计学意义(P < 0.05)。见表 2。
表 2 7组患者镇静成功、不良反应发生情况比较[n(%)]组别 n 镇静成功 不良反应 呛咳 体动 呃逆 低氧血症 注射痛 R1组 50 8(16.0)* 28(56.0)* 32(64.0)* 16(32.0)* 2(4.0)* 1(2.0)* R2组 50 17(34.0)* 26(52.0)* 29(58.0)* 15(30.0)* 3(6.0)* 3(6.0)* R3组 50 19(38.0)* 24(48.0)* 25(50.0)* 12(24.0)* 2(4.0)* 2(4.0)* R4组 50 24(48.0)* 19(38.0)* 24(48.0)* 13(26.0)* 2(4.0)* 2(4.0)* R5组 50 29(58.0)* 15(30.0)* 19(38.0)* 16(32.0)* 4(8.0)* 2(4.0)* R6组 50 36(72.0) 14(28.0)* 16(32.0)* 14(28.0)* 4(8.0)* 1(2.0)* 对照组 50 41(82.0) 6(12.0) 7(14.0) 4(8.0) 10(20.0) 19(38.0) 与对照组比较, *P < 0.05。 2.3 给药前后血流动力学指标变化情况比较
给药后1 min, 7组患者MAP均低于给药前,HR均高于给药前,差异有统计学意义(P < 0.05); R1组、R2组、R3组、R4组、R5组、R6组MAP变化量与对照组比较,差异无统计学意义(P>0.05); R1组、R2组、R3组、R4组、R5组、R6组HR变化量高于对照组,差异有统计学意义(P < 0.05)。见表 3。
表 3 7组患者给药前后血流动力学指标变化情况比较(x±s)组别 n MAP/mmHg HR/(次/min) 给药前 给药后1 min △MAP 给药前 给药后1 min △HR R1组 50 102.5±12.3 87.4±10.5* 15.0±10.1 73.0±8.8 80.0±10.0* 6.8±8.4# R2组 50 104.0±10.8 87.2±8.0* 16.8±7.5 72.5±11.9 82.2±15.8* 9.7±11.0# R3组 50 104.0±14.8 85.4±11.7* 18.6±10.0 74.6±13.5 81.8±13.2* 7.2±7.7# R4组 50 103.5±12.8 84.8±9.4* 18.7±11.0 73.5±11.8 80.9±12.3* 7.4±9.0# R5组 50 104.1±11.7 84.5±11.6* 19.6±8.7 75.7±12.0 83.5±11.1* 7.8±7.6# R6组 50 106.8±14.5 86.9±13.0* 19.9±11.7 72.4±11.4 81.9±9.8* 9.5±8.2# 对照组 50 106.1±12.2 88.7±12.3* 17.3±13.6 74.7±11.2 77.3±11.5* 2.6±10.0 MAP: 平均动脉压; HR: 心率; △MAP: 给药前后平均动脉压变化量; △HR: 给药前后心率变化量。
与给药前比较, *P < 0.05; 与对照组比较, #P < 0.05。2.4 胃镜检查时间、苏醒时间和离院时间比较
7组患者胃镜检查时间比较,差异无统计学意义(P>0.05); 与对照组患者比较,R2组、R3组、R4组、R5组、R6组患者苏醒时间延长,R1组、R2组、R3组、R4组、R5组、R6组患者离院时间延长,差异有统计学意义(P < 0.05)。见表 4。
表 4 7组患者胃镜检查时间、苏醒时间和离院时间比较(x±s)min 组别 n 胃镜检查时间 苏醒时间 离院时间 R1组 50 5.0±2.0 11.7±4.0 38.2±8.7* R2组 50 4.6±1.7 13.0±3.9* 42.9±9.1* R3组 50 4.9±1.4 14.6±5.0* 45.3±9.6* R4组 50 5.4±2.1 16.2±6.5* 49.3±8.6* R5组 50 4.7±1.4 17.5±5.4* 51.7±10.3* R6组 50 5.0±1.3 20.2±7.2* 55.8±9.9* 对照组 50 4.8±1.4 10.0±3.3 29.8±9.4 与对照组比较, *P < 0.05。 3. 讨论
随着舒适化医疗技术的推广,丙泊酚已被广泛应用于无痛胃镜检查中,但其带来的各种不良反应如呼吸、循环抑制和注射痛等亦给医生带来了一定困扰。瑞马唑仑作为一种新开发的药物,与咪达唑仑一样通过作用于γ-氨基丁酸(GABA)受体产生镇静作用,其在体内会被非特异性酯酶水解为唑仑丙酸,而唑仑丙酸对GABA受体的亲和力仅为瑞马唑仑的1/400[4], 几乎不具备原有的药理作用,因此患者苏醒快。此外,瑞马唑仑起效快,对呼吸和循环影响小,且无注射痛[2], 理论上可能比丙泊酚更适用于无痛胃镜检查。
本研究发现,单纯瑞马唑仑应用于无痛胃镜检查中,患者呛咳、体动和呃逆发生率高,且体动与呛咳经常相伴发生。咽喉部分布的与咳嗽相关的感受器RARs对机械刺激敏感, RARs可将机械刺激经迷走神经传入脑干,脑干发出的信号再经迷走神经传出,形成呛咳反射[5], 所以胃镜经过咽喉部时易引起呛咳。研究[6]显示,足够的镇静或麻醉深度可抑制外来刺激引起的应激反应。本研究发现,随着瑞马唑仑剂量的增加,患者呛咳率总体呈下降趋势,但静脉注射0.55 mg/kg瑞马唑仑的呛咳发生率依然远高于丙泊酚,这可能与瑞马唑仑对应激反应的抑制作用弱于丙泊酚有关。相关研究[7]发现,在胃镜检查中应用苯二氮卓类药物,患者呃逆发生率可达20.5%, 且随着药物剂量的增加,呃逆发生率亦增加。本研究中,不同剂量瑞马唑仑组的呃逆发生率为24.0%~32.0%, 可能与瑞马唑仑剂量偏大和静脉注射速度过快有关,但呃逆发生率与瑞马唑仑剂量的相关性并不明显,这是否与封顶效应有关尚待进一步研究。
无痛胃镜检查单纯应用瑞马唑仑的镇静成功率与瑞马唑仑使用剂量呈正相关,但静脉注射0.50 mg/kg瑞马唑仑的镇静成功率依然远低于丙泊酚,主要是因为入镜过程中的呛咳和体动妨碍了操作的顺利进行,使得成功率下降。本研究在预试验中静脉注射0.20 mg/kg瑞马唑仑的镇静成功率仅5.0%, 且一旦初始入镜时镇静失败,即便追加瑞马唑仑,患者的呛咳和体动情况也不会有明显改善,故正式试验时加大了麻醉诱导初始剂量,且仅单次给药,不再设置追加剂量。本研究结果显示,不同剂量瑞马唑仑组镇静成功者共133例,且一旦初始入镜成功,镇静效果皆能维持至术毕,术中无需追加药物。
本研究发现,随着瑞马唑仑剂量的增加,患者的苏醒时间和离院时间逐渐延长。虽然瑞马唑仑代谢产物的活性仅为瑞马唑仑的1/400, 但其消除半衰期长达116 min[8]。分析原因,本研究瑞马唑仑使用剂量较大,代谢产物的蓄积可发挥镇静作用,导致患者苏醒时间和离院时间延长。患者苏醒后滞留医院的主要原因是步态不稳,这可能与苯二氮卓类具有影响姿势稳定性和平衡的副作用有关[9]。
单纯瑞马唑仑应用于无痛胃镜检查,对患者循环系统有明显抑制作用,但对呼吸功能无明显影响。患者静脉注射瑞马唑仑1 min后的MAP下降程度与丙泊酚相当,很有可能与使用剂量过大有关,其HR略有上升,但尚未被证实具有临床意义[10]。即使静脉注射0.55 mg/kg瑞马唑仑,患者低氧血症的发生率也仅有8.0%, 远低于丙泊酚的20.0%。由此提示,瑞马唑仑具有对呼吸影响小的优势,有利于临床进一步拓展应用范围。本研究尚存在不足之处,例如不同医生胃镜检查技术的熟练程度存在差异,且按实际体质量给药会导致体质量相差较大的患者给药剂量亦相差较大,从而影响镇静成功率,或许改变给药剂量的计算方式能获得更优的结果。
综上所述,在无痛胃镜检查中,单纯应用瑞马唑仑的镇静成功率与剂量呈正相关,其剂量达0.55 mg/kg时与2 mg/kg丙泊酚的镇静成功率相当,但瑞马唑仑会引起患者呛咳、体动和呃逆发生率增高,苏醒时间和离院时间延长。
-
表 1 DLBCL患者PFS的Cox分析结果
参数 单因素分析 多因素分析 HR(95%CI) P HR(95%CI) P 性别 0.484(0.169~1.392) 0.178 0.692(0.279~1.714) 0.426 年龄 1.062(1.012~1.114) 0.014 1.047(0.999~1.098) 0.058 临床分期 1.385(0.853~2.248) 0.188 1.256(0.838~1.882) 0.269 SUVmax0 1.080(0.989~1.180) 0.087 1.064(0.974~1.162) 0.167 SUVmax1 0.934(0.876~0.996) 0.036 0.931(0.862~1.006) 0.070 ΔSUVmax 1.111(0.978~1.261) 0.105 1.072(0.970~1.186) 0.173 ΔSUVmax% 0.965(0.949~0.981) <0.001 0.973(0.960~0.985) <0.001 Deauville评分 1.193(0.738~1.926) 0.472 1.172(0.730~1.882) 0.510 免疫组化分型 4.114(1.093~15.487) 0.037 3.797(1.048~13.764) 0.042 -
[1] 中华医学会核医学分会. 淋巴瘤18F-FDG PET/CT及PET/MR显像临床应用指南(2021版)[J]. 中华核医学与分子影像杂志, 2021, 41(3): 161-169. https://www.cnki.com.cn/Article/CJFDTOTAL-XYXZ202301052.htm [2] HANS C P, WEISENBURGER D D, GREINER T C, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J]. Blood, 2004, 103(1): 275-282. doi: 10.1182/blood-2003-05-1545
[3] 朱思光, 孙倩. 18氟-氟代脱氧葡萄糖-正电子发射体层显像/计算机体层成像测定密度比在诊断非小细胞肺癌纵隔淋巴结转移中的应用价值[J]. 实用临床医药杂志, 2019, 23(1): 18-21. doi: 10.7619/jcmp.201901005 [4] LIU T B, CHEN L H, PAN J, et al. Retrospective analysis of a new prognostic score for diffuse large B-cell lymphoma based on interim positron emission tomography-computed tomography[J]. Acta Haematol, 2018, 139(3): 148-157. doi: 10.1159/000479486
[5] KURCH L, HVTTMANN A, GEORGI T W, et al. Interim PET in diffuse large B-cell lymphoma[J]. J Nucl Med, 2021, 62(8): 1068-1074. doi: 10.2967/jnumed.120.255034
[6] 李梦丹, 敬兴果. PET/CT不同评价体系在弥漫性大B细胞淋巴瘤预后评估中的应用[J]. 国际放射医学核医学杂志, 2020, 44(2): 99-104. [7] ZHANG X Y, SONG L, WANG P J, et al. Prognostic value of pre-autologous stem cell transplantation PET/CT in diffuse large B-cell lymphoma: the Deauville score is prognostically superior to ΔSUVmax[J]. Acta Haematol, 2020, 143(2): 124-130. doi: 10.1159/000500512
[8] JIANG M Q, CHEN P, RUAN X Z, et al. Interim 18F-FDG PET/CT and BCL2 for predicting the prognosis of patients with diffuse large B-cell lymphoma in the rituximab era[J]. Nucl Med Commun, 2018, 39(2): 147-153. doi: 10.1097/MNM.0000000000000784
[9] 贺慧慧, 吴小红, 杜晓庆, 等. 18F-FDG PET/CT Deauville评分和IHP标准在弥漫性大B细胞淋巴瘤疗效评估中的应用[J]. 中华核医学与分子影像杂志, 2019, 39(5): 266-271. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYYZ202109022.htm [10] KIM J, SONG Y S, LEE J S, et al. Risk stratification of diffuse large B-cell lymphoma with interim PET-CT based on different cutoff Deauville scores[J]. Leuk Lymphoma, 2018, 59(2): 340-347. doi: 10.1080/10428194.2017.1339877
[11] 李娟, 赵铭, 原凌, 等. 18F-FDG PET/CT的基线代谢参数对弥漫大B细胞淋巴瘤预后评估的价值[J]. 临床放射学杂志, 2021, 40(7): 1329-1334. https://www.cnki.com.cn/Article/CJFDTOTAL-LCFS202107019.htm [12] ZHANG Y Y, SONG L, ZHAO M X, et al. A better prediction of progression-free survival in diffuse large B-cell lymphoma by a prognostic model consisting of baseline TLG and%ΔSUVmax[J]. Cancer Med, 2019, 8(11): 5137-5147. doi: 10.1002/cam4.2284
[13] 陈虞梅, 周明舸, 刘建军, 等. 化疗中期及化疗后18F-FDG PET/CT对弥漫性大B细胞淋巴瘤患者预后判断的价值[J]. 中华核医学与分子影像杂志, 2018, 38(9): 598-601. https://cdmd.cnki.com.cn/Article/CDMD-10089-1021848419.htm [14] LI X Q, SUN X, LI J, et al. Interim PET/CT based on visual and semiquantitative analysis predicts survival in patients with diffuse large B-cell lymphoma[J]. Cancer Med, 2019, 8(11): 5012-5022. doi: 10.1002/cam4.2404
[15] ITTI E, MEIGNAN M, BERRIOLO-RIEDINGER A, et al. An international confirmatory study of the prognostic value of early PET/CT in diffuse large B-cell lymphoma: comparison between Deauville criteria and ΔSUVmax[J]. Eur J Nucl Med Mol Imaging, 2013, 40(9): 1312-1320. doi: 10.1007/s00259-013-2435-6
[16] 高艳, 赵晋华, 宋建华, 等. △SUV法和Deauville五分法在弥漫性大B细胞淋巴瘤预后中的作用[J]. 中华核医学与分子影像杂志, 2016, 36(5): 420-425. [17] 张倩, 段山. 中国人群弥漫大B细胞淋巴瘤的特点[J]. 国际肿瘤学杂志, 2018, 45(3): 187-190. https://www.cnki.com.cn/Article/CJFDTOTAL-YYCY201727037.htm [18] 谢微, 江旭峰, 赵维莅, 等. PET/CT不同判读方法对霍奇金淋巴瘤及弥漫大B细胞淋巴瘤的预后评估作用[J]. 上海交通大学学报: 医学版, 2018, 38(8): 955-959, 954. https://www.cnki.com.cn/Article/CJFDTOTAL-SHEY201808024.htm [19] HUANG Y, YE S, CAO Y B, et al. Outcome of R-CHOP or CHOP regimen for germinal center and nongerminal center subtypes of diffuse large B-cell lymphoma of Chinese patients[J]. Sci World J, 2012, 2012: 897178.
-
期刊类型引用(5)
1. 张亚敏. 血清心肌肌钙蛋白T、C反应蛋白水平与维持性血液透析患者预后的相关性. 河南医学研究. 2021(06): 1005-1007 .  百度学术
百度学术
2. 叶文捷. 维持性血液透析患者血清铁蛋白水平与临床预后的相关性研究. International Infections Diseases(Electronic Edition). 2020(01): 1-3 .  百度学术
百度学术
3. 董雄军,汤迎春,汪正翔,唐丽娟. 维持性血液透析患者血压变异性、血清cTnT及CRP与预后的相关性分析. 中国中西医结合肾病杂志. 2020(11): 1015-1016 .  百度学术
百度学术
4. 郭颖,冯海晴,钱锋,房向东. 腹膜透析和血液透析对尿毒症患者血清肌钙蛋白TI及钙磷代谢的影响. 基层医学论坛. 2019(17): 2437-2438 .  百度学术
百度学术
5. 徐道祥,史惠敏,林小东. 维持性血液透析患者精神心理状况分析及其与血清色氨酸水平的相关性研究. 中国现代医生. 2018(02): 1-3+11 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
