Expression of serum inflammatory cytokines in patients with diabetic cardiomyopathy and their effects on mitochondrial function of cardiomyocytes
-
摘要:目的
探讨炎症因子白细胞介素(IL)-1β和IL-18在糖尿病性心肌病(DCM)中的表达水平及其对心肌细胞线粒体功能的影响。
方法采集104例DCM患者(DCM组)和90例健康志愿者(健康对照组)的外周血血清,检测2组血清IL-1β和IL-18浓度。培养人心肌细胞系AC16,将AC16细胞分为对照组、IL-1β组(加入10 ng/mL的重组人IL-1β)和IL-18组(加入10 ng/mL的重组人IL-18)。采用CCK-8法检测细胞增殖活性;分别采用JC-1染色法和钙黄绿素染色法检测心肌细胞线粒体膜电位和膜通透性;采用Western blot检测细胞凋亡相关蛋白Bax、Bcl-2和Cleaved-Caspase-3(C-Casp3)的表达水平。
结果与健康对照组相比,DCM组血清IL-1β和IL-18浓度升高,差异有统计学意义(P < 0.05)。与对照组比较,AC16细胞加入IL-1β或IL-18培养48、72 h后,AC16细胞增殖活性下降,差异有统计学意义(P < 0.05);与对照组相比,IL-1β组和IL-18组线粒体膜电势下降的细胞比率增加,差异有统计学意义(P < 0.001);IL-1β组、IL-18组钙黄绿素平均荧光强度均高于对照组,差异有统计学意义(P < 0.001)。与对照组相比,IL-1β组和IL-18组细胞Bax/Bcl-2、C-Casp3/GAPDH比值升高,差异有统计学意义(P < 0.01或P < 0.001)。
结论IL-1β和IL-18在DCM患者外周血中表达水平升高,并通过抑制线粒体活性影响其心肌细胞功能。
Abstract:ObjectiveTo investigate the expression levels of inflammatory cytokines interleukin (IL)-1β and IL-18 in diabetic cardiomyopathy (DCM) and their effects on mitochondrial function of cardiomyocytes.
MethodsThe peripheral blood serum of 104 DCM patients (DCM group) and 90 healthy volunteers (healthy control group) were collected, and the serum levels of IL-1β and IL-18 in the two groups were detected. Human myocardial cell line AC16 was cultured and divided into control group, IL-1β group (adding 10 ng/mL recombinant human IL-1β) and IL-18 group (adding 10 ng/mL recombinant human IL-18). Cell proliferation activity was detected by CCK-8 assay; mitochondrial membrane potential and permeability were detected by JC-1 staining and calcein staining, respectively; the expression levels of apoptosis-related proteins Bax, Bcl-2 and Cleaved Caspase-3 (C-Casp3) were detected by western blot.
ResultsCompared with the healthy control group, serum IL-1β and IL-18 concentrations in the DCM group were increased, and the difference was statistically significant (P < 0.05). Compared with the control group, the proliferating activity of AC16 cells was significantly decreased after incubation with IL-1β or IL-18 for 48 and 72 h (P < 0.05); compared with the control group, the percentage of cells with decreased mitochondrial membrane potential in the IL-1β and IL-18 groups was significantly increased (P < 0.001); the average fluorescence intensity of calcein in the IL-1β group and IL-18 group was significantly higher than that in the control group (P < 0.001). Compared with the control group, the Bax/Bcl-2 and C-Casp3/GAPDH in the IL-1β and IL-18 groups were significantly increased (P < 0.01 or P < 0.001).
ConclusionThe expression levels of IL-1β and IL-18 in peripheral blood of DCM patients are increased, and the function of cardiomyocytes is affected by inhibiting mitochondrial activity.
-
Keywords:
- diabetic cardiomyopathy /
- interleukin /
- myocardial cells /
- mitochondria
-
糖尿病性心肌病(DCM)是临床常见的糖尿病并发症,患者临床表现为心肌功能不全,影像学检查可见左心室膨大,收缩能力下降,但患者无冠状动脉粥样硬化、高血压病等其他心血管疾病。DCM最终进展为心力衰竭,甚至引发心源性休克和猝死,严重威胁糖尿病患者的生命健康[1]。DCM的发病机制已有较多研究,通常认为慢性高血糖引发活性氧(ROS)过度积累,进一步通过影响心肌细胞钙离子稳态和糖脂代谢稳态,导致心肌细胞线粒体功能异常,最终影响心肌功能[2]。研究[3-4]发现,白细胞介素(IL)-6和肿瘤坏死因子-α(TNF-α)等炎症因子与DCM的发病密切相关。
IL-1β和IL-18是炎症小体介导释放的一类炎症因子,在肿瘤和多种感染性疾病中发挥了重要作用[5]。研究[6-7]发现,二甲双胍、SIRT3等可以通过调控炎症小体的活性,影响心肌细胞功能,干预DCM的发病。但IL-1β和IL-18是否与DCM发病存在关联的研究较少。本研究观察IL-1β和IL-18在DCM患者外周血中的表达水平,并分析其对心肌细胞线粒体功能的影响。
1. 资料与方法
1.1 一般资料
选取2019—2021年诊断为DCM的患者104例为研究对象(DCM组)。纳入标准: 符合2010年美国糖尿病协会发布的2型糖尿病(T2DM)诊断标准者; 就诊前半年内出现心力衰竭、心律失常、胸闷和端坐呼吸等心肌功能异常的症状和体征者; 影像学检查显示左心室舒张功能减退者。排除标准: 合并冠心病、先天性心脏病、高血压性心脏病、病毒性心肌炎等其他继发心肌病者; 合并其他感染性疾病、自身免疫性疾病、肝肾功能不全等疾病患者。另选取90例健康志愿者作为健康对照组。
1.2 试剂和材料
IL-1β和IL-18 Human ProcartaPlexTM Simplex检测试剂盒、DMEM高糖培养基、胎牛血清(FBS)购自美国赛默飞世尔科技公司; 重组人IL-1β、重组人IL-18细胞因子购自美国R & D system公司; CCK-8细胞活性检测试剂盒、JC-1线粒体活性检测试剂、线粒体通透性转换孔(MPTP)检测试剂盒均购自上海碧云天生物科技公司; 鼠源抗Bax抗体、抗Bcl-2抗体、抗Clevead-Caspase-3(C-Casp3)抗体和抗GAPDH抗体购自美国Abcam公司。
1.3 方法
1.3.1 血清IL-1β、IL-18检测
临床采集健康志愿者和DCM患者外周血血清样本,冻存于-80 ℃超低温冰箱。使用IL-1β和IL-18 Human Procarta PlexTM Simplex细胞因子检测试剂盒,在LuminexTM 200设备平台检测各组血清样本的IL-1β、IL-18表达水平。
1.3.2 细胞培养及分组:
人心肌细胞系AC16购自美国Sigma-Aldrich公司,细胞培养在含10% FBS的DMEM完全培养基中。AC16细胞分为对照组、IL-1β组和IL-18组。对照组仅用完全培养基培养, IL-1β组和IL-18组分别加入终浓度为10 ng/mL的重组人IL-1β或IL-18, 放置于37 ℃的CO2培养箱中培养。
1.3.3 细胞增殖实验
AC16细胞接种于96孔细胞培养板,每孔1×104个细胞。在分组培养24、48、72 h后,每孔加入10 μL CCK-8试剂, 37 ℃孵育1 h。随后利用酶标仪检测450 nm的吸光值,并计算细胞相对增殖活力。
1.3.4 线粒体膜电位检测
胰酶消化各组AC16细胞,重悬后取100 μL细胞悬液,加入100 μL JC-1染色工作液,放置于37 ℃孵育20 min。随后离心收集细胞沉淀,漂洗2次,最后用500 μL缓冲液重悬细胞,用流式细胞仪检测细胞红色和绿色荧光信号,并统计红色信号减弱的细胞比率。
1.3.5 线粒体通透性转换孔检测
胰酶消化离心各组AC16细胞,重悬并调整细胞密度为1×106/mL。取100 μL细胞悬液,加入钙黄绿素(Calcein AM)染色液,放置于37 ℃避光孵育30 min。离心收集细胞,加入500 μL检测缓冲液重悬细胞沉淀,用流式细胞仪分析绿色信号强度,并计算各组细胞平均荧光强度(MFI)。
1.3.6 Western blot实验
收集各组细胞,加入含蛋白酶抑制剂的RIPA细胞裂解液, 4 ℃孵育30 min。随后离心收集上清全细胞裂解液,加入5×SDS上样缓冲液, 100 ℃金属浴加热10 min。用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白样品,并转印到聚偏氟乙烯膜(PVDF)上。PVDF经脱脂奶粉封闭后,分别加入抗Bax抗体、抗Bcl-2抗体、抗C-Casp3抗体和抗GAPDH抗体稀释液,室温孵育2 h。随后用带辣根过氧化物酶标记的二抗孵育1 h,最后加入显色底物显示蛋白条带。用Image J软件分析各蛋白条带灰度值,计算Bax/Bcl-2比值和C-Casp3相对表达水平。
1.4 统计学分析
采用SPSS 19.0统计学软件进行数据分析,计量资料用(x±s)表示,两组间比较采用t检验; P < 0.05为差异有统计学意义。
2. 结果
2.1 IL-1β及IL-18在DCM患者血清中的表达水平
与健康对照组相比, DCM组患者外周血血清中IL-1β、IL-18水平均呈升高趋势,差异有统计学意义(P < 0.05)。见表 1。
表 1 各组血清IL-1β和IL-18水平比较(x±s)ng/L组别 IL-1β IL-18 健康对照组(n=90) 61.77±33.06 35.73±21.12 DCM组(n=104) 73.58±39.09* 45.14±26.55* 与健康对照组比较, *P < 0.05。 2.2 IL-1β和IL-18对心肌细胞增殖活性的影响
与对照组相比,在加药后24 h, IL-1β和IL-18处理的心肌细胞系AC16细胞增殖活力略下降,但差异无统计学意义(P>0.05); 继续加药培养至48、72 h后, IL-1β和IL-18均抑制AC16细胞的增殖活性,差异有统计学意义(P < 0.05)。见表 2。
表 2 各组细胞增殖相对活性(x±s)组别 0 h 24 h 48 h 72 h 对照组 1.02±0.03 1.42±0.05 2.15±0.09 3.46±0.32 IL-1β组 1.01±0.01 1.30±0.02 1.82±0.15* 2.63±0.28* IL-18组 0.99±0.03 1.33±0.06 1.75±0.14* 2.78±0.34* 与对照组比较, *P < 0.05。 2.3 IL-1β及IL-18对线粒体膜电势的影响
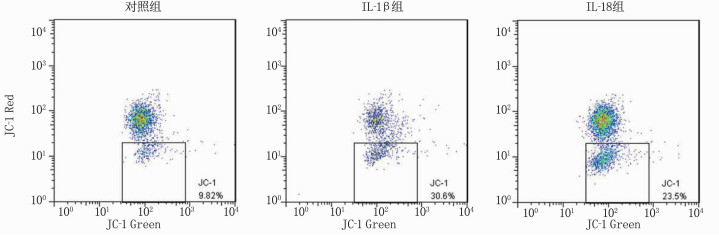
线粒体膜电位由高降低时, JC-1由聚集体转换为单体,红色荧光水平下降。对照组JC-1单体比率为(9.17±1.49)%, IL-1β组为(27.55±4.04)%, IL-18组为(20.11±4.81)%; 与对照组相比, IL-1β组和IL-18组线粒体膜电势下降的细胞比率增加,差异具有统计学意义(P < 0.001), 见图 1。
2.4 IL-1β及IL-18对线粒体膜通透性的影响
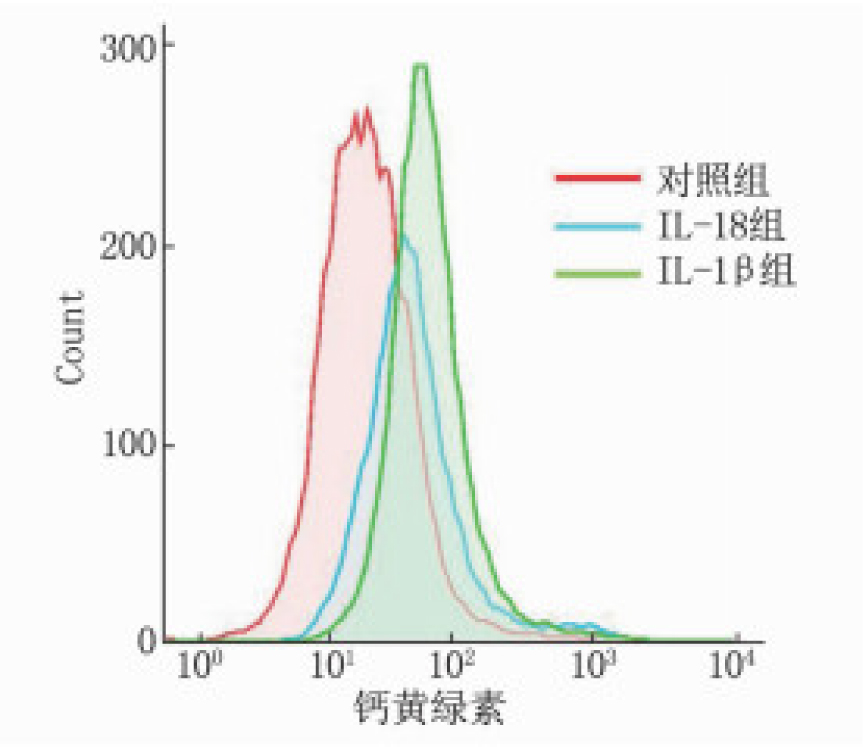
用钙黄绿素标记线粒体通透性,流式细胞仪实验数据表明,与对照组相比, IL-1β组和IL-18组AC16细胞钙黄绿素荧光强度增强,见图 2。对照组钙黄绿素平均荧光强度为(37.69±4.49), IL-1β组为(89.51±8.85), IL-18组为(65.72±4.03); IL-1β组、IL-18组钙黄绿素平均荧光强度均高于对照组,差异有统计学意义(P < 0.001)。
2.5 线粒体依赖的细胞凋亡
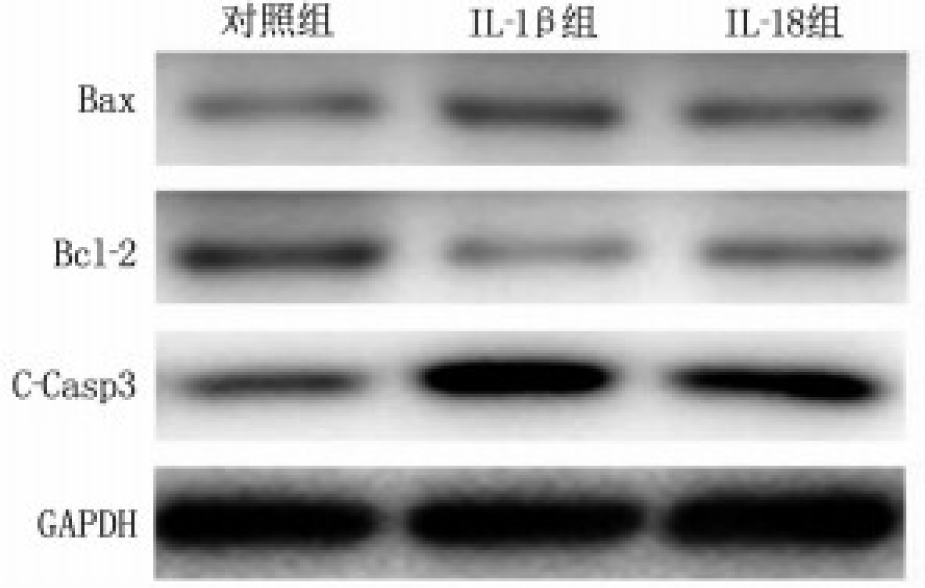
Western blot实验结果表明, IL-1β或IL-18处理细胞后, Bax蛋白表达水平下降, Bcl-2、C-Casp3表达水平升高,见图 3。对蛋白表达水平定量分析发现,与对照组相比, IL-1β组和IL-18组细胞Bax/Bcl-2、C-Casp3/GAPDH升高,差异有统计学意义(P < 0.01或P < 0.001), 见表 3。
表 3 各组凋亡相关蛋白相对表达水平(x±s)组别 Bax/Bcl-2 C-Casp3/GAPDH 对照组 0.47±0.11 0.18±0.03 IL-1β组 1.58±0.28** 0.67±0.09*** IL-18组 1.07±0.12** 0.42±0.07*** 与对照组比较, **P < 0.01, ***P < 0.001。 3. 讨论
炎症小体在炎症反应中被激活,并通过激活Caspase-1对IL-1β-pro和IL-18-pro进行剪切,促进炎症因子IL-1β和IL-18的释放[8]。研究[9-10]发现,炎症小体的活化与心血管疾病的发病具有显著相关性,但其下游的IL-1β和IL-18在DCM疾病和心肌损伤中的功能尚未阐明。
本研究通过检测外周血血清中IL-1β和IL-18的表达,发现了IL-1β和IL-18在DCM患者外周血中显著升高,提示IL-1β和IL-18可能参与了DCM疾病的发生和进展。研究[11-12]发现,通过抑制炎症小体及下游IL-1β, 可以保护败血症引发的心肌损伤; 在急性心肌梗死中,使用IL-1β的中和抗体可以促进心肌细胞排毒和修复。关于IL-18的研究[13]也证实,在肾上腺素引发的心肌炎症反应中,炎症小体的活化增加了IL-18的剪切,促进了心脏炎症损伤。这些研究都提示高水平的IL-1β和IL-18可以直接引起心肌损伤。本研究通过体外培养人心肌细胞AC16研究发现, IL-1β和IL-18可以抑制AC16细胞的增殖活性。进一步研究发现, IL-1β和IL-18不仅可降低心肌细胞线粒体膜电位,也增强了线粒体通透性。
当前研究对DCM具体的致病因素仍不明确,研究[14-15]认为高血糖引发的过氧化物积累和心肌细胞脂质过氧化,可进一步促进细胞自噬和凋亡。在细胞自噬和凋亡的激活中,线粒体都发挥了重要作用。线粒体不仅为心肌细胞提供ATP, 促进心肌收缩,也是心肌细胞糖脂代谢和活性氧产生的重要场所。线粒体膜电位的下降会影响线粒体氧化还原稳态,减少ATP的合成; 线粒体通透性的增加则促进了细胞色素c的释放,进一步激活了线粒体依赖的细胞凋亡[16]。本研究也发现, IL-1β和IL-18处理的AC16心肌细胞Bax蛋白表达水平升高,而Bcl-2表达水平下降, Bax/Bcl-2比值显著升高。Bax上调会促进其形成二聚体,打开线粒体膜通道,降低线粒体膜电位,进而促进细胞色素c的释放。而生理条件下, Bcl-2可以与Bax相互作用,抑制Bax, 维持线粒体膜电位[17]。对Bax、Bcl-2表达水平的分析结果与既往研究中线粒体膜电位下降、线粒体通透性增加的结果相一致,表明IL-1β和IL-18作用于心肌细胞,可以促进线粒体依赖的细胞凋亡。
本研究也存在不足,体外实验及细胞系实验存在一定的局限性,本研究后续将结合药物诱导的DCM疾病模型小鼠以及小鼠原代心肌细胞,深入探究IL-1β和IL-18在调控DCM疾病进展及心肌细胞损伤中的作用机制。
综上所述, DCM疾病进展中,炎症小体相关的炎症因子IL-1β和IL-18表达水平升高。IL-1β和IL-18则通过抑制线粒体活性,促进线粒体依赖的细胞凋亡影响心肌细胞的活性,诱导心肌损伤。本研究揭示了炎症小体相关因子促进心肌细胞损伤的作用,为深入了解DCM的发病机制提供了新视角。
-
表 1 各组血清IL-1β和IL-18水平比较(x±s)ng/L
组别 IL-1β IL-18 健康对照组(n=90) 61.77±33.06 35.73±21.12 DCM组(n=104) 73.58±39.09* 45.14±26.55* 与健康对照组比较, *P < 0.05。 表 2 各组细胞增殖相对活性(x±s)
组别 0 h 24 h 48 h 72 h 对照组 1.02±0.03 1.42±0.05 2.15±0.09 3.46±0.32 IL-1β组 1.01±0.01 1.30±0.02 1.82±0.15* 2.63±0.28* IL-18组 0.99±0.03 1.33±0.06 1.75±0.14* 2.78±0.34* 与对照组比较, *P < 0.05。 表 3 各组凋亡相关蛋白相对表达水平(x±s)
组别 Bax/Bcl-2 C-Casp3/GAPDH 对照组 0.47±0.11 0.18±0.03 IL-1β组 1.58±0.28** 0.67±0.09*** IL-18组 1.07±0.12** 0.42±0.07*** 与对照组比较, **P < 0.01, ***P < 0.001。 -
[1] MARFELLA R, SARDU C, MANSUETO G, et al. Evidence for human diabetic cardiomyopathy[J]. Acta Diabetol, 2021, 58(8): 983-988. doi: 10.1007/s00592-021-01705-x
[2] SALVATORE T, PAFUNDI P C, GALIERO R, et al. The diabetic cardiomyopathy: the contributing pathophysiological mechanisms[J]. Front Med (Lausanne), 2021, 8: 695792.
[3] ABDELRAHMAN A H, SALAMA I I, SALAMA S I, et al. Role of some serum biomarkers in the early detection of diabetic cardiomyopathy[J]. Future Sci OA, 2021, 7(5): FSO682. doi: 10.2144/fsoa-2020-0184
[4] YOUSSEF M E, ABDELRAZEK H M, MOUSTAFA Y M. Cardioprotective role of GTS-21 by attenuating the TLR4/NF-κB pathway in streptozotocin-induced diabetic cardiomyopathy in rats[J]. Naunyn Schmiedebergs Arch Pharmacol, 2021, 394(1): 11-31. doi: 10.1007/s00210-020-01957-4
[5] RATHINAM V A K, FITZGERALD K A. Inflammasome complexes: emerging mechanisms and effector functions[J]. Cell, 2016, 165(4): 792-800. doi: 10.1016/j.cell.2016.03.046
[6] YANG F, QIN Y, WANG Y Q, et al. Metformin inhibits the NLRP3 inflammasome via AMPK/mTOR-dependent effects in diabetic cardiomyopathy[J]. Int J Biol Sci, 2019, 15(5): 1010-1019. doi: 10.7150/ijbs.29680
[7] SONG S, DING Y, DAI G L, et al. Sirtuin 3 deficiency exacerbates diabetic cardiomyopathy via necroptosis enhancement and NLRP3 activation[J]. Acta Pharmacol Sin, 2021, 42(2): 230-241. doi: 10.1038/s41401-020-0490-7
[8] HE Y, HARA H, NUÑEZ G. Mechanism and regulation of NLRP3 inflammasome activation[J]. Trends Biochem Sci, 2016, 41(12): 1012-1021. doi: 10.1016/j.tibs.2016.09.002
[9] ABBATE A, TOLDO S, MARCHETTI C, et al. Interleukin-1 and the inflammasome as therapeutic targets in cardiovascular disease[J]. Circ Res, 2020, 126(9): 1260-1280. doi: 10.1161/CIRCRESAHA.120.315937
[10] LIBBY P. Targeting inflammatory pathways in cardiovascular disease: the inflammasome, interleukin-1, interleukin-6 and beyond[J]. Cells, 2021, 10(4): 951. doi: 10.3390/cells10040951
[11] BUSCH K, KNY M, HUANG N, et al. Inhibition of the NLRP3/IL-1β axis protects against Sepsis-induced cardiomyopathy[J]. J Cachexia Sarcopenia Muscle, 2021, 12(6): 1653-1668. doi: 10.1002/jcsm.12763
[12] LI Z H, HU S Q, HUANG K, et al. Targeted anti-IL-1β platelet microparticles for cardiac detoxing and repair[J]. Sci Adv, 2020, 6(6): eaay0589. doi: 10.1126/sciadv.aay0589
[13] XIAO H, LI H, WANG J J, et al. IL-18 cleavage triggers cardiac inflammation and fibrosis upon β-adrenergic insult[J]. Eur Heart J, 2018, 39(1): 60-69. doi: 10.1093/eurheartj/ehx261
[14] ABATE M, FESTA A, FALCO M, et al. Mitochondria as playmakers of apoptosis, autophagy and senescence[J]. Semin Cell Dev Biol, 2020, 98: 139-153. doi: 10.1016/j.semcdb.2019.05.022
[15] DABRAVOLSKI S A, ZHURAVLEV A D, KARTUESOV A G, et al. Mitochondria-mediated cardiovascular benefits of sodium-glucose co-transporter 2 inhibitors[J]. Int J Mol Sci, 2022, 23(10): 5371. doi: 10.3390/ijms23105371
[16] YANG F, PEI R N, ZHANG Z W, et al. Copper induces oxidative stress and apoptosis through mitochondria-mediated pathway in chicken hepatocytes[J]. Toxicol In Vitro, 2019, 54: 310-316. doi: 10.1016/j.tiv.2018.10.017
[17] LIU S P, ZHU Y Y, YAN S S, et al. Phenethyl isothiocyanate induces IPEC-J2 cells cytotoxicity and apoptosis via S-G2/M phase arrest and mitochondria-mediated Bax/Bcl-2 pathway[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2019, 226: 108574. doi: 10.1016/j.cbpc.2019.108574
-
期刊类型引用(3)
1. 张常喜,张亚平,张晓晋,张雄慧,闫文瑞,马力. 基于“络脉”理论的通心络胶囊对糖尿病大鼠心肌TGF-β1-p38MAPK-CREB信号通路的影响. 中国老年学杂志. 2025(02): 340-344 .  百度学术
百度学术
2. 崔甫朦,代云. 达格列净与恩格列净对2型糖尿病合并射血分数降低型心力衰竭患者血糖控制及BNP、cTnI、hs-CRP水平的影响. 中国处方药. 2024(11): 151-155 .  百度学术
百度学术
3. 吴欢欢. 血清脑钠肽(BNP)等生化指标在糖尿病心肌病患者早期诊断中的效果观察. 中西医结合心血管病电子杂志. 2023(19): 83-85 .  百度学术
百度学术
其他类型引用(2)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号