Application value of a new predictive scoring system for fatty pancreas based on endoscopic ultrasound diagnosis
-
摘要:目的
探讨新型评分系统用于临床诊断脂肪胰(FP)的可行性。
方法选取2021年4月—2022年6月扬州大学附属医院消化内科消化内镜中心行超声内镜(EUS)诊断者55例为研究对象, 经超声内镜分为FP组与非FP组。比较2组一般资料和生化指标。以脂肪肝、高甘油三酯血症、腹型肥胖共3个指标改良评分系统,采用受试者工作特征(ROC)曲线评估改良后新评分系统预测FP的可行性。
结果共纳入55例研究对象,其中FP组20例,非FP组35例。FP组腹围、体质量指数(BMI)、高脂血症占比和脂肪肝患病率大于或高于非FP组,差异有统计学意义(P < 0.05)。FP组甘油三酯、谷丙转氨酶、谷草转氨酶高于非FP组,高密度脂蛋白低于非FP组,差异有统计学意义(P < 0.05)。FP组合并代谢综合征参数平均数量、合并代谢综合征参数数量≥3个者占比多于或高于非FP组,差异有统计学意义(P < 0.05)。改良后新型评分系统预测FP的效能显著改善[曲线下面积(AUC)由0.651上升至0.731]。
结论改良后的新型评分系统可作为临床工作中预测FP的简易工具。
Abstract:ObjectiveTo explore the feasibility of a new scoring system for the clinical diagnosis of the fatty pancreas(FP).
MethodsFrom April 2021 to June 2022, 55 patients who underwent endoscopic ultrasound (EUS) diagnosis in the Gastroenterology Center of the Affiliated Hospital of Yangzhou University were selected as research objects. The patients were divided into FP group and non-FP group by endoscopic ultrasound. The general data and biochemical parameters of the two groups were compared. Fatty liver, hypertriglyceridemia and abdominal obesity were used to be improved scoring system. Receiver operating characteristic (ROC) curve was used to evaluate the feasibility of the new improved scoring system in predicting FP.
ResultsA total of 55 subjects were included, including 20 in the FP group and 35 in the non-FP group. The abdominal circumference, body mass index (BMI), proportion of hyperlipidemia and prevalence of fatty liver in the FP group were significantly more or higher than those in the non-FP group(P < 0.05). Triglyceride, alanine aminotransferase, aspartate aminotransferase in the FP group were significantly higher than those in the non-FP group, and high-density lipoprotein was significantly lower than that in the non-FP group (P < 0.05). The average number of FP combined with metabolic syndrome parameters and the proportion of the number of metabolic syndrome parameters ≥ 3 in the FP group were significantly more or higher than those in the non-FP group (P < 0.05). After improvement, the efficiency of the new scoring system in predicting FP was significantly improved (AUC increased from 0.651 to 0.731).
ConclusionThe improved scoring system can be used as a simple tool to predict FP in clinical work.
-
Keywords:
- endoscopic ultrasonography /
- fatty pancreas /
- metabolic syndrome /
- new scoring system
-
脂肪胰(FP)与代谢综合征、胰腺炎严重程度等因素有关[1]。FP是指过多脂肪沉积于腺泡或间质内的一种临床病理综合征[2]。FP诊断的金标准是组织活检,但有创性操作的缺点限制了其在临床上的应用。影像学检查如腹部彩超、CT在FP诊治方面应用广泛[3-4], 但关于该疾病的诊断尚没有共识。研究[5]认为,超声内镜(EUS)是观察胰腺的最佳方式,而EUS是一项侵入性操作,现阶段无法作为筛查FP的工具。儿童的胰腺脂肪沉积问题严重影响了其胰腺外分泌功能[6],因此临床早期诊断FP在一定程度上可改善脏器脂肪沉积及预防代谢性疾病的发生发展[7]。目前,临床上缺乏简单有效的评分系统来预测FP。本研究探讨新型改良后的评分系统(脂肪肝、高甘油三酯血症、腹型肥胖共3项指标建立预测模型)在FP临床诊断中的应用效果。
1. 资料与方法
1.1 一般资料
选取2021年4月—2022年6月在扬州大学附属医院消化内科消化内镜中心完善超声内镜检查的人群,排除一般资料及生化资料不完整的人群,最终纳入研究对象55例。经超声内镜分为FP组20例与非FP组35例,对2组一般资料及临床生化指标进行分析。本研究符合《赫尔辛基宣言》的伦理原则,该研究经扬州大学附属医院伦理委员会批准(伦理批号: 2121-YKL4-28-007)。
1.2 方法
收集一般资料: 性别、年龄、身高、体质量、腹围(WC)、血压(收缩压和舒张压),计算体质量指数(BMI)。既往史: 吸烟史、饮酒史、是否伴有高血压、2型糖尿病、脂肪肝病史。实验室指标: 肝功能、肾功能、血脂、空腹血糖。结合受试者资料记录代谢综合征参数数量,以及是否达到代谢综合征的诊断标准。
1.3 诊断标准
吸烟史: 每天至少吸1支烟,已持续半年以上或戒烟年限 < 15年者,否则为非吸烟者; 饮酒史: 男性平均每日乙醇摄入量≥20 g, 女性≥10 g, 连续或累计饮酒6个月以上者,否则为非饮酒者; 脂肪肝: 1个月内,腹部B超诊断为脂肪肝者,否则为不伴有脂肪肝; 腹型肥胖: 男性WC≥90 cm, 女性WC≥85 cm; 高甘油三酯血症: 空腹甘油三酯≥1.7 mmol/L, 高胆固醇血症: 总胆固醇≥5.69 mmol/L。代谢综合征: 符合下列4项中3项或全部即可诊断: ①超重或肥胖, BMI≥25 kg/m2; ②高血糖: 空腹血糖≥6.1 mmol/L和(或)餐后2 h血糖≥11.1 mmol/L, 或已明确诊断为糖尿病的患者; ③高血压: 血压≥140/90 mmHg或已明确诊断为高血压并治疗者; ④血脂异常: 空腹甘油三酯≥1.7 mmol/L和高密度脂蛋白 < 0.9 mmol/L(男)或 < 1.0 mmol/L(女)。
FP诊断标准: FP的诊断通过EUS检查进行,由本院消化科内镜中心经验丰富的医师操作,并由另一位EUS专家审查和批准,使用频率为5 MHz的超声内窥镜(E2-2000, Olympus)进行检查。患者采取左侧卧位,静脉注射丙泊酚麻醉剂进行全身静脉麻醉,予鼻导管吸氧,并通过脉搏血氧仪测量患者的氧饱和度。2位超声内镜操作医师使用统一的FP诊断标准: 胰腺形态饱满,体积略增大,边缘模糊; 胰腺头、体、尾部回声细密、明亮,强于正常脾脏、肾脏回声[5]。
1.4 统计学分析
应用SPSS 25.0软件对数据进行统计学分析。对于符合正态分布的计量资料,采用(x±s)表示,组间比较采用t检验,计数资料采用[n(%)]表示,组间比较采用χ2检验。分别绘制改良前和改良后评分系统预测FP的受试者工作特征(ROC)曲线,比较曲线下面积(AUC), 所有检验均为双侧概率检验。P < 0.05表示差异有统计学意义。
2. 结果
2.1 FP与非FP超声内镜下表现
FP: 胰腺形态饱满,体积略增大,边缘模糊; 胰腺头、体、尾部回声细密、明亮,强于正常脾脏、肾脏回声(图 1A)。非FP: 胰腺形态基本正常,边缘轮廓清楚,与脾脏或肾脏相比,胰腺实质表现为等回声或者略强(图 1B)。
2.2 一般资料分析
研究对象共纳入55例,其中FP组20例(36.36%)。FP组WC、BMI、高脂血症占比和脂肪肝患病率大于或高于非FP组,饮酒史占比低于非FP组,差异有统计学意义(P < 0.05)。2组性别、年龄、总体血压、吸烟史、是否伴有2型糖尿病、高血压方面比较,差异无统计学意义(P>0.05)。见表 1。
表 1 FP组与非FP组的一般资料(x±s)[n(%)]一般资料 FP组(n=20) 非FP组(n=35) 性别 男 12(60.00) 25(71.43) 女 8(40.00) 10(28.57) 年龄/岁 53.75±10.42 50.00±10.23 体质量指数/(kg/m2) 27.37±2.92* 24.84±2.66 腹围/cm 93.25±7.48* 87.03±6.71 收缩压/(mm/Hg) 127.85±12.58 121.74±15.54 舒张压/(mm/Hg) 81.70±10.48 79.71±9.69 高血压 7(35.00) 6(17.14) 2型糖尿病 3(15.00) 1(2.86) 高脂血症 17(85.00)* 18(51.43) 脂肪肝 17(85.00)* 20(57.14) 吸烟史 2(10.00) 8(22.86) 饮酒史 0* 8(22.86) 与非FP组比较, * P < 0.05。 2.3 实验室生化指标分析
FP组甘油三酯、谷丙转氨酶、谷草转氨酶高于非FP组,高密度脂蛋白低于非FP组,差异有统计学意义(P < 0.05)。2组胆固醇、低密度脂蛋白及肾功能比较,差异无统计学意义(P>0.05)。见表 2。
表 2 FP组与非FP组的实验室指标分析(x±s)指标 FP组(n=20) 非FP组(n=35) 甘油三酯/(mmol/L) 2.53±1.09* 1.90±1.01 胆固醇/(mmol/L) 5.13±1.32 5.01±0.79 高密度脂蛋白/(mmol/L) 1.09±0.22* 1.25±0.26 低密度脂蛋白/(mmol/L) 2.75±1.00 2.94±0.62 白蛋白/(g/L) 44.26±3.03 46.63±9.04 球蛋白/(g/L) 31.92±6.13 29.91±4.93 谷丙转氨酶/(U/L) 41.09±31.51* 25.55±10.97 谷草转氨酶/(U/L) 30.64±17.12* 20.79±5.62 直接胆红素/(μmol/L) 3.29±1.66 3.61±1.39 间接胆红素/(μmol/L) 10.55±3.49 11.20±3.35 γ-谷氨酰转肽酶/(U/L) 49.98±42.10 43.76±42.34 空腹血糖/(mmol/L) 5.78±0.66 6.23±2.27 肌酐/(μmol/L) 66.93±17.90 73.98±19.75 尿素/(mmol/L) 5.45±1.31 5.28±1.18 尿酸/(μmol/L) 337.99±75.01 342.35±92.31 与非FP组比较, * P < 0.05。 2.4 代谢综合征与FP的分析
FP组合并代谢综合征参数数量平均为(2.70±0.92)个,多于FP组的(1.77±1.24)个, 差异有统计学意义(P < 0.05); FP组合并代谢综合征参数数量≥3个的占比为70.00%(14/20), 高于非FP组的31.43%(11/35), 差异有统计学意义(P < 0.05)。见表 3。
表 3 FP组与非FP组的代谢综合征参数的数量分析[n(%)]合并代谢综合征参数数量/个 FP组(n=20) 非FP组(n=35) 0 0 6(17.14) 1 3(15.00) 10(28.57) 2 3(15.00) 8(22.86) 3 11(55.00) 8(22.86) 4 3(15.00) 3(8.57) 2.5 改良后新型评分系统预测FP的ROC曲线
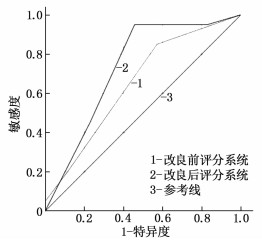
参考KHOURY T等[8]研究,改良前评分系统为脂肪肝、高胆固醇血症、BMI≥30 kg/m2共3项指标,各赋1分。对上述评分系统进行改良: 脂肪肝、高甘油三酯血症、腹型肥胖共3项指标,各赋1分,见表 4。绘制改良前评分系统与改良后评分系统的ROC曲线(图 2), 结果显示,改良后新型评分系统AUC为0.731(95%CI: 0.596~0.866, P=0.005), 改良前评分系统AUC为0.651(95%CI: 0.503~0.799, P=0.065), 提示改良后评分系统的预测性能显著上升。
表 4 2种评分系统的赋分评分系统 指标 计分 改良前评分系统 脂肪肝 1 高胆固醇血症 1 体质量指数≥30 kg/m2 1 改良后评分系统 脂肪肝 1 高甘油三酯血症 1 腹型肥胖 1 3. 讨论
在临床工作中,目前缺乏简单明确、可常规开展诊断FP的方法,因此建立一个简单易获得的评分系统预测FP就显得尤为重要[9-10]。WC与BMI作为日常生活及临床工作中评估肥胖的常用指标,研究[11-13]显示, WC相较于BMI与代谢性疾病及腹型肥胖有更密切的相关性。WC已被临床作为广泛评估腹部脂肪与心血管疾病风险的常用指标,在各项评分系统中, WC反映肥胖的效能优于BMI。研究[14-18]指出,甘油三酯与内脏脂肪沉积关系更为密切。本研究中,对纳入研究对象的一般资料及实验室生化指标分析,结果显示FP组腹围显著大于非FP组(P=0.003); 2组BMI、甘油三酯及脂肪肝患病率方面比较,差异有统计学意义(P < 0.05)。基于上述背景,本研究将KHOURY T等[8]创立的评分系统进行改良,即通过脂肪肝、腹型肥胖、高甘油三酯血症共3项指标建立新评分系统预测FP的存在。本研究结果显示,改良后评分系统预测性能显著改善(AUC由0.651升至0.731), 表明该简易评分系统在临床上可作为有效预测FP的工具。
本研究存在不足之处:首先, FP通过超声内镜下诊断,缺少活检组织标本进一步验证上述结果;其次,本研究显示,非FP组饮酒史人群比率高于FP组,与李鑫等[19]研究结果不一致,分析原因可能为本研究样本量较少;再次,本研究为观察性研究,且纳入人群为成年人群体,还需进一步扩大样本量,进行多中心、前瞻性研究,并将研究对象扩展到青少年群体中。
综上所述,上述改良后的简易评分系统可在一定程度上帮助临床医生有效预测FP, 以提高患者健康意识,及时进行干预。
-
表 1 FP组与非FP组的一般资料(x±s)[n(%)]
一般资料 FP组(n=20) 非FP组(n=35) 性别 男 12(60.00) 25(71.43) 女 8(40.00) 10(28.57) 年龄/岁 53.75±10.42 50.00±10.23 体质量指数/(kg/m2) 27.37±2.92* 24.84±2.66 腹围/cm 93.25±7.48* 87.03±6.71 收缩压/(mm/Hg) 127.85±12.58 121.74±15.54 舒张压/(mm/Hg) 81.70±10.48 79.71±9.69 高血压 7(35.00) 6(17.14) 2型糖尿病 3(15.00) 1(2.86) 高脂血症 17(85.00)* 18(51.43) 脂肪肝 17(85.00)* 20(57.14) 吸烟史 2(10.00) 8(22.86) 饮酒史 0* 8(22.86) 与非FP组比较, * P < 0.05。 表 2 FP组与非FP组的实验室指标分析(x±s)
指标 FP组(n=20) 非FP组(n=35) 甘油三酯/(mmol/L) 2.53±1.09* 1.90±1.01 胆固醇/(mmol/L) 5.13±1.32 5.01±0.79 高密度脂蛋白/(mmol/L) 1.09±0.22* 1.25±0.26 低密度脂蛋白/(mmol/L) 2.75±1.00 2.94±0.62 白蛋白/(g/L) 44.26±3.03 46.63±9.04 球蛋白/(g/L) 31.92±6.13 29.91±4.93 谷丙转氨酶/(U/L) 41.09±31.51* 25.55±10.97 谷草转氨酶/(U/L) 30.64±17.12* 20.79±5.62 直接胆红素/(μmol/L) 3.29±1.66 3.61±1.39 间接胆红素/(μmol/L) 10.55±3.49 11.20±3.35 γ-谷氨酰转肽酶/(U/L) 49.98±42.10 43.76±42.34 空腹血糖/(mmol/L) 5.78±0.66 6.23±2.27 肌酐/(μmol/L) 66.93±17.90 73.98±19.75 尿素/(mmol/L) 5.45±1.31 5.28±1.18 尿酸/(μmol/L) 337.99±75.01 342.35±92.31 与非FP组比较, * P < 0.05。 表 3 FP组与非FP组的代谢综合征参数的数量分析[n(%)]
合并代谢综合征参数数量/个 FP组(n=20) 非FP组(n=35) 0 0 6(17.14) 1 3(15.00) 10(28.57) 2 3(15.00) 8(22.86) 3 11(55.00) 8(22.86) 4 3(15.00) 3(8.57) 表 4 2种评分系统的赋分
评分系统 指标 计分 改良前评分系统 脂肪肝 1 高胆固醇血症 1 体质量指数≥30 kg/m2 1 改良后评分系统 脂肪肝 1 高甘油三酯血症 1 腹型肥胖 1 -
[1] WAGNER R, ECKSTEIN S S, YAMAZAKI H, et al. Metabolic implications of pancreatic fat accumulation[J]. Nat Rev Endocrinol, 2022, 18(1): 43-54. doi: 10.1038/s41574-021-00573-3
[2] PEZZILLI R, CALCULLI L. Pancreatic steatosis: is it related to either obesity or diabetes mellitus?[J]. World J Diabetes, 2014, 5(4): 415-419. doi: 10.4239/wjd.v5.i4.415
[3] ZHOU J, LI M L, ZHANG D D, et al. The correlation between pancreatic steatosis and metabolic syndrome in a Chinese population[J]. Pancreatology, 2016, 16(4): 578-583. doi: 10.1016/j.pan.2016.03.008
[4] HOOGENBOOM S A, BOLAN C W, CHUPRIN A, et al. Pancreatic steatosis on computed tomography is an early imaging feature of pre-diagnostic pancreatic cancer: a preliminary study in overweight patients[J]. Pancreatology, 2021, 21(2): 428-433. doi: 10.1016/j.pan.2021.01.003
[5] SEPE P S, OHRI A, SANAKA S, et al. A prospective evaluation of fatty pancreas by using EUS[J]. Gastrointest Endosc, 2011, 73(5): 987-993. doi: 10.1016/j.gie.2011.01.015
[6] KIM J, ALBAKHEET S S, HAN K, et al. Quantitative MRI assessment of pancreatic steatosis using proton density fat fraction in pediatric obesity[J]. Korean J Radiol, 2021, 22(11): 1886-1893. doi: 10.3348/kjr.2020.1343
[7] TAYLOR R, BARNES A C. Translating aetiological insight into sustainable management of type 2 diabetes[J]. Diabetologia, 2018, 61(2): 273-283. doi: 10.1007/s00125-017-4504-z
[8] KHOURY T, MARI A, SBEIT W. A novel clinical score predicting the presence of fatty pancreas[J]. J Clin Med, 2021, 10(24): 5843. doi: 10.3390/jcm10245843
[9] WANG C Y, OU H Y, CHEN M F, et al. Enigmatic ectopic fat: prevalence of nonalcoholic fatty pancreas disease and its associated factors in a Chinese population[J]. J Am Heart Assoc, 2014, 3(1): e000297. doi: 10.1161/JAHA.113.000297
[10] SINGH R G, YOON H D, WU L M, et al. Ectopic fat accumulation in the pancreas and its clinical relevance: a systematic review, meta-analysis, and meta-regression[J]. Metabolism, 2017, 69: 1-13. doi: 10.1016/j.metabol.2016.12.012
[11] ZHOU C M, ZHAN L, YUAN J, et al. Comparison of visceral, general and central obesity indices in the prediction of metabolic syndrome in maintenance hemodialysis patients[J]. Eat Weight Disord, 2020, 25(3): 727-734. doi: 10.1007/s40519-019-00678-9
[12] TIAN T, ZHANG J X, ZHU Q R, et al. Predicting value of five anthropometric measures in metabolic syndrome among Jiangsu Province, China[J]. BMC Public Health, 2020, 20(1): 1317. doi: 10.1186/s12889-020-09423-9
[13] ZHANG F L, REN J X, ZHANG P, et al. Strong association of waist circumference (WC), body mass index (BMI), waist-to-height ratio (WHtR), and waist-to-hip ratio (WHR) with diabetes: a population-based cross-sectional study in Jilin Province, China[J]. J Diabetes Res, 2021, 2021: 8812431.
[14] PINNICK K E, COLLINS S C, LONDOS C, et al. Pancreatic ectopic fat is characterized by adipocyte infiltration and altered lipid composition[J]. Obesity (Silver Spring), 2008, 16(3): 522-530. doi: 10.1038/oby.2007.110
[15] JIALAL I, ADAMS-HUET B. Comparison of the triglyceride-waist circumference and the C-reactive protein-waist circumference indices in nascent metabolic syndrome[J]. Int J Physiol Pathophysiol Pharmacol, 2021, 13(5): 126-131.
[16] KOÇ U, TAYDAȘ O. Evaluation of pancreatic steatosis prevalence and anthropometric measurements using non-contrast computed tomography[J]. Turk J Gastroenterol, 2020, 31(9): 640-648. doi: 10.5152/tjg.2020.19434
[17] ZHANG Y, LI J, XU Y Q. Association of incidence between pancreatic adipose infiltration and metabolic syndrome: a literature review and meta-analysis[J]. Comput Math Methods Med, 2021, 2021: 5747558.
[18] SINGH R G, YOON H D, POPPITT S D, et al. Ectopic fat accumulation in the pancreas and its biomarkers: a systematic review and meta-analysis[J]. Diabetes Metab Res Rev, 2017, 33(8): 1-13.
[19] 李鑫, 胡梦琪, 郎艳飞, 等. 超声内镜对脂肪胰的诊断及相关临床因素分析[J]. 中南医学科学杂志, 2020, 48(1): 72-75. https://www.cnki.com.cn/Article/CJFDTOTAL-HYYY202001019.htm





 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
