Effects of diabetes and smoking on occurrence of pancreatic cancer and their interaction
-
摘要:目的
探讨糖尿病、吸烟对胰腺癌(PC)的影响和两者之间的相互作用。
方法基于英国生物样本数据库(UKB)中约50万名参与者的表型数据, 将研究对象分为糖尿病人群和非糖尿病人群、吸烟人群和非吸烟人群。应用多变量调整的Logistic回归模型分析吸烟、糖尿病与PC事件之间的关联性,并应用加性模型评估2种危险因素之间的相互作用。
结果本研究共纳入492 637名研究对象,其中包含1 223名PC患者和491 414名非PC患者。调整年龄、性别、种族、体质量指数(BMI)等混杂因素后发现,糖尿病人群(OR=1.999, 95%CI: 1.704~2.344)、吸烟人群(OR=1.246, 95%CI: 1.109~1.400) PC患病风险分别高于非糖尿病人群、非吸烟人群,差异有统计学意义(P < 0.05)。吸烟且有糖尿病病史人群相较于从不吸烟且无糖尿病史人群PC发病风险增加了近4倍(OR=3.561, 95%CI: 2.949~4.300, P < 0.001)。
结论糖尿病和吸烟是PC的独立危险因素,两者之间相互作用增加PC的患病风险。
Abstract:ObjectiveTo investigate the effects of diabetes and smoking on occurrence of pancreatic cancer (PC) and their interaction.
MethodsBased on the phenotype data of about 500 000 participants in the UK Bio-bank (UKB), the subjects were divided into people with diabetes and non-diabeties, smokers and non-smokers. Multivariate adjusted Logistic regression model was used to analyze the association between smoking, diabetes and PC. The interaction between the two risk factors was assessed by an additive model.
ResultsA total of 492 637 participants were included, including 1 223 patients with PC and 491 414 patients without PC. After adjusting for age, gender, race, body mass index (BMI) and other confounding factors, it was founded that the risk of PC in people with diabetes (OR=1.999, 95%CI, 1.704 to 2.344) and people with smoking (OR=1.246, 95%CI, 1.109 to 1.400) were significantly higher than those of people with non-diabetes or non-smokers (P < 0.05). People who smoked and had a history of diabetes had a nearly 4-fold increased risk of developing PC compared with those who never smoked and had no history of diabetes (OR=3.561, 95%CI, 2.949 to 4.300, P < 0.001).
ConclusionDiabetes and smoking are independent risk factors for PC, and their interaction increases the risk of PC.
-
Keywords:
- diabetes /
- smoking /
- interaction /
- pancreatic cancer /
- UK Bio-bank
-
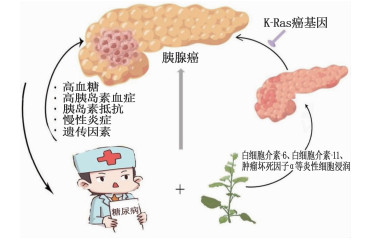
胰腺癌(PC)是一种具有高度侵袭性的肿瘤, 5年生存率低于10%[1], 且发病率逐年上升[2]。PC临床早期诊断困难,进展迅速,且治疗疗效有限,对人类健康构成了严重威胁[3]。故早发现、早预防相关危险因素对改善PC患者预后意义重大。已知糖尿病[4-5]和吸烟[6-7]是PC的危险因素,目前国内探索糖尿病和吸烟对PC影响的大样本数据不足。本研究分析了英国生物样本数据库(UKB)中2006—2010年招募的约50万名40~69岁参与者的PC患病情况[8], 旨在研究糖尿病、吸烟对PC发病的影响,并选择加性模型探索2种暴露因素之间的相互作用(图 1)。
1. 对象与方法
1.1 研究对象
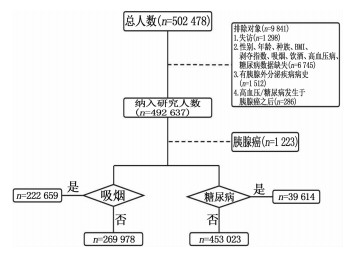
UKB是一项基于人群的队列研究,具有来自英国的约50万名参与者的表型数据[9], 其数据通过触摸屏问卷、物理测量以及生物样本等方式获取。本研究从中获取502 478名志愿者的基线调查信息,对人口学特征(性别、年龄、种族)、生活方式(吸烟、饮酒)、生活形态(汤森剥夺指数)、体格检查指标(身高、体质量)、既往病史(高血压病、糖尿病、胰腺外分泌疾病)等进行详细评估。排除标准: 入组后失访者; 存在表型数据缺失者,如性别、年龄、种族、体质量指数(BMI)、剥夺指数、吸烟、饮酒、高血压病、糖尿病等数据; 有胰腺外分泌疾病病史患者; 高血压病、糖尿病发生于PC诊断之后者。最终纳入492 637名研究对象。纳入流程见图 2。
1.2 方法
从UKB中提取所有样本的基线数据,包括性别(0=女性, 1=男性)、年龄、种族(0=其他, 1=白人, 2=混血, 3=亚洲人, 4=黑人)、BMI、汤森剥夺指数、自我报告的吸烟情况或饮酒情况(0=从不吸烟或饮酒, 1=当前吸烟或饮酒),以及自我报告的医生诊断的高血压病、糖尿病病史(0=无,1=有)。结局事件是PC的发生(0=无,1=有)。若参与者未提供疾病诊断时间(距1960年1月1日的时间),则删除个案。UKB项目获得了英国西北多中心研究伦理委员会North-West Hay dock的批准,所有参与者在参加研究之前均签署了书面知情同意书。
1.3 统计学分析
将数据导入SPSS 25.0统计软件,计量资料满足正态分布,采用(x±s)表示,根据方差齐性选择t检验或t′检验; 不满足正态分布的计量资料表示为中位数和四分位距(IQR), 使用U检验; 分类资料表示为百分比,使用χ2检验计算χ2值及P值; 连续数值变量使用非参数检验计算Z值及P值。采用Logistic回归分析评估自变量糖尿病、吸烟情况与因变量PC发生之间的关联程度,以P和OR表示,置信区间为95%CI。P < 0.05表示差异具有统计学意义。
采用交互效应加性模型探讨糖尿病和吸烟的相互作用,计算指标为协同效应指数(SI)、相互作用超额相对危险度(RERI)、相互作用归因比(AP)和纯相互作用归因比。
2. 结果
2.1 糖尿病与非糖尿病观察对象一般资料比较
本研究最终纳入492 637名研究对象,包括453 023名无糖尿病病史及39 614名有糖尿病病史人群。糖尿病者与非糖尿病者在性别、年龄、汤森剥夺指数、种族、吸烟、饮酒、BMI、高血压病病史分布方面比较,差异均有统计学意义(P < 0.05)。糖尿病人群中PC发病人数为231例(0.6%), 非糖尿病人群PC发病人数为992例(0.2%)。见表 1。
表 1 糖尿病者和非糖尿病者基线资料[M(Q1, Q3)][n(%)]变量 非糖尿病(n=453 023) 糖尿病(n=39 614) χ2/Z P 性别 女 252 162(55.7) 16 224(41.0) 3 177.177 < 0.001 男 200 861(44.3) 23 390(59.0) 入组年龄/岁 58(50,63) 62(56,66) -79.571 < 0.001 剥夺指数 -2(-4, 0) -1(-3, 2) -55.431 < 0.001 种族 白人 411 875(90.9) 34 947(88.2) 739.984 < 0.001 混血 16 356(3.6) 2 026(5.1) 亚洲人 15 864(3.5) 1 232(3.1) 黑人 2 323(0.5) 453(1.1) 其他 6 605(1.5) 956(2.4) 体质量指数 < 25 kg/m2 136 389(30.1) 3 387(8.6) 22 547.197 < 0.001 25~ < 30 kg/m2 204 520(45.1) 12 962(32.7) ≥30 kg/m2 112 114(24.7) 23 265(58.7) 吸烟 200 733(44.3) 21 926(55.3) 1 792.347 < 0.001 饮酒 434 648(95.9) 36 265(91.5) 1 671.573 < 0.001 高血压病 111 694(24.7) 29 668(74.9) 44 933.609 < 0.001 胰腺癌 992(0.2) 231(0.6) 195.070 < 0.001 根据WHO标准,定义BMI < 25 kg/m2为正常或偏瘦, BMI 25~ < 30 kg/m2为偏胖, BMI≥30 kg/m2为肥胖。 2.2 糖尿病情况与PC发病风险的关联
以是否具有糖尿病病史为自变量, PC事件发生为因变量,进行Logistic比例风险回归分析。未调整混杂因素前,糖尿病患者PC发生风险是非糖尿病人群的2.673倍(95%CI: 2.315~3.085, P < 0.001); 模型Ⅱ调整年龄、性别、种族、BMI、剥夺指数后,糖尿病仍是PC发生的高危因素(OR=2.004, 95%CI: 1.721~2.333, P < 0.001); 在模型Ⅱ的基础上校正吸烟、饮酒、高血压病,糖尿病患者的PC发病的OR为1.999(95%CI: 1.704~2.344), 差异有统计学意义(P < 0.05)。见表 2。
表 2 糖尿病对PC发病影响的Logistic回归模型糖尿病模型 b Wald χ2 P OR(95%CI) 模型Ⅰ 0.983 180.161 < 0.001 2.673(2.315~3.085) 模型Ⅱ 0.695 80.103 < 0.001 2.004(1.721~2.333) 模型Ⅲ 0.692 72.565 < 0.001 1.999(1.704~2.344) 以无糖尿病病史人群为参照。模型Ⅰ: 未调整其他混杂因素; 模型Ⅱ: 调整年龄、性别、种族、BMI、剥夺指数; 模型Ⅲ: 在模型Ⅱ基础上调整吸烟、饮酒、高血压病。 2.3 吸烟与非吸烟观察对象一般资料比较
纳入研究对象中包含269 978名非吸烟人群和222 659名吸烟人群,两者在性别、年龄、汤森剥夺指数、种族、饮酒、BMI、高血压病病史、糖尿病病史分布方面比较,差异均具有统计学意义(P < 0.05)。随访期间,吸烟人群中673例(0.3%)发生PC, 非吸烟人群550例发生PC(0.2%), 差异有统计学意义(P < 0.001)。见表 3。
表 3 吸烟人群和非吸烟人群基线资料[M(Q1, Q3)][n(%)]变量 非吸烟(n=269 978) 吸烟(n=222 659) χ2/Z P 性别 女 160 035(59.3) 108 351(48.7) 5 543.969 < 0.001 男 109 943(40.7) 114 308(51.3) 入组年龄/岁 57(50, 63) 59(52, 64) -66.268 < 0.001 剥夺指数 -2(-4, 0) -2(-3, 1) -70.255 < 0.001 种族 白人 245 341(90.9) 201 481(90.5) 587.854 < 0.001 混血 10 027(3.7) 8 355(3.8) 亚洲人 8 161(3.0) 8 935(4.0) 黑人 1 714(0.6) 1 062(0.5) 其他 4 735(1.8) 2 826(1.3) 体质量指数 <25 kg/m2 83 124(30.8) 56 652(25.4) 2 034.098 < 0.001 25~<30 kg/m2 117 730(43.6) 99 752(44.8) ≥30 kg/m2 69 124(25.6) 66 255(29.8) 饮酒 252 237(93.4) 218 676(98.2) 6 620.863 < 0.001 高血压病 68 091(25.2) 73 271(32.9) 3 523.331 < 0.001 糖尿病 17 688(6.6) 21 926(9.8) 1 792.347 < 0.001 胰腺癌 550(0.2) 673(0.3) 47.842 < 0.001 2.4 吸烟情况与PC发病风险的关联
未调整混杂因素前(模型Ⅰ),吸烟人群PC发生风险上升(OR=1.485, 95%CI: 1.327~1.662, P < 0.001); 调整年龄、性别、种族、BMI、剥夺指数等混杂因素(模型Ⅱ)和在此基础上调整剩余混杂因素(模型Ⅲ)后,吸烟人群PC发病风险均高于非吸烟人群(OR>1, P < 0.05)。见表 4。
表 4 吸烟对PC发病影响的Logistic回归模型吸烟模型 b Wald χ2 P OR(95%CI) 模型ⅰ 0.396 47.228 < 0.001 1.485(1.327~1.662) 模型Ⅱ 0.230 15.297 < 0.001 1.258(1.121~1.412) 模型Ⅲ 0.220 13.701 < 0.001 1.246(1.109~1.400) 以非吸烟人群为参照。模型Ⅰ: 未校正其他混杂因素; 模型Ⅱ: 调整年龄、性别、种族、BMI、剥夺指数; 模型Ⅲ: 在模型Ⅱ基础上调整饮酒、高血压、糖尿病。 2.5 糖尿病、吸烟相互作用与PC发病风险的关联
相较于非糖尿病且不吸烟人群,非糖尿病吸烟人群PC发病风险上升(OR=1.449, 95%CI: 1.279~1.642, P < 0.001); 糖尿病不吸烟人群的PC风险为非糖尿病且不吸烟人群的2.763倍(95%CI: 2.201~3.468, P < 0.001), 糖尿病且吸烟人群PC风险更高(OR=3.561, 95%CI: 2.949~4.300, P < 0.001)。采用加性模型计算相互作用效应指标。糖尿病和吸烟对PC的SI为1.158[(3.561-1.000)/(2.763-1.000+1.449-1.000)], SI>1表明糖尿病和吸烟之间存在正交互作用; RERI为0.349[(3.561-2.763-1.449+1.000)/1.000], AP为9.80%[100.000×0.349/3.561], 纯相互作用归因比为13.63%[100.000×0.349/(3.561-1.000)]。PAP结果显示,当同时暴露于糖尿病和吸烟时, 13.63%的PC可归因于2种危险因素之间的相互作用。见表 5。
表 5 糖尿病、吸烟相互作用对PC影响的Logistic回归模型糖尿病 吸烟 PC人数 b Wald χ2 P OR(95%CI) - - 461 — 214.074 — 1 - + 531 0.371 33.851 < 0.001 1.449(1.279~1.642) + - 89 1.016 76.679 < 0.001 2.763(2.201~3.468) + + 142 1.270 174.155 < 0.001 3.561(2.949~4.300) 3. 讨论
本研究纳入492 637名研究对象,其中1 223名为PC病例,通过多因素调整的Logistic回归模型证实糖尿病和吸烟是PC发病的独立危险因素。本研究发现,当同时暴露于糖尿病和吸烟时, PC发病风险增加了近4倍(OR=3.561, 95%CI: 2.949~4.300, P < 0.001)。
糖尿病是一种慢性代谢性疾病,发病人数从1980年的1.08亿增至2014年的4.22亿,预计到2040年将增至6.42亿[10]。研究[11-13]证实,糖尿病和PC之间呈双向相关,高血糖、高胰岛素血症、胰岛素抵抗、慢性炎症和遗传因素均促进两者之间的关联。一项人口学研究[14]估计,临床9.7%的PC可归因于糖尿病,超过2/3的PC患者患有糖尿病或前期糖尿病[15]。本研究发现,调整年龄、性别、吸烟、饮酒等混杂因素后,糖尿病人群PC的发病风险显著高于非糖尿病人群(OR=1.999, 95%CI: 1.704~2.344, P < 0.001), 结论与2019年的一项涉及多种族的队列研究[16]一致。诸多回顾性临床数据[17-19]显示,糖尿病患者长期服用二甲双胍后PC患病风险下降,磺酰脲类药物或胰岛素反而会增加PC的患病风险。因相关数据不足,本研究未能对降糖药物进一步分析。
吸烟促使胰腺组织和间质进行性纤维化[20], 是PC最确定的环境危险因素。相关证据[21]表明,吸烟诱导的活性氧和由此产生的氧化应激在炎症和癌症中起着重要作用。PC主要是由K-Ras癌基因驱动[22], 烟草烟雾会刺激白细胞介素-6(IL-6)、白细胞介素-11(IL-11)、肿瘤坏死因子α(TNF-α)等炎性细胞浸润[23-24], 炎症与K-Ras合作启动、加速PC的进展[25]。本研究发现, PC发病风险是不吸烟人群的1.246倍(95%CI: 1.109~1.400, P < 0.001)。2022年的一项最新回顾性队列研究[20]进一步佐证了本研究的结论,即吸烟有发生PC的显著风险。
既往研究少有考虑到糖尿病和吸烟在PC发生上的相互作用,本研究发现糖尿病和吸烟之间存在正交互作用,两者之间存在风险因素之间的可加性和协同作用(SI>0), 当同时暴露于糖尿病和吸烟时, 13.63%的PC可归因于2种危险因素之间的相互作用。相关研究[26]通过加性模型发现,糖尿病和吸烟状态相互作用增加PC的发病率(SI=4.93)。
本研究优势在于: ① UKB具有广泛的表型,其中的社会人口学因素及生活方式可进行调整,这一基于大样本量的队列研究使得结果较为稳定; ②研究因素之间的相互作用,更能反映因素与结果之间的真实关系。但本研究也存在一定的局限性: ①由于数据来源的限制,研究对象以英国白种人为主,需进一步在亚洲人群中进行验证; ②部分基线数据多为自我报告,缺乏具体细节,不能反映个体的动态变化; ③ UKB队列的随访时间有限, PC的病例数不高。
综上所述,本研究证实糖尿病和吸烟是PC的2个独立危险因素,二者之间相互作用增加PC的发病风险。
-
表 1 糖尿病者和非糖尿病者基线资料[M(Q1, Q3)][n(%)]
变量 非糖尿病(n=453 023) 糖尿病(n=39 614) χ2/Z P 性别 女 252 162(55.7) 16 224(41.0) 3 177.177 < 0.001 男 200 861(44.3) 23 390(59.0) 入组年龄/岁 58(50,63) 62(56,66) -79.571 < 0.001 剥夺指数 -2(-4, 0) -1(-3, 2) -55.431 < 0.001 种族 白人 411 875(90.9) 34 947(88.2) 739.984 < 0.001 混血 16 356(3.6) 2 026(5.1) 亚洲人 15 864(3.5) 1 232(3.1) 黑人 2 323(0.5) 453(1.1) 其他 6 605(1.5) 956(2.4) 体质量指数 < 25 kg/m2 136 389(30.1) 3 387(8.6) 22 547.197 < 0.001 25~ < 30 kg/m2 204 520(45.1) 12 962(32.7) ≥30 kg/m2 112 114(24.7) 23 265(58.7) 吸烟 200 733(44.3) 21 926(55.3) 1 792.347 < 0.001 饮酒 434 648(95.9) 36 265(91.5) 1 671.573 < 0.001 高血压病 111 694(24.7) 29 668(74.9) 44 933.609 < 0.001 胰腺癌 992(0.2) 231(0.6) 195.070 < 0.001 根据WHO标准,定义BMI < 25 kg/m2为正常或偏瘦, BMI 25~ < 30 kg/m2为偏胖, BMI≥30 kg/m2为肥胖。 表 2 糖尿病对PC发病影响的Logistic回归模型
糖尿病模型 b Wald χ2 P OR(95%CI) 模型Ⅰ 0.983 180.161 < 0.001 2.673(2.315~3.085) 模型Ⅱ 0.695 80.103 < 0.001 2.004(1.721~2.333) 模型Ⅲ 0.692 72.565 < 0.001 1.999(1.704~2.344) 以无糖尿病病史人群为参照。模型Ⅰ: 未调整其他混杂因素; 模型Ⅱ: 调整年龄、性别、种族、BMI、剥夺指数; 模型Ⅲ: 在模型Ⅱ基础上调整吸烟、饮酒、高血压病。 表 3 吸烟人群和非吸烟人群基线资料[M(Q1, Q3)][n(%)]
变量 非吸烟(n=269 978) 吸烟(n=222 659) χ2/Z P 性别 女 160 035(59.3) 108 351(48.7) 5 543.969 < 0.001 男 109 943(40.7) 114 308(51.3) 入组年龄/岁 57(50, 63) 59(52, 64) -66.268 < 0.001 剥夺指数 -2(-4, 0) -2(-3, 1) -70.255 < 0.001 种族 白人 245 341(90.9) 201 481(90.5) 587.854 < 0.001 混血 10 027(3.7) 8 355(3.8) 亚洲人 8 161(3.0) 8 935(4.0) 黑人 1 714(0.6) 1 062(0.5) 其他 4 735(1.8) 2 826(1.3) 体质量指数 <25 kg/m2 83 124(30.8) 56 652(25.4) 2 034.098 < 0.001 25~<30 kg/m2 117 730(43.6) 99 752(44.8) ≥30 kg/m2 69 124(25.6) 66 255(29.8) 饮酒 252 237(93.4) 218 676(98.2) 6 620.863 < 0.001 高血压病 68 091(25.2) 73 271(32.9) 3 523.331 < 0.001 糖尿病 17 688(6.6) 21 926(9.8) 1 792.347 < 0.001 胰腺癌 550(0.2) 673(0.3) 47.842 < 0.001 表 4 吸烟对PC发病影响的Logistic回归模型
吸烟模型 b Wald χ2 P OR(95%CI) 模型ⅰ 0.396 47.228 < 0.001 1.485(1.327~1.662) 模型Ⅱ 0.230 15.297 < 0.001 1.258(1.121~1.412) 模型Ⅲ 0.220 13.701 < 0.001 1.246(1.109~1.400) 以非吸烟人群为参照。模型Ⅰ: 未校正其他混杂因素; 模型Ⅱ: 调整年龄、性别、种族、BMI、剥夺指数; 模型Ⅲ: 在模型Ⅱ基础上调整饮酒、高血压、糖尿病。 表 5 糖尿病、吸烟相互作用对PC影响的Logistic回归模型
糖尿病 吸烟 PC人数 b Wald χ2 P OR(95%CI) - - 461 — 214.074 — 1 - + 531 0.371 33.851 < 0.001 1.449(1.279~1.642) + - 89 1.016 76.679 < 0.001 2.763(2.201~3.468) + + 142 1.270 174.155 < 0.001 3.561(2.949~4.300) -
[1] MIZRAHI J D, SURANA R, VALLE J W, et al. Pancreatic cancer[J]. Lancet, 2020, 395(10242): 2008-2020. doi: 10.1016/S0140-6736(20)30974-0
[2] HU J X, ZHAO C F, CHEN W B, et al. Pancreatic cancer: a review of epidemiology, trend, and risk factors[J]. World J Gastroenterol, 2021, 27(27): 4298-4321. doi: 10.3748/wjg.v27.i27.4298
[3] 朱鑫哲, 李浩, 徐华祥, 等. 2021年胰腺癌研究及诊疗新进展[J]. 中国癌症杂志, 2022, 32(1): 1-12. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGAZ202201001.htm [4] YUAN C, BABIC A, KHALAF N, et al. Diabetes, weight change, and pancreatic cancer risk[J]. JAMA Oncol, 2020, 6(10): e202948. doi: 10.1001/jamaoncol.2020.2948
[5] SHARMA A, KANDLAKUNTA H, NAGPAL S J S, et al. Model to determine risk of pancreatic cancer in patients with new-onset diabetes[J]. Gastroenterology, 2018, 155(3): 730-739, e3. doi: 10.1053/j.gastro.2018.05.023
[6] PANG Y J, HOLMES M V, GUO Y, et al. Smoking, alcohol, and diet in relation to risk of pancreatic cancer in China: a prospective study of 0. 5 million people[J]. Cancer Med, 2018, 7(1): 229-239. doi: 10.1002/cam4.1261
[7] MOCCI E, KUNDU P, WHEELER W, et al. Smoking modifies pancreatic cancer risk loci on 2q21. 3[J]. Cancer Res, 2021, 81(11): 3134-3143. doi: 10.1158/0008-5472.CAN-20-3267
[8] COLLINS R. What makes UK biobank special?[J]. Lancet, 2012, 379(9822): 1173-1174. doi: 10.1016/S0140-6736(12)60404-8
[9] HAN X K, STEVEN K, QASSIM A, et al. Automated AI labeling of optic nerve head enables insights into cross-ancestry glaucoma risk and genetic discovery in >280, 000 images from UKB and CLSA[J]. Am J Hum Genet, 2021, 108(7): 1204-1216. doi: 10.1016/j.ajhg.2021.05.005
[10] OGURTSOVA K, DA ROCHA FERNANDES J D, HUANG Y, et al. IDF Diabetes Atlas: global estimates for the prevalence of diabetes for 2015 and 2040[J]. Diabetes Res Clin Pract, 2017, 128: 40-50. doi: 10.1016/j.diabres.2017.03.024
[11] ROY A, SAHOO J, KAMALANATHAN S, et al. Diabetes and pancreatic cancer: exploring the two-way traffic[J]. World J Gastroenterol, 2021, 27(30): 4939-4962. doi: 10.3748/wjg.v27.i30.4939
[12] KHADKA R, TIAN W J, HAO X, et al. Risk factor, early diagnosis and overall survival on outcome of association between pancreatic cancer and diabetes mellitus: changes and advances, a review[J]. Int J Surg, 2018, 52: 342-346. doi: 10.1016/j.ijsu.2018.02.058
[13] QUOC LAM B, SHRIVASTAVA S K, SHRIVASTAVA A, et al. The Impact of obesity and diabetes mellitus on pancreatic cancer: molecular mechanisms and clinical perspectives[J]. J Cell Mol Med, 2020, 24(14): 7706-7716. doi: 10.1111/jcmm.15413
[14] ROSATO V, POLESEL J, BOSETTI C, et al. Population attributable risk for pancreatic cancer in Northern Italy[J]. Pancreas, 2015, 44(2): 216-220. doi: 10.1097/MPA.0000000000000251
[15] SHARMA A, CHARI S T. Pancreatic cancer and diabetes mellitus[J]. Curr Treat Options Gastroenterol, 2018, 16(4): 466-478. doi: 10.1007/s11938-018-0197-8
[16] SETIAWAN V W, STRAM D O, PORCEL J, et al. Pancreatic cancer following incident diabetes in African Americans and latinos: the multiethnic cohort[J]. J Natl Cancer Inst, 2019, 111(1): 27-33. doi: 10.1093/jnci/djy090
[17] 谭志强, 何立, 江妍霞. 二甲双胍抗糖尿病患者消化系统肿瘤分子机制的研究进展[J]. 中国全科医学, 2021, 24(21): 2744-2748. doi: 10.12114/j.issn.1007-9572.2021.00.513 [18] MA M L, LI W, XU LL, et al. Diabetes duration and weight loss are associated with onset age and remote metastasis of pancreatic cancer in patients with diabetes mellitus[J]. J Diabetes, 2022, 14(4): 261-270. doi: 10.1111/1753-0407.13259
[19] JEON C Y, KIM S, LIN Y C, et al. Prediction of pancreatic cancer in diabetes patients with worsening glycemic control[J]. Cancer Epidemiol Biomarkers Prev, 2022, 31(1): 242-253. doi: 10.1158/1055-9965.EPI-21-0712
[20] SUBHAN M, SAJI PAREL N, KRISHNA P V, et al. Smoking and pancreatic cancer: smoking patterns, tobacco type, and dose-response relationship[J]. Cureus, 2022, 14(6): e26009.
[21] CALIRI A W, TOMMASI S, BESARATINIA A. Relationships among smoking, oxidative stress, inflammation, macromolecular damage, and cancer[J]. Mutat Res Rev Mutat Res, 2021, 787: 108365. doi: 10.1016/j.mrrev.2021.108365
[22] LIU J, KANG R, TANG D L. The art of war: ferroptosis and pancreatic cancer[J]. Front Pharmacol, 2021, 12: 773909. doi: 10.3389/fphar.2021.773909
[23] WEISSMAN S, TAKAKURA K, EIBL G, et al. The diverse involvement of cigarette smoking in pancreatic cancer development and prognosis[J]. Pancreas, 2020, 49(5): 612-620. doi: 10.1097/MPA.0000000000001550
[24] EDDERKAOUI M, XU S P, CHHEDA C, et al. HDAC3 mediates smoking-induced pancreatic cancer[J]. Oncotarget, 2016, 7(7): 7747-7760. doi: 10.18632/oncotarget.6820
[25] YUAN C, MORALES-OYARVIDE V, KHALAF N, et al. Prediagnosticinflammation and pancreatic cancer survival[J]. J Natl Cancer Inst, 2021, 113(9): 1186-1193.
[26] LA TORRE G, SFERRAZZA A, GUALANO M R, et al. Investigating the synergistic interaction of diabetes, tobacco smoking, alcohol consumption, and hypercholesterolemia on the risk of pancreatic cancer: a case-control study in Italy[J]. Biomed Res Int, 2014, 2014: 481019.
-
期刊类型引用(2)
1. 胡晓丹,曹鑫彦,聂莹. 胰腺癌患者反刍性沉思在心理弹性与希望水平间的中介效应研究. 临床护理杂志. 2024(01): 36-39 .  百度学术
百度学术
2. 李婷婷,张琳. 乙型肝炎病毒感染患者的临床特征与预后的相关性. 河南大学学报(医学版). 2024(04): 69-73 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号