Effect of hyperdynamic left ventricular ejection fraction on prognosis of early septic shock patients
-
摘要:目的
探讨高动力左室射血分数(HDLVEF)对早期感染性休克患者预后的影响。
方法选取苏北人民医院收治的96例感染性休克患者为研究对象。根据28 d内是否发生死亡将患者分为死亡组(n=40)和生存组(n=56)。采用独立样本t检验或卡方检验分析2组各项临床资料是否存在差异。采用二元Logistic回归模型评估感染性休克患者发生死亡的影响因素。采用Pearson和Spearman相关性分析探讨HDLVEF与急性生理学和慢性健康状况评价Ⅱ(APACHE Ⅱ)评分、序贯器官衰竭估计(SOFA)评分的相关性。釆用受试者工作特征(ROC)曲线评价各指标对感染性休克患者发生死亡的预测价值。采用Kaplan-Meier曲线对感染性休克患者进行预后生存分析。
结果死亡组患者中心静脉动脉二氧化碳分压差[pcv-a(CO2)]、APACHE Ⅱ评分、SOFA评分及HDLVEF高于存活组,差异有统计学意义(P < 0.05)。二元Logistic回归分析显示,HDLVEF、pcv-a(CO2)和SOFA评分是感染性休克患者发生死亡的影响因素(P < 0.05)。Pearson及Spearman相关性分析显示,HDLVEF与SOFA评分、APACHE Ⅱ评分均呈正相关(P < 0.01)。ROC曲线显示,HDLVEF预测的曲线下面积(AUC)高于pcv-a(CO2)、SOFA评分。HDLVEF、SOFA评分联合pcv-a(CO2)诊断的AUC高于单一指标[HDLVEF、SOFA评分或pcv-a(CO2)],且敏感度和特异度分别为87.50%和83.93%。Kaplan-Meier曲线显示,HDLVEF高水平感染性休克患者的28 d生存率低于HDLVEF低水平患者(P < 0.05)。
结论HDLVEF水平是影响感染性休克患者发生死亡的重要因素,且其水平能够侧面反映患者病情,预测患者死亡情况,有望成为有效的临床指标。
-
关键词:
- 感染性休克 /
- 高动力左室射血分数 /
- 动脉血二氧化碳分压差 /
- 序贯器官衰竭估计评分 /
- 相关性 /
- 预后
Abstract:ObjectiveTo investigate the effect of hyperdynamic left ventricular ejection fraction (HDLVEF) on prognosis of patients with early septic shock.
MethodsA total of 96 patients with septic shock admitted to Northern Jiangsu People's Hospital were selected as study objects. Patients were divided into death group (n=40) and survival group (n=56) according to whether patients died within 28 days or not. Independent sample t test or Chi-square test were used to analyze whether there were significant differences in clinical data between the two groups. Influencing factors for occurrence of death in patients with septic shock were assessed by binary Logistic regression model. The correlations of HDLVEF with acute physiology and chronic health evaluation Ⅱ (APACHE Ⅱ) and sequential organ failure estimation (SOFA) score were evaluated by Pearson and Spearman correlation analysis. Receiver operating characteristic (ROC) curve was used to evaluate the predictive value of indicators for death in patients with septic shock. Kaplan-Meier curve was used to analyze the prognostic survival of patients with septic shock.
ResultsThe differential pressure of central venous arterial carbon dioxide[pcv-a(CO2)], APACHE Ⅱ score, SOFA score and HDLVEF in the death group were higher than those in the survival group (P < 0.05). Binary Logistic regression analysis showed that HDLVEF, pcv-a(CO2) and SOFA score were infuencing factors for death in septic shock patients (P < 0.05). Pearson and Spearman correlation analysis showed that HDLVEF was positively correlated with SOFA score and APACHE Ⅱ score (P < 0.05). ROC curve showed that the area under the curve (AUC) of HDLVEF was higher than that of pcv-a(CO2) or SOFA. AUC of HDLVEF combined with SOFA score and pcv-a(CO2) was significantly higher than those of single index[HDLVEF, SOFA score or pcv-a(CO2)], and the sensitivity and specificity were 87.50% and 83.93%, respectively. Kaplan-Meier curve showed that the 28-day survival rate in patients with septic shock was lower in high HDLVEF level patients than those with low HDLVEF level(P < 0.05).
ConclusionThe level of HDLVEF is an important factor affecting the death of patients with septic shock, and it can reflect the patient's condition and predict the death of patients, which is expected to become an effective clinical indicator.
-
感染性休克是一种由病原菌所致机体免疫系统异常紊乱引起的急性血液循环衰竭,其致死率较高,也是导致重症监护室(ICU)患者死亡的主要病因[1-3]。目前,临床评估休克复苏的常用指标有血乳酸(Lac)、序贯器官衰竭估计(SOFA)评分、中心静脉动脉二氧化碳分压差[pcv-a(CO2)]、急性生理学与慢性健康状况评价Ⅱ(APACHE Ⅱ)评分等[4-7]。随着床边超声的发展,经胸超声心动图(TTE)能实时动态地观察心脏结构及功能,及时判定休克类型对临床具有重要价值[8]。MICEK S T等[9]发现,左心室功能障碍在脓毒症休克患者中很常见,而左心室射血分数(LVEF)是评估左心室收缩功能最常用的指标,因此LVEF水平的高低对评估感染性休克病情具有重要意义。为了更好地区分LVEF水平,美国心脏病学会已将LVEF>70%定义为高动力左室射血分数(HDLVEF)[10]。本研究探讨感性休克患者死亡的影响因素,并对其预后短期生存情况进行评估,现报告如下。
1. 资料与方法
1.1 一般资料
选取2021年4月—2022年4月在苏北人民医院ICU收治的感染性休克患者96例为研究对象,根据28 d预后情况将其分为生存组(n=56) 和死亡组(n=40)。其中生存组男30例,女26例,年龄(57.8±17.5)岁; 死亡组男27例,女13例,年龄(61.5±19.2)岁。本研究经医院伦理委员会批准,且研究对象或其家属均签署知情同意书。入选标准: ①感染性休克患者均符合《中国急诊感染性休克临床实践指南》[11]中的诊断标准; ②临床资料完整(姓名、年龄、性别、住院号和预后等)者; ③发病时间 < 24 h者; ④入院时所测LVEF >70%者。排除标准: ①心源性休克、失血性休克等其他休克类型者; ②入院24 h内死亡者; ③转院或主动放弃治疗者; ④合并其他危急重症(如脑干出血、实质脏器破裂、急性心肌梗死及急性脑梗死等)者; ⑤合并恶性肿瘤等; ⑥妊娠期或哺乳期女性患者; ⑦伴有精神障碍者; ⑧伴有严重心脏疾病(心脏瓣膜功能障碍、大量心包积液、心肌梗死及心房颤动等)者。
1.2 方法
1.2.1 超声心动图检测
使用飞利浦超声诊断仪(EPIQ-7C)及X5-1相控阵探头(探头频率2.8 MHz)进行超声心动图检测。由1位经验丰富的主治医师进行经胸超声心动图测量(TTE), 受检者取左侧卧位,选取心尖四腔切面及心尖两腔切面[11], 采用双平面Simpson法测定左室射血分数(LVEF)和左室舒张末期容积(LVEDV), 测量3次,取平均值。
1.2.2 血气分析指标及实验室检查
观察平均动脉压(MAP)、中心静脉压(CVP)、乳酸(Lac)实验室指标,并进行血气分析,检测pcv-a(CO2)水平。
1.2.3 APACHE Ⅱ评分[12]及SOFA评分[13]
APACHCE Ⅱ评分系统共分为3个部分。①急性生理学变量评分; ②年龄评分; ③慢性健康状况评分。APACHCE Ⅱ评分系统总分71分,分值越高表示病情越严重。SOFA评分系统包括6项系统功能评分,即心血管系统、呼吸系统、神经系统、肾脏系统及血液系统,共计24分,分值越高表示病情越严重。
1.3 随访
随访时间从入院开始至第28天或患者死亡(全因感染性休克死亡)。随访结束时,将存活患者纳入存活组,死亡患者纳入死亡组。
1.4 统计学处理
采用SPSS 22.0软件录入数据并进行统计学分析。计数资料以[n(%)]表示,釆用χ2检验。计量资料以(x±s)表示,采用独立样本t检验。通过Logistic回归模型、Pearson和Spearman方法进行相关性分析; 釆用Kaplan-Meier曲线及受试者工作特征(ROC)曲线对预后生存、死亡的预测进行分析。P < 0.05为差异有统计学意义。
2. 结果
2.1 2组临床资料比较
死亡组pcv-a(CO2)、APACHE Ⅱ评分、SOFA评分及HDLVEF高于存活组,差异有统计学意义(P < 0.05)。2组年龄、性别、体温、心率、MAP、CVP、中心静脉的血氧饱和度(ScvO2)、LVEDV以及Lac水平比较,差异均无统计学意义(P>0.05)。见表 1。
表 1 2组临床资料比较(x±s)[n(%)]指标 死亡组(n=40) 生存组(n=56) t/χ2 P 年龄/岁 61.50±19.20 57.80±17.50 0.99 0.32 男 27(67.50) 30(53.57) 1.88 0.17 APACHE Ⅱ评分/分 32.87±9.29 25.15±6.88 4.45 < 0.01 SOFA评分/分 10.28±2.64 7.04±1.59 6.92 < 0.01 LVEDV/mL 94.61±9.02 97.61±9.89 1.52 0.13 体温/℃ 38.02±2.36 37.96±2.83 0.11 0.91 ScvO2/% 62.07±17.63 67.16±14.04 1.57 0.12 MAP/mmHg 57.05±16.64 62.80±11.54 1.88 0.06 CVP/mmHg 6.55±1.06 6.73±1.37 0.69 0.49 HDLVEF/% 79.95±4.27 73.30±3.09 8.40 < 0.01 pcv-a(CO2)/mmHg 8.77±1.32 7.03±1.28 6.48 < 0.01 心率/(次/min) 121.27±12.99 119.18±12.43 0.80 0.43 Lac/(mmol/L) 11.02±2.36 10.94±2.77 0.15 0.88 APACHE Ⅱ: 急性生理学和慢性健康状况评价Ⅱ; SOFA: 序贯器官衰竭估计; LVEDV: 左室舒张末期容积;
ScvO2: 中心静脉的血氧饱和度; MAP: 平均动脉压; CVP: 中心静脉压; HDLVEF: 高动力左室射血分数;
pcv-a(CO2): 中心静脉动脉二氧化碳分压差; Lac: 乳酸。2.2 感染性休克患者死亡影响因素的二元Logistic回归模型分析
以感染性休克患者是否发生死亡为因变量(否=0, 是=1), 以APACHE Ⅱ评分、SOFA评分、HDLVEF及pcv-a(CO2)为自变量。二元Logistic回归分析显示, HDLVEF、pcv-a(CO2)和SOFA评分是感染性休克患者死亡的影响因素(P < 0.05), 见表 2。
表 2 二元Logistic回归模型分析感染性休克患者死亡的影响因素因素 B SE Wald χ2 P OR(95%CI) pcv-a(CO2) 0.67 0.27 6.05 0.01 1.95(1.15~3.33) SOFA评分 0.62 0.22 8.22 < 0.01 1.87(1.22~2.86) HDLVEF 0.72 0.31 5.59 0.02 2.06(1.13~3.74) APACHE Ⅱ评分 0.62 0.41 2.31 0.13 1.85(0.84~4.12) 2.3 感染性休克患者HDLVEF与APACHE Ⅱ评分、SOFA评分的相关性分析
Pearson相关性分析显示, HDLVEF与APACHE Ⅱ评分(r=0.63, P < 0.01)、SOFA评分(r=0.62, P < 0.01) 呈正相关。Spearman相关性分析显示, HDLVEF与APACHE Ⅱ评分(r=0.66, P < 0.01)、SOFA评分(r=0.65, P < 0.01)呈正相关。
2.4 HDLVEF、pcv-a(CO2)及SOFA评分对感染性休克患者28 d死亡的预测价值
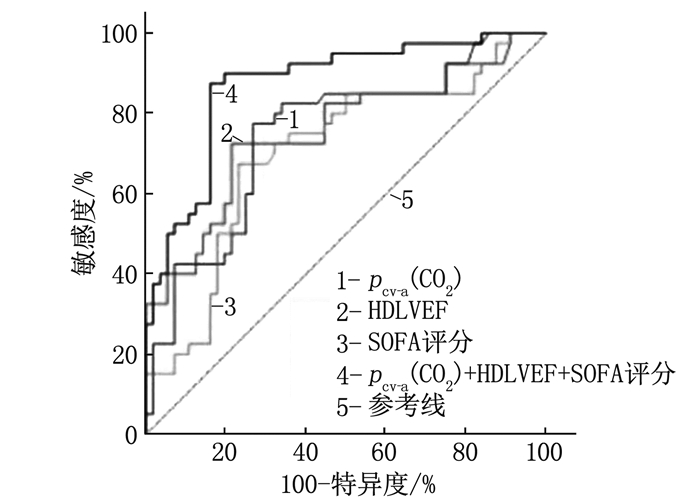
以感染性休克患者28 d内是否发生死亡为前提绘制ROC曲线。结果显示, HDLVEF、SOFA评分及pcv-a(CO2)联合预测的AUC高于单一指标[HDLVEF、SOFA评分或pcv-a(CO2)]的AUC(P < 0.05), 见表 3和图 1。
表 3 不同指标对感染性休克患者28 d死亡的预测价值指标 AUC(95%CI) 最佳截断值 约登指数 灵敏度/% 特异度/% HDLVEF 0.754(0.651~0.858) 76.87 0.51 72.50 78.57 pcv-a(CO2) 0.750(0.648~0.851) 7.98 0.51 77.50 73.21 SOFA评分 0.706(0.597~0.815) 9.29 0.44 67.50 76.79 HDLVEF、pcv-a(CO2)联合SOFA评分 0.874(0.801~0.946) — 0.71 87.50 83.93 2.5 感染性休克患者HDLVEF水平与预后的关系
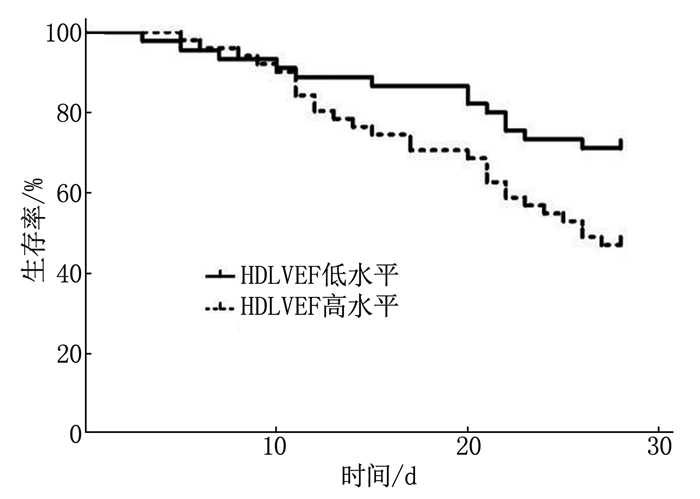
以感染性休克患者HDLVEF水平的中位数76.28为临界值,将患者分为HDLVEF高水平51例和HDLVEF低水平45例, HDLVEF高水平患者的28 d生存率为47.06%(24/51), HDLVEF低水平患者的28 d生存率为71.11%(32/45)。HDLVEF高水平患者的28 d生存率较HDLVEF低水平患者低,差异有统计学意义(χ2=5.232, P=0.022), 见图 2。
3. 讨论
感染性休克又称脓毒性休克,是一种以微循环障碍为主要特点的临床危重症疾病[1-3]。控制感染、液体复苏及器官支持是治疗感染性休克的主要原则。然而,即使血流动力学指标恢复正常,但对微循环障碍情况改善较小,使得感染性休克患者病死率较高。临床上, CVP和心室舒张末容积是常用的反映心脏前负荷的参数,全身血管阻力(SVR)为监测左心室后负荷的指标,每搏输出量(SV)、射血分数等指标反映了心肌收缩力的变化[8]。当LVEF将左心室收缩力与前负荷和后负荷结合在一起时,这些生理变量中的任何一个变量都可能导致HDLVEF。由于HDLVEF患者的SVR更低,并且SVR与HDLVEF的存在呈负相关,从而提示脓毒症未减轻的血管麻痹可能导致病情加重,导致预后不良。血管麻痹可引起代偿性超常的心排出量(CO), 导致HDLVEF。对于既定的血管收缩药物剂量四分位数, LVEF正常患者的病死率低于HDLVEF患者,因此采用血管收缩药物治疗可终止血管麻痹[14]。本研究结果显示,死亡组和存活组年龄、性别、体温、心率、MAP、CVP、ScvO2、LVEDV以及Lac水平差异均无统计学意义,说明常规指标对监测感染性休克早期患者的价值有限,对预后生存情况无法做出准确评估。本研究结果提示, APACHE Ⅱ评分、SOFA评分、HDLVEF及pcv-a(CO2)的水平是评估感染性休克患者是否能够存活的重要依据,与MALLAT J等[15-16]研究结论一致。文献[17-19]报道, ICU患者中HDLVEF的发生率为18.6%。研究[14, 20-21]发现, HDLVEF更常见于脓毒症患者,原因是通常脓毒症患者外周血管阻力较低,循环中释放过多的儿茶酚胺,导致心脏收缩力增加,提示在大量重症脓毒症患者中, HDLVEF与病死率相关。
二元Logistic回归分析显示, HDLVEF、pcv-a(CO2)和SOFA评分是感染性休克患者发生死亡的影响因素,其升高时可能增高患者死亡的发生风险。因此,在抢救感染性休克患者时,除了关注基本生命体征外, HDLVEF、pcv-a(CO2)和SOFA评分的变化也应被重视。为了进一步验证HDLVEF与pcv-a(CO2)、SOFA评分是否具有相关性,本研究进行了Pearson及Spearman相关性分析。结果显示, HDLVEF与SOFA评分、APACHE Ⅱ评分均呈正相关,提示HDLVEF水平的变化有助于评估休克患者的病情严重程度和机体组织灌注情况,并对预后情况具有一定指示作用。ROC曲线显示, HDLVEF、pcv-a(CO2)和SOFA评分的AUC分别为0.754、0.750及0.706, 说明联合应用对感染性休克患者发生死亡的预测效果较好。当HDLVEF≥76.87%、pcv-a(CO2)≥7.98 mmHg及SOFA评分≥9.29分时,提示临床应密切关注感染性休克患者的状态,及时采取有效手段降低患者的死亡风险。对HDLVEF、pcv-a(CO2)和SOFA评分联合应用时发现, 3者联合预测的AUC高于单一指标,且敏感度和特异度较单一指标高,提示联合评估能够有效提升感染性休克患者28 d发生死亡的预测概率,保证预测的准确度,同时,较高的敏感度也能够筛查感染性休克早期可能出现死亡的患者,为临床后续治疗提供有力支持。Kaplan-Meier生存曲线显示, HDLVEF水平升高时,感染性休克患者的病死率增高,说明HDLVEF水平可能影响感染性休克患者的预后存活时间,提示阻碍HDLVEF的发生可能是未来临床治疗感染性休克的重要方向。本研究同时也存在着一定的局限性。①本研究为单中心研究,且病例数有限,后续会逐步开展多中心、大样本研究。②受实验设备的限制,未能探索HDLVEF水平升高造成感染性休克患者病死率增高的具体机制,后续会通过基础实验深入分析。
综上所述, HDLVEF水平、pcv-a(CO2)和SOFA评分是影响感染性休克患者发生死亡的影响因素。HDLVEF、pcv-a(CO2)和SOFA评分联合评估对预测感染性休克患者28 d死亡情况具有较高价值。同时, HDLVEF水平能够侧面反映患者病情,评估患者预后生存时间,有望成为临床筛查的有效指标。
-
表 1 2组临床资料比较(x±s)[n(%)]
指标 死亡组(n=40) 生存组(n=56) t/χ2 P 年龄/岁 61.50±19.20 57.80±17.50 0.99 0.32 男 27(67.50) 30(53.57) 1.88 0.17 APACHE Ⅱ评分/分 32.87±9.29 25.15±6.88 4.45 < 0.01 SOFA评分/分 10.28±2.64 7.04±1.59 6.92 < 0.01 LVEDV/mL 94.61±9.02 97.61±9.89 1.52 0.13 体温/℃ 38.02±2.36 37.96±2.83 0.11 0.91 ScvO2/% 62.07±17.63 67.16±14.04 1.57 0.12 MAP/mmHg 57.05±16.64 62.80±11.54 1.88 0.06 CVP/mmHg 6.55±1.06 6.73±1.37 0.69 0.49 HDLVEF/% 79.95±4.27 73.30±3.09 8.40 < 0.01 pcv-a(CO2)/mmHg 8.77±1.32 7.03±1.28 6.48 < 0.01 心率/(次/min) 121.27±12.99 119.18±12.43 0.80 0.43 Lac/(mmol/L) 11.02±2.36 10.94±2.77 0.15 0.88 APACHE Ⅱ: 急性生理学和慢性健康状况评价Ⅱ; SOFA: 序贯器官衰竭估计; LVEDV: 左室舒张末期容积;
ScvO2: 中心静脉的血氧饱和度; MAP: 平均动脉压; CVP: 中心静脉压; HDLVEF: 高动力左室射血分数;
pcv-a(CO2): 中心静脉动脉二氧化碳分压差; Lac: 乳酸。表 2 二元Logistic回归模型分析感染性休克患者死亡的影响因素
因素 B SE Wald χ2 P OR(95%CI) pcv-a(CO2) 0.67 0.27 6.05 0.01 1.95(1.15~3.33) SOFA评分 0.62 0.22 8.22 < 0.01 1.87(1.22~2.86) HDLVEF 0.72 0.31 5.59 0.02 2.06(1.13~3.74) APACHE Ⅱ评分 0.62 0.41 2.31 0.13 1.85(0.84~4.12) 表 3 不同指标对感染性休克患者28 d死亡的预测价值
指标 AUC(95%CI) 最佳截断值 约登指数 灵敏度/% 特异度/% HDLVEF 0.754(0.651~0.858) 76.87 0.51 72.50 78.57 pcv-a(CO2) 0.750(0.648~0.851) 7.98 0.51 77.50 73.21 SOFA评分 0.706(0.597~0.815) 9.29 0.44 67.50 76.79 HDLVEF、pcv-a(CO2)联合SOFA评分 0.874(0.801~0.946) — 0.71 87.50 83.93 -
[1] VINDHYAL M R, LU L K, RANKA S, et al. Impact of underlying congestive heart failure on in-hospital outcomes in patients with septic shock[J]. J Intensive Care Med, 2022, 37(7): 965-969. doi: 10.1177/08850666211061472
[2] SIVAPALAN P, MEYHOFF T S, HJORTRUP P B, et al. Conservative vs. liberal fluid therapy in septic shock-Protocol for secondary Bayesian analyses of the CLASSIC trial[J]. Acta Anaesthesiol Scand, 2022, 66(6): 767-771. doi: 10.1111/aas.14058
[3] GROUP S C C T. Incidence of severe Sepsis and septic shock in German intensive care units: the prospective, multicentre INSEP study[J]. Intensive Care Med, 2016, 42(12): 1980-1989. doi: 10.1007/s00134-016-4504-3
[4] DUBRAWKA C A, BETTHAUSER K D, POPE H E, et al. Effect of vasopressin dose on hemodynamic response in obese patients with septic shock: a retrospective observational study[J]. Ann Pharmacother, 2021, 55(12): 1447-1454. doi: 10.1177/10600280211007213
[5] SAKAMOTO Y, MASHIKO K, MATSUMOTO H, et al. Selection of acute blood purification therapy according to severity score and blood lactic acid value in patients with septic shock[J]. Indian J Crit Care Med, 2010, 14(4): 175-179. doi: 10.4103/0972-5229.76080
[6] DE LA TORRE-PRADOS M V, GARCIA-DE LA TORRE A, ENGUIX A, et al. Mid-regional pro-adrenomedullin as prognostic biomarker in septic shock[J]. Minerva Anestesiol, 2016, 82(7): 760-766.
[7] RHODES A, EVANS L E, ALHAZZANI W, et al. Surviving Sepsis campaign: international guidelines for management of Sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377. doi: 10.1007/s00134-017-4683-6
[8] SCHNITTKE N, SCHMIDT J, BARVALIA U, et al. Assessment of dynamic changes in cardiac function during resuscitation of patients with suspected septic shock: a prospective, observational, cohort study[J]. Am J Emerg Med, 2020, 38(12): 2653-2657. doi: 10.1016/j.ajem.2020.08.058
[9] MICEK S T, MCEVOY C, MCKENZIE M, et al. Fluid balance and cardiac function in septic shock as predictors of hospital mortality[J]. Crit Care, 2013, 17(5): R246. doi: 10.1186/cc13072
[10] 中华医学会重症医学分会. 成人严重感染与感染性休克血流动力学监测与支持指南[J]. 中华内科杂志, 2007, 46(4): 344-349. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGWK200701001.htm [11] 中国医师协会急诊医师分会. 中国急诊感染性休克临床实践指南[J]. 中华急诊医学杂志, 2016, 25(3): 274-287. [12] OH TE, HUTCHINSONR, SHORT S, et al. Verification of the Acute Physiology and Chronic Health Evaluation scoring system in a Hong Kong intensive care unit[J]. Crit Care Med, 1993, 21(5): 698-705. doi: 10.1097/00003246-199305000-00013
[13] YAGHOUBIAN A, BATTER, MOZAFARPOUR S, et al. Use of the Quick Sequential Organ Failure Assessment Score for Prediction of Intensive Care Unit Admission Due to Septic Shock after Percutaneous Nephrolithotomy: A Multicenter Study[J]. J Urol, 2019, 202(2): 314-318. doi: 10.1097/JU.0000000000000195
[14] CHOTALIA M, ALI M, HEBBALLI R, et al. Hyperdynamic left ventricular ejection fraction in ICU patients with Sepsis[J]. Crit Care Med, 2022, 50(5): 770-779. doi: 10.1097/CCM.0000000000005315
[15] MALLAT J, PEPY F, LEMYZE M, et al. Central venous-to-arterial carbon dioxide partial pressure difference in early resuscitation from septic shock: a prospective observational study[J]. Eur J Anaesthesiol, 2014, 31(7): 371-380. doi: 10.1097/EJA.0000000000000064
[16] VINCENT J L, LATERRE P F, COHEN J, et al. A pilot-controlled study of a polymyxin B-immobilized hemoperfusion cartridge in patients with severe Sepsis secondary to intra-abdominal infection[J]. Shock, 2005, 23(5): 400-405. doi: 10.1097/01.shk.0000159930.87737.8a
[17] PAONESSA J R, BRENNAN T, PIMENTEL M, et al. Hyperdynamic left ventricular ejection fraction in the intensive care unit[J]. Crit Care, 2015, 19(1): 288. doi: 10.1186/s13054-015-1012-8
[18] 王雪婷, 高雪花, 曹雯, 等. 血乳酸联合中心静脉-动脉血二氧化碳分压差与动脉-中心静脉血氧含量差比值预测脓毒性休克患者预后的应用价值[J]. 中华危重病急救医学, 2020, 32(1): 39-43. [19] 刘冬辉, 刘超, 文海燕, 等. 中心静脉压联合下腔静脉呼吸变异度在脓毒性休克患者液体复苏中的预测价值[J]. 川北医学院学报, 2021, 36(11): 1441-1444. https://www.cnki.com.cn/Article/CJFDTOTAL-NOTH202111009.htm [20] 王喆, 李华, 张劲松. 红细胞分布宽度对肺炎并感染性休克病人预后的预测价值[J]. 蚌埠医学院学报, 2018, 43(11): 1437-1439. https://www.cnki.com.cn/Article/CJFDTOTAL-BANG201811045.htm [21] 张娟. 脉搏指示连续心排血量监测下液体复苏治疗感染性休克效果观察[J]. 交通医学, 2021, 35(6): 574-576. https://www.cnki.com.cn/Article/CJFDTOTAL-JTYX202106008.htm -
期刊类型引用(2)
1. 王春玲,张卓,赵景,周庆明,王莉莎. 感染性休克患者血管加压素水平变化与病情程度及预后的关系. 国际检验医学杂志. 2024(16): 1952-1956+1961 .  百度学术
百度学术
2. 周天天,孙尊鹏. 重症超声联合PICCO技术对采用液体复苏感染性休克患者的治疗效果及安全性影响. 世界复合医学. 2023(10): 174-177 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号