Mediating role of ruminant thinking in perceived social support, anxiety and depression in patients with pulmonary nodules
-
摘要:目的
探讨肺结节患者领悟社会支持、反刍思维与焦虑、抑郁的关系。
方法依据便利抽样法选取扬州市的苏北人民医院和扬州大学附属医院共323例肺结节患者为研究对象,采用焦虑自评量表、抑郁自评量表、领悟社会支持量表、反刍思维量表进行问卷调查。
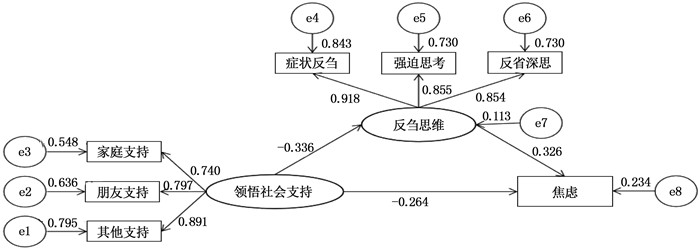
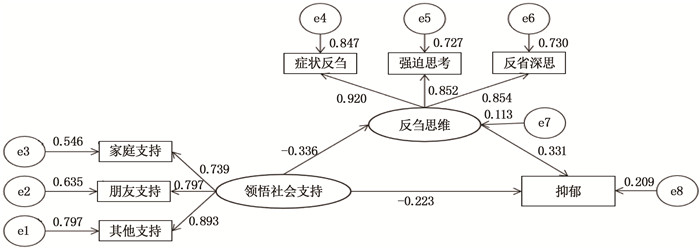
结果肺结节患者领悟社会支持与反刍思维(r=-0.321,P < 0.01)、焦虑(r=-0.370,P < 0.01)、抑郁(r=-0.336,P < 0.01)均呈负相关,反刍思维与焦虑(r=0.401,P < 0.01)、抑郁(r=0.392,P < 0.01)呈正相关。反刍思维在领悟社会支持与焦虑、领悟社会支持与抑郁中有部分中介效应,分别占总效应的29.32%、33.23%。
结论反刍思维能够调节领悟社会支持对肺结节患者焦虑、抑郁情绪的影响。医务人员应当提高肺结节患者领悟社会支持水平并减少反刍思维的发生,以降低患者焦虑、抑郁程度。
Abstract:ObjectiveTo explore the relationships of perceived social support and ruminant thinking with anxiety and depression in patients with pulmonary nodules.
MethodsA total of 323 patients with pulmonary nodules in Subei People's Hospital and Affiliated Hospital of Yangzhou University in Yangzhou City were selected as research objects by convenient sampling method, and they were investigated by the Self-rating Anxiety Scale, the Self-rating Depression Scale, the Perceived Social Support Scale and the Ruminant Thinking Scale.
ResultsIn patients with pulmonary nodules, the perceived social support was negatively correlated with ruminant thinking (r=-0.321, P < 0.01), anxiety (r=-0.370, P < 0.01) and depression (r=-0.336, P < 0.01), while the ruminant thinking was positively correlated with anxiety (r=0.401, P < 0.01) and depression (r=0.392, P < 0.01). Ruminant thinking had a partial mediating effect in perceived social support with anxiety and depression, accounting for 29.32% and 33.23% respectively of the total effect.
ConclusionRuminant thinking can regulate the impacts of perceived social support on anxiety and depression in patients with pulmonary nodules. Medical staffs should improve the level of perceived social support and reduce occurrence of ruminant thinking in patients with pulmonary nodules in order to reduce their anxiety and depression degrees.
-
Keywords:
- perceived social support /
- ruminant thinking /
- anxiety /
- depression /
- pulmonary nodules
-
长链非编码RNA(lncRNA)指长度超过200个核苷酸的RNA分子,通常不含开放阅读框,因此较少编码或不编码蛋白质[1]。lncRNA通过其复杂的三维结构与蛋白质等生物大分子相互作用,参与细胞分化和生长的调控[2]。lncRNA在细胞中的分布位置不同,其生物学功能和作用机制亦不同,细胞核内的lncRNA主要调控基因的表观遗传修饰和转录水平,而细胞质中的lncRNA则主要调控翻译水平和转录后基因表达[3]。此外, lncRNA能作为竞争性内源RNA(ceRNA), 通过与多种miRNA结合,调控相关基因的表达及其信号通路[4]。目前, lncRNA已被证实参与多种恶性肿瘤相关的生物学进程。例如,在结直肠癌中, lncRNA TUG1/miR-197/TYMS轴不仅促进肿瘤生长和复发,还增强了肿瘤细胞对5-氟尿嘧啶的耐药性[5]。2011年,研究人员在前列腺癌细胞系及组织中首次鉴定出一种长度约为1 900个核苷酸的lncRNA, 并将其命名为前列腺癌相关转录物1(PCAT1)。后续研究显示, PCAT1的过表达能够促进前列腺癌的进展,提示其可能是一个潜在的致癌因子。本文综述了lncRNA PCAT1在不同类型肿瘤中的促癌作用,旨在为后续研究提供参考。
长链非编码RNA(lncRNA)指长度超过200个核苷酸的RNA分子,通常不含开放阅读框,因此较少编码或不编码蛋白质[1]。lncRNA通过其复杂的三维结构与蛋白质等生物大分子相互作用,参与细胞分化和生长的调控[2]。lncRNA在细胞中的分布位置不同,其生物学功能和作用机制亦不同,细胞核内的lncRNA主要调控基因的表观遗传修饰和转录水平,而细胞质中的lncRNA则主要调控翻译水平和转录后基因表达[3]。此外, lncRNA能作为竞争性内源RNA(ceRNA), 通过与多种miRNA结合,调控相关基因的表达及其信号通路[4]。目前, lncRNA已被证实参与多种恶性肿瘤相关的生物学进程。例如,在结直肠癌中, lncRNA TUG1/miR-197/TYMS轴不仅促进肿瘤生长和复发,还增强了肿瘤细胞对5-氟尿嘧啶的耐药性[5]。2011年,研究人员在前列腺癌细胞系及组织中首次鉴定出一种长度约为1 900个核苷酸的lncRNA, 并将其命名为前列腺癌相关转录物1(PCAT1)。后续研究显示, PCAT1的过表达能够促进前列腺癌的进展,提示其可能是一个潜在的致癌因子。本文综述了lncRNA PCAT1在不同类型肿瘤中的促癌作用,旨在为后续研究提供参考。
长链非编码RNA(lncRNA)指长度超过200个核苷酸的RNA分子,通常不含开放阅读框,因此较少编码或不编码蛋白质[1]。lncRNA通过其复杂的三维结构与蛋白质等生物大分子相互作用,参与细胞分化和生长的调控[2]。lncRNA在细胞中的分布位置不同,其生物学功能和作用机制亦不同,细胞核内的lncRNA主要调控基因的表观遗传修饰和转录水平,而细胞质中的lncRNA则主要调控翻译水平和转录后基因表达[3]。此外, lncRNA能作为竞争性内源RNA(ceRNA), 通过与多种miRNA结合,调控相关基因的表达及其信号通路[4]。目前, lncRNA已被证实参与多种恶性肿瘤相关的生物学进程。例如,在结直肠癌中, lncRNA TUG1/miR-197/TYMS轴不仅促进肿瘤生长和复发,还增强了肿瘤细胞对5-氟尿嘧啶的耐药性[5]。2011年,研究人员在前列腺癌细胞系及组织中首次鉴定出一种长度约为1 900个核苷酸的lncRNA, 并将其命名为前列腺癌相关转录物1(PCAT1)。后续研究显示, PCAT1的过表达能够促进前列腺癌的进展,提示其可能是一个潜在的致癌因子。本文综述了lncRNA PCAT1在不同类型肿瘤中的促癌作用,旨在为后续研究提供参考。
1. PCAT1概述
人类PCAT1基因位于8号染色体的126 552 462至127 419 050区域,总长度为866 589 bp, 邻近c-Myc癌基因上游约725 kb处的染色体8q24.21区域(图 1A)。通过RNAfold WebServer在线软件(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)预测二级结构发现, PCAT1含有多个茎环结构(图 1B), 提示其可能参与基因的转录或转录后调控[6]。利用GeneCards数据库(https://www.genecards.org/)分析显示, PCAT1在多种正常组织中均有表达(图 2)。由于染色体8q24区域频繁发生基因扩增,并且含有与前列腺癌易感性相关的单核苷酸多态性(SNP)位点,该区域受到广泛关注。YANG M L等[7]发现PCAT1 rs2632159位点的SNP可增加结直肠癌的易感性,而ZHANG Y等[8]发现PCAT1 rs1026411位点的SNP是胃癌患者不良预后的独立预测因子。
目前, PCAT1已被发现在多种恶性肿瘤中高表达,并且其表达水平与肿瘤大小和预后等临床病理特征密切相关。机制研究[9]发现,转录因子GATA6可靶向结合PCAT1启动子并诱导其表达,从而调控下游Fyn相关激酶(FRK), 促进非小细胞肺癌的发生和转移。PCAT1可通过与特定蛋白质相互作用,调节许多关键的生物过程。例如, PCAT1可以与急性髓系白血病细胞中的卷曲蛋白6(FZD6)直接结合,提高其稳定性,激活Wnt信号通路,从而促进癌细胞增殖、细胞周期进展并抑制细胞凋亡[10]。DING C等[11]研究发现,干扰PCAT1表达可显著降低卵巢癌细胞中细胞周期蛋白D1(Cyclin D1)和细胞周期依赖性激酶4(CDK4)的表达,抑制细胞周期进程,为提高癌细胞对紫杉醇化疗的敏感性提供了新的思路。PCAT1还可与组蛋白甲基转移酶增强子Zeste同源物2(EZH2)相互作用,调控胃癌细胞中磷酸酶与张力蛋白同源物(PTEN)的表达,诱导胃癌细胞对顺铂的耐药性[12]。此外, PCAT1通过充当某些微小RNA(miRNA)的“海绵分子”调节基因表达。例如, ZANG B等[13]发现, PCAT1通过充当miR-508-3p的“海绵”,抑制其表达,从而上调其靶基因膜联蛋白A10(ANXA10)的表达,促进食管鳞状细胞癌细胞的增殖。在非小细胞肺癌细胞中, PCAT1通过竞争性吸附miR-149-5p上调富含亮氨酸重复序列免疫球蛋白样结构域2(LRIG2)的表达,推动非小细胞肺癌的恶性进展[4]。这些研究表明,PCAT1可通过不同作用方式或机制调控相关基因的表达,从而促进癌细胞的恶性表型。
1. PCAT1概述
人类PCAT1基因位于8号染色体的126 552 462至127 419 050区域,总长度为866 589 bp, 邻近c-Myc癌基因上游约725 kb处的染色体8q24.21区域(图 1A)。通过RNAfold WebServer在线软件(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)预测二级结构发现, PCAT1含有多个茎环结构(图 1B), 提示其可能参与基因的转录或转录后调控[6]。利用GeneCards数据库(https://www.genecards.org/)分析显示, PCAT1在多种正常组织中均有表达(图 2)。由于染色体8q24区域频繁发生基因扩增,并且含有与前列腺癌易感性相关的单核苷酸多态性(SNP)位点,该区域受到广泛关注。YANG M L等[7]发现PCAT1 rs2632159位点的SNP可增加结直肠癌的易感性,而ZHANG Y等[8]发现PCAT1 rs1026411位点的SNP是胃癌患者不良预后的独立预测因子。
目前, PCAT1已被发现在多种恶性肿瘤中高表达,并且其表达水平与肿瘤大小和预后等临床病理特征密切相关。机制研究[9]发现,转录因子GATA6可靶向结合PCAT1启动子并诱导其表达,从而调控下游Fyn相关激酶(FRK), 促进非小细胞肺癌的发生和转移。PCAT1可通过与特定蛋白质相互作用,调节许多关键的生物过程。例如, PCAT1可以与急性髓系白血病细胞中的卷曲蛋白6(FZD6)直接结合,提高其稳定性,激活Wnt信号通路,从而促进癌细胞增殖、细胞周期进展并抑制细胞凋亡[10]。DING C等[11]研究发现,干扰PCAT1表达可显著降低卵巢癌细胞中细胞周期蛋白D1(Cyclin D1)和细胞周期依赖性激酶4(CDK4)的表达,抑制细胞周期进程,为提高癌细胞对紫杉醇化疗的敏感性提供了新的思路。PCAT1还可与组蛋白甲基转移酶增强子Zeste同源物2(EZH2)相互作用,调控胃癌细胞中磷酸酶与张力蛋白同源物(PTEN)的表达,诱导胃癌细胞对顺铂的耐药性[12]。此外, PCAT1通过充当某些微小RNA(miRNA)的“海绵分子”调节基因表达。例如, ZANG B等[13]发现, PCAT1通过充当miR-508-3p的“海绵”,抑制其表达,从而上调其靶基因膜联蛋白A10(ANXA10)的表达,促进食管鳞状细胞癌细胞的增殖。在非小细胞肺癌细胞中, PCAT1通过竞争性吸附miR-149-5p上调富含亮氨酸重复序列免疫球蛋白样结构域2(LRIG2)的表达,推动非小细胞肺癌的恶性进展[4]。这些研究表明,PCAT1可通过不同作用方式或机制调控相关基因的表达,从而促进癌细胞的恶性表型。
1. PCAT1概述
人类PCAT1基因位于8号染色体的126 552 462至127 419 050区域,总长度为866 589 bp, 邻近c-Myc癌基因上游约725 kb处的染色体8q24.21区域(图 1A)。通过RNAfold WebServer在线软件(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)预测二级结构发现, PCAT1含有多个茎环结构(图 1B), 提示其可能参与基因的转录或转录后调控[6]。利用GeneCards数据库(https://www.genecards.org/)分析显示, PCAT1在多种正常组织中均有表达(图 2)。由于染色体8q24区域频繁发生基因扩增,并且含有与前列腺癌易感性相关的单核苷酸多态性(SNP)位点,该区域受到广泛关注。YANG M L等[7]发现PCAT1 rs2632159位点的SNP可增加结直肠癌的易感性,而ZHANG Y等[8]发现PCAT1 rs1026411位点的SNP是胃癌患者不良预后的独立预测因子。
目前, PCAT1已被发现在多种恶性肿瘤中高表达,并且其表达水平与肿瘤大小和预后等临床病理特征密切相关。机制研究[9]发现,转录因子GATA6可靶向结合PCAT1启动子并诱导其表达,从而调控下游Fyn相关激酶(FRK), 促进非小细胞肺癌的发生和转移。PCAT1可通过与特定蛋白质相互作用,调节许多关键的生物过程。例如, PCAT1可以与急性髓系白血病细胞中的卷曲蛋白6(FZD6)直接结合,提高其稳定性,激活Wnt信号通路,从而促进癌细胞增殖、细胞周期进展并抑制细胞凋亡[10]。DING C等[11]研究发现,干扰PCAT1表达可显著降低卵巢癌细胞中细胞周期蛋白D1(Cyclin D1)和细胞周期依赖性激酶4(CDK4)的表达,抑制细胞周期进程,为提高癌细胞对紫杉醇化疗的敏感性提供了新的思路。PCAT1还可与组蛋白甲基转移酶增强子Zeste同源物2(EZH2)相互作用,调控胃癌细胞中磷酸酶与张力蛋白同源物(PTEN)的表达,诱导胃癌细胞对顺铂的耐药性[12]。此外, PCAT1通过充当某些微小RNA(miRNA)的“海绵分子”调节基因表达。例如, ZANG B等[13]发现, PCAT1通过充当miR-508-3p的“海绵”,抑制其表达,从而上调其靶基因膜联蛋白A10(ANXA10)的表达,促进食管鳞状细胞癌细胞的增殖。在非小细胞肺癌细胞中, PCAT1通过竞争性吸附miR-149-5p上调富含亮氨酸重复序列免疫球蛋白样结构域2(LRIG2)的表达,推动非小细胞肺癌的恶性进展[4]。这些研究表明,PCAT1可通过不同作用方式或机制调控相关基因的表达,从而促进癌细胞的恶性表型。
2. PCAT1在消化系统肿瘤中的促癌作用
本课题组前期研究发现,PCAT1在胰腺癌组织中的高表达与患者预后不良紧密相关。PCAT1通过诱导E-钙黏蛋白(E-cadherin)mRNA的m6A修饰并促进其降解,从而下调E-cadherin的表达,推动胰腺癌细胞上皮-间质转化(EMT)进程、迁移和侵袭[2]。SADI KHOSROSHAHI N等[14]评估100份伊朗患者的结直肠肿瘤组织后发现, PCAT1高表达与结直肠肿瘤的发生显著相关,因此, PCAT1可作为结直肠癌的预后生物学标志物。PCAT1可靶向锌指蛋白217(ZNF217), 调节与EMT相关的转移相关蛋白2(MTA2)/转移相关蛋白3(MTA3)/Snail家族锌指蛋白1(Snai1)/E-cadherin信号传导通路,加速结直肠癌的发生和发展[15]。PCAT1还可通过调节Bcl-2相关X蛋白(Bax)与B细胞淋巴瘤2(Bcl-2)的比例,增加结肠癌细胞的活力,诱导细胞增殖,并抑制其对化疗药的敏感性[16]。FANG X等[17]发现,结直肠癌细胞系外泌体中的PCAT1可通过miR-329-3p/神经导向因子1(Netrin-1)轴,推动T84细胞的迁移、EMT及增殖。此外, PCAT1可以通过靶向miR-149-5p调节结直肠癌细胞的增殖、侵袭和凋亡[18]。相关研究[13]表明, PCAT1能促进食管鳞状细胞癌细胞的增殖、迁移和侵袭,从而加快癌症的发生和进展。HUANG L J等[19]通过在实验中敲除PCAT1, 降低了癌细胞中细胞周期蛋白B1(cyclin B1)和细胞分裂周期蛋白2(CDC2)的表达,导致细胞周期停滞在G2/M期,并增强了食管鳞状细胞癌细胞对紫杉醇的敏感性。机制研究[13]显示, miR-326是PCAT1的直接靶标; PCAT1可以降低miR-326表达,从而对丝裂原活化蛋白激酶(AKT)信号通路起到抑制作用,通过miR-508-3p靶向调节ANXA10, 在食管鳞状细胞癌恶性进展中扮演重要角色。PCAT1在胃癌组织中的表达显著上调[20], 并与患者的不良预后紧密相关[12, 21]。在胃癌细胞中, PCAT1可以作为miR-128的“分子海绵”,通过上调锌指E盒结合同源异型盒1(ZEB1), 或者通过与EZH2蛋白结合,以表观遗传调控方式下调PTEN的表达,从而增强胃癌细胞对顺铂的耐药性[12, 20]。SUN D等[22]研究证实,转录因子YY1可以与PCAT1启动子结合,上调PCAT1的表达。PCAT1进一步通过与miR-216a-3p竞争结合,上调B细胞淋巴瘤因子3(BCL3)的表达,在胆管癌中发挥促癌作用。
2. PCAT1在消化系统肿瘤中的促癌作用
本课题组前期研究发现,PCAT1在胰腺癌组织中的高表达与患者预后不良紧密相关。PCAT1通过诱导E-钙黏蛋白(E-cadherin)mRNA的m6A修饰并促进其降解,从而下调E-cadherin的表达,推动胰腺癌细胞上皮-间质转化(EMT)进程、迁移和侵袭[2]。SADI KHOSROSHAHI N等[14]评估100份伊朗患者的结直肠肿瘤组织后发现, PCAT1高表达与结直肠肿瘤的发生显著相关,因此, PCAT1可作为结直肠癌的预后生物学标志物。PCAT1可靶向锌指蛋白217(ZNF217), 调节与EMT相关的转移相关蛋白2(MTA2)/转移相关蛋白3(MTA3)/Snail家族锌指蛋白1(Snai1)/E-cadherin信号传导通路,加速结直肠癌的发生和发展[15]。PCAT1还可通过调节Bcl-2相关X蛋白(Bax)与B细胞淋巴瘤2(Bcl-2)的比例,增加结肠癌细胞的活力,诱导细胞增殖,并抑制其对化疗药的敏感性[16]。FANG X等[17]发现,结直肠癌细胞系外泌体中的PCAT1可通过miR-329-3p/神经导向因子1(Netrin-1)轴,推动T84细胞的迁移、EMT及增殖。此外, PCAT1可以通过靶向miR-149-5p调节结直肠癌细胞的增殖、侵袭和凋亡[18]。相关研究[13]表明, PCAT1能促进食管鳞状细胞癌细胞的增殖、迁移和侵袭,从而加快癌症的发生和进展。HUANG L J等[19]通过在实验中敲除PCAT1, 降低了癌细胞中细胞周期蛋白B1(cyclin B1)和细胞分裂周期蛋白2(CDC2)的表达,导致细胞周期停滞在G2/M期,并增强了食管鳞状细胞癌细胞对紫杉醇的敏感性。机制研究[13]显示, miR-326是PCAT1的直接靶标; PCAT1可以降低miR-326表达,从而对丝裂原活化蛋白激酶(AKT)信号通路起到抑制作用,通过miR-508-3p靶向调节ANXA10, 在食管鳞状细胞癌恶性进展中扮演重要角色。PCAT1在胃癌组织中的表达显著上调[20], 并与患者的不良预后紧密相关[12, 21]。在胃癌细胞中, PCAT1可以作为miR-128的“分子海绵”,通过上调锌指E盒结合同源异型盒1(ZEB1), 或者通过与EZH2蛋白结合,以表观遗传调控方式下调PTEN的表达,从而增强胃癌细胞对顺铂的耐药性[12, 20]。SUN D等[22]研究证实,转录因子YY1可以与PCAT1启动子结合,上调PCAT1的表达。PCAT1进一步通过与miR-216a-3p竞争结合,上调B细胞淋巴瘤因子3(BCL3)的表达,在胆管癌中发挥促癌作用。
2. PCAT1在消化系统肿瘤中的促癌作用
本课题组前期研究发现,PCAT1在胰腺癌组织中的高表达与患者预后不良紧密相关。PCAT1通过诱导E-钙黏蛋白(E-cadherin)mRNA的m6A修饰并促进其降解,从而下调E-cadherin的表达,推动胰腺癌细胞上皮-间质转化(EMT)进程、迁移和侵袭[2]。SADI KHOSROSHAHI N等[14]评估100份伊朗患者的结直肠肿瘤组织后发现, PCAT1高表达与结直肠肿瘤的发生显著相关,因此, PCAT1可作为结直肠癌的预后生物学标志物。PCAT1可靶向锌指蛋白217(ZNF217), 调节与EMT相关的转移相关蛋白2(MTA2)/转移相关蛋白3(MTA3)/Snail家族锌指蛋白1(Snai1)/E-cadherin信号传导通路,加速结直肠癌的发生和发展[15]。PCAT1还可通过调节Bcl-2相关X蛋白(Bax)与B细胞淋巴瘤2(Bcl-2)的比例,增加结肠癌细胞的活力,诱导细胞增殖,并抑制其对化疗药的敏感性[16]。FANG X等[17]发现,结直肠癌细胞系外泌体中的PCAT1可通过miR-329-3p/神经导向因子1(Netrin-1)轴,推动T84细胞的迁移、EMT及增殖。此外, PCAT1可以通过靶向miR-149-5p调节结直肠癌细胞的增殖、侵袭和凋亡[18]。相关研究[13]表明, PCAT1能促进食管鳞状细胞癌细胞的增殖、迁移和侵袭,从而加快癌症的发生和进展。HUANG L J等[19]通过在实验中敲除PCAT1, 降低了癌细胞中细胞周期蛋白B1(cyclin B1)和细胞分裂周期蛋白2(CDC2)的表达,导致细胞周期停滞在G2/M期,并增强了食管鳞状细胞癌细胞对紫杉醇的敏感性。机制研究[13]显示, miR-326是PCAT1的直接靶标; PCAT1可以降低miR-326表达,从而对丝裂原活化蛋白激酶(AKT)信号通路起到抑制作用,通过miR-508-3p靶向调节ANXA10, 在食管鳞状细胞癌恶性进展中扮演重要角色。PCAT1在胃癌组织中的表达显著上调[20], 并与患者的不良预后紧密相关[12, 21]。在胃癌细胞中, PCAT1可以作为miR-128的“分子海绵”,通过上调锌指E盒结合同源异型盒1(ZEB1), 或者通过与EZH2蛋白结合,以表观遗传调控方式下调PTEN的表达,从而增强胃癌细胞对顺铂的耐药性[12, 20]。SUN D等[22]研究证实,转录因子YY1可以与PCAT1启动子结合,上调PCAT1的表达。PCAT1进一步通过与miR-216a-3p竞争结合,上调B细胞淋巴瘤因子3(BCL3)的表达,在胆管癌中发挥促癌作用。
3. PCAT1在泌尿/生殖系统癌症中的促癌作用
PCAT1的促癌作用最初在前列腺癌中被发现和证实。后续研究[23]显示, PCAT1与FK506结合蛋白51(FKBP51)结合,取代了PH结构域亮氨酸富集重复蛋白(PHLPP)/FKBP51/核因子κB激酶α(IKKα)复合物中的PHLPP, 从而激活去势抵抗性前列腺癌细胞中的AKT和核因子κB (NF-κB)信号通路,诱导前列腺癌的发展。JIANG X等[24]研究发现,转录因子AP-2γ(TFAP2C)可以促进PCAT1的转录。PCAT1通过与c-Myc结合并增强其稳定性,提高了铁死亡抑制因子胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(SLC7A11)的转录水平。同时, PCAT1作为miR-25-3p的“分子海绵”上调SLC7A11的表达,增强了癌细胞对多西他赛的耐药性。这揭示了TFAP2C/PCAT1/c-Myc/miR-25-3p/SLC7A11轴在前列腺癌化疗抵抗中的分子机制。
PCAT1在卵巢癌细胞系及癌组织中高表达,通过上调Wnt和丝裂原活化蛋白激酶2(NEK2)通路相关基因,调控细胞迁移、增殖和凋亡[25]。此外, PCAT1通过靶向抑制miR-129-5p(一种抑制细胞增殖和诱导凋亡的分子),从而促进卵巢癌的发展[26]。GE X等[27]发现,宫颈癌细胞系中PCAT1表达水平较高。PCAT1通过调控PCAT1/miR-128/高尔基体膜蛋白1(GOLM1)轴,促进宫颈癌细胞的侵袭和增殖,并提升其对放疗的抵抗力。在子宫内膜癌组织中, PCAT1高表达与肿瘤恶性程度高及患者总体生存期较短显著相关。下调PCAT1可显著降低子宫内膜癌细胞中Bcl-2、波形蛋白(Vimentin)和N-钙黏蛋白(N-cadherin)等促癌蛋白的表达,同时增加E-cadherin和Bad等抑癌蛋白的表达[28]。在乳腺癌组织中, PCAT1表达水平与患者不良临床结果和乳腺癌病理等级呈显著正相关[29]。PCAT1通过靶向性别决定区Y框蛋白4(SOX4)、缺氧诱导因子-1α(HIF-1α)/受体识别相关蛋白1(RACK1)通路和配对样同源框转录因子2(PITX2)/miR-134-3p轴,有效调控乳腺癌细胞的代谢、凋亡和增殖,促进乳腺癌的迁移和入侵[29-31]。
3. PCAT1在泌尿/生殖系统癌症中的促癌作用
PCAT1的促癌作用最初在前列腺癌中被发现和证实。后续研究[23]显示, PCAT1与FK506结合蛋白51(FKBP51)结合,取代了PH结构域亮氨酸富集重复蛋白(PHLPP)/FKBP51/核因子κB激酶α(IKKα)复合物中的PHLPP, 从而激活去势抵抗性前列腺癌细胞中的AKT和核因子κB (NF-κB)信号通路,诱导前列腺癌的发展。JIANG X等[24]研究发现,转录因子AP-2γ(TFAP2C)可以促进PCAT1的转录。PCAT1通过与c-Myc结合并增强其稳定性,提高了铁死亡抑制因子胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(SLC7A11)的转录水平。同时, PCAT1作为miR-25-3p的“分子海绵”上调SLC7A11的表达,增强了癌细胞对多西他赛的耐药性。这揭示了TFAP2C/PCAT1/c-Myc/miR-25-3p/SLC7A11轴在前列腺癌化疗抵抗中的分子机制。
PCAT1在卵巢癌细胞系及癌组织中高表达,通过上调Wnt和丝裂原活化蛋白激酶2(NEK2)通路相关基因,调控细胞迁移、增殖和凋亡[25]。此外, PCAT1通过靶向抑制miR-129-5p(一种抑制细胞增殖和诱导凋亡的分子),从而促进卵巢癌的发展[26]。GE X等[27]发现,宫颈癌细胞系中PCAT1表达水平较高。PCAT1通过调控PCAT1/miR-128/高尔基体膜蛋白1(GOLM1)轴,促进宫颈癌细胞的侵袭和增殖,并提升其对放疗的抵抗力。在子宫内膜癌组织中, PCAT1高表达与肿瘤恶性程度高及患者总体生存期较短显著相关。下调PCAT1可显著降低子宫内膜癌细胞中Bcl-2、波形蛋白(Vimentin)和N-钙黏蛋白(N-cadherin)等促癌蛋白的表达,同时增加E-cadherin和Bad等抑癌蛋白的表达[28]。在乳腺癌组织中, PCAT1表达水平与患者不良临床结果和乳腺癌病理等级呈显著正相关[29]。PCAT1通过靶向性别决定区Y框蛋白4(SOX4)、缺氧诱导因子-1α(HIF-1α)/受体识别相关蛋白1(RACK1)通路和配对样同源框转录因子2(PITX2)/miR-134-3p轴,有效调控乳腺癌细胞的代谢、凋亡和增殖,促进乳腺癌的迁移和入侵[29-31]。
3. PCAT1在泌尿/生殖系统癌症中的促癌作用
PCAT1的促癌作用最初在前列腺癌中被发现和证实。后续研究[23]显示, PCAT1与FK506结合蛋白51(FKBP51)结合,取代了PH结构域亮氨酸富集重复蛋白(PHLPP)/FKBP51/核因子κB激酶α(IKKα)复合物中的PHLPP, 从而激活去势抵抗性前列腺癌细胞中的AKT和核因子κB (NF-κB)信号通路,诱导前列腺癌的发展。JIANG X等[24]研究发现,转录因子AP-2γ(TFAP2C)可以促进PCAT1的转录。PCAT1通过与c-Myc结合并增强其稳定性,提高了铁死亡抑制因子胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(SLC7A11)的转录水平。同时, PCAT1作为miR-25-3p的“分子海绵”上调SLC7A11的表达,增强了癌细胞对多西他赛的耐药性。这揭示了TFAP2C/PCAT1/c-Myc/miR-25-3p/SLC7A11轴在前列腺癌化疗抵抗中的分子机制。
PCAT1在卵巢癌细胞系及癌组织中高表达,通过上调Wnt和丝裂原活化蛋白激酶2(NEK2)通路相关基因,调控细胞迁移、增殖和凋亡[25]。此外, PCAT1通过靶向抑制miR-129-5p(一种抑制细胞增殖和诱导凋亡的分子),从而促进卵巢癌的发展[26]。GE X等[27]发现,宫颈癌细胞系中PCAT1表达水平较高。PCAT1通过调控PCAT1/miR-128/高尔基体膜蛋白1(GOLM1)轴,促进宫颈癌细胞的侵袭和增殖,并提升其对放疗的抵抗力。在子宫内膜癌组织中, PCAT1高表达与肿瘤恶性程度高及患者总体生存期较短显著相关。下调PCAT1可显著降低子宫内膜癌细胞中Bcl-2、波形蛋白(Vimentin)和N-钙黏蛋白(N-cadherin)等促癌蛋白的表达,同时增加E-cadherin和Bad等抑癌蛋白的表达[28]。在乳腺癌组织中, PCAT1表达水平与患者不良临床结果和乳腺癌病理等级呈显著正相关[29]。PCAT1通过靶向性别决定区Y框蛋白4(SOX4)、缺氧诱导因子-1α(HIF-1α)/受体识别相关蛋白1(RACK1)通路和配对样同源框转录因子2(PITX2)/miR-134-3p轴,有效调控乳腺癌细胞的代谢、凋亡和增殖,促进乳腺癌的迁移和入侵[29-31]。
4. PCAT1在头颈部癌中的促癌作用
SUR S等[32]研究发现,干扰PCAT1的表达可以激活头颈部鳞状细胞癌中的凋亡信号调节激酶1(ASK1)和p38丝裂原活化蛋白激酶(p38 MAPK), 并下调c-Myc和AKT1的表达,从而显著抑制癌细胞的增殖并诱导其凋亡。HU W等[33]检测50例喉癌患者的癌组织样本后发现, PCAT1的表达水平显著升高,且干扰PCAT1的表达可以抑制喉癌细胞的迁移、侵袭及移植瘤的生长,提示PCAT1可作为miR-210-3p的“分子海绵”在喉癌细胞中发挥促癌作用。
4. PCAT1在头颈部癌中的促癌作用
SUR S等[32]研究发现,干扰PCAT1的表达可以激活头颈部鳞状细胞癌中的凋亡信号调节激酶1(ASK1)和p38丝裂原活化蛋白激酶(p38 MAPK), 并下调c-Myc和AKT1的表达,从而显著抑制癌细胞的增殖并诱导其凋亡。HU W等[33]检测50例喉癌患者的癌组织样本后发现, PCAT1的表达水平显著升高,且干扰PCAT1的表达可以抑制喉癌细胞的迁移、侵袭及移植瘤的生长,提示PCAT1可作为miR-210-3p的“分子海绵”在喉癌细胞中发挥促癌作用。
4. PCAT1在头颈部癌中的促癌作用
SUR S等[32]研究发现,干扰PCAT1的表达可以激活头颈部鳞状细胞癌中的凋亡信号调节激酶1(ASK1)和p38丝裂原活化蛋白激酶(p38 MAPK), 并下调c-Myc和AKT1的表达,从而显著抑制癌细胞的增殖并诱导其凋亡。HU W等[33]检测50例喉癌患者的癌组织样本后发现, PCAT1的表达水平显著升高,且干扰PCAT1的表达可以抑制喉癌细胞的迁移、侵袭及移植瘤的生长,提示PCAT1可作为miR-210-3p的“分子海绵”在喉癌细胞中发挥促癌作用。
5. PCAT1血液系统肿瘤中的促癌作用
临床常见的血液系统肿瘤包括各种类型的白血病、多发性骨髓瘤和淋巴瘤等。SHEN X等[34]研究显示,PCAT1在多发性骨髓瘤的肿瘤组织和细胞系中高表达。PCAT1通过调控p38和c-Jun氨基末端激酶(JNK)信号通路,促进多发性骨髓瘤的进展和化疗耐药。此外, PCAT1还可以作为miR-129的“分子海绵”,通过调控丝裂原活化蛋白3激酶7(MAP3K7)/NF-κB通路推动多发性骨髓瘤细胞的增殖和细胞周期进程[35]。YUAN Y等[10]发现,在急性髓系白血病细胞中, PCAT1可以与FZD6蛋白结合并提高其稳定性,激活β-连环蛋白(β-catenin)/Wnt信号通路,从而诱导癌细胞增殖并抑制细胞凋亡。
5. PCAT1血液系统肿瘤中的促癌作用
临床常见的血液系统肿瘤包括各种类型的白血病、多发性骨髓瘤和淋巴瘤等。SHEN X等[34]研究显示,PCAT1在多发性骨髓瘤的肿瘤组织和细胞系中高表达。PCAT1通过调控p38和c-Jun氨基末端激酶(JNK)信号通路,促进多发性骨髓瘤的进展和化疗耐药。此外, PCAT1还可以作为miR-129的“分子海绵”,通过调控丝裂原活化蛋白3激酶7(MAP3K7)/NF-κB通路推动多发性骨髓瘤细胞的增殖和细胞周期进程[35]。YUAN Y等[10]发现,在急性髓系白血病细胞中, PCAT1可以与FZD6蛋白结合并提高其稳定性,激活β-连环蛋白(β-catenin)/Wnt信号通路,从而诱导癌细胞增殖并抑制细胞凋亡。
5. PCAT1血液系统肿瘤中的促癌作用
临床常见的血液系统肿瘤包括各种类型的白血病、多发性骨髓瘤和淋巴瘤等。SHEN X等[34]研究显示,PCAT1在多发性骨髓瘤的肿瘤组织和细胞系中高表达。PCAT1通过调控p38和c-Jun氨基末端激酶(JNK)信号通路,促进多发性骨髓瘤的进展和化疗耐药。此外, PCAT1还可以作为miR-129的“分子海绵”,通过调控丝裂原活化蛋白3激酶7(MAP3K7)/NF-κB通路推动多发性骨髓瘤细胞的增殖和细胞周期进程[35]。YUAN Y等[10]发现,在急性髓系白血病细胞中, PCAT1可以与FZD6蛋白结合并提高其稳定性,激活β-连环蛋白(β-catenin)/Wnt信号通路,从而诱导癌细胞增殖并抑制细胞凋亡。
6. PCAT1在其他系统肿瘤中的促癌作用
PCAT1在非小细胞肺癌组织中高表达,并与肿瘤大小、远处转移和肿瘤分期密切相关。PCAT1高表达的患者生存时间显著缩短[4]。PCAT1通过上调SRY相关HMG盒基因2(SOX2), 直接抑制环磷酸鸟苷-腺苷酸合成酶(cGAS)/干扰素基因刺激因子(STING)通路,进而抑制抗肿瘤免疫反应并促进肿瘤发生[36]。体外实验[9]发现, PCAT1能够诱导非小细胞肺癌细胞增殖,并维持其干细胞特性。PCAT1通过与角蛋白假尿苷合酶1(DKC1)蛋白结合,进一步通过血管内皮生长因子(VEGF)/AKT/Bcl-2/胱天蛋白酶9(caspase 9)通路调控非小细胞肺癌细胞的增殖、侵袭、凋亡及EMT进程[37]。此外, PCAT1通过结合miR-129促进ATP结合盒亚家族B成员1(ABCB1)的表达,或通过调节AKT/磷脂酰肌醇3-激酶(PI3K)信号通路,使癌细胞对顺铂或吉非替尼产生耐药性[38-39]。在骨肉瘤组织中, PCAT1的表达显著升高,且高水平的PCAT1与患者较差的预后相关。PCAT1可通过靶向miR-508-3p调节ZEB1的表达,促进骨肉瘤细胞的侵袭和增殖[40]。ZHANG P H等[41]研究发现, PCAT1可通过靶向胶质瘤干细胞中的miR-129-5p, 上调高迁移率族蛋白B1(HMGB1)的表达,从而降低肿瘤细胞的放射敏感性,并维持神经胶质瘤干细胞的干性。此外,已有研究[42]指出, PCAT1在多形胶质母细胞瘤中参与DNA损伤反应,但其具体机制尚未明确。
6. PCAT1在其他系统肿瘤中的促癌作用
PCAT1在非小细胞肺癌组织中高表达,并与肿瘤大小、远处转移和肿瘤分期密切相关。PCAT1高表达的患者生存时间显著缩短[4]。PCAT1通过上调SRY相关HMG盒基因2(SOX2), 直接抑制环磷酸鸟苷-腺苷酸合成酶(cGAS)/干扰素基因刺激因子(STING)通路,进而抑制抗肿瘤免疫反应并促进肿瘤发生[36]。体外实验[9]发现, PCAT1能够诱导非小细胞肺癌细胞增殖,并维持其干细胞特性。PCAT1通过与角蛋白假尿苷合酶1(DKC1)蛋白结合,进一步通过血管内皮生长因子(VEGF)/AKT/Bcl-2/胱天蛋白酶9(caspase 9)通路调控非小细胞肺癌细胞的增殖、侵袭、凋亡及EMT进程[37]。此外, PCAT1通过结合miR-129促进ATP结合盒亚家族B成员1(ABCB1)的表达,或通过调节AKT/磷脂酰肌醇3-激酶(PI3K)信号通路,使癌细胞对顺铂或吉非替尼产生耐药性[38-39]。在骨肉瘤组织中, PCAT1的表达显著升高,且高水平的PCAT1与患者较差的预后相关。PCAT1可通过靶向miR-508-3p调节ZEB1的表达,促进骨肉瘤细胞的侵袭和增殖[40]。ZHANG P H等[41]研究发现, PCAT1可通过靶向胶质瘤干细胞中的miR-129-5p, 上调高迁移率族蛋白B1(HMGB1)的表达,从而降低肿瘤细胞的放射敏感性,并维持神经胶质瘤干细胞的干性。此外,已有研究[42]指出, PCAT1在多形胶质母细胞瘤中参与DNA损伤反应,但其具体机制尚未明确。
6. PCAT1在其他系统肿瘤中的促癌作用
PCAT1在非小细胞肺癌组织中高表达,并与肿瘤大小、远处转移和肿瘤分期密切相关。PCAT1高表达的患者生存时间显著缩短[4]。PCAT1通过上调SRY相关HMG盒基因2(SOX2), 直接抑制环磷酸鸟苷-腺苷酸合成酶(cGAS)/干扰素基因刺激因子(STING)通路,进而抑制抗肿瘤免疫反应并促进肿瘤发生[36]。体外实验[9]发现, PCAT1能够诱导非小细胞肺癌细胞增殖,并维持其干细胞特性。PCAT1通过与角蛋白假尿苷合酶1(DKC1)蛋白结合,进一步通过血管内皮生长因子(VEGF)/AKT/Bcl-2/胱天蛋白酶9(caspase 9)通路调控非小细胞肺癌细胞的增殖、侵袭、凋亡及EMT进程[37]。此外, PCAT1通过结合miR-129促进ATP结合盒亚家族B成员1(ABCB1)的表达,或通过调节AKT/磷脂酰肌醇3-激酶(PI3K)信号通路,使癌细胞对顺铂或吉非替尼产生耐药性[38-39]。在骨肉瘤组织中, PCAT1的表达显著升高,且高水平的PCAT1与患者较差的预后相关。PCAT1可通过靶向miR-508-3p调节ZEB1的表达,促进骨肉瘤细胞的侵袭和增殖[40]。ZHANG P H等[41]研究发现, PCAT1可通过靶向胶质瘤干细胞中的miR-129-5p, 上调高迁移率族蛋白B1(HMGB1)的表达,从而降低肿瘤细胞的放射敏感性,并维持神经胶质瘤干细胞的干性。此外,已有研究[42]指出, PCAT1在多形胶质母细胞瘤中参与DNA损伤反应,但其具体机制尚未明确。
7. 总结与展望
现有研究已初步证实, lncRNA PCAT1在大多数癌症中发挥促进癌症发生和发展的作用。然而,关于PCAT1在神经系统、内分泌系统、皮肤及肌肉骨骼系统肿瘤中的作用及其机制的研究仍较为缺乏。目前, PCAT1在各类癌症中的信号通路研究尚处于初始阶段,其具体机制及与其他信号通路的相互作用仍需深入探讨。值得注意的是,已有研究[43]表明PCAT1在重塑肿瘤微环境中发挥关键作用,这为PCAT1作为促癌因子提供了新的依据。在临床研究方面,现有数据支持PCAT1可辅助临床检测,并作为预后标志物,但将PCAT1作为癌症治疗靶点的研究仍不充分。总之, PCAT1在多种癌症中高表达,其作用机制复杂且促癌方式多样,深入研究PCAT1有望为癌症治疗提供新的靶点和生物标志物。
7. 总结与展望
现有研究已初步证实, lncRNA PCAT1在大多数癌症中发挥促进癌症发生和发展的作用。然而,关于PCAT1在神经系统、内分泌系统、皮肤及肌肉骨骼系统肿瘤中的作用及其机制的研究仍较为缺乏。目前, PCAT1在各类癌症中的信号通路研究尚处于初始阶段,其具体机制及与其他信号通路的相互作用仍需深入探讨。值得注意的是,已有研究[43]表明PCAT1在重塑肿瘤微环境中发挥关键作用,这为PCAT1作为促癌因子提供了新的依据。在临床研究方面,现有数据支持PCAT1可辅助临床检测,并作为预后标志物,但将PCAT1作为癌症治疗靶点的研究仍不充分。总之, PCAT1在多种癌症中高表达,其作用机制复杂且促癌方式多样,深入研究PCAT1有望为癌症治疗提供新的靶点和生物标志物。
7. 总结与展望
现有研究已初步证实, lncRNA PCAT1在大多数癌症中发挥促进癌症发生和发展的作用。然而,关于PCAT1在神经系统、内分泌系统、皮肤及肌肉骨骼系统肿瘤中的作用及其机制的研究仍较为缺乏。目前, PCAT1在各类癌症中的信号通路研究尚处于初始阶段,其具体机制及与其他信号通路的相互作用仍需深入探讨。值得注意的是,已有研究[43]表明PCAT1在重塑肿瘤微环境中发挥关键作用,这为PCAT1作为促癌因子提供了新的依据。在临床研究方面,现有数据支持PCAT1可辅助临床检测,并作为预后标志物,但将PCAT1作为癌症治疗靶点的研究仍不充分。总之, PCAT1在多种癌症中高表达,其作用机制复杂且促癌方式多样,深入研究PCAT1有望为癌症治疗提供新的靶点和生物标志物。
-
表 1 焦虑、抑郁评分在一般人口学资料分布中的情况(x±s)
资料 n 焦虑评分/分 t/F P 抑郁评分/分 t/F P 性别 -0.372 0.710 -0.985 0.326 男 126 48.88±6.93 50.40±5.89 女 197 49.19±7.40 51.20±6.54 民族 -2.393 0.017 -2.508 0.013 汉族 317 48.94±7.19 50.70±6.24 其他 6 56.00±4.94 57.17±6.62 年龄 0.193 0.824 0.961 0.384 18~39岁 107 48.89±6.37 50.32±5.90 40~59岁 172 49.29±7.43 51.28±6.46 ≥60岁 44 48.64±8.35 50.30±6.58 文化程度 1.107 0.332 2.383 0.094 初中及以下 123 49.83±7.41 51.77±6.36 高中及大专 74 48.58±7.47 50.55±6.57 本科及以上 126 48.61±6.86 50.07±5.99 工作状态 3.699 0.026 4.181 0.016 无业 69 50.49±6.81 52.12±6.10 退休 60 47.08±7.72 48.97±6.02 在职 194 49.18±7.09 50.95±6.35 家庭月收入 2.161 0.117 1.730 0.179 3 000元人民币 56 49.54±7.70 51.63±6.69 3 000~5 000元人民币 56 50.12±6.87 51.44±6.14 >5 000元人民币 168 48.29±7.20 50.21±6.22 吸烟状态 2.322 0.100 1.481 0.229 吸烟 33 48.73±7.48 50.70±5.74 已戒烟 36 51.50±7.32 52.53±6.46 从不吸烟 254 48.77±7.13 50.61±6.33 医疗支付方式 2.091 0.125 3.059 0.048 自费 61 50.59±7.61 52.55±6.17 公费 4 45.50±5.00 48.50±3.79 肺癌家族史 -2.156 0.032 -2.059 0.037 是 35 46.60±6.71 48.74±5.30 否 288 49.37±7.23 51.08±6.37 肺结节个数 -1.772 0.077 -2.463 0.014 单个 144 48.28±7.40 49.87±6.16 多个 179 49.70±7.02 51.60±6.31 实性肺结节 -1.151 0.251 0.141 0.888 无 233 48.78±7.13 50.58±6.17 有 90 49.81±7.42 51.49±6.60 亚实性肺结节 -0.652 0.515 0.141 0.888 无 273 48.96±7.20 50.85±6.39 有 50 49.68±7.33 50.72±5.81 磨玻璃肺结节 1.698 0.090 1.553 0.121 无 119 49.96±7.06 51.55±6.05 有 204 48.55±7.27 50.41±6.42 高血压 1.980 0.049 1.778 0.076 无 258 49.47±7.12 51.14±6.36 有 65 47.49±7.43 49.60±5.93 糖尿病 0.607 0.544 1.060 0.290 无 302 49.13±7.32 50.93±6.38 有 21 48.14±5.51 49.43±4.84 关节炎 -2.757 0.006 -1.592 0.003 无 316 48.90±7.17 50.75±6.33 有 7 56.42±5.12 54.57±2.23 肺结核 -0.948 0.344 -0.916 0.360 无 317 49.02±7.20 50.79±6.30 有 6 51.83±7.96 53.17±6.46 表 2 反刍思维、领悟社会支持与焦虑、抑郁得分及相关性分析 (n=323)(x ±s)
项目 得分范围/分 总分均分/分 领悟社会支持 反刍思维 焦虑 抑郁 领悟社会支持 12~84 61.89±12.05 1 — — — 反刍思维 22~70 34.68±9.23 -0.321** 1 — — 焦虑 31~74 49.07±7.21 -0.370** 0.401** 1 — 抑郁 36~71 50.83±6.30 -0.336** 0.392** 0.896** 1 **表示在0.01级别(双尾)的相关性显著。 -
[1] 周清华, 范亚光, 王颖, 等. 中国肺癌低剂量螺旋CT筛查指南(2018年版)[J]. 中国肺癌杂志, 2018, 21(2): 67-75. https://www.cnki.com.cn/Article/CJFDTOTAL-FAIZ201802001.htm [2] SLATORE C G, WIENER R S, GOLDEN S E, et al. Longitudinal assessment of distress among veterans with incidental pulmonary nodules[J]. Ann Am Thorac Soc, 2016, 13(11): 1983-1991. doi: 10.1513/AnnalsATS.201607-555OC
[3] 付玲, 魏拓, 隆海红, 等. 社区低剂量螺旋CT肺癌筛查患者心理状况与影响因素分析[J]. 石河子大学学报: 自然科学版, 2019, 37(6): 764-769. https://www.cnki.com.cn/Article/CJFDTOTAL-SHZN201906018.htm [4] LI L H, ZHAO Y, LI H. Assessment of anxiety and depression in patients with incidental pulmonary nodules and analysis of its related impact factors[J]. Thorac Cancer, 2020, 11(6): 1433-1442. doi: 10.1111/1759-7714.13406
[5] 王浩宇. 初诊肺结节患者伴发抑郁情绪的研究及干预[D]. 大连: 大连医科大学, 2019. [6] WANG L N, WEI Y Y, HU H Q, et al. Correlation between anxiety, depression and changes in Th17/treg and inflammatory levels in patients with pulmonary nodules[J]. Zhongguo Fei Ai Za Zhi, 2020, 23(7): 554-560.
[7] SCHWARTZ S. Outcomes for the sociology of mental health: are we meeting our goals?[J]. J Health Soc Behav, 2002, 43(2): 223-235. doi: 10.2307/3090198
[8] ROBERTS T J, LENNES I T, HAWARI S, et al. Integrated, multidisciplinary management of pulmonary nodules can streamline care and improve adherence to recommendations[J]. Oncologist, 2020, 25(5): 431-437. doi: 10.1634/theoncologist.2019-0519
[9] BORGES E L, FRANCESCHINI J, COSTA L H, et al. Family caregiver burden: the burden of caring for lung cancer patients according to the cancer stage and patient quality of life[J]. J Bras Pneumol, 2017, 43(1): 18-23. doi: 10.1590/s1806-37562016000000177
[10] 张丛丽, 周宗奎. 被动性社交网站使用、社交焦虑、反刍思维与青少年抑郁的关系: 有调节的中介效应分析[J]. 中国临床心理学杂志, 2018, 26(3): 490-493, 497. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLCY201803016.htm [11] 李艳, 朱蓉蓉, 何畏, 等. 大学生反刍思维在孤独感与自杀意念相关性中的中介作用[J]. 中国心理卫生杂志, 2018, 32(10): 873-876. https://www.cnki.com.cn/Article/CJFDTOTAL-ZXWS201810012.htm [12] 宋颖, 张守臣. 领悟社会支持对社交焦虑的影响: 反刍思维的中介作用和社会阻抑的调节作用[J]. 心理科学, 2016, 39(1): 172-177. https://www.cnki.com.cn/Article/CJFDTOTAL-XLKX201601026.htm [13] NOLEN-HOEKSEMA S, WISCO B E, LYUBOMIRSKY S. Rethinking rumination[J]. Perspect Psychol Sci, 2008, 3(5): 400-424. doi: 10.1111/j.1745-6924.2008.00088.x
[14] 黄韵榛, 周鹏, 丁欣放, 等. 特质反刍思维个体的注意范围及其调节能力[J]. 中国临床心理学杂志, 2019, 27(2): 227-231. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLCY201902004.htm [15] 中华医学会呼吸病学分会肺癌学组, 中国肺癌防治联盟专家组. 肺结节诊治中国专家共识(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(10): 763-771. https://www.cnki.com.cn/Article/CJFDTOTAL-SYNK201905011.htm [16] 姜乾金. 领悟社会支持量表[J]. 中国行为医学科学, 2001, 10(10): 41-43. https://www.cnki.com.cn/Article/CJFDTOTAL-SXHZ201813017.htm [17] 韩秀, 杨宏飞. Nolen-Hoeksema反刍思维量表在中国的试用[J]. 中国临床心理学杂志, 2009, 17(5): 550-551, 549. https://www.cnki.com.cn/Article/CJFDTOTAL-ZLCY200905010.htm [18] ZUNG W W K. A self-rating depression scale[J]. Arch Gen Psychiatry, 1965, 12: 63-70.
[19] ZUNG W W K. A rating instrument for anxiety disorders[J]. Psychosomatics, 1971, 12(6): 371-379.
[20] JOHNSON H M. Anxiety and hypertension: is there a link?A literature review of the comorbidity relationship between anxiety and hypertension[J]. Curr Hypertens Rep, 2019, 21(9): 66.
[21] 周娜, 何静文, 李玲, 等. 外军留学生焦虑、抑郁与领悟社会支持的关系[J]. 第二军医大学学报, 2021, 42(2): 224-227. [22] ZAMANIAN H, AMINI-TEHRANI M, JALALI Z, et al. Perceived social support, coping strategies, anxiety and depression among women with breast cancer: evaluation of a mediation model[J]. Eur J Oncol Nurs, 2021, 50: 101892.
[23] 赵丽婷, 王雁. 特教教师核心自我评价与心理健康: 领悟社会支持的中介作用[J]. 中国特殊教育, 2016(6): 78-83. https://www.cnki.com.cn/Article/CJFDTOTAL-ZDTJ201606014.htm [24] 高雅琴, 李玉红, 步仰高, 等. 心理韧性在产妇反刍思维与产后抑郁间的中介效应[J]. 解放军护理杂志, 2020, 37(7): 11-14, 19. https://www.cnki.com.cn/Article/CJFDTOTAL-JFHL202007005.htm [25] 林雯仪, 何昊, 关青. 反刍思维的脑功能网络机制[J]. 心理科学进展, 2022, 30(6): 1262-1269. https://www.cnki.com.cn/Article/CJFDTOTAL-XLXD202206007.htm [26] 蒲廷娅. 大学生创伤后成长及其与反刍思维、心理韧性的关系研究[D]. 天津: 天津大学, 2017.





 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
