Values of D-dimer, prealbumin and soluble triggering receptor expressed on myeloid cells-1 in diagnosing severe pneumonia in children
-
摘要:目的
分析血清D-二聚体(D-D)、前白蛋白(PA)、可溶性髓系细胞触发受体-1(sTREM-1)联合检测诊断儿童重症肺炎的价值。
方法将70例住院肺炎患儿根据疾病严重程度分为重症肺炎组与普通肺炎组,每组35例; 重症肺炎组又根据住院期间预后情况分为存活亚组30例与死亡亚组5例。采用酶联免疫吸附(ELISA)检测sTREM-1水平,采用免疫比浊法检测血清D-D、PA水平; 采用受试者工作特征(ROC)曲线分析血清D-D、PA、sTREM-1联合检测对儿童重症肺炎的诊断价值; 采用Logistic回归模型分析血清D-D、PA、sTREM-1对重症肺炎发生的影响。
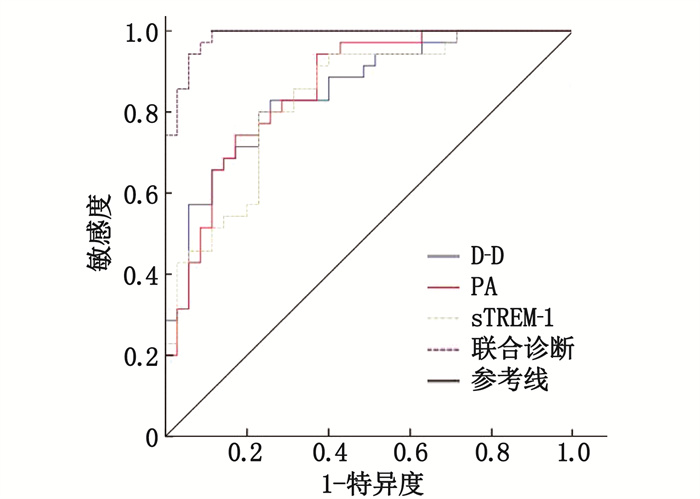
结果普通肺炎组入院时血清D-D、sTREM-1水平低于重症肺炎组,血清PA水平高于重症肺炎组,差异有统计学意义(P < 0.05)。血清D-D、PA、sTREM-1及其联合诊断儿童重症肺炎的曲线下面积(AUC)分别为0.849、0.858、0.833、0.986。存活亚组入院治疗后血清D-D、sTREM-1水平逐渐降低,血清PA水平逐渐升高,差异有统计学意义(P < 0.01); 死亡亚组入院治疗后血清D-D、sTREM-1水平逐渐升高,血清PA水平逐渐降低,差异有统计学意义(P < 0.01)。入院时、入院3 d及入院1周时,死亡亚组血清D-D、sTREM-1水平均高于存活亚组,血清PA水平低于存活亚组,差异有统计学意义(P < 0.01)。sTREM-1升高是重症肺炎发生的独立危险因素(P < 0.05)。
结论重症肺炎患儿血清D-D、sTREM-1水平升高, PA水平降低, 3项指标联合检测不仅可以提高重症肺炎的早期诊断率,而且也能指导疗效评估。
Abstract:ObjectiveTo analyze the value of combined detection of serum D-dimer (D-D), prealbumin (PA) and soluble triggering receptor expressed on myeloid cells-1 (sTREM-1) in diagnosing severe pneumonia in children.
MethodsA total of 70 hospitalized children with pneumonia were divided into severe pneumonia group and common pneumonia group according to severity of disease, with 35 cases in each group; the severe pneumonia group was divided into survival subgroup with 30 cases and death subgroup with 5 cases according to the prognosis during hospitalization. Enzyme-linked immunosorbent assay (ELISA) was used to detect the level of sTREM-1, and immunoturbidimetry was used to detect the levels of serum D-D and PA; the receiver operating characteristic (ROC) curve was used to analyze the value of combined detection of serum D-D, PA and sTREM-1 in diagnosing severe pneumonia in children; the Logistic regression model was used to analyze the effects of serum D-D, PA and sTREM-1 on the occurrence of severe pneumonia.
ResultsThe levels of serum D-D and sTREM-1 at hospital admission in the common pneumonia group were significantly lower than those in the severe pneumonia group, while the level of serum PA was significantly higher than that in the severe pneumonia group (P < 0.05). Values of the area under the curve (AUC) of serum D-D, PA, sTREM-1 and their combined detection for diagnosis of severe pneumonia in children were 0.849, 0.858, 0.833 and 0.986 respectively. After treatment in hospital, the levels of D-D and sTREM-1 in the survival subgroup significantly gradually decreased, while the level of serum PA significantly gradually increased (P < 0.01); the levels of D-D and sTREM-1 in the death subgroup gradually increased after treatment in hospital, while the level of serum PA gradually decreased (P < 0.01). At the time points of hospital admission, 3 days after admission and 1 week after admission, the serum D-D and sTREM-1 levels in the death subgroup were significantly higher than those in the survival subgroup, while the serum PA levels were significantly lower than that in the survival subgroup (P < 0.01). The increased sTREM-1 was an independent risk factor for occurrence of severe pneumonia (P < 0.05).
ConclusionIn the children with severe pneumonia, the levels of serum D-D and sTREM-1 increase, while the level of PA decreases, and the combined detection of the three indicators can not only increase the early diagnosis rate of severe pneumonia, but also guide the efficacy evaluation.
-
多发性骨髓瘤(MM)是一种血液系统恶性肿瘤,也是一种起源于骨髓浆细胞的淋巴瘤疾病[1]。MM的主要临床表现为浆细胞的恶性增殖、单克隆免疫球蛋白异常升高[2]。MM早期症状并不明显,发病早期常被诊断为骨科疾病,多数患者确诊时已为晚期,严重影响治疗效果[3]。此外,该疾病多发于老年群体,治疗后生存率较低[4]。血清或者血浆中的微小RNA(miRNA)是近年来用于临床诊断的非编码RNA, 研究[5]指出miRNA参与了MM的发病过程,发挥关键调控作用。微小RNA-625(miR-625)可调节肿瘤细胞自噬、增殖和凋亡,并参与多种肿瘤的发病过程[6-7]。研究[8]指出,血清miR-625表达下调会促进肿瘤细胞的增殖、分化,加速癌症进展。研究[9]指出,过表达微小RNA-203(miR-203)可显著降低食管癌细胞的增殖、迁移和侵袭能力,且miR-203是一种食管癌患者预后的标志物。miR-203在宫颈癌、胃癌等肿瘤中表达下调,是一种有价值的预后标志物[10]。本研究分析血清miR-625、miR-203在不同诊疗状况、不同分期MM中的水平变化及临床诊断价值,现将结果报告如下。
1. 资料与方法
1.1 一般资料
选取2021年6月—2023年8月在本院治疗的103例确诊MM患者为观察组,男54例,女49例,年龄45~65岁,平均(53.47±6.32)岁。根据多发性骨髓瘤国际分期体系(ISS)[11]分为Ⅰ期(n=23)、Ⅱ期(n=31)和Ⅲ期(n=49)。骨病分级依据CT影像检查及《中国多发性骨髓瘤诊治指南》[12]中相关标准: 1~2级是指患者存在严重弥漫性骨质疏松及1个解剖学部位出现多个溶骨性损害; 3~4级是指患者多个解剖学部位存在骨性损害或严重溶骨性损害并发病理性骨折。按照诊疗情况将103例患者分为初诊组(n=75)和复发组(n=28)。纳入标准: ①符合MM诊断标准者[12]; ②临床资料完整者; ③依从性较强者; ④患者及家属知情同意。排除标准: ①合并精神疾病者; ②伴有免疫疾病或血液疾病者; ③伴有心、肝严重损伤者。另选取103例同期本院体检健康者为对照组,男48例,女55例,年龄45~65岁,平均(52.67±5.82)岁。本研究经本院伦理委员会批准。
1.2 方法
1.2.1 临床资料收集
收集观察组与对照组患者的一般临床资料,资料来源为医院电子病历信息系统和实验室检测数据,主要包括年龄、性别、体质量指数(BMI)、血肌酐、尿素氮、M蛋白、血红蛋白、血清β2微球蛋白、白蛋白和血清钙水平。
1.2.2 血清miR-625、miR-203的检测
采集MM患者入院第2天清晨、健康者体检时的空腹静脉血5 mL, 2 000 r/min离心15 min获得血清,采用逆转录-实时定量聚合酶链反应(RT-qPCR)检测血清miR-625、miR-203的表达水平。采用RNA提取试剂盒(赛默飞世尔科技公司,货号12183555), 加入Trizol试剂,提取总RNA后,反转录获得cDNA, 采用RT-qPCR仪(赛默飞世尔科技公司,型号Biomek i7 Automated Workstation)进行扩增,使用20 μL反应体系: 10 μL 2×SYBR Green qPCR Mix(赛默飞世尔科技公司,货号: K0222), 0.5 μL上、下游引物(10 μmol/L), 2 μL cDNA(50 ng/μL), 加ddH2O至20 μL。以 U6 为内参基因, U6 上游引物为5′-GCTACGGAGTGATAACTAAT-3′, 下游引物为5′-CGCTGCACG TAAAGCGTCAT-3′。miR-625的上游引物为5′-C CAGGCGATATAGTCC-3′, 下游引物为5′-CGCTT CACCTATAAGTCTCG-3′; miR-203的上游引物为5′-GUGAAAUGUUUAGGACCACUAG-3′, 下游引物为5′-CCAGUGGUUCUUAACAGUUCAAC-3′; 采用2-△△CT法计算miR-625、miR-203表达水平。
1.3 统计学分析
采用SPSS 25.0软件进行数据分析,计量资料符合正态分布,采用(x±s)表示,组间比较采用独立样本t检验,多组比较采用单因素方差分析,进一步两两比较采用SNK-q检验; 计数资料采用[n(%)]表示,比较采用检验,采用多因素Logistic模型分析MM的影响因素; 采用受试者工作特征(ROC)曲线分析血清miR-625、miR-203诊断MM的临床价值,曲线下面积(AUC)比较采用Z检验。P < 0.05为差异有统计学意义。
2. 结果
2.1 对照组与观察组血清miR-625、miR-203水平和临床资料比较
观察组和对照组性别、年龄、BMI比较,差异无统计学意义(P>0.05); 观察组M蛋白、血红蛋白、白蛋白、miR-625和miR-203水平均低于对照组,血肌酐、24 h尿蛋白、尿素氮、血清β2微球蛋白和血清钙水平高于对照组,差异有统计学意义(P < 0.05)。见表 1。
表 1 对照组、观察组血清miR-625、miR-203水平和临床资料比较(x±s)[n(%)]临床病理特征 观察组(n=103) 对照组(n=103) t/χ2 P 性别 男 54(52.43) 48(46.60) 0.699 0.403 女 49(47.57) 55(53.40) 年龄 < 50岁 47(45.63) 51(49.51) 0.311 0.577 ≥50岁 56(54.37) 52(50.49) 体质量指数/(kg/m2) 23.16±3.24 22.94±3.38 0.477 0.634 血肌酐/(mg/dL) 1.86±0.33 0.87±0.21 25.687 < 0.001 24 h尿蛋白/mg 155.84±18.72 125.65±13.15 9.916 < 0.001 尿素氮/(mg/dL) 23.22±3.24 14.35±2.18 15.791 < 0.001 M蛋白/(g/L) 25.33±2.89 38.72±4.01 19.690 < 0.001 血红蛋白/(g/L) 92.50±10.72 115.43±12.65 9.950 < 0.001 血清β2微球蛋白/(mg/L) 4.62±1.02 1.36±0.19 21.135 < 0.001 白蛋白/(g/L) 31.54±4.25 48.36±5.38 17.731 < 0.001 血清钙/(mg/dL) 11.26±1.19 9.83±1.01 9.576 < 0.001 微小RNA-625 0.71±0.19 1.01±0.30 8.574 < 0.001 微小RNA-203 0.56±0.14 0.98±0.31 12.531 < 0.001 2.2 初诊组与复发组血清miR-625、miR-203水平比较
初诊组血清miR-625、miR-203水平分别为(0.79±0.16)、(0.61±0.10), 高于复发组的(0.51±0.09)、(0.44±0.13), 差异有统计学意义(t=8.741、7.053, P < 0.05)。
2.3 不同ISS分期患者血清miR-625、miR-203水平比较
ISS分期Ⅱ期、Ⅲ期的MM患者血清miR-625、miR-203水平均低于Ⅰ期MM患者, ISS分期Ⅲ期的MM患者血清miR-625、miR-203水平均低于Ⅱ期MM患者,差异均有统计学意义(P < 0.05), 见表 2。
表 2 不同ISS分期患者血清miR-625、miR-203水平比较(x±s)ISS分期 n 微小RNA-625 微小RNA-203 Ⅰ期 23 0.83±0.16 0.72±0.21 Ⅱ期 31 0.76±0.13* 0.59±0.15* Ⅲ期 49 0.63±0.09*# 0.47±0.11*# 与Ⅰ期比较, * P < 0.05; 与Ⅱ期比较, #P < 0.05。 2.4 血清miR-625、miR-203表达与患者临床病理特征的关系
不同性别、年龄、血肌酐水平、24 h尿蛋白、骨病类型、肿瘤细胞形态的MM患者血清miR-625、miR-203表达比较,差异无统计学意义(P>0.05); 溶骨性病变 < 2个的MM患者血清miR-625与溶骨性病变≥2个的MM患者比较,差异无统计学意义(P>0.05), 溶骨性病变x2个的MM患者血清miR-203高于溶骨性病变≥2个的MM患者,差异有统计学意义(P < 0.05); 骨病分级为1~2级的MM患者血清miR-625水平高于骨病分级为3~4级的MM患者,差异有统计学意义(P < 0.05); 骨病分级为1~2级的MM患者血清miR-203水平与骨病分级为3~4级的MM患者比较,差异无统计学意义(P>0.05)。见表 3。
表 3 血清miR-625、miR-203表达与患者临床病理特征的关系(x±s)临床病理特征 分类 n 微小RNA-625 微小RNA-203 性别 男 54 0.71±0.18 0.58±0.11 女 49 0.72±0.15 0.54±0.14 年龄 < 50岁 47 0.68±0.21 0.57±0.13 ≥50岁 56 0.74±0.19 0.56±0.08 血肌酐 < 2.00 mg/dL 42 0.73±0.21 0.58±0.15 ≥2.00 mg/dL 61 0.69±0.17 0.55±0.13 24 h尿蛋白 ≤150 mg 57 0.69±0.20 0.55±0.08 >150 mg 46 0.74±0.23 0.57±0.09 溶骨性病变 < 2个 65 0.72±0.12 0.59±0.09* ≥2个 38 0.70±0.16 0.51±0.12 骨病类型 骨质疏松 48 0.73±0.14 0.58±0.13 溶骨性破坏 27 0.69±0.17 0.57±0.14 病理性骨折 25 0.68±0.15 0.53±0.08 其他 3 0.66±0.11 0.51±0.09 骨病分级 1~2级 58 0.76±0.13# 0.58±0.11 3~4级 45 0.65±0.09 0.54±0.12 肿瘤细胞形态 成熟浆细胞 58 0.70±0.11 0.57±0.08 原幼浆细胞 45 0.73±0.09 0.54±0.10 ≥2个溶骨性病变比较, * P < 0.05;
与骨病分级1~2级比较, #P < 0.05。2.5 多因素Logistic分析MM发生的影响因素
以MM为因变量(是=1, 否=0), 以血肌酐(实测值)、miR-625(实测值)、miR-203(实测值)为自变量,多因素Logistic分析显示miR-625、miR-203是MM的保护因素(P < 0.05), 见表 4。
表 4 多因素Logistic分析MM发生的影响因素影响因素 β SE Wald P OR 95%CI 血肌酐 0.226 0.246 0.847 0.357 1.254 0.774~2.031 微小RNA-625 -0.483 0.227 4.525 0.033 0.617 0.395~0.963 微小RNA-203 -0.627 0.261 5.778 0.016 0.534 0.320~0.891 2.6 血清miR-625、miR-203表达水平对MM的诊断价值
血清miR-625诊断MM的AUC为0.808, 敏感度为85.44%, 特异度为66.99%, 最佳截断值为0.86; 血清miR-203诊断MM的AUC为0.866, 敏感度为89.32%, 特异度为75.73%, 最佳截断值为0.73; 血清miR-625与miR-203联合诊断的AUC为0.919, 敏感度为76.70%, 特异度为95.10%,二者联合诊断优于血清miR-625、miR-203各自单独诊断(Z二者联合-miR-625=3.816, P=0.001; Z二者联合-miR-203=2.157, P=0.031), 见图 1。
3. 讨论
MM的发病率和病死率均占全球癌症发病率和病死率的1%左右[13-15]。MM是浆细胞恶性克隆且无法治愈的肿瘤疾病[16]。研究[17]认为MM的发生与遗传、辐射、病毒感染等因素有关。目前MM的主要治疗方法有化疗、造血干细胞移植、蛋白酶体抑制剂及免疫调节剂等,但由于该病前期症状不明显,多数患者均在晚期确诊,导致治疗效果及预后不佳[18-19]。
研究[20]指出, miR-625参与细胞增殖、侵袭、迁移、凋亡、细胞周期调节和耐药等多种生物学过程,且在癌症诊断、治疗和预后方面存在潜在价值。牛媛等[21]研究指出, miR-625在MM小鼠细胞中高表达,通过调控RAS通路影响小鼠生物学行为,与本研究结果相反,其原因可能是小鼠细胞与人类细胞存在差异。MM与白血病均为血癌,ALIABEDI B等[22]研究指出,白血病中过表达miR-625可通过Integrin-linked kinase信号通路降低急性髓系白血病细胞的肿瘤发生。CHEN S[23]指出,过表达miR-625可通过与LINC00852结合靶向E2F1, 抑制肝癌细胞的增殖。本研究发现, MM患者的血清miR-625水平低于健康志愿者,这可能是因为miR-625表达下调促进了MM致癌细胞因子的表达,促进MM细胞增殖和迁移; 初诊组MM患者血清miR-625水平高于复发组,提示检测miR-625的表达水平可以及时判断MM患者的复发情况; ISS分期Ⅱ期、Ⅲ期血清miR-625水平均低于Ⅰ期,Ⅲ期血清miR-625水平低于Ⅱ期,表明miR-625水平与MM病情进展相关,可能会促进MM患者的浆细胞恶性增殖,进而导致患者骨质遭到破坏,加重MM病情。
miR-203是多能干细胞分化的强驱动因子,可促进肿瘤细胞的分化[24]。GUPTA N等[25]研究发现, MM患者miR-203相对表达显著降低,且与MM的相关参数显著相关,与病情严重程度呈负相关。徐成波等[26]指出, miR-203在MM中低表达,可导致CREB1表达上调促进MM的病情进展。本研究发现, MM患者的血清miR-203水平低于健康志愿者,这可能是因为miR-203表达下调可靶向CREB1表达上调,促进浆细胞增殖,进而导致MM的发生与发展; 初诊组MM患者血清miR-203水平高于复发组,提示检测miR-203的表达水平可了解MM患者复发情况; ISS分期Ⅱ期、Ⅲ期血清miR-203水平均低于Ⅰ期, Ⅲ期血清miR-203水平低于Ⅱ期,表明miR-203在DNA中高甲基化且呈现低表达,会导致患者骨髓微环境变化,升高患者骨病分级,破坏骨质,加重MM病情。本研究采用Logistic回归分析发现miR-625、miR-203是MM的独立保护因素,提示miR-625、miR-203与MM的发病有紧密联系; 血清miR-625、miR-203诊断MM的AUC分别0.808、0.866, 截断值分别为0.86、0.73, 二者联合诊断预测的AUC为0.919, 表明二者对MM均有一定的诊断价值,且联合诊断的效能高于二者单独诊断。
综上所述, MM患者血清miR-625、miR-203水平下降,且与患者病情关系密切; miR-625联合miR-203对MM具有较高的诊断价值,其可作为诊断MM的标志物。
-
表 1 普通肺炎组与重症肺炎组患儿入院时一般资料比较(x±s)[n(%)]
组别 n 年龄/岁 性别 体质量/kg 发病至入院时间/d 男 女 普通肺炎组 35 4.72±0.85 18(51.43) 17(48.57) 14.89±1.74 3.89±0.62 重症肺炎组 35 4.70±0.92 16(45.71) 19(54.29) 15.02±1.91 3.92±0.58 表 2 普通肺炎组与重症肺炎组患儿入院时血清D-D、PA、sTREM-1水平比较(x±s)
组别 n D-D/(μg/mL) PA/(mg/L) sTREM-1/(pg/mL) 普通肺炎组 35 2.14±0.69 167.42±23.66 40.96±13.28 重症肺炎组 35 3.96±1.29* 130.75±18.95* 65.45±16.73* D-D: D-二聚体; PA: 前白蛋白; sTREM-1: 可溶性髓系细胞触发受体-1。与普通肺炎组比较, *P < 0.05。 表 3 死亡亚组与存活亚组治疗前后血清D-D、PA、sTREM-1水平比较(x±s)
指标 组别 入院时 入院3 d 入院1周 D-D/(μg/mL) 存活亚组(n=30) 3.48±1.04 2.82±0.45** 2.44±0.31**## 死亡亚组(n=5) 6.83±1.16△△ 8.44±1.08**△△ 10.22±1.20**##△△ PA/(mg/L) 存活亚组(n=30) 140.28±19.74 150.36±12.15** 160.84±10.21**## 死亡亚组(n=5) 73.59±15.33△△ 56.24±12.17**△△ 38.72±9.62**##△△ sTREM-1/(pg/mL) 存活亚组(n=30) 60.37±15.84 50.17±12.06** 40.99±10.10**## 死亡亚组(n=5) 95.93±18.49△△ 119.32±15.03**△△ 149.69±15.28**##△△ D-D: D-二聚体; PA: 前白蛋白; sTREM-1: 可溶性髓系细胞触发受体-1。
与入院时比较, **P < 0.01; 与入院3 d比较, ##P < 0.01; 与存活亚组比较, △△P < 0.01。表 4 血清D-D、PA、sTREM-1影响重症肺炎发生的Logistic回归分析
影响因素 B SE Wald P OR 95%CI D-D 0.041 0.105 0.154 0.695 1.042 0.848~1.280 PA 0.102 0.115 0.781 0.377 1.107 0.884~1.387 sTREM-1 0.899 0.298 9.092 0.003 2.456 1.370~4.404 D-D: D-二聚体; PA: 前白蛋白; sTREM-1: 可溶性髓系细胞触发受体-1。 -
[1] 许惠敏, 马永涛, 李杰. 重症肺炎儿童患者痰液中的细菌构成及其临床意义[J]. 中国儿童保健杂志, 2020, 28(1): 93-96. https://www.cnki.com.cn/Article/CJFDTOTAL-ERTO202001027.htm [2] 李曼. 老年人肺部感染的血培养和痰培养分析[J]. 中国社区医师, 2020, 36(15): 120-121. https://www.cnki.com.cn/Article/CJFDTOTAL-XCYS202015073.htm [3] HOWIE S R C, EBRUKE B E, MCLELLAN J L, et al. The etiology of childhood pneumonia in the Gambia: findings from the pneumonia etiology research for child health (PERCH) study[J]. Pediatr Infect Dis J, 2021, 40(9S): S7-S17. doi: 10.1097/INF.0000000000002766
[4] GARCIA-OLIVÉ I, SINTES H, RADUA J, et al. Predicting pulmonary embolism in patients infected with COVID-19 based on D-dimer levels and days between diagnosis of the infection and D-dimer determination[J]. Arch Monaldi Le Malattie Del Torace, 2021, 91(2): 1-13.
[5] 石芳. 血清淀粉样蛋白A、C反应蛋白与前白蛋白比值诊断慢性阻塞性肺疾病急性加重期合并下呼吸道感染的价值[J]. 实用临床医药杂志, 2020, 24(19): 22-25. doi: 10.7619/jcmp.202019007 [6] FANG C C, MAO Y Y, JIANG M F, et al. Serum sTREM-1 and CXCL-16 levels in children with Mycoplasma pneumoniae pneumonia and their diagnostic value[J]. Evid Based Complement Alternat Med, 2021, 2021: 7179796.
[7] 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013修订)(下)[J]. 中华儿科杂志, 2013, 51(11): 856-862. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHFY201406007.htm [8] 张衡. 小儿早期预警评分在小儿重症肺炎病情评估中的价值及护理管理对策[J]. 医学理论与实践, 2019, 32(6): 910-911. https://www.cnki.com.cn/Article/CJFDTOTAL-YXLL201906075.htm [9] 郭正平, 张红. 纤维支气管镜肺泡灌洗对重症肺炎患儿炎症及血气指标的影响[J]. 实用临床医药杂志, 2020, 24(1): 50-53. doi: 10.7619/jcmp.202001013 [10] 胡亮, 罗勇, 丁绍华. 不同药物联合治疗重症肺炎患儿后对其免疫功能和炎症因子的影响分析[J]. 当代医学, 2020, 26(6): 178-179. https://www.cnki.com.cn/Article/CJFDTOTAL-DDYI202006074.htm [11] DEAN P, FLORIN T A. Factors associated with pneumonia severity in children: a systematic review[J]. J Pediatric Infect Dis Soc, 2018, 7(4): 323-334.
[12] 王玉连. 观察血小板计数、平均血小板体积与D-二聚体水平变化在重症肺炎患者诊断中的意义[J]. 临床医药文献电子杂志, 2019, 6(A4): 136-136, 166. https://www.cnki.com.cn/Article/CJFDTOTAL-LCWX2019A4090.htm [13] ELJILANY I, ELZOUKI A N. D-dimer, fibrinogen, and IL-6 in COVID-19 patients with suspected venous thromboembolism: a narrative review[J]. Vasc Health Risk Manag, 2020, 16: 455-462.
[14] 郭健, 汤瑾, 朱亮, 等. 重症肺炎患者中医证型与氧合指数、乳酸、D-二聚体的关系研究[J]. 实用临床医药杂志, 2021, 25(1): 81-84. doi: 10.7619/jcmp.20200734 [15] 宁利佳, 袁雪. 儿童重症肺炎凝血指标与免疫指标及危重评分的相关性分析[J]. 血栓与止血学, 2020, 26(5): 823-824. https://www.cnki.com.cn/Article/CJFDTOTAL-XSZX202005040.htm [16] LI Y L, SUN Y B, HE J, et al. Preliminary study on relationships among nutritional risk, serum prealbumin, and peripheral blood T cell subsets in patients with severe COVID-19[J]. Infect Dis (Lond), 2021, 53(1): 69-71.
[17] DUAN J, WANG X H, CHI J, et al. Correlation between the variables collected at admission and progression to severe cases during hospitalization among patients with COVID-19 in Chongqing[J]. J Med Virol, 2020, 92(11): 2616-2622.
[18] 赵纪维, 琚国文, 白丽梅. sTREM-1、IL-17、PCT及PA联合检测在重症肺炎中的诊断价值[J]. 中国现代医生, 2018, 56(3): 34-37. https://www.cnki.com.cn/Article/CJFDTOTAL-ZDYS201803011.htm [19] WANG Y H, ZHANG S, LI L, et al. The usefulness of serum procalcitonin, C-reactive protein, soluble triggering receptor expressed on myeloid cells 1 and Clinical Pulmonary Infection Score for evaluation of severity and prognosis of community-acquired pneumonia in elderly patients[J]. Arch Gerontol Geriatr, 2019, 80: 53-57.




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号