Establishment and value of a diagnostic model for gastric precancerous lesions based on hematological indicators
-
摘要:目的
构建基于多个血液学指标的胃癌前病变(GPL)诊断模型,探讨其临床诊断效能。
方法纳入经上消化道肿瘤筛查确诊GPL的1 142例受试者,同时以1 222例正常或浅表性胃炎的受试者作为对照。采用Rand随机函数将所有受试者按7∶3的比例分为训练组(1 655例,其中GPL者779例,对照者876例)和验证组(709例,其中GPL者363例,对照者346例)。比较训练组中GPL患者与对照者的临床特征和实验室指标; 绘制受试者工作特征(ROC)曲线,获得GPL相关危险因素的诊断效能及最佳临界值,建立诊断模型。采用Hosmer-Lemeshow检验评估模型的拟合度,通过验证组进行内部验证; 采用曲线下面积(AUC)评估诊断模型的区分度。
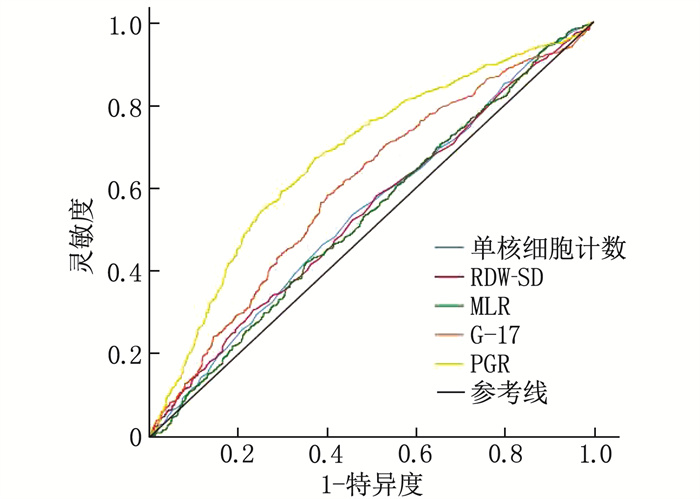
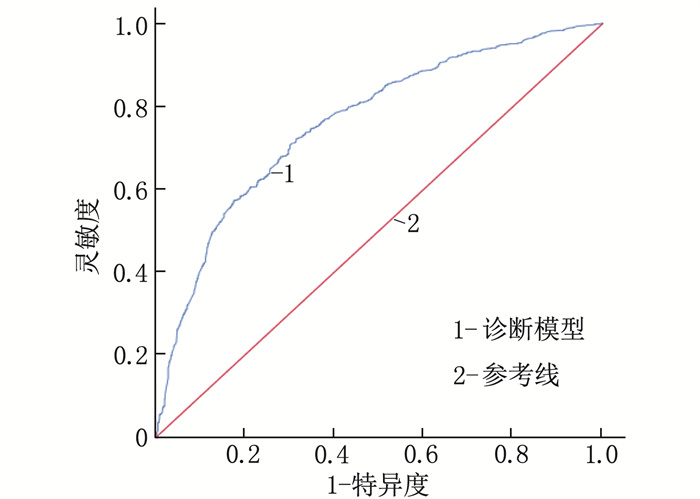
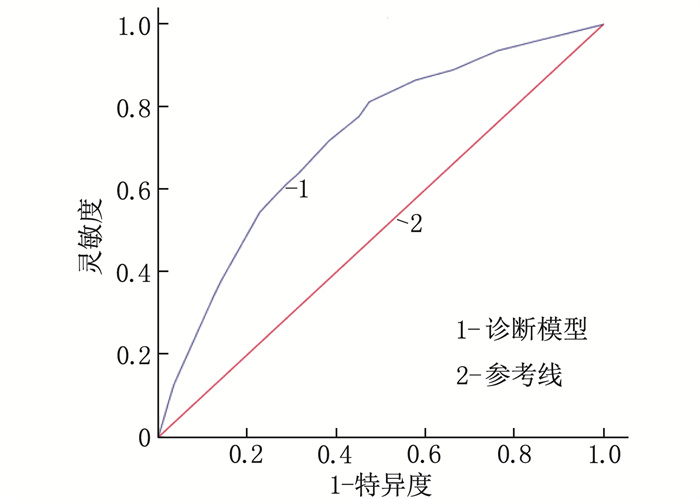
结果训练组中,男性、有吸烟史、饮酒史和幽门螺杆菌(H.pylori)感染史的受试者更易出现GPL, 而对照者进食速度更快、更易出现消化不良症状和胃病史,差异有统计学意义(P < 0.05); GPL组的单核细胞计数、红细胞分布宽度标准差(RDW-SD)、单核细胞与淋巴细胞比值(MLR)、血清胃泌素-17(G-17)最佳临界值依次为0.34×109/L、46.55 fL、0.23、3.98 pmol/L, 均高于对照组,差异有统计学意义(P < 0.05); GPL组胃蛋白酶原Ⅰ与胃蛋白酶原Ⅱ比值(PGR)的最佳临界值为11.80, 低于对照组,差异有统计学意义(P < 0.05)。多因素回归分析显示,具有H.pylori感染史、RDW-SD>46.55 fL、PGR < 11.80和G-17>3.98 pmol/L是GPL的独立危险因素(P < 0.001)。在训练组中,诊断模型的AUC=0.762(95%CI: 0.739~0.785, P < 0.001), 灵敏度为72.2%, 特异度为68.5%。将该模型应用于验证组进行内部验证,结果显示模型的AUC=0.719(95%CI: 0.681~0.756, P < 0.001), 灵敏度为81.3%, 特异度为52.6%, 提示该模型的区分能力较好。Hosmer-Lemeshow检验提示模型的拟合优度较好。
结论基于RDW、PGR、G-17和H.pylori感染史建立的GPL诊断模型具有较好的区分度和校准度,可以帮助早期识别GPL患者。
Abstract:ObjectiveTo establish a diagnostic model for gastric precancerous lesions (GPL) based on multiple hematological indicators, and to explore its clinical diagnostic efficiency.
MethodsA total of 1 142 subjects diagnosed as GPL by upper gastrointestinal cancer screening were enrolled, and 1 222 healthy subjects or patients with superficial gastritis were enrolled as controls. All the subjects were divided into training group (n=1 655, including 779 GPL cases and 876 controls) and validation group (n=709, including 363 GPL cases and 346 controls) at a ratio of 7 to 3 by Rand random function. Clinical characteristics and laboratory parameters were compared between GLP patients and controls in the training group; the receiver operator characteristic curve (ROC) was drawn to obtain the diagnostic efficacy and optimal threshold valuesfor GPL related risk factors, and the diagnostic model was established. The Hosmer-Lemeshow test was used to evaluate the fit of the model, and internal validation was performed through the validation group; the discrimination of the diagnostic model was evaluated by area under the curve (AUC).
ResultsIn the training group, patients with gender of male, a history of smoking, a history of drinking and a history of H.pylori infection were more likely to develop GPL, while the controls were faster in eating, had more digestive symptoms and history of stomach disease (P < 0.05). The optimal cut-off values of monocyte count, standard deviation of red blood cell distribution width (RDW-SD), monocyte-to-lymphocyte ratio (MLR), and serum gastrin-17 (G-17) were 0.34×109/L, 46.55 fL, 0.23, 3.98 pmol/L, respectively in the GPL group, which were higher than those of the control group (P < 0.05). The optimal cut-off value of pepsinogen Ⅰ-to-pepsinogen Ⅱ ratio (PGR) was 11.80 in the GPL group, which was significantly lower than that in the control group (P < 0.05). Multivariate regression analysis showed that a history of H.pylori infection, RDW-SD>46.55 fL, PGR < 11.80 and G-17>3.98 pmol/L were independent risk factors for GPL (P < 0.001). In the training cohort, the diagnostic model had an AUC of 0.762 (95%CI, 0.739 to 0.785; P < 0.001), sensitivity of 72.2%, and specificity of 68.5%. Validation of this model using the validation cohort showed that the model had an AUC of 0.719 (95%CI, 0.681 to 0.756; P < 0.001), sensitivity of 81.3%, and specificity of 52.6%, suggesting that the model had good discriminatory ability. The Hosmer-Lemeshow test indicated that the model had a good fitting.
ConclusionThe diagnostic model for GPL established based on RDW, PGR, G-17 and a history of H.pylori infection has good discrimination and calibration, and is a useful tool for the early identification of GPL patients.
-
目前,冠心病诊断的“金标准”是冠状动脉造影(CAG),临床中多依据CAG评估患者冠状动脉狭窄程度,并结合患者临床资料决定是否行介入治疗。但CAG难以对狭窄病变导致的心肌缺血情况进行评估,且受多种因素影响,导致其在评估冠状动脉狭窄程度上存在一定的局限性,特别是对于狭窄程度50%~70%的临界病变准确性较低[1]。临界病变治疗方案选择需结合斑块稳定性及是否导致心肌缺血来综合评估,明确斑块性质及血流动力学对治疗方案的选择尤为重要[2]。血管内超声(IVUS)及血流储备分数(FFR)是临界病变治疗方案选择的重要参考依据,其中IVUS是评估斑块稳定性的检查手段,而FFR是评估是否导致心肌缺血的检查手段[3-4]。本研究回顾性分析65例非ST段抬高型急性冠状动脉综合征(NSTE-ACS)患者临床资料,比较IUVS、FFR指导下的PCI对临界病变患者血浆脑钠肽(BNP)、超敏C反应蛋白(hs-CRP)水平及主要不良心血管事件(MACE)的影响,现报告如下。
1. 资料与方法
1.1 一般资料
回顾性分析2018年1月—2020年1月本院收治的65例行经皮冠状动脉介入(PCI)治疗的NSTE-ACS临界病变(冠状动脉狭窄50%~70%, 单支血管病变,直径≥2.5 mm)患者的临床资料,其中男40例,女25例,年龄55~75岁,平均(65.67±8.04)岁。纳入标准: ①患者均符合《非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)》[5]中的相关诊断标准,且经CAG确诊为临界病变; ②可行PCI治疗者; ③患者或其家属知情。排除标准: ①合并严重心、肝、肾等脏器功能障碍者; ②合并弥漫性病变、左主干病变、多支血管病变等复杂病变者; ③存在PCI禁忌或IUVS、FFR检查禁忌者; ④ ST段抬高型急性心肌梗死者; ⑤既往PCI史者; ⑥合并恶性肿瘤者; ⑦预计生存期 < 1年者。根据PCI指导方式分为IVUS组33例和FFR组32例。
1.2 方法
依据Judkins法穿刺桡动脉或股动脉行CAG检查,根据患者病变部位获取全方位、多角度的造影图像,准确判断患者冠状动脉病变长度、部位、狭窄程度及血管壁状况。
IVUS组: CAG检查结束后,顺导丝置入超声导管于狭窄血管远端,以手动或自动方式缓慢(1 mm/s)回撤超声导管,超声导管前端探头获取、储存、分析血管横截面图像,并测定最小管腔面积(MLA),评估斑块性质。回撤过程中标记感兴趣重要血管解剖部位,以确定狭窄病变部位。根据MLA值及斑块性质确定PCI术中支架长度及直径。
FFR组: CAG检查结束及体外校正压力导丝完毕后,沿指引导管及导引针置入压力传感器于冠状动脉开口处,X线透视下确定压力传感器位置正确后校零,并送压力导丝进入冠状动脉病变部,将导丝上携带压力感受器置于距冠状动脉病变部远端2~3 cm处,前臂正中静脉持续泵注三磷酸腺苷(ATP), 直至冠状动脉微血管充血扩张至最大状态,动脉检测仪显示屏上即可显示FFR值,待FFR值稳定后取最小值作为最终结果。
1.3 观察指标
比较2组患者PCI情况及手术前后血浆BNP、hs-CRP水平。入院即刻和PCI术后7 d时抽取2组患者肘静脉血3 mL, 置于EDTA抗凝管, -70 ℃冷存待检。采用酶联免疫吸附法(ELISA)检测待测样本中的BNP、hs-CRP水平,试剂盒购自上海酶联生物科技有限公司,严格按照试剂盒说明书进行操作。术后随访12个月,比较2组患者MACE发生情况。
1.4 统计学方法
采用SPSS 22.0软件处理数据,计数资料以[n(%)]表示,组间差异采用Fisher确切概率分析检验; 正态分布的计量资料以(x±s)表示,组间差异采用独立样本t检验,组内治疗前后差异采用配对样本t检验。P < 0.05表示差异有统计学意义。
2. 结果
2.1 2组患者基线资料比较
2组患者性别、年龄、体质量指数(BMI)、高血压史、高脂血症史、糖尿病史、吸烟史、心肌梗死史、心率、左室射血分数(LVEF)等基线资料比较,差异均无统计学意义(P>0.05), 见表 1。
表 1 2组患者基线资料比较(x±s)[n(%)]基线资料 IVUS组(n=33) FFR组(n=32) 男 21(63.64) 19(59.38) 女 12(36.36) 13(40.63) 年龄/岁 65.71±8.06 65.63±8.19 体质量指数/(kg/m2) 23.74±2.09 23.88±2.36 高血压 15(45.45) 14(43.75) 高脂血症 10(30.30) 11(34.38) 糖尿病 4(12.12) 3(9.38) 吸烟史 6(18.18) 7(21.88) 心肌梗死史 3(9.09) 2(6.25) 心率/(次/min) 87.76±8.95 89.31±9.42 左室射血分数/% 57.20±7.45 55.05±10.07 2.2 2组患者PCI情况比较
2组患者的病变部位、狭窄程度、病变血管直径、病变长度、支架植入率、支架植入数、PCI相关并发症等比较,差异均无统计学意义(P>0.05), 见表 2。
表 2 2组患者PCI情况比较(x±s)[n(%)]指标 IVUS组(n=33) FFR组(n=32) 病变部位 左前降支 17(51.52) 20(62.50) 左回旋支 6(18.18) 4(12.50) 右冠状动脉 10(30.30) 8(25.00) 狭窄程度/% 62.61±5.05 60.26±7.51 病变血管直径/mm 3.58±0.74 3.31±0.55 病变长度/mm 20.23±6.83 21.51±7.01 支架植入 18(54.55) 12(37.50) 支架植入数/个 1.45±0.44 1.60±0.51 PCI相关并发症 3(9.09) 1(3.13) 2.3 2组患者手术前后血浆BNP、hs-CRP水平比较
2组患者入院即刻的血浆BNP、hs-CRP水平比较,差异无统计学意义(P>0.05); 2组患者术后7 d的血浆BNP、hs-CRP水平均低于入院即刻,且IVUS组低于FFR组,差异有统计学意义(P < 0.05), 见表 3。
表 3 2组患者手术前后血浆BNP、hs-CRP水平比较(x±s)组别 时点 BNP/(ng/L) hs-CRP/(mg/L) IVUS组(n=33) 入院即刻 159.43±33.48 11.48±3.45 术后7 d 118.66±24.39*# 7.45±2.36*# FFR组(n=32) 入院即刻 161.38±35.35 11.69±3.34 术后7 d 133.52±28.89* 9.52±2.94* BNP: 脑钠肽; hs-CRP: 超敏C反应蛋白。
与入院即刻比较, *P < 0.05; 与FFR组比较, #P < 0.05。2.4 2组患者MACE发生情况比较
2组患者MACE发生情况及复发性心绞痛比较,差异无统计学意义(P>0.05), 见表 4。
表 4 2组患者MACE发生情况比较[n(%)]组别 IVUS组(n=33) FFR组(n=32) 靶血管血运重建 5(15.15) 3(9.38) 非致死性心肌梗死 1(3.03) 1(3.13) 心源性死亡 0 1(3.13) 复发性心绞痛 2(6.06) 3(9.38) MACE 6(18.18) 5(15.63) 心源性死亡采用Fisher确切概率分析;
复发性心绞痛不属于MACE; MACE: 主要不良心血管事件。3. 讨论
研究[7]显示,冠状动脉狭窄程度在50%~70%的临界病变通常是不会导致心肌缺血,但少数临界病变会引发心肌缺血甚至急性冠状动脉综合征,这些病变斑块稳定性较差,易破裂形成血栓。因此,病变稳定性对患者预后影响程度大于病变狭窄程度。目前,针对临界病变治疗策略存在较大分歧,研究[8]认为临界病变存在心肌缺血、心绞痛等证据时,主张行PCI治疗,若缺少心肌缺血证据时,则需行冠状动脉影像学检查以指导选择治疗方案。
CAG是冠心病诊断的“金标准”,但不能准确判断临界病变。IVUS、FFR技术的运用在较大程度上弥补了CAG不足,使临床医师对临界病变的斑块性质及血流动力学判断更为准确[9]。FFR是评估冠状动脉狭窄是否导致心肌缺血的重要方法,已被多个指南纳入并推荐作为指导、评估PCI的方法之一,特别对临界病变的血运重建治疗方案选择具有重要指导价值。FFR局限性是当患者处于急性心肌梗死、左心室肥厚、严重微循环障碍、冠状动脉痉挛、侧支循环等病理生理状态下时,难以评估病变血管的血流动力学,且活性药物存在一定不良反应[10]。IVUS可清晰显示冠状动脉管腔并精确定位病变部位,弥补CAG在狭窄程度、病变范围评估等方面的不足。国外研究[11]表明, IVUS指导临界病变血运重建标志为MLA≤4.0 mm2, 敏感度、特异度分别为88%、90%。本研究沿用此标准, MLA≤4.0 mm2的患者则行PCI治疗,反之则行药物治疗。
本研究结果表明, IVUS组及FFR组在病变部位、狭窄程度、病变血管直径、病变长度、支架植入率、支架植入数、PCI相关并发症等方面差异无统计学意义(P>0.05), 提示2种技术均可准确反映临界病变冠状动脉情况,但IVUS组支架植入率相对更高。BNP是一种多肽类激素,心肌缺血、左心室容量和压力负荷增大时,血浆BNP水平会显著升高。BNP具有重要的病理生理学意义,可以促进排钠、排尿,具有较强的舒张血管作用,可对抗肾素-血管紧张素-醛固酮系统(RAAS)的缩血管作用[12-13]。CRP是一种急性时相蛋白,其本身直接参与了炎症与动脉粥样硬化等心血管疾病过程,是心血管疾病最强有力的预示因子与危险因子。研究[14-15]证实hs-CRP与冠状动脉斑块稳定性密切相关。本研究中,2组患者入院时血浆BNP、hs-CRP均高于正常值,提示机体处于心肌缺血及高炎症状态,而2组术后7 d血浆BNP、hs-CRP均降低,且IVUS组降低程度更大,提示IVUS指导PCI治疗NSTE-ACS临界病变可改善患者心肌缺血、炎性反应。此外,术后随访12个月发现,2组患者MACE发生率无差异,表明IVUS指导PCI治疗NSTE-ACS临界病变患者的短期预后与FFR指导PCI治疗无异[16]。
综上所述, IVUS指导PCI治疗NSTE-ACS临界病变可改善患者血浆BNP、hs-CRP水平,且不会增高MACE发生风险。
-
表 1 训练组与验证组的基线资料比较[M(P25, P75)][n(%)]
基线资料 分类 训练组(n=1 655) 验证组(n=709) χ2/Z P 性别 男 660(39.9) 294(41.5) 0.520 0.471 女 995(60.1) 415(58.5) 年龄/岁 56.0(51.0, 65.0) 56.0(50.0, 64.0) -0.926 0.354 体质量指数/(kg/m2) 24.1(22.2, 26.3) 24.0(22.1, 26.1) -0.875 0.381 吸烟史 从不 1 200(72.5) 495(69.8) 1.978 0.372 已戒烟 91(5.5) 46(6.5) 吸烟 364(22.0) 168(23.7) 饮酒史 无 1 362(82.3) 582(82.1) 0.015 0.903 有 293(17.7) 127(17.9) 每日三餐情况 规律 1 443(87.2) 614(86.6) 0.165 0.921 较规律/偶尔不规律 182(11.0) 82(11.6) 经常不规律 30(1.8) 13(1.8) 进食速度 过慢 79(4.8) 33(4.7) 0.647 0.724 正常 1 293(78.1) 564(79.5) 过快 283(17.1) 112(15.8) 进食温度 过冷 41(2.5) 11(1.6) 2.347 0.309 温度适中 1 489(90.0) 649(91.5) 过烫 125(7.5) 49(6.9) 一级亲属癌症家族史 否 1 082(65.4) 471(66.4) 0.245 0.621 是 573(34.6) 238(33.6) H.pylori感染史 无 857(51.8) 363(51.2) 0.068 0.795 有 798(48.2) 346(48.8) 反复的消化不良症状 否 1 212(73.2) 518(73.1) 0.007 0.931 是 443(26.8) 191(26.9) 胃病史 无 1 003(60.6) 456(64.3) 2.894 0.089 有 652(39.4) 253(35.7) 中性粒细胞计数/(×109/L) 3.4(2.8, 4.3) 3.5(2.9, 4.4) 1.706 0.088 淋巴细胞计数/(×109/L) 1.7(1.3, 2.1) 1.7(1.4, 2.1) 1.274 0.202 单核细胞计数/(×109/L) 0.3(0.2, 0.5) 0.3(0.2, 0.5) 0.791 0.429 红细胞计数/(×1012/L) 4.6(4.3, 4.9) 4.6(4.3, 4.9) 0.546 0.585 血小板计数/(×109/L) 161.0(127.0, 201.0) 163.0(128.0, 206.5) 1.098 0.272 红细胞分布宽度标准差/fL 43.7(42.2, 45.8) 43.9(42.2, 45.7) 0.819 0.413 单核细胞与淋巴细胞比值 0.2(0.1, 0.3) 0.2(0.1, 0.3) -0.105 0.916 胃蛋白酶原Ⅰ与胃蛋白酶原Ⅱ比值 11.6(7.2, 16.8) 11.1(7.1, 15.6) -1.565 0.118 血清胃泌素-17/(pmol/L) 3.8(2.0, 8.4) 3.9(2.0, 8.6) 0.805 0.421 表 2 训练组中GPL相关参数的单因素分析[M(P25, P75)][n(%)]
参数 分类 GPL组(n=779) 对照组(n=876) χ2/Z P 性别 男 333(42.7) 327(37.3) 5.049 0.025 女 446(57.3) 549(62.7) 年龄/岁 56.0(51.0, 64.5) 56.0(51.0, 65.0) 0.249 0.803 体质量指数/(kg/m2) 24.0(22.2, 26.0) 24.3(22.3, 26.4) -1.505 0.132 吸烟史 从不 535(68.7) 665(75.9) 11.007 0.004 已戒烟 47(6.0) 44(5.0) 吸烟 197(25.3) 167(19.1) 饮酒史 无 621(79.7) 741(84.6) 6.716 0.010 有 158(20.3) 135(15.4) 每日三餐情况 规律 673(86.4) 770(87.9) 4.734 0.094 较规律/偶尔不规律 86(11.0) 96(11.0) 经常不规律 20(2.6) 10(1.1) 进食速度 过慢 32(4.1) 47(5.4) 7.121 0.028 正常 631(81.0) 662(75.6) 过快 116(14.9) 167(19.0) 进食温度 过冷 20(2.6) 21(2.4) 0.846 0.655 温度适中 705(90.5) 784(89.5) 过烫 54(6.9) 71(8.1) 一级亲属癌症家族史 否 504(64.7) 578(66.0) 0.300 0.584 是 275(35.3) 298(34.0) H.pylori感染史 无 257(33.0) 600(68.5) 208.144 < 0.001 有 522(67.0) 276(31.5) 反复的消化不良症状 否 589(75.6) 623(71.1) 4.243 0.039 是 190(24.4) 253(28.9) 胃病史 无 513(65.9) 490(55.9) 16.986 < 0.001 有 266(34.1) 386(44.1) 中性粒细胞计数/(×109/L) 3.5(2.8, 4.3) 3.4(2.8, 4.2) 1.622 0.105 淋巴细胞计数/(×109/L) 1.7(1.4, 2.1) 1.7(1.3, 2.1) 0.735 0.462 单核细胞计数/(×109/L) 0.3(0.2, 0.5) 0.3(0.2, 0.4) 3.058 0.002 红细胞计数/(×1012/L) 4.6(4.3, 4.9) 4.6(4.3, 4.9) -0.394 0.693 血小板计数/(×109/L) 161.0(127.0, 201.5) 161.0(128.0, 199.0) -0.205 0.837 红细胞分布宽度标准差/fL 43.9(42.3, 46.3) 43.5(42.1, 45.4) 2.884 0.004 单核细胞与淋巴细胞比值 0.2(0.1, 0.3) 0.2(0.1, 0.3) 2.321 0.020 胃蛋白酶原Ⅰ与胃蛋白酶原Ⅱ比值 9.0(6.0, 13.5) 13.8(9.6, 18.7) -12.408 < 0.01 血清胃泌素-17/(pmol/L) 4.7(2.4, 10.0) 3.1(1.7, 7.1) 7.007 < 0.001 表 3 多因素Logistic回归模型分析GPL的独立危险因素
参数 分类 回归系数 OR 95%CI P 性别 男 — — — — 女 — — — 0.975 吸烟史 从不 — — — — 已戒烟 — — — 0.168 吸烟 — — — 0.823 饮酒史 无 — — — — 有 — — — 0.587 进食速度 过慢 — — — — 正常 — — — 0.245 过快 — — — 0.290 H.pylori感染史 无 — 1.000 — — 有 -1.325 0.266 0.213~0.332 < 0.001 反复出现消化不良症状 否 — — — — 是 — — — 0.465 胃病史 无 — — — — 有 — — — 0.096 单核细胞计数 ≤0.34×109/L — — — — > 0.34×109/L — — — 0.123 红细胞分布宽度标准差 ≤45.55 fL — 1.000 — — > 45.55 fL -0.646 0.524 0.400~0.687 < 0.001 单核细胞与淋巴细胞比值 ≤0.23 — — — — > 0.23 — — — 0.094 胃蛋白酶原Ⅰ与胃蛋白酶原Ⅱ比值 ≥11.80 — 1.000 — — < 11.80 -0.867 0.420 0.335~0.527 < 0.001 血清胃泌素-17 ≤3.98 pmol/L — 1.000 — — > 3.98 pmol/L -0.459 0.632 0.507~0.788 < 0.001 常量 1.881 — — — -
[1] 赫捷, 陈万青, 李兆申, 等. 中国胃癌筛查与早诊早治指南(2022, 北京)[J]. 中国肿瘤, 2022, 31(7): 488-527. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHLU202207009.htm [2] ZHANG Y J, WU X, ZHANG C L, et al. Dissecting expression profiles of gastric precancerous lesions and early gastric cancer to explore crucial molecules in intestinal-type gastric cancer tumorigenesis[J]. J Pathol, 2020, 251(2): 135-146. doi: 10.1002/path.5434
[3] 廖专, 孙涛, 吴浩, 等. 中国早期胃癌筛查及内镜诊治共识意见(2014年4月·长沙)[J]. 胃肠病学, 2014, 19(7): 408-427. https://www.cnki.com.cn/Article/CJFDTOTAL-WIEC201407008.htm [4] 张华颖, 黄鑫宇, 薛会光, 等. 慢性萎缩性胃炎发生胃癌的危险因素: 一项长期随访研究[J]. 世界华人消化杂志, 2018, 26(31): 1812-1817. https://www.cnki.com.cn/Article/CJFDTOTAL-XXHB201831005.htm [5] 王青青, 王子安. 外周血红细胞分布宽度、超氧化物歧化酶与胃癌预后的相关性[J]. 现代肿瘤医学, 2022, 30(6): 1041-1046. https://www.cnki.com.cn/Article/CJFDTOTAL-SXZL202206018.htm [6] SHEN H Z, XIONG K W, WU X Y, et al. The diagnostic value of serum gastrin-17 and pepsinogen for gastric cancer screening in eastern China[J]. Gastroenterol Res Pract, 2021, 2021: 6894248.
[7] HIROAKI S, SHOTA S, YUJI S, et al. Prognostic significance of the combination of preoperative red cell distribution width and platelet distribution width in patients with gastric cancer[J]. BMC Cancer, 2021, 21(1): 1317. doi: 10.1186/s12885-021-09043-5
[8] 牟龙霞, 王萍, 李冰, 等. 农村居民相对精准胃癌筛查评分系统的研究与应用[J]. 中华肿瘤防治杂志, 2022, 29(17): 1249-1255. https://www.cnki.com.cn/Article/CJFDTOTAL-QLZL202217002.htm [9] YIN X Y, PANG T, LIU Y, et al. Development and validation of a nomogram for preoperative prediction of lymph node metastasis in early gastric cancer[J]. World J Surg Oncol, 2020, 18(1): 2. doi: 10.1186/s12957-019-1778-2
[10] 房静远, 杜奕奇, 刘文忠, 等. 中国慢性胃炎共识意见(2017年, 上海)[J]. 胃肠病学, 2017, 22(11): 670-687. https://www.cnki.com.cn/Article/CJFDTOTAL-WIEC201711013.htm [11] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[12] YOSHIDA N, DOYAMA H, YANO T, et al. Original research: Early gastric cancer detection in high-risk patients: a multicentre randomised controlled trial on the effect of second-generation narrow band imaging[J]. Gut, 2021, 70(1): 67. doi: 10.1136/gutjnl-2019-319631
[13] 陈万青, 左婷婷. 中国上消化道癌防控初显成效[J]. 中华预防医学杂志, 2017, 51(5): 378-380. [14] 朱云峰, 陈新民, 沈永洲, 等. 2019年浙江省海宁市上消化道肿瘤机会性筛查效果评价[J]. 中国肿瘤, 2020, 29(12): 910-913. https://www.cnki.com.cn/Article/CJFDTOTAL-ZHLU202012004.htm [15] KHANDIA R, MUNJAL A. Interplay between inflammation and cancer[J]. Adv Protein Chem Struct Biol, 2020, 119: 199-245.
[16] FANG T Y, WANG Y M, YIN X, et al. Diagnostic sensitivity of NLR and PLR in early diagnosis of gastric cancer[J]. J Immunol Res, 2020, 2020: 9146042.
[17] OHSAWA M, HAMAI Y, EMI M, et al. Blood biomarkers as predictors of pathological lymph node metastasis in clinical stage T1N0 esophageal squamous cell carcinoma[J]. Dis Esophagus, 2022, 36(1): doac042.
[18] LIANG L, HUANG L Y, ZHAO X M, et al. Prognostic value of RDW alone and in combination with NT-proBNP in patients with heart failure[J]. Clin Cardiol, 2022, 45(7): 802-813.
[19] LIU J, HUANG X Y, YUE S R, et al. Association of red cell distribution width-to-platelet ratio and mortality in patients with Sepsis[J]. Mediators Inflamm, 2022, 2022: 4915887.
[20] TARGONSKI R, SADOWSKI J, STAREK-STELMASZCZYK M, et al. Prognostic significance of red cell distribution width and its relation to increased pulmonary pressure and inflammation in acute heart failure[J]. Cardiol J, 2020, 27(4): 394-403.
[21] PIETRZYK L, PLEWA Z, DENISOW-PIETRZYK M, et al. Diagnostic power of blood parameters as screening markers in gastric cancer patients[J]. Asian Pac J Cancer Prev, 2016, 17(9): 4433-4437.
[22] ALSALMAN A, AL-MTERIN M A, ABU-DAYEH A, et al. Associations of complete blood count parameters with disease-free survival in right- and left-sided colorectal cancer patients[J]. J Pers Med, 2022, 12(5): 816.
[23] ILHAN A, GURLER F, YILMAZ F, et al. The relationship between hemoglobin-RDW ratio and clinical outcomes in patients with advanced pancreas cancer[J]. Eur Rev Med Pharmacol Sci, 2023, 27(5): 2060-2067.
[24] SAYED I M, SAHAN A Z, VENKOVA T, et al. Helicobacter pylori infection downregulates the DNA glycosylase NEIL2, resulting in increased genome damage and inflammation in gastric epithelial cells[J]. J Biol Chem, 2020, 295(32): 11082-11098.
[25] 冯娟. 血清胃蛋白酶原与幽门螺旋杆菌筛查对胃癌早期诊断的临床价值分析[J]. 实用临床医药杂志, 2018, 22(19): 21-24. doi: 10.7619/jcmp.201819006 [26] KRIKE P, SHUMS Z, POLAKA I, et al. The diagnostic value of anti-parietal cell and intrinsic factor antibodies, pepsinogens, and gastrin-17 in corpus-restricted atrophic gastritis[J]. Diagnostics, 2022, 12(11): 2784.
-
期刊类型引用(2)
1. 夏冬梅,石光顺,韩婷婷,金水. 血清半胱氨酸蛋白酶抑制剂S在胃癌患者中的诊断价值. 实用临床医药杂志. 2025(02): 48-51 .  本站查看
本站查看
2. 胡飞,张克昌,陈峰,童正喜,涂秀. 胃癌患者血清胃泌素释放肽前体、鳞癌相关抗原和糖类抗原72-4的变化及意义. 实用临床医药杂志. 2024(12): 46-50 .  本站查看
本站查看
其他类型引用(1)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号