Possible mechanism of anlotinib combined with anti-programmed death receptor-1 inhibitors in inhibiting lung adenocarcinoma
-
摘要:目的
探讨安罗替尼联合抗程序性死亡受体-1(抗PD-1)单抗通过抑制血管内皮生长因子/原癌基因(VEGF/c-Kit)调控Wnt/β-catenin通路来抑制肺腺癌的可能机制。
方法建立C57小鼠荷瘤模型, 并分为阴性对照组、安罗替尼组、抗PD-1单抗组和安罗替尼联合抗PD-1单抗组, 每组8只。连续给药25 d后, 比较各组小鼠肿瘤体积的变化。采用基因富集分析(GSEA)探讨癌症基因图谱(TCGA)数据库中肺腺癌(LUAD)队列中c-Kit和VEGF富集的相关通路; 采用CIBERSORTx分析c-Kit和VEGFR对22种免疫细胞浸润的影响; 分析c-Kit和VEGFR与免疫相关分子的相关性。采用细胞转染敲低c-Kit表达并分组, 对照组为正常LLC细胞, si-c-Kit组为siRNA敲低c-Kit表达, 安罗替尼处理组为安罗替尼处理LLC细胞。采用Western Blot实验检测各组细胞c-Kit、Wnt1、β-catenin、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、PD-L1、c-Myc、c-Jun表达。
结果与阴性对照组比较, 安罗替尼组、PD-1单抗组、安罗替尼联合PD-1单抗组均可抑制肿瘤的生长, 差异有统计学意义(P < 0.05); 与安罗替尼组、PD-1单抗组比较, 安罗替尼联合PD-1单抗组可抑制肿瘤的生长, 差异有统计学意义(P < 0.05)。GSEA表明, IFN-γ通路富集在c-Kit低表达样本中, Wnt/β-catenin通路富集在c-Kit高表达样本中, 血管生成及IL-6/JAK/STAT3通路富集在VEGFR高表达样本中, 差异均有统计学意义(P < 0.05)。CIBERSORTx分析发现, c-Kit高表达样本中有更少的抗肿瘤免疫细胞以及更多的免疫抑制细胞, 差异有统计学意义(P < 0.05)。VEGFR低表达样本中有更多的抗肿瘤免疫细胞以及更少免疫抑制细胞, 差异有统计学意义(P < 0.05)。c-Kit与颗粒酶A(GZMA)、颗粒酶B(GZMB)、IFN-γ等促免疫分子呈负相关(r < 0, P < 0.05), 与CD274(PD-L1)、转化生长因子β (TGF-β)、T细胞免疫球蛋白结构域和粘蛋白结构域-3(TIM3)等免疫抑制分子呈正相关(r>0, P < 0.05)。VEGFR与GZMA、TNF-α、GZMB、IFN-γ等免疫促进分子均呈负相关(r < 0, P < 0.05), 与CD274(即PD-L1)、TIM3、PD-1、低氧诱导因子-1A (HIF1A)、淋巴细胞激活基因-3 (LAG3)、TGF-β、细胞毒T淋巴细胞相关抗原4 (CTLA4)等免疫抑制分子均呈正相关(r>0, P < 0.05)。Western Blot实验证实, 安罗替尼或敲低c-Kit均抑制了Wnt/β-catenin通路及下游分子, 调控TNF-α相关分子的表达。
结论安罗替尼联合抗PD-1药物可以更好地抑制肿瘤生长, 其可能机制是安罗替尼通过靶向c-Kit抑制Wnt/β-catenin通路调节免疫微环境, 促进抗肿瘤免疫细胞浸润, 有助于提高抗PD-1单抗抑制肿瘤生长的疗效。
Abstract:ObjectiveTo explore the possible mechanism of arotinib combined with anti-programmed death receptor-1 (anti-PD-1) in inhibiting lung adenocarcinoma by regulating Wnt/β-catenin pathway through inhibiting vascular endothelial growth factor/c-Kit (VEGF/c-Kit).
MethodsA lung adenocarcinoma model was established in C57 mice, and the mice were divided into negative control group, arotinib group, anti-PD-1 monoclonal antibody group and arotinib combined with anti-PD-1 monoclonal antibody group, with 8 mice in each group. After continuous administration for 25 days, the change in tumor volume in each group was compared. Gene Set Enrichment Analysis (GSEA) was used to explore the pathways related to the enrichment of c-Kit and VEGF in the lung adenocarcinoma (LUAD) cohort of the Cancer Genome Atlas (TCGA) database; the CIBERSORTx was used to analyze the influence of c-Kit and VEGFR on the infiltration of 22 types of immune cells; the correlations of c-Kit and VEGFR with immune-related molecules were analyzed. Cell transfection was used to knock down c-Kit expression and the cells were divided into groups, the control group was normal LLC cells, the si-c-Kit group was siRNA knocked down c-Kit, and the arotinib treatment group was LLC cells processed with arotinib. Western Blot assay was used to detect expressions of c-Kit, Wnt1, β-catenin, gamma interferon (IFN-γ), tumor necrosis factor-alpha (TNF-α), PD-L1, c-Myc and c-Jun.
ResultsCompared with the negative control group, tumor growth was significantly inhibited in the arotinib group, PD-1 monoclonal antibody group, and the combination of arotinib and PD-1 monoclonal antibody group (P < 0.05). Compared with the arotinib group and PD-1 monoclonal antibody group, the tumor growth was significantly inhibited in the combination of arotinib and PD-1 monoclonal antibody group (P < 0.05). GSEA analysis showed that the IFN-γ pathway was enriched in c-Kit low expression samples, Wnt/β-catenin pathway was enriched in c-Kit high expression samples, while the angiogenesis and IL-6/JAK/STAT3 pathway were enriched in VEGFR high expression samples (P < 0.05). CIBERSORTx analysis found that there were fewer anti-tumor immune cells and more immunosuppressive cells in the high expression samples of c-Kit (P < 0.05). There were more anti-tumor immune cells and fewer immunosuppressive cells in the low expression samples of VEGFR (P < 0.05). The c-Kit was negatively correlated with immune promoting molecules such as granzyme A (GZMA), granzyme B (GZMB) and IFN-γ (r < 0, P < 0.05), and was positively correlated with CD274 (PD-L1), transforming growth factor-β (TGF-β), T-cell immunoglobulin and mucin domain 3 (TIM3) (r>0, P < 0.05). VEGFR was negatively correlated with immune promoting molecules in GZMA, TNF-α, GZMB and IFN-γ (r < 0, P < 0.05), and was positively correlated with immunosuppressive molecules such as CD274 (PD-L1), TIM3, PD-1, hypoxiainduciblefactor-1 alpha (HIF1A), lymphocyte activation gene 3 (LAG3), TGF-β and cytotoxic T-lymphocyte-associated protein 4 (CTLA4) (r>0, P < 0.05). Western blot experiment had confirmed that enrotinib or knocking down c-Kit both inhibited Wnt/β-catenin pathway and downstream molecules, and regulated TNF-α expression.
ConclusionThe combination of arotinib and anti PD-1 drugs can significantly inhibit tumor growth, and the possible mechanism is that arotinib inhibits Wnt/β-catenin pathway in lung adenocarcinoma by targeting c-Kit to regulate immune microenvironment and promote anti-tumor immune cell infiltration, which is helpful to improve the efficacy of anti-PD-1 monoclonal antibody in inhibiting tumor growth.
-
抗程序性死亡-配体1(PD-L1)的免疫治疗在非小细胞肺癌中取得了一系列突破性进展,已有多种药物获批临床适应证[1-4]。然而,并不是所有患者都能从抗PD-L1的免疫治疗中获益。研究[5-6]表明,血管内皮生长因子(VEGF)及血管内皮生长因子受体(VEGFR)介导的肿瘤血管新生在肿瘤免疫逃避中发挥重要作用,而抗VEGF或VEGFR的药物联合抗PD-L1的药物也取得了更好的抗肿瘤效果[7]。作为一个多靶点的激酶抑制剂,安罗替尼的靶点包括VEGFR、血小板衍生生长因子(PDGFR)、成纤维细胞生长因子受体(FGFR)和原癌基因(c-Kit)等,具有抗肿瘤血管生成和抑制肿瘤生长的双重作用[8-9]。本研究探讨安罗替尼是否能够提高程序性死亡受体-1(PD-1)单抗的疗效,现将结果报告如下。
1. 资料与方法
1.1 一般材料
LLC细胞系购自上海中科院细胞库,采用RPMI1640培养基+10%胎牛血清培养; 靶向c-Kit的siRNA购自美国Santa Cruz公司,货号sc-29852; siRNA转染相关试剂购自美国Santa Cruz公司; 6周龄雌性C57小鼠购自北京维通利华实验动物技术有限公司,体质量18~22 g, 无特定病原体(SPF)级,动物合格证号为SCXK(京)2006-0009; 安罗替尼,规格为10 mg/粒,国药准字H20180003, 正大天晴药业集团股份有限公司; 抗PD-1单抗购自美国BioXcell公司; 凝胶电泳仪、垂直电泳槽及凝胶成像系统均购自美国Bio-rad公司; 微量紫外可见光分光光度计购自瑞士梅特勒托利多; 细胞裂解液P0013购自碧云天生物; 抗c-Kit、Wnt1 β-catenin、γ干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、PD-L1、c-Myc、c-Jun、GAPDH一抗抗体均购自Cell Signaling Technology; 抗兔、鼠二抗购自美国Affinity公司; LipofectamineⓇ 2000购自美国Invitrogen公司。
1.2 肺癌荷瘤小鼠模型制备及给药
将LLC细胞重悬于磷酸盐缓冲液(PBS), 浓度调整为5×105个/L, 皮下种瘤,接种体积100 μL/只,接种7 d, 肉眼可见接种处有明显的鼓包,提示肺癌荷瘤小鼠制备成功。将制备成功的肺癌小鼠模型随机分为4组,即阴性对照组、安罗替尼组、抗PD-1单抗组、安罗替尼联合抗PD-1单抗组,每组8只。阴性对照组给予灌胃生理盐水,安罗替尼组给予灌胃安罗替尼(剂量为每100 g 16 μg, 1次/d), 抗PD-1单抗组腹腔内注射抗PD-1单抗(剂量为每次按100 g 1 mg, 每3 d注射1次),安罗替尼联合抗PD-1单抗组给予灌胃安罗替尼(剂量为每次100 g 16 μg, 1次/d)和腹腔内注射抗PD-1单抗(剂量为每次按100 g 1 mg, 每3 d注射1次)。所有组别连续治疗25 d。
1.3 指标检测
采用游标卡尺测量各组小鼠接种处的肿瘤直径,并计算肿瘤体积,测量时点为给药0、5、10、15、20、25 d。
1.4 生物信息学分析
基因富集分析(GSEA)在Java环境下的GSEA桌面应用中进行(GSEA v4.0.1, http://software.broadinstitute.org/gsea/index.jsp)。22种免疫细胞浸润分析在CIBERSORTx官网的在线工具(https://cibersortx.stanford.edu/)中进行。相关性分析的数据来自肿瘤与癌症基因组图谱(TCGA)数据库中肺腺癌(LUAD)队列。
1.5 Western Blot实验
在转染前1 d, 将对数生长期的LLC细胞从培养皿中消化、重悬,细胞计数后按每孔1×106个细胞接种于6孔板中,在培养基中培养过夜,待6孔板细胞密度达到约70%时,根据Lipofectamine 2000说明书转染。转染48 h后分组,其中对照组为正常LLC细胞, si-c-Kit组为siRNA敲低c-Kit表达,安罗替尼处理组为安罗替尼处理LLC细胞。提取各组细胞总蛋白,采用细胞裂解液裂解,待细胞完全裂解后置于离心机中离心,收集上清液于EP管中,采用BCA蛋白检测试剂盒测定细胞总蛋白浓度。蛋白变性处理,进行SDS-PAGE电泳。蛋白电泳分离后转胶至PVDF膜上,脱脂牛奶封闭。加入一抗c-Kit、Wnt1、β-catenin、IFN-γ、TNF-α、PD-L1、c-Myc、c-Jun、GAPDH单克隆抗体,工作浓度均为1∶ 1 000, 4 ℃孵育过夜,将HRP标记的二抗加入到溶液中,继续孵育2 h, 曝光成像。GAPDH为内参。
1.6 统计学分析
采用SPSS 19.0软件包进行统计学分析,计量资料采用均值±标准差(x±s)表示,多组计量资料比较采用单因素方差分析,组间两两比较采用LSD-t检验,计数资料采用卡方检验, P < 0.05为差异有统计学意义。
2. 结果
2.1 安罗替尼联合PD-1单抗对肺癌小鼠肿瘤体积的影响
与阴性对照组比较,安罗替尼组、PD-1单抗组、安罗替尼联合PD-1单抗组均可抑制肿瘤的生长,差异有统计学意义(P < 0.05); 与安罗替尼组、PD-1单抗组比较,安罗替尼联合PD-1单抗可抑制肿瘤的生长,差异有统计学意义(P < 0.05)。见图 1。
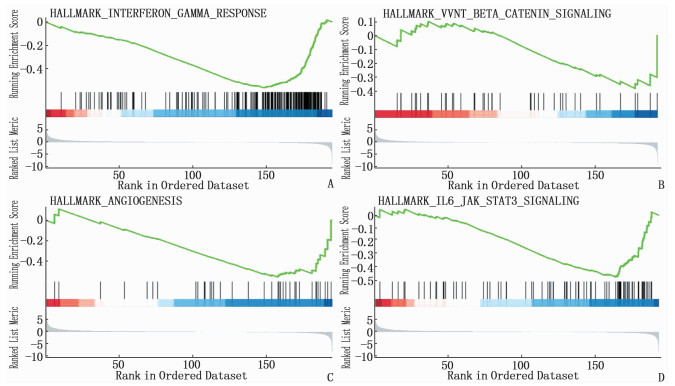
2.2 c-Kit和VEGFR的GSEA
GSEA结果表明, c-Kit低表达样本IFN-γ通路富集,差异有统计学意义(P < 0.05)(图 2A), c-Kit高表达样本Wnt/β-catenin通路富集,差异有统计学意义(P < 0.05)(图 2B),提示安罗替尼抑制c-Kit可能通过调节IFN-γ通路和Wnt/β-catenin通路提高了PD-1单抗抑制肺癌小鼠肿瘤体积的疗效。VEGFR高表达的样本肿瘤血管生成通路和IL-6/JAK/STAT3通路富集,差异有统计学意义(P < 0.05)(图 2C、2D), 提示安罗替尼抑制VEGFR可能通过抑制血管生成和IL-6/JAK/STAT3通路提高了PD-1单抗抑制肺癌小鼠肿瘤体积的疗效。
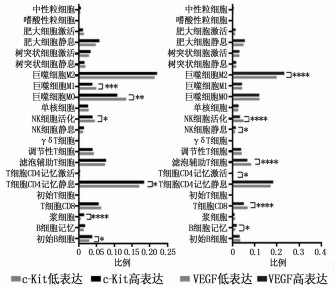
2.3 c-Kit和VEGFR对肿瘤淋巴细胞浸润的影响
本研究分析了c-Kit和VEGFR对肿瘤组织中淋巴细胞浸润的影响。通过CIBERSORTx, 计算TCGA数据库中LUAD队列的不同c-Kit和VEGFR表达的样本中22种淋巴细胞的浸润比例,结果显示(图 3), 相较于c-Kit高表达(高于或等于表达中位数), c-Kit低表达(低于表达中位数)样本中有更多的M1型巨噬细胞、M0型巨噬细胞、活化的NK细胞及更少的剩余记忆性CD4 T细胞、浆细胞和Naïve B细胞,差异均有统计学意义(P < 0.05)。相较于VEGFR高表达(高于或等于表达中位数),VEGFR低表达(低于表达中位数)样本中有更多的活化的NK细胞、滤泡辅助性T细胞、活化的记忆性CD4 T细胞、CD8 T细胞及更少的M2型巨噬细胞、剩余未活化的NK细胞、记忆性B细胞,差异均有统计学意义(P < 0.05)。c-Kit和VEGFR低表达均伴随着更多的抗肿瘤免疫细胞, c-Kit和VEGFR高表达则伴随着更多的免疫抑制细胞。
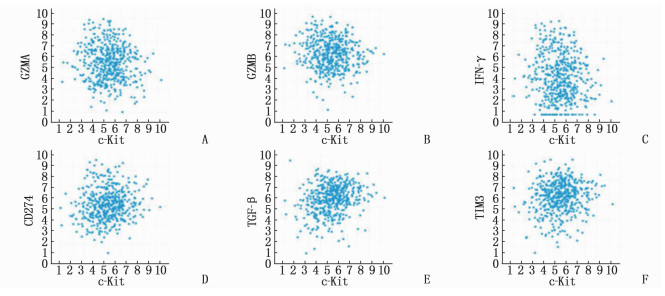
在TCGA数据库的LUAD队列中, c-Kit与颗粒酶A(GZMA)、颗粒酶B(GZMB)、IFN-γ等促免疫分子呈负相关(r < 0, P < 0.05)(图 4A、4B、4C), 与CD274(PD-L1)、转化生长因子β(TGF-β)、T细胞免疫球蛋白结构域和粘蛋白结构域-3(TIM3)等免疫抑制分子呈正相关(r>0, P < 0.05)(图 4D、4E、4F)。
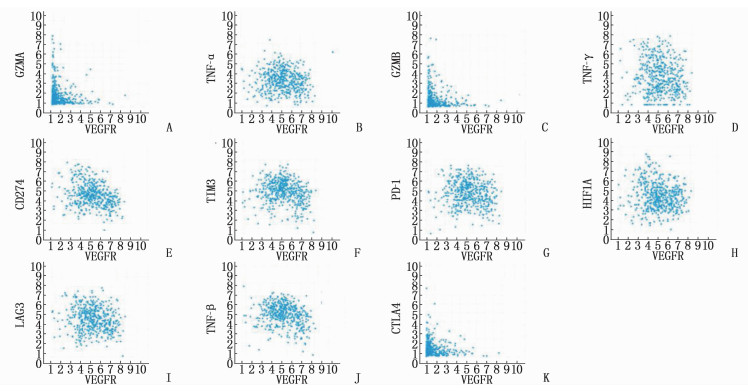
VEGFR与GZMA、TNF-α、GZMB、IFN-γ等免疫促进分子均呈负相关(r < 0, P < 0.05) (图 5A、5B、5C、5D), 与CD274(即PD-L1)、TIM3、PD-1、低氧诱导因子-1A(HIF1A)、淋巴细胞激活基因-3 (LAG3)、TGF-β、细胞毒T淋巴细胞相关抗原4 (CTLA4)等免疫抑制分子均呈正相关(r>0, P < 0.05)(图 5E、5F、5G、5H、5K)。上述结果表明,安罗替尼抑制c-Kit和VEGFR, 有可能抑制相关免疫抑制分子,促进免疫促进分子的表达。
2.4 安罗替尼通过抑制Wnt/β-catenin通路促进肿瘤免疫
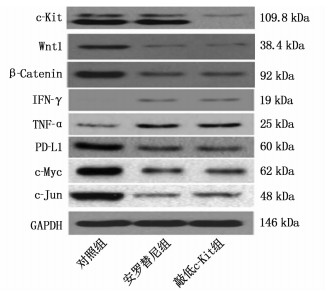
c-Kit对于免疫微环境的调控作用尚不明确,在LLC细胞系中用siRNA敲低c-Kit表达,并与安罗替尼处理后的细胞进行对比。基于图 2中的GSEA结果,分析c-Kit对Wnt/β-catenin通路及相关免疫分子表达的影响。Western Blot实验证实,采用siRNA抑制c-Kit可降低Wnt1和β-catenin的表达, Wnt/β-catenin通路的下游分子c-Myc、c-Jun的表达也受到抑制, IFN-γ和TNF-α等抗肿瘤免疫的表达则升高, PD-L1的表达降低,差异均有统计学意义(P < 0.05)。采用安罗替尼处理细胞的结果与采用siRNA敲低c-Kit表达的结果类似,但安罗替尼不改变c-Kit表达,差异无统计学意义(P>0.05)。见图 6。
3. 讨论
虽然抗PD-L1的免疫检查点抑制剂在非小细胞肺癌中取得了突破性进展[1, 4, 9], 但仍有相当一部分患者不能从中获益或者获益较少。研究[7]表明,抗PD-L1的免疫检查点抑制剂阿替利珠单抗联合含铂双药后,再联合抗血管生成的药物贝伐珠单抗,可以进一步提高非鳞非小细胞肺癌患者的疗效,延长了无进展生存期,为抗PD-L1的免疫检查点抑制剂联合其他靶向药物提供了新的实例。
作为一个靶向VEGFR、PDGFR、FGFR和c-Kit等多靶点的抑制剂,安罗替尼具有抗肿瘤血管生成和抑制肿瘤的双重作用[8-9]。本研究通过LLC细胞荷瘤小鼠实验证实,与安罗替尼组、PD-1单抗组相比,安罗替尼联合PD-1单抗连续给药25 d可显著抑制肿瘤的生长,差异有统计学意义(P < 0.05)。基于TCGA数据库中LUAD队列的生物信息学分析表明, c-Kit和VEGFR与免疫抑制通路、免疫抑制细胞的浸润及免疫相关分子的表达均存在线性关系。Western Blot实验亦表明,安罗替尼或敲低c-Kit表达均可以抑制LLC细胞的Wnt/β-catenin通路,并促进IFN-γ、TNF-α的表达,抑制PD-L1的表达,该结果印证了LUAD队列的生物信息学分析结果,即安罗替尼通过靶向c-Kit抑制Wnt/β-catenin通路调节免疫微环境,促进抗肿瘤免疫细胞浸润,提高了抗PD-1单抗抑制肿瘤生长的疗效。
本研究不足之处: 本研究仅进行了生物信息学预测与Western Blot实验,未能从机制方面说明安罗替尼通过抑制VEGFR/c-Kit调控Wnt/β-catenin通路在肺腺癌中的调控及安罗替尼通过抑制Wnt/β-catenin通路促进肿瘤免疫,因此有后续研究有必要增加靶向细胞转染相关的研究进行验证。
综上所述,安罗替尼联合抗PD-1药物可以更好地抑制肿瘤生长,其可能机制是安罗替尼通过靶向c-Kit抑制Wnt/β-catenin通路调节免疫微环境,促进抗肿瘤免疫细胞浸润,有助于提高抗PD-1单抗抑制肿瘤生长的疗效。
-
-
[1] ZHOU Y X, ZHANG Y Q, GUO G F, et al. Nivolumab plus ipilimumab versus pembrolizumab as chemotherapy-free, first-line treatment for PD-L1-positive non-small cell lung cancer[J]. Clin Transl Med, 2020, 10(1): 107-115. doi: 10.1002/ctm2.14
[2] MOK T S K, WU Y L, KUDABA I, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019, 393(10183): 1819-1830. doi: 10.1016/S0140-6736(18)32409-7
[3] HELLMANN M D, PAZ-ARES L, BERNABE CARO R, et al. Nivolumab plus ipilimumab in advanced non-small-cell lung cancer[J]. N Engl J Med, 2019, 381(21): 2020-2031. doi: 10.1056/NEJMoa1910231
[4] RECK M, RODRÍGUEZ-ABREU D, ROBINSON A G, et al. Updated analysis of KEYNOTE-024: pembrolizumab versus platinum-based chemotherapy for advanced non-small-cell lung cancer with PD-L1 tumor proportion score of 50% or greater[J]. J Clin Oncol, 2019, 37(7): 537-546. doi: 10.1200/JCO.18.00149
[5] WALLIN J J, BENDELL J C, FUNKE R, et al. Atezolizumab in combination with bevacizumab enhances antigen-specific T-cell migration in metastatic renal cell carcinoma[J]. Nat Commun, 2016, 7: 12624. doi: 10.1038/ncomms12624
[6] TADA Y, TOGASHI Y, KOTANI D, et al. Targeting VEGFR2 with Ramucirumab strongly impacts effector/activated regulatory T cells and CD8+ T cells in the tumor microenvironment[J]. J Immunother Cancer, 2018, 6(1): 106. doi: 10.1186/s40425-018-0403-1
[7] SOCINSKI M A, JOTTE R M, CAPPUZZO F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med, 2018, 378(24): 2288-2301. doi: 10.1056/NEJMoa1716948
[8] HAN B H, LI K, WANG Q M, et al. Effect of anlotinib as a third-line or further treatment on overall survival of patients with advanced non-small cell lung cancer: the ALTER 0303 phase 3 randomized clinical trial[J]. JAMA Oncol, 2018, 4(11): 1569-1575. doi: 10.1001/jamaoncol.2018.3039
[9] WANG Y H, SHI X H, QI Q H, et al. Safety of anlotinib capsules combined with PD-1 inhibitor camrelizumab in the third-line treatment of advanced non-small-cell lung cancer and their effect on serum tumor markers[J]. J Healthc Eng, 2021, 2021: 2338800.
-
期刊类型引用(1)
1. 徐芸,张鸿博,王代勇,郑文. 程序性死亡受体1/程序性死亡受体配体1抑制剂联合安罗替尼在广泛期小细胞肺癌维持治疗中的应用. 癌症进展. 2024(10): 1113-1116 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
