Values of new inflammatory indicators in predicting atrial fibrillation in elderly patients with severe chronic obstructive pulmonary disease
-
摘要:目的
探讨单核细胞与高密度脂蛋白胆固醇比值(MHR)、中性粒细胞与淋巴细胞比值(NLR)及红细胞分布宽度(RDW)与老年重度慢性阻塞性肺疾病(COPD)并发心房颤动(AF)的相关性。
方法选取143例稳定期重度COPD患者, 根据非瓣膜性AF发作情况及AF分型[阵发性AF(PAF), 持续性、长程持续性以及永久性AF(SAF)]分为3组, 即COPD组(n=50)、COPD合并PAF组(n=45)、COPD合并SAF组(n=48)。检测3组外周血MHR、NLR、RDW水平。采用二元Logistic回归模型分析MHR、NLR、RDW是否为PAF和SAF的独立预测因子。采用受试者工作特征(ROC)曲线分析独立预测因子的诊断效能。
结果MHR(OR=1.438, 95%CI: 1.107~2.962, P=0.029)、NLR(OR=2.715, 95%CI: 1.066~8.537, P=0.042)是老年重度CODP患者发生PAF的独立预测因子。MHR(OR=1.477, 95%CI: 1.091~2.951, P=0.031)、NLR(OR=2.628, 95%CI: 1.017~7.063, P=0.036)和RDW(OR=1.149, 95%CI: 1.003~4.655, P=0.047)均是老年重度CODP患者发生SAF的独立预测因子。ROC曲线分析显示, MHR[曲线下面积(AUC)=0.644, 95%CI: 0.556~0.831, 约登指数为0.653, 敏感度为73%, 特异度为80%]和NLR(AUC=0.732, 95%CI: 0.575~0.829, 约登指数为0.791, 敏感度为78%, 特异度为88%)预测老年重度COPD患者发生PAF具有较高的诊断效能, NLR与MHR联合预测时诊断效能最佳(AUC=0.803, 95%CI: 0.619~0.897)。ROC曲线分析显示, MHR(AUC=0.693, 95%CI: 0.519~0.766, 约登指数为0.753, 敏感度为83%, 特异度为92%)、NLR(AUC=0.736, 95%CI: 0.549~0.822, 约登指数为0.651, 敏感度为91%, 特异度为87%)和RDW(AUC=0.708, 95%CI: 0.642~0.873, 约登指数为0.738, 敏感度为94%, 特异度为80%)预测老年重度COPD患者发生SAF时具有较高的诊断效能, NLR、MHR和RDW联合预测时诊断效能最佳(AUC=0.824, 95%CI: 0.738~0.916)。
结论外周血MHR、NLR和RDW联合检测在预测老年重度COPD患者AF发生和AF严重程度方面具有重要的临床价值。
-
关键词:
- 慢性阻塞性肺疾病 /
- 心房颤动 /
- 单核细胞与高密度脂蛋白胆固醇比值 /
- 中性粒细胞与淋巴细胞比值 /
- 红细胞分布宽度
Abstract:ObjectiveTo investigate the relationships of the monocyte to high-density lipoprotein cholesterol ratio (MHR), the neutrophils to lymphocytes ratio (NLR) and the red blood cell distribution width (RDW) with atrial fibrillation (AF) in elderly patients with severe chronic obstructive pulmonary disease (COPD).
MethodsA total of 143 patients with severe COPD in stable phase were selected, and according to incidence and classification of non-valvular AF[paroxysmal AF (PAF), persistent and long-standing persistent and sustained AF (SAF)], they were divided into COPD group (n=50), COPD combined with PAF group (n=45), and COPD combined with SAF group (n=48). Levels of MHR, NLR and RDW in peripheral blood were detected in the three groups. A binary Logistic regression model was used to analyze whether MHR, NLR and RDW were independent predictors of PAF and SAF. Receiver operating characteristic (ROC) curve was used to analyze the diagnostic efficacy of independent predictors.
ResultsMHR (OR=1.438; 95%CI, 1.107 to 2.962, P=0.029) and NLR (OR=2.715; 95%CI, 1.066 to 8.537, P=0.042) were the independent predictors of PAF in elderly patients with severe COPD. MHR (OR=1.477; 95%CI, 1.091 to 2.951, P=0.031), NLR (OR=2.628; 95%CI, 1.017 to 7.063, P=0.036) and RDW (OR=1.149; 95%CI, 1.003 to 4.655, P=0.047) were the independent predictors of SAF in elderly patients with severe COPD. ROC curve analysis showed that MHR[area under the curve (AUC) was 0.644, 95%CI, 0.556 to 0.831, Youden index was 0.653, sensitivity was 73%, and specificity was 80%]and NLR (AUC was 0.732, 95%CI, 0.575 to 0.829, Youden index was 0.791, sensitivity was 78%, and specificity was 88%) had high diagnostic efficacies in predicting PAF in elderly patients with severe COPD, and the diagnostic efficiency reached the best value when NLR was combined with MHR for prediction (AUC was 0.803, 95%CI, 0.619 to 0.897). ROC curve analysis showed that MHR (AUC was 0.693, 95%CI, 0.519 to 0.766, Youden index was 0.753, sensitivity was 83%, and specificity was 92%), NLR (AUC was 0.736, 95%CI, 0.549 to 0.822, Youden index was 0.651, sensitivity was 91%, and specificity was 87%) and RDW (AUC was 0.708, 95%CI, 0.642 to 0.873, Youden index was 0.738, sensitivity was 94%, and specificity was 80%) had high diagnostic efficacies in predicting SAF in elderly patients with severe COPD, and the diagnostic efficiency reached the best value when NLR was combined with MHR and RDW for prediction (AUC was 0.824, 95%CI, 0.738 to 0.916).
ConclusionThe combined detection of MHR, NLR and RDW in peripheral blood has important clinical value in predicting the occurrence and severity of AF in elderly patients with severe COPD.
-
衰老是慢性阻塞性肺疾病(COPD)和心房颤动(AF)共同的独立危险因素[1-2]。动物实验和临床研究[3-5]均证实合并COPD时更易发生AF。流行病学调查[6]显示, 65~80岁人群AF患病率为2.0%~8.8%, 老年人群患病率显著增高。AF是脑卒中的独立危险因素[7]。世界卫生组织[8]估计,全世界约有3.28亿COPD患者, COPD是目前全球第4大死亡原因。COPD患病率随着年龄的增长而增高,研究[9-10]预测中国到2033年将有6 500万例患者死于COPD及其合并症,其中COPD合并AF患者具有较高的致残率及病死率。研究[11-12]报道,单核细胞与高密度脂蛋白胆固醇比值(MHR)、中性粒细胞与淋巴细胞比值(NLR)及红细胞分布宽度(RDW)等新型炎性指标可能是AF导管消融术后复发、心肌梗死后、冠状动脉搭桥术后AF发作的独立预测因子。本研究探讨MHR、NLR和RDW联合检测对老年重度COPD患者AF发作及AF严重程度的预测价值,现报告如下。
1. 资料与方法
1.1 一般资料
选取2016—2022年南京医科大学附属脑科医院胸科院区(原东南大学医学院附属南京胸科医院)呼吸科和心血管内科收治的稳定期重度COPD患者为研究对象,根据是否发生非瓣膜性AF及AF分型分为3组: ① COPD组50例,稳定期COPD不合并AF发作患者; ② 45例稳定期COPD合并阵发性非瓣膜性房颤(PAF)患者设为COPD合并PAF组; ③ 48例稳定期COPD合并持续性或长程持续性或永久性非瓣膜性房颤(SAF)患者设为COPD合并SAF组。3组患者接受相同的COPD常规治疗方案。
诊断标准: ①稳定期COPD诊断符合2023年慢性阻塞性肺疾病全球倡议组织(GOLD)制订的诊断标准[13], 即有危险因素暴露史、(慢性咳嗽、咳痰、呼吸困难)症状和体征及肺功能检查等临床资料,并排除可引起类似症状和持续气流受限的其他疾病。肺功能检查表现为持续气流受限,吸入支气管舒张剂后第1秒用力呼气容积与用力肺活量的比值(FEV1/FVC) < 70%, 根据肺功能分级为轻度(FEV1/FVC≥80%)、中度(FEV1/FVC在50%~ < 80%)、重度(FEV1/FVC在30%~ < 50%)、极重度(FEV1/FVC < 30%)。稳定期COPD被定义为在过去4周内没有恶化,症状恢复到急性加重前表现。② AF诊断符合欧洲心脏病学会《心房颤动的诊断和管理指南2020》[14]中的相关标准,依据患者病史、12导联心电图和24 h动态心电图诊断为AF。
纳入标准: ①年龄≥60岁者; ②符合重度COPD稳定期诊断标准者; ③符合AF诊断标准者; ④签署知情同意书者。上述条件均需满足。排除标准: ①病例资料不完整者,包括血常规、生化检验、心脏彩超、胸部CT、肺功能等; ②COPD急性发作期或COPD病情严重者; ③高血压控制不良者(收缩压≥180 mmHg或舒张压≥100 mmHg); ④合并严重的心脏瓣膜病或瓣膜性AF或严重的肺源性心脏病者; ⑤合并严重的心力衰竭(Ⅳ级)或肝肾功能不全者; ⑥伴造血系统或肿瘤等严重原发性疾病者; ⑦合并其他类型心律失常者(例如阵发性室上速和预激综合征等); ⑧ 2个月内有急性冠状动脉综合征或脑卒中病史者、手术史者; ⑨近期存在严重感染或使用抗炎药物者; ⑩ Ⅰ型和Ⅱ型呼吸衰竭者。符合上述任何一项者即被排除。本研究经医院伦理委员会批准(伦理审查批件号: 2022-KY104-01), 所有受试患者均在充分了解诊疗目的及风险的情况下,自愿参加并签署知情同意书。
1.2 方法
1.2.1 临床资料收集
所有受试者均由心血管内科专科医师询问病史,采集相关资料,记录现病史和既往史(例如高血压、冠心病、糖尿病、脑梗死等病史资料),并进行体格检查,测量心率、身高、体质量、收缩压和舒张压等。
1.2.2 实验室检测
所有受试者均要求空腹10~12 h, 并于次日清晨抽取肘静脉血样本,采用MEK-6318全自动血细胞分析仪(光电株式会社,日本)检测红细胞(RBC)、单核细胞计数(M)、RDW、中性粒细胞计数(N)、淋巴细胞计数(L)、白细胞(WBC)等指标。采用BECKMAN-AU5800全自动生化分析仪(Olympus, 日本)检测生化指标如肌酐(Cr)、谷氨酸氨基转移酶(ALT)、低密度脂蛋白胆固醇(LDL-C)、天冬氨酸氨基转移酶(AST)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、甘油三酯(TG)。所有检测均由同一名检验科中级职称及以上人员严格按照标准操作流程完成。
1.2.3 器械检查
① 72 h动态心电图。采用动态心电图检查仪(Mamarquette MARS 3000, 美国)连续72 h记录患者AF发作情况。②超声心动图。采用彩色超声多普勒心动图仪(HpSONOS 5500, 美国)测量左室射血分数(LVEF)、左心房内径(LAD)等指标,以上测量值都是连续3个心动周期的测量均值。③肺功能。采用肺功能仪(MINATO AS-507, 日本)测量患者肺功能。④胸部CT平扫: 采用256排CT(Brilliance iCT, 荷兰)检查患者慢性支气管炎、肺气肿情况。上述指标检测均由同一名专科主治及以上职称医师完成并出具报告。
1.2.4 观察指标
① NLR, NLR=N(×109/L)/L(×109/L); ② MHR, MHR=单核细胞(×109/L)/高密度脂蛋白胆固醇(mmol/L); ③ RDW。
1.3 统计学分析
采用SPSS 21.0软件对数据进行统计分析,符合正态分布的计量资料以平均值±标准差表示, 3组间比较采用单因素方差分析,两两比较行LSD-t检验; 计数资料以率(%)表示,组间比较采用χ2检验; 不符合正态分布的数据以[M(P25, P75)]表示,组间比较采用Mann-Whitney U秩和检验。采用多因素Logistic回归分析影响老年COPD患者AF发作的因素,并对多因素分析中有统计学意义的独立预测因子行受试者工作特征(ROC)曲线分析。P < 0.05为差异有统计学意义。
2. 结果
2.1 3组患者基线资料比较
COPD组、COPD合并PAF组、COPD合并SAF组基线资料比较显示, MHR、NLR、RDW、M、HDL-C的组间差异有统计学意义(P < 0.05); COPD合并SAF组LAD大于COPD组、COPD合并PAF组,差异有统计学意义(P < 0.05)。见表 1。
表 1 3组患者基线资料比较(x±s)[n(%)]因素 COPD组(n=50) COPD合并PAF组(n=45) COPD合并SAF组(n=48) F/χ2 P 性别(男) 31(62.00) 26(57.78) 29(60.42) 1.342 0.516 年龄/岁 71.59±8.82 72.13±9.66 72.66±9.19 0.236 0.742 吸烟 11(22.00) 11(24.44) 12(25.00) 0.138 0.933 饮酒 19(38.00) 18(40.00) 21(43.75) 0.344 0.842 BMI/(kg/m2) 26.31±3.61 27.11±3.35 27.32±4.15 0.429 0.656 COPD病程/年 8.20±5.64 10.39±4.77 11.67±4.52 0.548 0.779 高血压 19(38.00) 20(44.44) 23(47.92) 1.012 0.603 糖尿病 4(8.00) 4(8.89) 6(12.50) 0.622 0.733 陈旧性心肌梗死 1(2.00) 1(2.22) 2(4.17) 0.503 0.778 脑梗死 6(12.00) 5(11.11) 6(12.50) 0.044 0.978 睡眠呼吸暂停 2(4.00) 2(4.44) 5(10.42) 2.090 0.352 甲状腺功能异常 0 2(4.44) 2(4.17) 2.219 0.330 RBC/(×1012/L) 4.70±0.80 4.55±0.77 4.11±0.72 0.734 0.844 WBC/(×109/L) 6.67±1.18 7.03±1.56 7.33±1.66 1.077 0.851 中性粒细胞计数/(×109/L) 4.16±0.77 4.55±0.81 4.91±0.71 0.655 0.328 单核细胞计数/(×109/L) 0.41±0.11 0.49±0.14* 0.58±0.17*# 0.572 0.011 淋巴细胞计数/(×109/L) 1.61±0.65 1.57±0.61 1.56±0.84 1.619 0.874 总胆固醇/(mmol/L) 4.37±0.69 4.28±0.88 4.41±0.91 0.832 0.526 甘油三酯/(mmol/L) 1.25±0.33 1.43±0.50 1.36±0.48 1.049 0.477 HDL-C/(mmol/L) 1.29±0.29 1.12±0.30* 0.97±0.24*# 6.526 0.041 LDL-C/(mmol/L) 2.72±0.60 2.90±0.83 2.86±0.84 0.573 0.832 肌酐/(mmol/L) 70.65±15.13 72.38±19.45 78.14±18.03 0.731 0.590 ALT/(U/L) 22.49±4.06 21.38±4.72 21.10±4.49 0.897 0.512 AST/(U/L) 23.56±4.28 22.79±4.06 23.40±4.33 0.680 0.794 MHR 0.32±0.08 0.40±0.09* 0.57±0.11*# 7.842 0.001 NLR 1.56±0.44 2.01±0.50* 2.63±0.59*# 5.496 0.001 RDW/% 11.87±0.61 12.44±0.56* 13.95±0.52*# 1.377 0.018 LAD/mm 37.89±2.53 38.15±2.69 42.37±3.07*# 9.203 0.001 LVEF/% 53.44±8.07 52.77±8.99 51.85±8.62 0.625 0.401 收缩压/mmHg 137.92±11.16 139.65±12.08 135.44±12.71 0.918 0.336 舒张压/mmHg 84.21±7.35 87.33±10.59 85.97±9.67 0.885 0.409 BMI: 体质量指数; COPD: 慢性阻塞性肺疾病; RBC: 红细胞; WBC: 白细胞; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇; ALT: 谷氨酸氨基转移酶; AST: 天冬氨酸氨基转移酶; MHR: 单核细胞与高密度脂蛋白胆固醇比值; NLR: 中性粒细胞与淋巴细胞比值; RDW: 红细胞分布宽度; LAD: 左心房内径; LVEF: 左室射血分数。
与COPD组比较, *P < 0.05; 与COPD合并PAF组比较, #P < 0.05。2.2 MHR、NLR和RDW的Logistic回归分析
以是否发生PAF为因变量,以MHR、NLR和RDW为自变量,进行多因素二元Logistic回归分析,结果发现在校正了各项指标后, MHR(OR=1.438, 95%CI: 1.107~2.962, P=0.029)、NLR(OR=2.715, 95%CI: 1.066~8.537, P=0.042)是老年重度COPD患者发生PAF的独立预测因子。RDW样本均数在组间有差异,但经回归分析发现并非老年重度CODP患者发生PAF的独立预测因子(P=0.077)。以是否发生SAF为因变量,以MHR、NLR和RDW为自变量,进行多因素二元Logistic回归分析,结果发现在校正了各项指标后, MHR(OR=1.477, 95%CI: 1.091~2.951, P=0.031)、NLR(OR=2.628, 95%CI: 1.017~7.063, P=0.036)和RDW(OR=1.149, 95%CI: 1.003~4.655, P=0.047)均是老年重度CODP患者发生SAF的独立预测因子,见表 2。
表 2 炎性指标的多因素Logistic回归分析炎性指标 阵发性心房颤动 持续性心房颤动 OR 95%CI P OR 95%CI P MHR 1.438 1.107~2.962 0.029 1.477 1.091~2.951 0.031 NLR 2.715 1.066~8.537 0.042 2.628 1.017~7.063 0.036 RDW 1.034 0.084~3.945 0.077 1.149 1.003~4.655 0.047 2.3 MHR、NLR和RDW预测PAF和SAF发生的诊断效能
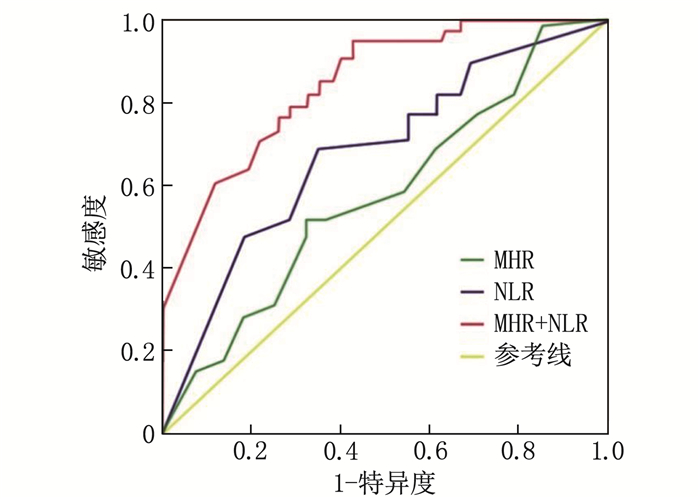
对MHR、NLR这2个独立预测因子进一步行ROC曲线分析,评估其预测老年重度COPD患者发生PAF的诊断效能,结果提示当单独使用NLR时,曲线下面积(AUC)为0.732(95%CI: 0.575~0.829), NLR临界值为1.930, 当NLR>1.930时, PAF发生率明显增加,敏感度为78%, 特异度为88%, 约登指数为0.791; 当单独使用MHR时, AUC为0.644(95%CI: 0.556~0.831), MHR临界值为0.405, 当MHR>0.405时, PAF发生率明显增加,敏感度为73%, 特异度为80%, 约登指数为0.653; 当NLR和MHR联合预测时,诊断效能最佳, AUC为0.803(95%CI: 0.619~0.897)。见表 3、图 1。
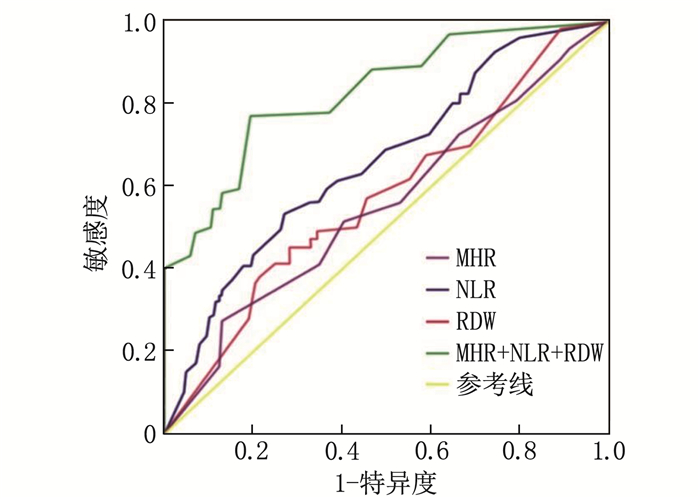
表 3 MHR、NLR预测PAF的诊断效能指标 AUC(95%CI) 约登指数 临界值 敏感度/% 特异度/% MHR 0.644(0.556~0.831) 0.653 0.405 73 80 NLR 0.732(0.575~0.829) 0.791 1.930 78 88 MHR联合NLR 0.803(0.619~0.897) — — — — 对MHR、NLR和RDW这3个独立预测因子进一步行ROC曲线分析,评估其预测老年重度COPD患者发生SAF的诊断效能,结果提示当单独使用RDW时, AUC为0.708(95%CI: 0.642~0.873), RDW临界值为13.165%,当RDW>13.165%时, SAF发生率明显增加,敏感度为94%, 特异度为80%, 约登指数为0.738; 当单独使用MHR时, AUC为0.693(95%CI: 0.519~0.766), MHR临界值为0.581, 当MHR>0.581时, SAF发生率明显增加,敏感度为83%, 特异度为92%, 约登指数为0.753; 当单独使用NLR时, AUC为0.736(95%CI: 0.549~0.822), NLR临界值为2.667, 当NLR>2.667时, SAF发生率明显增加,敏感度为91%, 特异度为87%, 约登指数为0.651; 当NLR、MHR和RDW联合预测时诊断效能最佳, AUC为0.824(95%CI: 0.738~0.916)。见表 4、图 2。
表 4 MHR、NLR和RDW预测SAF的诊断效能指标 AUC(95%CI) 约登指数 临界值 敏感度/% 特异度/% MHR 0.693(0.519~0.766) 0.753 0.581 83 92 NLR 0.736(0.549~0.822) 0.651 2.667 91 87 RDW 0.708(0.642~0.873) 0.738 13.165 94 80 MHR联合NLR及RDW 0.824(0.738~0.916) — — — — 3. 讨论
本研究初,作者随机抽取了本院近10年收治的300例COPD患者,按照COPD严重程度观察AF患病率,依次为轻度者AF患病率4.00%, 中度者5.67%, 重度者8.67%, 极重度者11.00%, 可见随着COPD病情的进展,合并AF的概率逐步增高。因此,本研究将受试人群集中在AF发病率较高的重度COPD患者,排除了不同COPD严重程度对RDW等炎性指标的影响[15]。
COPD与AF常常呈共患状态,且二者相互联系,相互促进[16]。鹿特丹的一项研究[17]发现, COPD人群要比非COPD人群并发AF的概率高28%, 在COPD急性加重期或者COPD频繁发作的患者中, AF发病率为非COPD人群的2倍。反向研究[18]还证实AF患者中合并COPD人群在导管消融术后复发、脑卒中和全因死亡率方面均显著高于非COPD人群。氧化应激(包括线粒体氧化应激)[19]和炎症反应[20]是COPD和AF发生、发展的共同致病机制。研究[17]证实COPD患者全身性炎症在AF发生的诸多驱动因素中至关重要。炎症反应引起AF的启动,而AF又导致炎症反应,从而促进AF的维持。同时,炎症反应还可导致炎症浸润、心肌细胞坏死和纤维化,进一步引发心房电重构及结构重构,从而促使AF的发生和持续[21-22]。由此可见,炎症反应是COPD患者并发AF的重要机制之一。
MHR是同时反映炎性与抗炎2个反向的复合指标,单核细胞生成于骨髓,可与巨噬细胞等共同分泌单核细胞趋化蛋白-1(MCP-1), MCP-1反过来又促进单核细胞表达黏附分子,诱导炎性介质分泌,最终导致炎症反应; HDL则具有拮抗单核细胞发挥抗炎的作用。既往研究[11]证实, MHR是AF导管消融术后复发、双腔起搏器植入术后发生无症状性AF、冠状动脉搭桥术后AF发作以及心肌梗死后AF发作的独立预测因子。本研究证实MHR对老年重度COPD患者发生AF和AF的严重程度具有诊断价值,且与NLR、RDW联合应用时诊断效能最佳。NLR反映了体内中性粒细胞与淋巴细胞水平的平衡状态。研究[23]认为, NLR参与了AF的发生、维持,其可作为冠状动脉搭桥患者术后并发AF、射频消融术后AF复发的独立预测因子。本研究证实NLR对老年重度COPD患者发生AF和AF的严重程度具有诊断价值,且与MHR、RDW联合应用时诊断效能最佳。RDW最初作为贫血的辅助诊断,目前认为RDW与心血管事件具有相关性[24]。研究[25]报道RDW对AF风险的评估具有重要价值, RDW值越高,发生AF风险越高, RDW是AF发生的独立危险因素。本研究证实RDW是老年重度COPD患者发生SAF的独立预测因子,尤其与MHR、NLR联合应用时诊断效能更佳,但对PAF无诊断价值。
本研究的创新: ①本研究探索了MHR、NLR和RDW在COPD人群中评估AF发病的应用价值; ②本研究证实了MHR、NLR可以作为老年COPD患者AF严重程度的分级指标,而RDW只在老年COPD合并SAF中具有一定价值,对合并PAF无诊断意义; ③为解决NLR、RDW在AF应用中尚存的争议提供了部分临床证据; ④将PAF与SAF分开研究,为提高COPD患者PAF的诊断率提供了一部分临床数据支撑。
本研究的不足: ①样本量较小,需进一步扩大样本量; ②由于COPD严重程度不同以及是否合并呼吸衰竭均对炎性指标有影响,因此本研究纳入对象局限于重度COPD患者,后续可进一步探索MHR、NLR和RDW与不同年龄、轻度、中度和极重度COPD患者发生AF的相关性。
综上所述,外周血MHR、NLR和RDW联合检测在预测老年重度COPD患者AF发生和AF严重程度方面具有重要的临床价值。
-
表 1 3组患者基线资料比较(x±s)[n(%)]
因素 COPD组(n=50) COPD合并PAF组(n=45) COPD合并SAF组(n=48) F/χ2 P 性别(男) 31(62.00) 26(57.78) 29(60.42) 1.342 0.516 年龄/岁 71.59±8.82 72.13±9.66 72.66±9.19 0.236 0.742 吸烟 11(22.00) 11(24.44) 12(25.00) 0.138 0.933 饮酒 19(38.00) 18(40.00) 21(43.75) 0.344 0.842 BMI/(kg/m2) 26.31±3.61 27.11±3.35 27.32±4.15 0.429 0.656 COPD病程/年 8.20±5.64 10.39±4.77 11.67±4.52 0.548 0.779 高血压 19(38.00) 20(44.44) 23(47.92) 1.012 0.603 糖尿病 4(8.00) 4(8.89) 6(12.50) 0.622 0.733 陈旧性心肌梗死 1(2.00) 1(2.22) 2(4.17) 0.503 0.778 脑梗死 6(12.00) 5(11.11) 6(12.50) 0.044 0.978 睡眠呼吸暂停 2(4.00) 2(4.44) 5(10.42) 2.090 0.352 甲状腺功能异常 0 2(4.44) 2(4.17) 2.219 0.330 RBC/(×1012/L) 4.70±0.80 4.55±0.77 4.11±0.72 0.734 0.844 WBC/(×109/L) 6.67±1.18 7.03±1.56 7.33±1.66 1.077 0.851 中性粒细胞计数/(×109/L) 4.16±0.77 4.55±0.81 4.91±0.71 0.655 0.328 单核细胞计数/(×109/L) 0.41±0.11 0.49±0.14* 0.58±0.17*# 0.572 0.011 淋巴细胞计数/(×109/L) 1.61±0.65 1.57±0.61 1.56±0.84 1.619 0.874 总胆固醇/(mmol/L) 4.37±0.69 4.28±0.88 4.41±0.91 0.832 0.526 甘油三酯/(mmol/L) 1.25±0.33 1.43±0.50 1.36±0.48 1.049 0.477 HDL-C/(mmol/L) 1.29±0.29 1.12±0.30* 0.97±0.24*# 6.526 0.041 LDL-C/(mmol/L) 2.72±0.60 2.90±0.83 2.86±0.84 0.573 0.832 肌酐/(mmol/L) 70.65±15.13 72.38±19.45 78.14±18.03 0.731 0.590 ALT/(U/L) 22.49±4.06 21.38±4.72 21.10±4.49 0.897 0.512 AST/(U/L) 23.56±4.28 22.79±4.06 23.40±4.33 0.680 0.794 MHR 0.32±0.08 0.40±0.09* 0.57±0.11*# 7.842 0.001 NLR 1.56±0.44 2.01±0.50* 2.63±0.59*# 5.496 0.001 RDW/% 11.87±0.61 12.44±0.56* 13.95±0.52*# 1.377 0.018 LAD/mm 37.89±2.53 38.15±2.69 42.37±3.07*# 9.203 0.001 LVEF/% 53.44±8.07 52.77±8.99 51.85±8.62 0.625 0.401 收缩压/mmHg 137.92±11.16 139.65±12.08 135.44±12.71 0.918 0.336 舒张压/mmHg 84.21±7.35 87.33±10.59 85.97±9.67 0.885 0.409 BMI: 体质量指数; COPD: 慢性阻塞性肺疾病; RBC: 红细胞; WBC: 白细胞; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇; ALT: 谷氨酸氨基转移酶; AST: 天冬氨酸氨基转移酶; MHR: 单核细胞与高密度脂蛋白胆固醇比值; NLR: 中性粒细胞与淋巴细胞比值; RDW: 红细胞分布宽度; LAD: 左心房内径; LVEF: 左室射血分数。
与COPD组比较, *P < 0.05; 与COPD合并PAF组比较, #P < 0.05。表 2 炎性指标的多因素Logistic回归分析
炎性指标 阵发性心房颤动 持续性心房颤动 OR 95%CI P OR 95%CI P MHR 1.438 1.107~2.962 0.029 1.477 1.091~2.951 0.031 NLR 2.715 1.066~8.537 0.042 2.628 1.017~7.063 0.036 RDW 1.034 0.084~3.945 0.077 1.149 1.003~4.655 0.047 表 3 MHR、NLR预测PAF的诊断效能
指标 AUC(95%CI) 约登指数 临界值 敏感度/% 特异度/% MHR 0.644(0.556~0.831) 0.653 0.405 73 80 NLR 0.732(0.575~0.829) 0.791 1.930 78 88 MHR联合NLR 0.803(0.619~0.897) — — — — 表 4 MHR、NLR和RDW预测SAF的诊断效能
指标 AUC(95%CI) 约登指数 临界值 敏感度/% 特异度/% MHR 0.693(0.519~0.766) 0.753 0.581 83 92 NLR 0.736(0.549~0.822) 0.651 2.667 91 87 RDW 0.708(0.642~0.873) 0.738 13.165 94 80 MHR联合NLR及RDW 0.824(0.738~0.916) — — — — -
[1] RAMALHO S H R, SHAH A M. Lung function and cardiovascular disease: a link[J]. Trends Cardiovasc Med, 2021, 31(2): 93-98. doi: 10.1016/j.tcm.2019.12.009
[2] DECRAMER M, JANSSENS W, MIRAVITLLES M. Chronic obstructive pulmonary disease[J]. Lancet, 2012, 379(9823): 1341-1351. doi: 10.1016/S0140-6736(11)60968-9
[3] CHAN C S, LIN Y S, LIN Y K, et al. Atrial arrhythmogenesis in a rabbit model of chronic obstructive pulmonary disease[J]. Transl Res, 2020, 223: 25-39. doi: 10.1016/j.trsl.2020.04.013
[4] NOUBIAP J J, TU S J, EMAMI M, et al. Incident atrial fibrillation in relation to ventilatory parameters: a prospective cohort study[J]. Can J Cardiol, 2023, 39(5): 614-622. doi: 10.1016/j.cjca.2023.02.004
[5] HEALEY J S, ROBERTS J D, FIELD T S. Who is at risk of atrial fibrillation?[J]. Heart Rhythm, 2021, 18(6): 853-854. doi: 10.1016/j.hrthm.2021.02.019
[6] WANG Q C, WANG Z Y. Big data and atrial fibrillation: current understanding and new opportunities[J]. J Cardiovasc Transl Res, 2020, 13(6): 944-952. doi: 10.1007/s12265-020-10008-5
[7] 崔玲玲, 王颖, 孙梦妍, 等. 衰弱对老年心房颤动住院患者预后的影响[J]. 中国心血管杂志, 2022, 27(1): 23-27. https://www.cnki.com.cn/Article/CJFDTOTAL-XIXG202201004.htm [8] LABAKI W W, ROSENBERG S R. Chronic obstructive pulmonary disease (japanese version)[J]. Ann Intern Med, 2020, 173(3): JITC17-JITC32. doi: 10.7326/IsTranslatedFrom_AITC202008040_Japanese
[9] JENKINS C. Differences between men and women with chronic obstructive pulmonary disease[J]. Clin Chest Med, 2021, 42(3): 443-456. doi: 10.1016/j.ccm.2021.06.001
[10] DURHEIM M T, HOLMES D N, BLANCO R G, et al. Characteristics and outcomes of adults with chronic obstructive pulmonary disease and atrial fibrillation[J]. Heart, 2018, 104(22): 1850-1858. doi: 10.1136/heartjnl-2017-312735
[11] 王海斌, 盖红哲, 王玉霞, 等. 单核细胞与高密度脂蛋白胆固醇比值对老年ST段抬高型心肌梗死患者预后的预测价值[J]. 中华老年心脑血管病杂志, 2022, 24(1): 47-50. https://www.cnki.com.cn/Article/CJFDTOTAL-LNXG202201013.htm [12] 刘金艳, 尹育华, 刘建伟, 等. 红细胞分布宽度和半乳糖凝集素3及中性粒细胞淋巴细胞比值与冠心病并发心房颤动关系及意义[J]. 中国心血管病研究, 2023, 21(1): 40-44. https://www.cnki.com.cn/Article/CJFDTOTAL-XXGZ202301009.htm [13] AGUSTÍA, CELLI B R, CRINER G J, et al. Global initiative for chronic obstructive lung disease 2023 report: gold executive summary[J]. Eur Respir J, 2023, 61(4): 2300239. doi: 10.1183/13993003.00239-2023
[14] HINDRICKS G, POTPARA T, DAGRES N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): the Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC[J]. Eur Heart J, 2021, 42(5): 373-498. doi: 10.1093/eurheartj/ehaa612
[15] 王迪, 张丽华, 刘艳伟, 等. 联合检测RDW、D-二聚体和BNP在慢性阻塞性肺病病情评估及预后中的价值[J]. 分子诊断与治疗杂志, 2021, 13(12): 2038-2041, 2046. https://www.cnki.com.cn/Article/CJFDTOTAL-YXYQ202112032.htm [16] RODRÍGUEZ-MAÍERO M, LÑPEZ-PARDO E, CORDERO A, et al. A prospective study of the clinical outcomes and prognosis associated with comorbid COPD in the atrial fibrillation population[J]. Int J Chron Obstruct Pulmon Dis, 2019, 14: 371-380. doi: 10.2147/COPD.S174443
[17] GRYMONPREZ M, VAKAET V, KAVOUSI M, et al. Chronic obstructive pulmonary disease and the development of atrial fibrillation[J]. Int J Cardiol, 2019, 276: 118-124. doi: 10.1016/j.ijcard.2018.09.056
[18] KOCHHÄUSER S, DECHERING D G, TROUGHT K, et al. Predictors for progression of atrial fibrillation in patients awaiting atrial fibrillation ablation[J]. Can J Cardiol, 2016, 32(11): 1348-1354. doi: 10.1016/j.cjca.2016.02.031
[19] ZHOU L L, LIU Y, WANG Z J, et al. Activation of NADPH oxidase mediates mitochondrial oxidative stress and atrial remodeling in diabetic rabbits[J]. Life Sci, 2021, 272: 119240. doi: 10.1016/j.lfs.2021.119240
[20] WANG X S, WANG Z Q, TANG D H. Aerobic exercise alleviates inflammation, oxidative stress, and apoptosis in mice with chronic obstructive pulmonary disease[J]. Int J Chronic Obstr Pulm Dis, 2021, 16: 1369-1379. doi: 10.2147/COPD.S309041
[21] VAN WAGONER D R. Editorial commentary: atrial fibrillation risk: can we see it now?[J]. Trends Cardiovasc Med, 2022, 32(1): 32-33. doi: 10.1016/j.tcm.2021.01.005
[22] LANCELLOTTI P, PIETTE C. Special issue on atrial fibrillation[J]. Acta Cardiol, 2023, 78(3): 269-273.
[23] SHAO Q M, CHEN K Y, RHA S W, et al. Usefulness of neutrophil/lymphocyte ratio as a predictor of atrial fibrillation: a meta-analysis[J]. Arch Med Res, 2015, 46(3): 199-206.
[24] 胡永玮, 张晓敏. 红细胞分布宽度联合碱性磷酸酶对维持性血液透析患者心血管事件的预测价值[J]. 实用临床医药杂志, 2022, 26(24): 102-106. doi: 10.7619/jcmp.20221617 [25] 石树青, 石晶晶, 王丹丹, 等. 红细胞分布宽度水平与心房颤动发生/复发关系的Meta分析[J]. 中国循证心血管医学杂志, 2021, 13(3): 268-273. https://www.cnki.com.cn/Article/CJFDTOTAL-PZXX202103003.htm -
期刊类型引用(1)
1. 曹娟,钟紫萱. 急性脑梗死患者神经功能损伤程度与NK细胞、NLR、Hcy的关系分析. 中国医学创新. 2024(19): 135-139 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
