Identification characteristic of benign and malignant pulmonary nodules and differential diagnostic indicators of the infiltration degree of malignant ground-glass nodules
-
摘要:目的
探讨鉴别肺结节良恶性的临床特征、CT影像特征以及诊断恶性磨玻璃结节(GGN)浸润程度的指标。
方法选取行胸腔镜手术治疗的205例肺结节患者作为研究对象, 根据术后病理结果分为良性结节组、恶性结节组,分析2组患者的临床特征、影像学特征。根据术后病理结果(浸润程度),将恶性GGN患者进一步分为侵袭前病变(PL)组、微浸润性腺癌(MIA)组、浸润性腺癌(IAC)组,进行定量分析和定性分析,筛选恶性GGN浸润程度的独立影响因素并评估其诊断价值。
结果良性结节组与恶性结节组的结节位置、结节类型、胸膜凹陷征、血管集束征比较,差异有统计学意义(P < 0.05); 多因素Logistic回归分析结果显示,结节类型、胸膜凹陷征、血管集束征均为肺结节良恶性的独立影响因素(P < 0.05)。PL组与MIA组年龄、血管集束征、结节长径、平均CT值、结节类型比较,差异有统计学意义(P < 0.05); MIA组与IAC组结节长径、平均CT值、实性成分长径、血管集束征、胸膜凹陷征比较,差异有统计学意义(P < 0.05); 多因素Logistic回归分析结果显示,结节长径、平均CT值为恶性GGN浸润程度的独立影响因素(P < 0.05)。受试者工作特征曲线分析结果显示,结节长径、平均CT值单独鉴别诊断PL与MIA的曲线下面积(AUC)分别为0.805、0.857, 截断值分别为7.2 mm、-612.3 HU, 两者联合鉴别诊断的AUC为0.923; 结节长径、平均CT值单独鉴别诊断MIA与IAC的AUC分别为0.860、0.703, 截断值分别为16.2 mm、-338.1 HU, 两者联合鉴别诊断的AUC为0.893。
结论对于GGN, 特别是存在胸膜凹陷征、血管集束征者,应高度怀疑恶性肺结节的可能。肺结节长径、平均CT值均对恶性GGN浸润程度具有一定鉴别诊断价值,且两者联合应用的价值更高。
Abstract:ObjectiveTo investigate the clinical features, CT imaging features of benign and malignant pulmonary nodules, as well as the indicators for diagnosing the infiltration degree of malignant ground-glass nodules (GGN).
MethodsA total of 205 patients with pulmonary nodules who underwent thoracoscopic surgery were selected as research subjects. According to the postoperative pathological results, they were divided into benign nodule group and malignant nodule group. The clinical features and imaging features of the two groups were analyzed. Based on the postoperative pathological results (infiltration degree), the patients with malignant GGN were further divided into preinvasive lesion (PL) group, minimally invasive adenocarcinoma (MIA) group, and invasive adenocarcinoma (IAC) group. Quantitative and qualitative analyses were conducted to screen for independent influencing factors of malignant GGN infiltration degree and evaluate their diagnostic value.
ResultsThere were significant differences in nodule location, nodule type, pleural indentation sign, and vascular clustering sign between the benign nodule group and the malignant nodule group (P < 0.05). Multivariate Logistic regression analysis showed that nodule type, pleural indentation sign, and vascular clustering sign were independent influencing factors of benign and malignant pulmonary nodules (P < 0.05). There were significant differences in age, vascular clustering sign, nodule length, average CT value, and nodule type between the PL group and the MIA group (P < 0.05); there were significant differences in nodule length, average CT value, solid component length, vascular clustering sign, and pleural indentation sign between the MIA group and the IAC group (P < 0.05). Multivariate Logistic regression analysis showed that nodule length and average CT value were independent influencing factors of malignant GGN infiltration degree (P < 0.05). The receiver operating characteristic curve analysis showed that the area under the curve (AUC) of nodule length and average CT value for differential diagnosis of PL and MIA were 0.805 and 0.857, respectively, with cutoff values of 7.2 mm and -612.3 HU, respectively. The AUC of their combined diagnosis was 0.923; the AUC of nodule length and average CT value for differential diagnosis of MIA and IAC were 0.860 and 0.703, respectively, with cutoff values of 16.2 mm and -338.1 HU, respectively. The AUC of their combined diagnosis was 0.893.
ConclusionFor GGN, especially those with pleural indentation sign and vascular clustering sign, a high suspicion of malignant pulmonary nodules should be raised. The length and average CT value of pulmonary nodules have certain diagnostic value for the infiltration degree of malignant GGN, and their combined application has higher diagnostic value.
-
随着全民健康意识的增强和CT体检筛查技术的普及,近年来肺部结节的检出率不断升高[1]。根据是否含有实性成分以及实性成分的比例,结节可分为纯磨玻璃结节(pGGN)、伴有实性成分的混合性磨玻璃结节(mGGN)和实性结节(SN)。约5%的肺结节最终可能发展为肺癌[2], 其中约18%的pGGN和约63%的mGGN最终发展为肺癌[3]。ⅠA期肺癌患者术后5年生存率可达60%, 晚期肺癌患者术后5年生存率则仅为17%[4]。尽早发现并及时处理高危肺结节具有非常重要的临床意义,但肺结节良恶性鉴别仍是困扰临床医生的难题。本研究探讨肺结节临床特征、CT影像特征与良恶性的关系,并评估相关特征对恶性磨玻璃结节(GGN)浸润程度的鉴别诊断价值,现报告如下。
1. 资料与方法
1.1 一般资料
选取2018年1月—2023年4月于南京鼓楼医院集团仪征医院接受胸腔镜手术治疗的205例肺结节患者作为研究对象,患者均无明显临床症状,于体检或检查时意外发现肺部结节。纳入标准: ①接受手术治疗,有明确术后病理检查结果,非转移性肿瘤者; ②临床资料完整者; ③有高分辨率CT影像资料,病灶最大径≤3 cm者; ④结节未行放疗、消融等治疗者。205例患者中,男82例,女123例; 年龄28~86岁,平均(61.1±10.0)岁; 合并高血压病78例,合并糖尿病26例; 术前有肿瘤手术史者16例; 肺结节类型为pGGN 14例、mGGN 111例、SN 80例,结节长径5.6~30.0 mm; 结节位置为左肺上叶49例、左肺下叶43例、右肺上叶73例、右肺中叶10例、右肺下叶30例; 术后病理结果显示良性结节32例、恶性结节173例。本研究经医院伦理委员会审核批准。
1.2 方法
1.2.1 CT扫描
使用GE 64排螺旋CT进行扫描,扫描范围自肺尖至肺底部,一次吸气后屏气完成,扫描层厚1.25 mm, 管电压120 kV, 管电流200~340 mA, 并设置肺窗(窗宽1 500 HU, 窗位-600 HU)、纵隔窗(窗宽400 HU, 窗位50 HU)数据。
1.2.2 图像重建及分析
在工作站进行后处理,包括冠状面、矢状面、多平面重建(MPR)、最大密度投影(MIP)、最小密度投影(MinIP)。图像后处理后,2位副高职称医师共同阅片,观察病灶形态,测量病灶大小、实性成分长径和CT值。①病灶形态观察,包括肺结节类型(pGGN、mGGN、SN)、病灶边缘特征(光滑、分叶、毛刺)和有无血管集束征、空泡征、胸膜凹陷征。②病灶大小测量,选取结节最大层面测量最长径及垂直最大短径。③实性成分测量,在肺窗影像上测量最大实性成分的最长径。④ CT值测量,在病灶的不同位置测量2次,避开同层面血管,取其平均值。
1.2.3 手术方法
实施全身麻醉、双腔气管插管后,使患者取健侧卧位,于腋前线第4或第5肋间做3 cm切口,置入切口保护套,胸腔镜及所有手术器械均经此唯一切口进出胸腔。对于肺外周结节,先以直线缝合器楔形切除肺结节,送检快速病理,根据病理类型再行肺段切除、肺叶切除; 对于非外周结节,行肺段切除、肺叶切除,手术顺序一般按照“单向式”进行,对肿瘤患者则清扫纵隔淋巴结,留置1根F24胸管至胸顶,逐层缝合切口。
1.2.4 病理诊断
病理诊断结果由病理科2名高级职称医师讨论后确定。按照2015年世界卫生组织国际肺腺癌分类标准,腺癌可分为非典腺瘤样增生(AAH)、原位腺癌(AIS)、微浸润性腺癌(MIA)、浸润性腺癌(IAC), 其中AAH与AIS称为侵袭前病变(PL), 所有恶性结节经免疫组化法进一步证实。
1.3 统计学处理
采用SPSS 21.0统计学软件分析数据,计量资料以(x±s)表示,组间比较采用t检验,计数资料以[n(%)]表示,比较采用χ2检验。通过单因素分析、多因素Logistic回归分析明确可鉴别肺结节良恶性的临床特征、影像学特征; 绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC)和截断值,评估相关指标对恶性GGN浸润程度的鉴别诊断效能。P < 0.05为差异有统计学意义。
2. 结果
2.1 术后病理结果
205例肺结节患者均接受胸腔镜手术治疗,根据术后病理结果,将32例良性肺结节(炎性假瘤9例,肉芽肿7例,错构瘤2例,硬化性血管瘤3例,孤立性纤维瘤2例,间质性肺炎3例,结核球2例,其他4例)患者纳入良性结节组,将173例恶性肺结节(鳞癌6例,腺癌166例,腺鳞癌1例)患者纳入恶性结节组。
2.2 临床特征、影像学特征比较
单因素分析结果显示,恶性结节组患者年龄、性别、高血压病史、糖尿病史、肿瘤史、分叶征、毛刺征、结节长径、结节短径与良性结节组比较,差异均无统计学意义(P>0.05); 2组结节位置、结节类型、胸膜凹陷征、血管集束征比较,差异有统计学意义(P < 0.05), 见表 1。良性结节组中, GGN占25.0%(8/32), 恶性结节组中, GGN占67.6%(117/173)。多因素Logistic回归分析结果显示,结节类型、胸膜凹陷征、血管集束征均为肺结节良恶性的独立影响因素(P < 0.05), 见表 2。
表 1 良性结节组与恶性结节组患者临床资料比较(x±s)[n(%)]指标 分类 良性结节组(n=32) 恶性结节组(n=173) t/χ2 P 年龄/岁 60.3±9.0 61.2±10.2 -0.557 0.578 性别 男 16(50.0) 66(38.2) 1.580 0.209 女 16(50.0) 107(61.8) 高血压病 有 14(43.8) 64(37.0) 0.523 0.470 无 18(56.2) 109(63.0) 糖尿病 有 5(15.6) 21(12.1) 0.065 0.799 无 27(84.4) 152(87.9) 肿瘤史 有 1(3.1) 15(8.7) 0.512 0.474 无 31(96.9) 158(91.3) 结节类型 纯磨玻璃结节 0 14(8.1) 21.115 < 0.001 混合性磨玻璃结节 8(25.0) 103(59.5) 实性结节 24(75.0) 56(32.4) 结节长径/mm 14.8±5.8 17.3±7.6 -1.133 0.259 结节短径/mm 11.2±4.4 13.2±6.3 -1.178 0.087 胸膜凹陷征 有 10(31.2) 99(57.2) 7.318 0.007 无 22(68.8) 74(42.8) 结节形态 分叶征 11(34.4) 84(48.6) 2.184 0.139 毛刺征 3(9.4) 40(23.1) 3.079 0.079 血管集束征 有 11(34.4) 117(67.6) 12.734 < 0.001 无 21(65.6) 56(32.4) 结节位置 左上叶 4(12.5) 45(26.0) 10.108 0.039 左下叶 13(40.6) 30(17.4) 右上叶 10(31.3) 63(36.4) 右中叶 2(6.2) 8(4.6) 右下叶 3(9.4) 27(15.6) 表 2 肺结节良恶性的多因素Logistic回归分析结果变量 回归系数 标准误 Wals P OR 95%CI 结节位置 0.108 0.162 0.442 0.506 1.114 0.810~1.532 结节类型 0.927 0.252 13.511 <0.001 2.526 1.541~4.141 胸膜凹陷征 1.063 0.464 5.259 0.022 2.895 1.167~7.180 血管集束征 0.971 0.441 4.841 0.028 2.641 1.112~6.272 常量 -1.211 0.708 2.924 0.087 0.298 — 2.3 GGN的影像学特征与病理类型
对117例恶性GGN进一步行亚组分析,根据不同病理类型(浸润程度)将患者分为PL组11例(结节类型均为pGGN)、MIA组45例、IAC组61例(结节类型均为mGGN)。单因素分析结果显示, PL组与MIA组性别、结节位置、分叶征、毛刺征、胸膜凹陷征比较,差异无统计学意义(P>0.05), PL组与MIA组年龄、血管集束征、结节长径、平均CT值、结节类型比较,差异有统计学意义(P < 0.05); MIA组与IAC组年龄、性别、结节位置、分叶征、毛刺征、结节类型比较,差异无统计学意义(P>0.05), MIA组与IAC组结节长径、平均CT值、实性成分长径、血管集束征、胸膜凹陷征比较,差异有统计学意义(P < 0.05), 见表 3。多因素Logistic回归分析结果显示,结节长径、平均CT值为恶性GGN浸润程度的独立影响因素(P < 0.05), 见表 4、表 5。
表 3 不同浸润程度恶性GGN患者的临床资料比较(x±s)[n(%)]指标 分类 PL组(n=11) MIA组(n=45) IAC组(n=61) PL组对比MIA组 MIA组对比IAC组 t/χ2 P t/χ2 P 年龄/岁 51.9±12.0 59.6±9.7 62.3±9.9 -2.252 0.028 -1.400 0.165 性别 男 2(18.2) 14(31.1) 29(47.5) 0.229 0.632 2.899 0.089 女 9(81.8) 31(68.9) 32(52.5) 结节位置 左上叶 4(36.3) 8(17.8) 17(27.9) 4.999* 0.256* 3.210 0.546 左下叶 2(18.2) 7(15.6) 7(11.5) 右上叶 3(27.3) 20(44.4) 26(42.6) 右中叶 2(18.2) 3(6.6) 1(1.6) 右下叶 0 7(15.6) 10(16.4) 结节长径/mm 8.2±2.1 11.6±3.7 19.5±7.0 -2.922 0.005 -6.888 < 0.001 平均CT值/HU -627.3±75.6 -472.4±127.2 -352.1±176.1 -3.859 < 0.001 -3.892 < 0.001 实性成分长径/mm — 4.4±1.4 10.1±3.6 — — -10.065 < 0.001 胸膜凹陷征 有 1(9.1) 13(28.9) 42(68.9) 0.943 0.332 15.567 < 0.001 无 10(90.9) 32(71.1) 19(31.1) 结节形态 分叶征 0 13(28.9) 29(47.5) 2.676 0.102 3.766 0.052 毛刺征 0 2(4.4) 10(16.4) — 1.000* 3.683 0.055 血管集束征 有 1(9.1) 23(51.1) 50(82.0) 4.773 0.029 11.500 0.001 无 10(90.9) 22(48.9) 11(18.0) 结节类型 pGGO 11(100.0) 3(6.7) 0 36.240 < 0.001 — 0.074* mGGO 0 42(93.3) 61(100.0) *: Fisher确切概率法。 表 4 PL与MIA的多因素Logistic回归分析结果变量 回归系数 标准误 Wals P OR 95%CI 结节长径 0.621 0.298 4.347 0.037 1.860 1.038~3.334 平均CT值 0.019 0.008 5.849 0.016 1.019 1.004~1.034 血管集束征 1.187 1.392 0.727 0.394 3.277 0.214~50.207 年龄 0.072 0.053 1.866 0.172 1.075 0.969~1.191 常量 2.113 4.040 0.273 0.601 8.272 — 表 5 MIA与IAC的多因素Logistic回归分析结果变量 回归系数 标准误 Wals P OR 95%CI 结节长径 0.322 0.077 17.355 < 0.001 1.380 1.186~1.605 平均CT值 0.006 0.002 6.899 0.009 1.006 1.001~1.010 血管集束征 0.059 0.628 0.009 0.925 1.061 0.310~3.633 胸膜凹陷征 1.014 0.554 3.359 0.067 2.758 0.932~8.161 常量 -2.536 1.208 4.409 0.036 0.079 — 2.4 相关指标对恶性GGN浸润程度的鉴别诊断价值
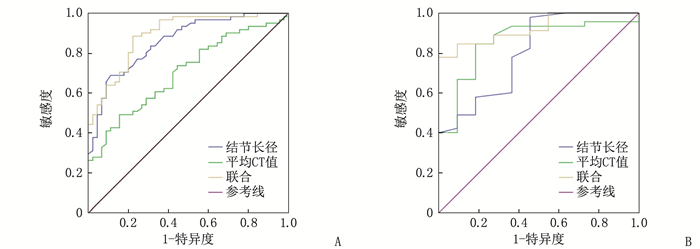
ROC曲线分析结果显示,结节长径、平均CT值单独鉴别诊断PL与MIA的AUC分别为0.805、0.857, 截断值分别为7.2 mm、-612.3 HU, 两者联合鉴别诊断的AUC为0.923; 结节长径、平均CT值单独鉴别诊断MIA与IAC的AUC分别为0.860、0.703, 截断值分别为16.2 mm、-338.1 HU, 两者联合鉴别诊断的AUC为0.893, 见图 1、表 6。
表 6 结节长径、平均CT值单独及联合应用对恶性GGN浸润程度的鉴别诊断效能变量 PL与MIA MIA与IAC AUC 敏感度 特异度 截断值 AUC 敏感度 特异度 截断值 结节长径/mm 0.805 0.978 0.545 7.2 0.860 0.689 0.889 16.2 平均CT值/HU 0.857 0.844 0.818 -612.3 0.703 0.492 0.844 -338.1 联合 0.923 0.778 0.956 — 0.893 0.885 0.778 — 3. 讨论
2020年全球癌症流行病学数据库(GLOBOCAN) 估算数据[5]显示,肺癌作为临床常见癌症,仍是世界范围内癌症相关死亡的主要原因。肺癌早期表现为无症状的肺结节,而CT检查因对肺结节具有较高的敏感度及特异度,已经成为肺癌筛查和健康体检的常规项目。通过CT影像特征进行定性或定量分析,可判断肺结节良恶性,尽早识别高危结节并及时干预,还可避免过度诊断及过度治疗。
文献[12]报道,长径大于20 mm的肺结节恶性概率为64%~82%, 而长径5~10 mm的肺结节恶性概率则为6%~28%。GGN大小被认为是其恶性程度的独立预测因子,即结节的直径越大,发生侵袭的风险越高[13-14]。YANG Y等[15]通过ROC曲线分析发现,结节直径大于1.1 cm时,对肿瘤侵袭性的诊断敏感度可达95.8%。本研究中, PL组、MIA组、IAC组平均病灶长径分别为8.2、11.6、19.5 mm, 随着结节直径的增加,病理等级(侵袭性)不断升高。进一步的ROC曲线分析结果显示,结节长径鉴别诊断PL与MIA的AUC为0.805, 截断值为7.2 mm, 敏感度、特异度分别为0.978、0.545, 结节长径鉴别诊断MIA与IAC的AUC分别为0.860, 截断值为16.2 mm, 敏感度、特异度分别为0.689、0.889, 提示结节大小对病理等级判断具有重要意义。
GGN从PL发展到MIA再到IAC是典型腺癌的病理发展过程, GGN的CT值测量在病理诊断中具有重要意义[16], 平均CT值可反映病灶密度,间接反映结节内部的病理改变,可辅助判断肺癌的病理类型。平均CT值可用于肿瘤性肺GGN的定性诊断,特别是小于1 cm的GGN[17]。KITAMI A等[18]对78例GGN进行分析发现,最大径≤10 mm且CT值≤-600 HU的GGN均无浸润性病变, 21例最大径>10 mm且CT值>-600 HU的GGN为浸润性病变。相关研究[19]显示,平均CT值与腺癌浸润程度呈正相关,对IAC的预测价值最高,临界值为-507 HU。本研究中, PL组、MIA组、IAC组的平均CT值分别为-627.3、-472.4、-352.1 HU, 差异有统计学意义; 平均CT值鉴别诊断PL与MIA的AUC为0.857, 截断值为-612.3 HU, 敏感度、特异度分别为0.844、0.818; 平均CT值鉴别诊断MIA与IAC的AUC为0.703, 截断值为-338.1 HU, 敏感度、特异度分别为0.492、0.844, 提示平均CT值对病理等级判断有一定参考价值; 结节长径、平均CT值联合应用鉴别诊断PL与MIA、MIA与IAC的AUC分别为0.923、0.893, 大于单独应用时的AUC, 更有利于GGN病理等级的诊断。
综上所述,对于GGN, 特别是存在胸膜凹陷征、血管集束征者,应高度怀疑恶性肺结节的可能。肺结节长径、平均CT值均对恶性GGN的浸润程度具有一定鉴别诊断价值,且联合应用时诊断效能更高。但本研究为回顾性研究,且仅选取手术治疗的肺结节患者作为研究对象,良性肺结节组样本量偏少,存在一定选择偏倚,未来还需深入开展大样本量的研究进一步加以验证。
-
表 1 良性结节组与恶性结节组患者临床资料比较(x±s)[n(%)]
指标 分类 良性结节组(n=32) 恶性结节组(n=173) t/χ2 P 年龄/岁 60.3±9.0 61.2±10.2 -0.557 0.578 性别 男 16(50.0) 66(38.2) 1.580 0.209 女 16(50.0) 107(61.8) 高血压病 有 14(43.8) 64(37.0) 0.523 0.470 无 18(56.2) 109(63.0) 糖尿病 有 5(15.6) 21(12.1) 0.065 0.799 无 27(84.4) 152(87.9) 肿瘤史 有 1(3.1) 15(8.7) 0.512 0.474 无 31(96.9) 158(91.3) 结节类型 纯磨玻璃结节 0 14(8.1) 21.115 < 0.001 混合性磨玻璃结节 8(25.0) 103(59.5) 实性结节 24(75.0) 56(32.4) 结节长径/mm 14.8±5.8 17.3±7.6 -1.133 0.259 结节短径/mm 11.2±4.4 13.2±6.3 -1.178 0.087 胸膜凹陷征 有 10(31.2) 99(57.2) 7.318 0.007 无 22(68.8) 74(42.8) 结节形态 分叶征 11(34.4) 84(48.6) 2.184 0.139 毛刺征 3(9.4) 40(23.1) 3.079 0.079 血管集束征 有 11(34.4) 117(67.6) 12.734 < 0.001 无 21(65.6) 56(32.4) 结节位置 左上叶 4(12.5) 45(26.0) 10.108 0.039 左下叶 13(40.6) 30(17.4) 右上叶 10(31.3) 63(36.4) 右中叶 2(6.2) 8(4.6) 右下叶 3(9.4) 27(15.6) 表 2 肺结节良恶性的多因素Logistic回归分析结果
变量 回归系数 标准误 Wals P OR 95%CI 结节位置 0.108 0.162 0.442 0.506 1.114 0.810~1.532 结节类型 0.927 0.252 13.511 <0.001 2.526 1.541~4.141 胸膜凹陷征 1.063 0.464 5.259 0.022 2.895 1.167~7.180 血管集束征 0.971 0.441 4.841 0.028 2.641 1.112~6.272 常量 -1.211 0.708 2.924 0.087 0.298 — 表 3 不同浸润程度恶性GGN患者的临床资料比较(x±s)[n(%)]
指标 分类 PL组(n=11) MIA组(n=45) IAC组(n=61) PL组对比MIA组 MIA组对比IAC组 t/χ2 P t/χ2 P 年龄/岁 51.9±12.0 59.6±9.7 62.3±9.9 -2.252 0.028 -1.400 0.165 性别 男 2(18.2) 14(31.1) 29(47.5) 0.229 0.632 2.899 0.089 女 9(81.8) 31(68.9) 32(52.5) 结节位置 左上叶 4(36.3) 8(17.8) 17(27.9) 4.999* 0.256* 3.210 0.546 左下叶 2(18.2) 7(15.6) 7(11.5) 右上叶 3(27.3) 20(44.4) 26(42.6) 右中叶 2(18.2) 3(6.6) 1(1.6) 右下叶 0 7(15.6) 10(16.4) 结节长径/mm 8.2±2.1 11.6±3.7 19.5±7.0 -2.922 0.005 -6.888 < 0.001 平均CT值/HU -627.3±75.6 -472.4±127.2 -352.1±176.1 -3.859 < 0.001 -3.892 < 0.001 实性成分长径/mm — 4.4±1.4 10.1±3.6 — — -10.065 < 0.001 胸膜凹陷征 有 1(9.1) 13(28.9) 42(68.9) 0.943 0.332 15.567 < 0.001 无 10(90.9) 32(71.1) 19(31.1) 结节形态 分叶征 0 13(28.9) 29(47.5) 2.676 0.102 3.766 0.052 毛刺征 0 2(4.4) 10(16.4) — 1.000* 3.683 0.055 血管集束征 有 1(9.1) 23(51.1) 50(82.0) 4.773 0.029 11.500 0.001 无 10(90.9) 22(48.9) 11(18.0) 结节类型 pGGO 11(100.0) 3(6.7) 0 36.240 < 0.001 — 0.074* mGGO 0 42(93.3) 61(100.0) *: Fisher确切概率法。 表 4 PL与MIA的多因素Logistic回归分析结果
变量 回归系数 标准误 Wals P OR 95%CI 结节长径 0.621 0.298 4.347 0.037 1.860 1.038~3.334 平均CT值 0.019 0.008 5.849 0.016 1.019 1.004~1.034 血管集束征 1.187 1.392 0.727 0.394 3.277 0.214~50.207 年龄 0.072 0.053 1.866 0.172 1.075 0.969~1.191 常量 2.113 4.040 0.273 0.601 8.272 — 表 5 MIA与IAC的多因素Logistic回归分析结果
变量 回归系数 标准误 Wals P OR 95%CI 结节长径 0.322 0.077 17.355 < 0.001 1.380 1.186~1.605 平均CT值 0.006 0.002 6.899 0.009 1.006 1.001~1.010 血管集束征 0.059 0.628 0.009 0.925 1.061 0.310~3.633 胸膜凹陷征 1.014 0.554 3.359 0.067 2.758 0.932~8.161 常量 -2.536 1.208 4.409 0.036 0.079 — 表 6 结节长径、平均CT值单独及联合应用对恶性GGN浸润程度的鉴别诊断效能
变量 PL与MIA MIA与IAC AUC 敏感度 特异度 截断值 AUC 敏感度 特异度 截断值 结节长径/mm 0.805 0.978 0.545 7.2 0.860 0.689 0.889 16.2 平均CT值/HU 0.857 0.844 0.818 -612.3 0.703 0.492 0.844 -338.1 联合 0.923 0.778 0.956 — 0.893 0.885 0.778 — -
[1] QI L L, WU B T, TANG W, et al. Long-term follow-up of persistent pulmonary pure ground-glass nodules with deep learning-assisted nodule segmentation[J]. Eur Radiol, 2020, 30(2): 744-755. doi: 10.1007/s00330-019-06344-z
[2] CARLOS R C, SICKS J D, CHILES C, et al. Lung cancer screening in the national cancer institute community oncology research program: availability and service organization[J]. J Am Coll Radiol, 2019, 16(4 Pt A): 427-434.
[3] DAI J, YU G Y, YU J Q. Can CT imaging features of ground-glass opacity predict invasiveness A meta-analysis[J]. Thorac Cancer, 2018, 9(4): 452-458. doi: 10.1111/1759-7714.12604
[4] MARTINI K, EBERHARD M, FRAUENFELDER T. Pulmonary nodules- an overview[J]. Ther Umsch, 2020, 77(2): 75-80. doi: 10.1024/0040-5930/a001156
[5] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. doi: 10.3322/caac.21660
[6] SWENSEN S J, SILVERSTEIN M D, ILSTRUP D M, et al. The probability of malignancy in solitary pulmonary nodules. Application to small radiologically indeterminate nodules[J]. Arch Intern Med, 1997, 157(8): 849-855. doi: 10.1001/archinte.1997.00440290031002
[7] 唐铷, 吕梦媛, 周健, 等. 肺磨玻璃结节影像学特征与肺腺癌预后关系的研究进展[J]. 中国胸心血管外科临床杂志, 2019, 26(12): 1252-1257. [8] TU W T, LI Z B, WANG Y, et al. The "solid" component with in subsolid nodules: imaging definition, display, and correlation with invasiveness of lung adenocarcinoma, a comparison of CT histograms and subjective evaluation[J]. Eur Radiol, 2019, 29(4): 1703-1713. doi: 10.1007/s00330-018-5778-3
[9] KIM H K, CHOI B H, QUAN Y H, et al. Correlation of levels of extracellular vesicles in peripheral and pulmonary blood plasma with pathological stages of lung cancer patients[J]. J Clin Oncol, 2020, 38(15): e15558.
[10] 刘莉, 吴宁, 周丽娜, 等. 亚实性结节血管及支气管异常与肺腺癌类病变侵袭性的相关性分析[J]. 中华放射学杂志, 2019, 53(11): 987-991. [11] 梅霞, 王礼同. 肺磨玻璃结节CT血管征在肺腺癌病理分型中的鉴别诊断价值[J]. 实用临床医药杂志, 2020, 24(3): 22-25. doi: 10.7619/jcmp.202003007 [12] NG C S H, CHU C M, LO C K, et al. Hybrid operating room Dyna-computed tomography combined image-guided electromagnetic navigation bronchoscopy dye marking and hookwire localization video-assisted thoracic surgery metastasectomy[J]. Interact Cardiovasc Thorac Surg, 2018, 26(2): 338-340. doi: 10.1093/icvts/ivx313
[13] ZHANG T, PU X H, YUAN M, et al. Histogram analysis combined with morphological characteristics to discriminate adenocarcinoma in situ or minimally invasive adenocarcinoma from invasive adenocarcinoma appearing as pure ground-glass nodule[J]. Eur J Radiol, 2019, 113: 238-244. doi: 10.1016/j.ejrad.2019.02.034
[14] SUN Y L, LI C, JIN L, et al. Radiomics for lung adenocarcinoma manifesting as pure ground-glass nodules: invasive prediction[J]. Eur Radiol, 2020, 30(7): 3650-3659. doi: 10.1007/s00330-020-06776-y
[15] YANG Y, WANG W W, REN Y, et al. Computerized texture analysis predicts histological invasiveness within lung adenocarcinoma manifesting as pure ground-glass nodules[J]. Acta Radiol, 2019, 60(10): 1258-1264. doi: 10.1177/0284185119826536
[16] LI X H, ZHANG W, YU Y Q, et al. CT features and quantitative analysis of subsolid nodule lung adenocarcinoma for pathological classification prediction[J]. BMC Cancer, 2020, 20(1): 60. doi: 10.1186/s12885-020-6556-6
[17] 曹捍波, 王梅, 范艳芬, 等. 平均CT值测量对≤1 cm同时多原发肺腺癌亚型分型的诊断价值[J]. 浙江医学, 2018, 40(4): 354-357. [18] KITAMI A, SANO F, HAYASHI S, et al. Correlation between histological invasiveness and the computed tomography value in pure ground-glass nodules[J]. Surg Today, 2016, 46(5): 593-598. doi: 10.1007/s00595-015-1208-1
[19] 顾鑫蕾, 刘展, 邵为朋, 等. 肺结节CT特征对腺癌病理亚型的预测价值[J]. 中国胸心血管外科临床杂志, 2022, 29(6): 684-692. -
期刊类型引用(3)
1. 贾乃龙,李传资,王绥煌,张余鹏,林志华,林昌昆,黄垂志. 低剂量能谱CT结合多平面重建技术对肺癌和肺炎性结节鉴别诊断意义. 中华肺部疾病杂志(电子版). 2024(02): 247-251 .  百度学术
百度学术
2. 孙志红,庞红艳,王睿. 呼出气体中VOCs联合CT征象诊断非实性肺结节的临床意义. 中华肺部疾病杂志(电子版). 2024(03): 442-445 .  百度学术
百度学术
3. 曹时荣,解琳. CT在肺结节良恶性鉴别诊断中的临床价值. 影像研究与医学应用. 2024(21): 41-43 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
