Bibliometric and visualized analysis of research in acute pancreatitis based on Web of Science database
-
摘要:目的
基于文献计量学方法对急性胰腺炎(AP)基础研究相关文献进行可视化分析。
方法以"acute pancreatitis"为关键词在Web of Science数据库中检索并筛选出2012—2021年发表的AP基础研究文献, 应用Cite Space和VOS viewer软件对所得文献的国家、研究机构、期刊、作者、高被引文献、高被引作者、关键词进行共现网络分析并绘制可视化知识图谱。
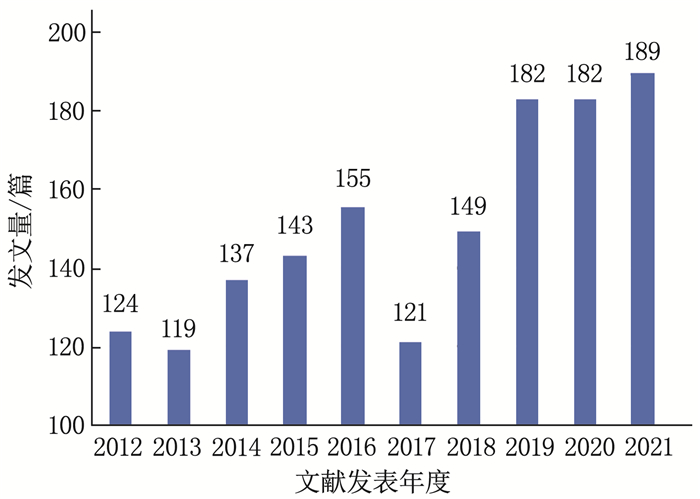
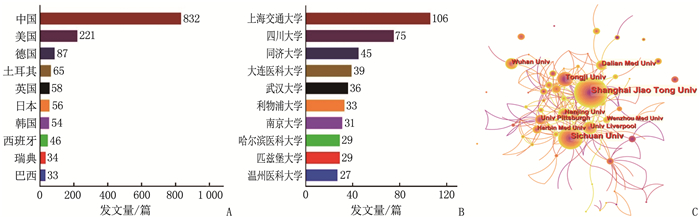
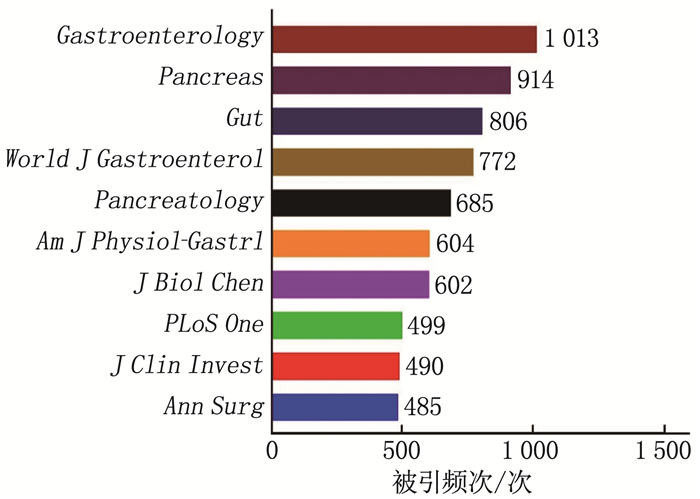
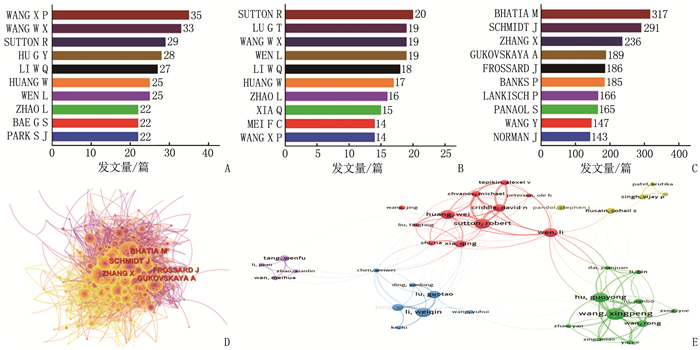
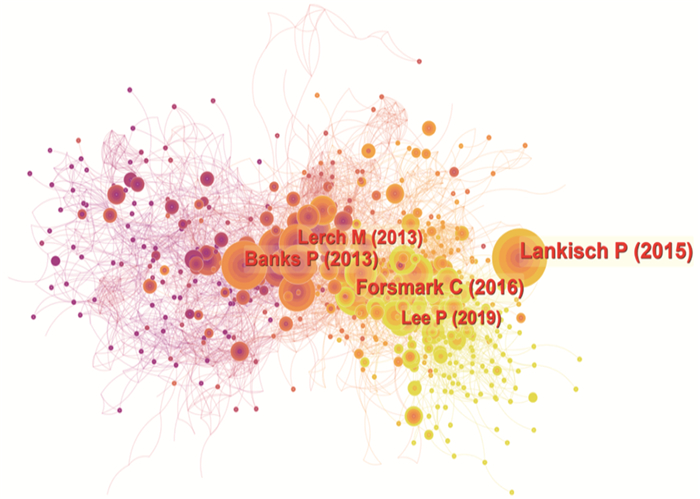
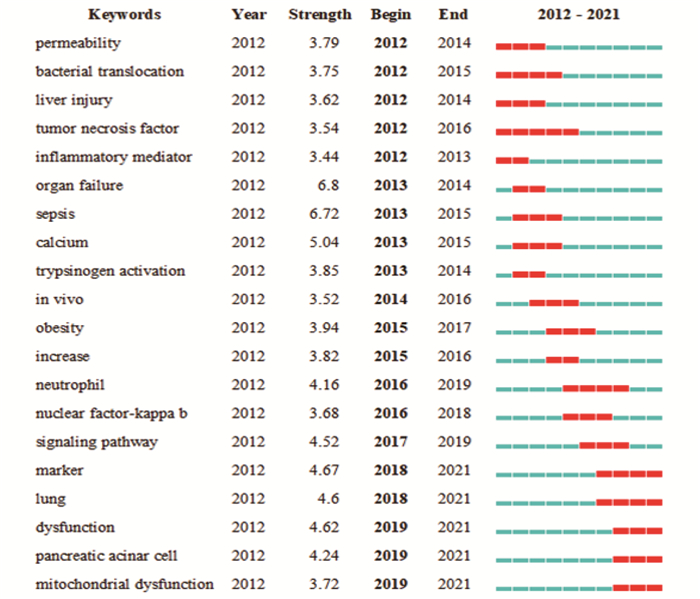
结果本研究最终共筛选出1 501篇AP基础实验性的科学引文索引(SCI)文献,年发文量总体呈波动上升趋势。发文量居前3位的国家分别为中国、美国、德国,发文量居前3位的研究机构分别为上海交通大学(106篇)、四川大学(75篇)、同济大学(45篇); 发文量居前3位的期刊分别为Pancreas(86篇)、Pancreatology(53篇)、Plos One(46篇),被引频次居前3位的期刊分别为Gastroenterology(1 013次)、Pancreas(914次)、Gut(806次); 发文量居前3位的作者分别为WANG X P(35篇)、WANG W X(33篇)、SUTTON R(29篇),被引频次居前2位的文献分别发表于Lancet、N Engl J Med。关键词共现网络显示,现阶段AP的研究热点为功能障碍、胰腺腺泡细胞和线粒体功能障碍。
结论文献计量和可视化分析可直观地展示AP基础研究领域现状和发展趋势,或可为未来AP的相关研究提供新思路。
Abstract:ObjectiveTo visually analyze the relevant literature on the basic research of acute pancreatitis (AP) through bibliometric methods.
MethodsThe basic literatures published from 2012 to 2022 were retrieved and screened from the Web of Science database with the keywords "acute pancreatitis". Cite Space and VOS viewer were used to conduct co-occurrence network analysis on countries, research institutions, journals, authors, highly cited articles, highly cited authors, keywords, and the corresponding visual knowledge maps were drawn.
ResultsA total of 1 501 basic experimental articles of AP in Science Citation Index(SCI)were included for analysis. The annual number showed an overall upward trend. The top three most productive countries were China, USA and Germany. The top three most productive research institutions were Shanghai Jiao Tong University (106 articles), Sichuan University (75 articles)and Tongji University(45 articles). Pancreas(86 articles), Pancreatology(53 articles) and Plos One (46 articles) were the most productive journals. and the top three cited journals were Gastroenterology (1 013 times), Pancreas (914 times) and Gut (806 times). WANG X P (35 papers), WANG W X (33 papers) and SUTTON R (29 papers) were the top three authors in the number of published papers, and the top two cited papers were published in the Lancet and N Engl J Med respectively. Keyword co-occurrence network showed that thefocus of AP research was dysfunction, pancreatic acinar cell and mitochondrial dysfunction.
ConclusionBibliometric and visualized analysis are intuitively displayed the current situation and development trend of the basic research field of AP.
-
Keywords:
- bibliometric /
- acute pancreatitis /
- visualized analysis /
- basic research
-
肺癌是常见的肿瘤之一,发病率及病死率均位居高位[1]。在中国,根据2022年国家癌症中心发布的全国癌症数据结果,每年80多万人被诊断为肺癌,近85%肺癌患者为非小细胞肺癌(NSCLC)[2]。高发病率、进展快、高病死率、预后差是NSCLC的主要流行病学特点[3]。临床上,少部分NSCLC患者可在早期(Ⅰ期或Ⅱ期)被明确诊断[4], 超过60%的肺癌患者因局部晚期或远处转移等表现诊断癌症晚期(Ⅲ期或Ⅳ期)[5], 侵袭、转移和复发是NSCLC的重要特点,与预后不良密切相关[6]。早期发现、诊断并干预肿瘤生长,有助于降低病死率,改善预后,延长生存期。因此,寻找诊断NSCLC的高特异性、高敏感的生物标志物仍是防治肺癌的热点。
长链非编码RNA(lncRNA)具有组织特异性表达,影响细胞增殖、凋亡和分化,其可用于癌症的诊断、预后和治疗[7]。研究[8]表明, lncRNA小核仁宿主基因20(lncRNA-SNHG20)在NSCLC肿瘤组织中表达上调,促进NSCLC细胞的增殖和迁移,进而影响预后。lncRNA转录因子7(lncRNA-TCF7)在NSCLC肿瘤组织中表达上调,增强NSCLC细胞侵袭性和自我更新能力[9]。但目前关于NSCLC患者血浆lncRNA-SNHG20和lncRNA-TCF7相对表达的研究较少。本研究选取120例NSCLC患者和120例良性肺病患者作为研究对象,采用实时荧光定量聚合酶链反应(qRT-PCR)检测血浆中lncRNA-SNHG20和lncRNA-TCF7的相对表达量,分析其与临床病理特征的相关性,并探讨SNHG20、TCF7诊断NSCLC的临床价值。
1. 对象与方法
1.1 研究对象
分别选择2020年12月—2022年6月江苏大学附属医院收治的120例NSCLC患者(NSCLC组)和良性肺病患者(良性肺病组)。NSCLC组: ①经细胞学或组织病理学确诊者; ②首次确诊,且原发病灶来源于肺部,未接受过手术、化疗、放疗等肿瘤干预措施者。NSCLC组中男68例,女52例; 年龄36~78岁; 病理组织分型为腺癌93例,鳞癌27例。根据UICC肺癌TNM分期(第8版)标准,临床分期为Ⅰ~Ⅱ期20例, Ⅲ~Ⅳ期90例,未明确分期10例。良性肺病组男65例,女55例; 年龄25~80岁; 疾病类型包括慢性阻塞性肺疾病48例,哮喘8例,支气管扩张14例,肺炎50例。为保证检测结果准确性,采集20例健康成人受试者血浆样本用于lncRNA检测结果校对。本研究已获得医院人文伦理委员会批准(批件号KY2022K0121)。
1.2 血浆标本采集及预处理
抽取研究对象5 mL外周静脉血于EDTA抗凝管, 30 min内利用低速离心机留取上层血浆,置于-80 ℃冰箱冻存留用。同时送检参与者血液标本至核医学科检测癌胚抗原(CEA)及细胞角蛋白19(Cyfra21-1, 参照试剂和说明书,正常参考值上限分别为5、7 ng/mL)。
1.3 RNA提取及逆转录
利用Trizols法提取上述标本血浆总RNA, 总RNA的浓度及纯度用紫外分光光度计检测。吸取固定体积的总RNA, 根据试剂盒说明书严格进行逆转录,逆转录结束标本可直接进行实时荧光定量PCR, 也可冻存于-20 ℃冰箱待用。
1.4 实时荧光定量PCR
吸取2 μL上述逆转录所得的cDNA作为模板,严格遵循TB Green Premix Ex TaqTM试剂操作步骤执行,根据说明书配置反应体系后,应用实时荧光定量PCR仪进行两步法PCR扩增。反应条件为预变性1个循环, 95 ℃, 30 s; PCR反应40个循环, 95 ℃ 5 s, 60 ℃ 30 s。任一样本的任一基因检测皆设置3个复孔。内参基因为GAPDH, 利用2-△△CT法计算上述2种lncRNAs的相对表达量。引物序列: GAPDH上游引物为5′-CAGGAGGCATTGCTGATGAT-3′, 下游引物为5′-GAAGGCTGGGGCTCATTT-3′; lncRNA-SNHG20上游引物为5′-ATGGCTATAAATAGATAGATACACG-3′, 下游引物为5′-GGTACAAACAGGGAGGGA-3′; lncRNA-TCF7上游引物为5′-AGGAGTCCTTGGACCTGAGC-3′, 下游引物为5′-AGTGGCTGGCATATAACCAACA-3′。
1.5 统计学分析
统计分析及绘图使用软件分别为SPSS 22.0(IBM)、Graphpad Prism 8.0。所有正态分布变量以(x±s)表示,行t检验或近似t检验进行组间比较。绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC), 获取诊断NSCLC的最佳临界值(cut-off值),计算出相应的特异度、敏感度、阳性预测值、阴性预测值、准确度。
2. 结果
2.1 血浆中lncRNA-SNHG20和lncRNA-TCF7的表达水平
NSCLC组、良性肺病组血浆中lncRNA-TCF7的相对表达量分别为(3.327±0.232)、(3.124±0.135), lncRNA-SNHG20的相对表达量分别为(2.655±0.139)、(2.591±0.121)。与良性肺病组相比, NSCLC患者血浆中lncRNA-SNHG20和lncRNA-TCF7表达水平上调,差异有统计学意义(P < 0.05)。见图 1。
2.2 NSCLC患者血浆中lncRNA-SNHG20和lncRNA-TCF7的相对表达水平与临床病理参数的关系
NSCLC患者血浆中lncRNA-SNHG20和lncRNA-TCF7的相对表达水平与性别、年龄、吸烟史、病理分型及临床TNM分期无关(P>0.05), 见表 1。
表 1 NSCLC组血浆中lncRNA-SNHG20和lncRNA-TCF7的表达水平与临床病理参数之间的关系临床病理参数 分类 n lncRNA-SNHG20相对表达 P lncRNA-TCF7相对表达 P 性别 男 68 2.655±0.147 0.315 3.327±0.221 0.287 女 52 2.653±0.129 3.325±0.248 年龄 ≤65岁 76 2.673±0.139 0.948 3.371±0.236 0.355 >65岁 44 2.644±0.139 3.300±0.227 吸烟史 ≥35包年 33 2.629±0.149 0.187 3.291±0.229 0.837 < 35包年 87 2.664±0.135 3.339±0.233 病理分型 腺癌 93 2.655±0.139 0.836 3.324±0.235 0.476 鳞癌 27 2.654±0.143 3.334±0.226 TNM分期* Ⅰ~Ⅱ期 20 2.650±0.145 0.611 3.332±0.239 0.928 Ⅲ~Ⅳ期 90 2.657±0.139 3.309±0.230 *: 有110例患者有明确TNM分期。 2.3 血浆中lncRNA-SNHG20、lncRNA-TCF7、CEA和Cyfra21-1对NCSLC的诊断效能
ROC曲线分析结果显示, lncRNA-SNHG20、lncRNA-TCF7、CEA、Cyfra21-1单独检测诊断NSCLC的AUC分别为0.648(0.579~0.717)、0.769(0.710~0.829)、0.755(0.692~0.817)、0.642(0.571~0.713), lncRNA-SNHG20、lncRNA-TCF7的AUC大于Cyfra21-1, CEA的AUC介于lncRNA-SNHG20和lncRNA-TCF7之间。lncRNA-SNHG20和lncRNA-TCF7联合诊断的AUC为0.772(0.713~0.832), 大于上述4种任一单独检测的AUC。lncRNA-SNHG20与lncRNA-TCF7联合Cyfra21-1的AUC为0.773(0.712~0.832), 低于lncRNA-SNHG20与lncRNA-TCF7联合CEA的AUC 0.882(0.839~0.926), 但大于lncRNA-SNHG20与lncRNA-TCF7联合检测的AUC。LncRNA-SNHG20、lncRNA-TCF7、CEA、Cyfra21-1这4种指标单独检测及lncRNA-SNHG20与lncRNA-TCF7联合检测、lncRNA-SNHG20与lncRNA-TCF7联合Cyfra21-1、lncRNA-SNHG20与lncRNA-TCF7联合CEA的AUC比较,差异有统计学意义(P < 0.05), 见图 2。
lncRNA-SNHG20与lncRNA-TCF7分别联合常规肿瘤标志物CEA及Cyfra21-1后AUC增大, lncRNA-SNHG20与lncRNA-TCF7联合CEA检测诊断的敏感度提高。诊断NSCLC的cut-off值、阳性预测值、阴性预测值及准确性见表 2。
表 2 lncRNA-SNHG20、lncRNA-TCF7、CEA及Cyfra21-1单独诊断及联合诊断NSCLC的效能指标 AUC(95%CI) 敏感度/% 特异度/% 阳性预测值/% 阴性预测值/% 准确性/% lncRNA-TCF7 0.769(0.710~0.829) 57.1 87.5 81.9 66.8 72.1 lncRNA-SNHG20 0.648(0.579~0.717) 81.5 42.5 65.5 68.9 61.7 CEA 0.755(0.692~0.817) 72.5 78.2 84.4 75.9 79.5 Cyfra21-1 0.642(0.571~0.713) 60.5 67.5 64.8 62.7 63.7 lncRNA-TCF7+lncRNA-SNHG20 0.772(0.713~0.832) 73.2 80.2 78.3 74.4 76.3 lncRNA-SNHG20+lncRNA-TCF7+Cyfra21-1 0.773(0.712~0.832) 73.2 80.2 78.3 74.4 76.3 lncRNA-SNHG20+lncRNA-TCF7+CEA 0.882(0.839~0.926) 79.0 83.3 82.4 79.4 80.8 SNHG20: 小核仁宿主基因20; TCF7: 转录因子7; CEA: 癌胚抗原; Cyfra21-1: 细胞角蛋白19。 3. 讨论
LncRNA是一组不具有蛋白翻译功能、长度超过200个核苷酸的转录本[10]。LncRNA在不同类型肿瘤细胞中异常表达,在不同水平的基因表达中发挥调控作用[11]。近年来, lncRNA因其在癌症中的调控作用而受到越来越多的关注。研究[12]发现, lncRNA异常表达可能会影响遗传表观信息,为肿瘤的细胞生长提供优势,通过调节微小RNA(miRNA)或mRNAs参与癌症进展。因此, lncRNA正在成为癌症诊断和治疗的新的标志物。
LncRNA-SNHG20位于染色体17q25.2, 具有2 183个碱基对,研究[13]认为过表达lncRNA-SNHG20可通过不同机制促进肿瘤细胞的细胞周期、增殖、侵袭和迁移能力。lncRNAs可以通过miRNAs调控卵巢癌的进展, lncRNA-SNHG20与卵巢癌的发生发展密切相关[14]。研究[15]发现,与正常人卵巢上皮细胞系相比,在4种卵巢癌细胞系中观察到lncRNA-SNHG20显著高表达,敲除lncRNA-SNHG20可抑制细胞增殖并诱导卵巢癌细胞凋亡。研究[16]表明,在卵巢癌组织和细胞中, lncRNA-SNHG20和MCL1水平上调,而miR3383p水平下调,经双荧光素酶报告分析进行发现lncRNA-SNHG20通过靶向miR-338-3p来增加MCL1的表达,从而促进卵巢癌的发展。相关研究通过检测68例结直肠癌组织及邻近正常组织的lncRNA-SNHG20表达水平发现, lncRNA-SNHG20在癌组织中呈高表达,而且癌细胞系中lncRNA-SNHG20的表达显著增加。miR495是lncRNA-SNHG20的直接靶点, STAT3被确定为结直肠癌中miR495的下游靶点, LncRNA-SNHG20通过调节STAT3表达和miR495促进结直肠癌进展[17]。此外,与癌旁组织相比,肺腺癌组织中lncRNA-SNHG20呈过表达,且lncRNA-SNHG20在肺腺癌细胞系中的表达高于正常上皮细胞系。进一步研究发现, lncRNA-SNHG20直接结合肺腺癌细胞中的miR-342, 而miR-342又直接结合DDX49, lncRNA-SNHG20通过海绵介导miR-342上调DDX49, 促进肺腺癌细胞增殖、侵袭和抑制凋亡[18]。本研究结果显示, NSCLC患者血浆中lncRNA-SNHG20呈高表达,与既往研究中lncRNA-SNHG20在肺癌、卵巢癌、结直肠癌等肿瘤组织中高表达结果相符。此外, NSCLC患者血浆中lncRNA-SNHG20表达上调,与年龄、吸烟史、性别、病理组织分型、临床分期等无明显相关性,检索Gepia数据库发现lncRNA-SNHG20的相对表达水平与NSCLC总生存期无明显相关性。
TCF7主要在T细胞中表达,在NK细胞及先天淋巴细胞的发育中其关键作用[19]。研究[20]发现,经IL-6/STAT3反激活诱导TCF7,通过上皮间质转化促进肝细胞癌的侵袭性。体外实验表明,敲低lncRNA-TCF7可以降低SK-Hep-1肝癌细胞系的细胞侵袭能力。研究表示, TCF7在结直肠癌细胞系中相对于正常结直肠上皮细胞高表达。免疫沉淀及荧光素酶报告基因分析显示,lncRNA-TCF7招募BAF170激活TCF7启动子,并调控TCF7表达。研究[21]表明, lncRNA-TCF7的下调可通过抑制TCF7的表达来抑制结直肠癌细胞的迁移和侵袭。通过流式细胞术及转染试验表明,沉默癌细胞中TCF7可抑制细胞增殖、迁移与侵袭,但对细胞凋亡无明显影响。表达lncRNA-TCF7可以增加细胞侵袭能力,而shRNA沉默lncRNA-TCF7可以降低NSCLC细胞侵袭能力[9]。因此,上述研究表明,lncRNA-TCF7在多种癌症中发挥促进肿瘤生长作用。本研究结果显示, NSCLC患者血浆中lncRNA-TCF7呈高表达,与上述研究肿瘤组织及细胞系高表达相符。同时, NSCLC患者血浆中lncRNA-TCF7高表达与年龄、吸烟史、性别、病理组织分型、临床分期等无明显相关性,但检索ULCAN数据库发现TCF7不仅在肺腺癌呈高表达,且在早期腺癌中TCF7的表达具有统计学意义(P < 0.05)。但本研究数据表明, NSCLC患者血浆中lncRNA-TCF7的表达水平与临床分期无明显相关性,考虑可能与本研究中早期样本仅20例有关。
本研究中,单独检测lncRNA-TCF7的AUC(0.769)大于常规肿瘤标志物CEA(0.755)和Cyfra21-1(0.642), 且lncRNA-TCF7的特异度(87.5%)高于CEA(78.2%)和Cyfra21-1(67.5%)。单独检测lncRNA-SNHG20的AUC(0.648)介于CEA(0.755)和Cyfra21-1 (0.642)之间,但lncRNA-SNHG20的敏感度为81.5%, 高于CEA的72.5%和Cyfra21-1的60.5%。联合检测lncRNA-TCF7及lncRNA-SNHG20的AUC为0.772, 敏感度为73.2%, 大于TCF7单独检测的AUC, 但低于lncRNA-SNHG20单独检测的敏感度; 特异度(80.2%)低于TCF7单独检测,但高于lncRNA-SNHG20(42.5%)、CEA(78.2%)及Cyfra21-1(67.5%)。联合检测lncRNA-TCF7+lncRNA-SNHG20+CEA的AUC(0.882)、敏感度(79.0%)、特异度(83.3%)均高于联合检测lncRNA-TCF7+lncRNA-SNHG20+Cyfra21-1的AUC(0.773)、敏感度(73.2%)、特异度(80.2%)。此外,不仅联合检测lncRNA-TCF7+lncRNA-SNHG20+CEA的敏感度提高,而且检测的准确性也提高,其可能成为NSCLC诊断的新的肿瘤标志物。
综上所述,与良性肺病患者相比, NSCLC患者血浆lncRNA-SNHG20和lncRNA-TCF7呈高表达。血浆lncRNA-SNHG20和lncRNA-TCF7的高表达与吸烟史、年龄、性别、病理分型、临床分期无明显相关性。lncRNA-TCF7、lncRNA-SNHG20和CEA联合诊断的敏感度及准确性高于单独诊断。但是,目前NSCLC的确诊仍需病理学依据,而早期肺癌多无明显临床症状, lncRNA-TCF7和lncRNA-SNHG20或可作为分子标志物在NSCLC的筛选中发挥作用。
-
表 1 发文量居前10位的期刊
序号 发文量/篇 期刊名称 影响因子 1 86 Pancreas 3.327 2 53 Pancreatology 3.996 3 46 PLoS One 3.240 4 41 Mol Med Rep 2.952 5 41 World J Gastroenterol 5.742 6 32 Dig Dis Sci 3.199 7 31 Biochem Biophys Res Commun 3.575 8 29 Gastroenterology 22.682 9 27 Int Immunopharmacol 4.932 10 25 Am J Physiol Gastrointest Liver Physiol 4.052 表 2 排名前10位的高被引文献
序号 被引频次/次 年份 高被引文献的来源期刊及DOI 1 92 2015 Lancet, DOI: 10.1016/S0140-6736(14)60649-8 2 66 2016 N Engl J Med, DOI: 10.1056/NEJMra1505202 3 61 2013 Gut, DOI: 10.1136/gutjnl-2012-302779 4 49 2013 Gastroenterology, DOI: 10.1053/j.gastro.2012.12.043 5 44 2019 Nat Rev Gastro Hepat, DOI: 10.1038/s41575-019-0158-2 6 43 2013 Gastroenterology, DOI: 10.1053/j.gastro.2012.09.059 7 41 2013 Gastroenterology, DOI: 10.1053/j.gastro.2013.01.068 8 39 2016 Pancreatology, DOI: 10.1016/j.pan.2016.05.001 9 37 2017 Gastroenterology, DOI: 10.1053/j.gastro.2017.08.071 10 37 2013 J Clin Invest, DOI: 10.1172/JCI64931 -
[1] 唐甜甜, 李慧, 陈春雷. 集束化护理在急性胰腺炎患者中的应用效果[J]. 实用临床医药杂志, 2023, 27(9): 127-130. doi: 10.7619/jcmp.20223522 [2] YANG C J, CHEN J, PHILLIPS A R, et al. Predictors of severe and critical acute pancreatitis: a systematic review[J]. Dig Liver Dis, 2014, 46(5): 446-451. doi: 10.1016/j.dld.2014.01.158
[3] 廖小胖, 邹晓东, 于博, 等. 甘油三酯-葡萄糖指数与中度重症及重症急性胰腺炎并发急性肾损伤的相关性[J]. 实用临床医药杂志, 2023, 27(9): 106-110. doi: 10.7619/jcmp.20223726 [4] AFGHANI E, PANDOL S J, SHIMOSEGAWA T, et al. Acute pancreatitis-progress and challenges: a report on an international symposium[J]. Pancreas, 2015, 44(8): 1195-1210. doi: 10.1097/MPA.0000000000000500
[5] GREENBERG J A, HSU J, BAWAZEER M, et al. Clinical practice guideline: management of acute pancreatitis[J]. Can J Surg, 2016, 59(2): 128-140. doi: 10.1503/cjs.015015
[6] YANG X M, YAO L B, FU X H, et al. Experimental acute pancreatitis models: history, current status, and role in translational research[J]. Front Physiol, 2020, 11: 614591. doi: 10.3389/fphys.2020.614591
[7] LEE P J, PAPACHRISTOU G I. New insights into acute pancreatitis[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(8): 479-496. doi: 10.1038/s41575-019-0158-2
[8] 张许婷, 罗彩凤, 吴贤群, 等. 基于Web of Science核心集的乳腺癌患者共享决策研究的可视化分析[J]. 实用临床医药杂志, 2023, 27(5): 37-42. doi: 10.7619/jcmp.20230022 [9] XIE L, CHEN Z H, WANG H L, et al. Bibliometric and visualized analysis of scientific publications on atlantoaxial spine surgery based on web of science and VOSviewer[J]. World Neurosurg, 2020, 137: 435-442, e4. doi: 10.1016/j.wneu.2020.01.171
[10] KOH Y H, MOOCHHALA S, BHATIA M. Activation of neurokinin-1 receptors up-regulates substance P and neurokinin-1 receptor expression in murine pancreatic acinar cells[J]. J Cell Mol Med, 2012, 16(7): 1582-1592. doi: 10.1111/j.1582-4934.2011.01475.x
[11] DENG Y Y, SHAMOON M, HE Y, et al. Cathelicidin-related antimicrobial peptide modulates the severity of acute pancreatitis in mice[J]. Mol Med Rep, 2016, 13(5): 3881-3885. doi: 10.3892/mmr.2016.5008
[12] MUKHERJEE R, MARENINOVA O A, ODINOKOVA I V, et al. Mechanism of mitochondrial permeability transition pore induction and damage in the pancreas: inhibition prevents acute pancreatitis by protecting production of ATP[J]. Gut, 2016, 65(8): 1333-1346. doi: 10.1136/gutjnl-2014-308553
[13] SENDLER M, WEISS F U, GOLCHERT J, et al. Cathepsin B-mediated activation of trypsinogen in endocytosing macrophages increases severity of pancreatitis in mice[J]. Gastroenterology, 2018, 154(3): 704-718, e10. doi: 10.1053/j.gastro.2017.10.018
[14] LANKISCH P G, APTE M, BANKS P A. Acute pancreatitis[J]. Lancet, 2015, 386(9988): 85-96. doi: 10.1016/S0140-6736(14)60649-8
[15] FORSMARK C E, VEGE S S, WILCOX C M. Acute pancreatitis[J]. N Engl J Med, 2016, 375(20): 1972-1981. doi: 10.1056/NEJMra1505202
[16] BANKS P A, BOLLEN T L, DERVENIS C, et al. Classification of acute pancreatitis: 2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. doi: 10.1136/gutjnl-2012-302779
[17] LERCH M M, GORELICK F S. Models of acute and chronic pancreatitis[J]. Gastroenterology, 2013, 144(6): 1180-1193. doi: 10.1053/j.gastro.2012.12.043
[18] HUANG H J, LIU Y, DANILUK J, et al. Activation of nuclear factor-κB in acinar cells increases the severity of pancreatitis in mice[J]. Gastroenterology, 2013, 144(1): 202-210. doi: 10.1053/j.gastro.2012.09.059
[19] YADAV D, LOWENFELS A B. The epidemiology of pancreatitis and pancreatic cancer[J]. Gastroenterology, 2013, 144(6): 1252-1261. doi: 10.1053/j.gastro.2013.01.068
[20] GUKOVSKAYA A S, GUKOVSKY I, ALGUL H, et al. Autophagy, inflammation, and immune dysfunction in the pathogenesis of pancreatitis[J]. Gastroenterology, 2017, 153(5): 1212-1226. doi: 10.1053/j.gastro.2017.08.071
[21] HUANG W, BOOTH D M, CANE M C, et al. Fatty acid ethyl ester synthase inhibition ameliorates ethanol-induced Ca2+-dependent mitochondrial dysfunction and acute pancreatitis[J]. Gut, 2014, 63(8): 1313-1324. doi: 10.1136/gutjnl-2012-304058
[22] SHORE E R, AWAIS M, KERSHAW N M, et al. Small molecule inhibitors of cyclophilin D to protect mitochondrial function as a potential treatment for acute pancreatitis[J]. J Med Chem, 2016, 59(6): 2596-2611. doi: 10.1021/acs.jmedchem.5b01801
[23] ARMSTRONG J A, CASH N J, MORTON J C, et al. Mitochondrial targeting of antioxidants alters pancreatic acinar cell bioenergetics and determines cell fate[J]. Int J Mol Sci, 2019, 20(7): 1700. doi: 10.3390/ijms20071700
[24] HUANG W, HAYNES A C, MUKHERJEE R, et al. Selective inhibition of BET proteins reduces pancreatic damage and systemic inflammation in bile acid- and fatty acid ethyl ester- but not caerulein-induced acute pancreatitis[J]. Pancreatology, 2017, 17(5): 689-697. doi: 10.1016/j.pan.2017.06.005
[25] DAI J J, HE Y, JIANG M J, et al. Reg4 regulates pancreatic regeneration following pancreatitis via modulating the Notch signaling[J]. J Cell Physiol, 2021, 236(11): 7565-7577. doi: 10.1002/jcp.30397
[26] GAO L, LU G T, LU Y Y, et al. Diabetes aggravates acute pancreatitis possibly via activation of NLRP3 inflammasome in db/db mice[J]. Am J Transl Res, 2018, 10(7): 2015-2025.
[27] YANG Q, PU N, LI X Y, et al. Digenic inheritance and gene-environment interaction in a patient with hypertriglyceridemia and acute pancreatitis[J]. Front Genet, 2021, 12: 640859. doi: 10.3389/fgene.2021.640859
[28] HU J, ZHANG Y M, MIAO Y F, et al. Effects of Yue-Bi-Tang on water metabolism in severe acute pancreatitis rats with acute lung-kidney injury[J]. World J Gastroenterol, 2020, 26(43): 6810-6821. doi: 10.3748/wjg.v26.i43.6810
[29] HONG Y P, DENG W H, GUO W Y, et al. Inhibition of endoplasmic reticulum stress by 4-phenylbutyric acid prevents vital organ injury in rat acute pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2018, 315(5): G838-G847. doi: 10.1152/ajpgi.00102.2018
[30] CHEN Y, WANG C Y, ZHAO L, et al. Inhibition of macrophage migration inhibitory factor prevents thyroid dysfunction in pregnant rats with acute pancreatitis[J]. Int Immunopharmacol, 2020, 87: 106771. doi: 10.1016/j.intimp.2020.106771
-
期刊类型引用(2)
1. 范骏,魏可,骆金华,薛磊. 血清微小RNA-184、微小RNA-451a表达对Ⅰ~ⅡA期非小细胞肺癌根治术后复发转移的预测价值. 实用临床医药杂志. 2024(13): 1-6 .  本站查看
本站查看
2. 居承辉,史雨晨. 外周血淋巴细胞亚群在非小细胞肺癌患者中的表达情况. 中外医学研究. 2024(25): 83-86 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:


 苏公网安备 32100302010246号
苏公网安备 32100302010246号