Differentially expressed genes of ulcerative colitis and associated microRNAs based on bioinformatics analysis
-
摘要:目的
基于生物信息学分析溃疡性结肠炎(UC)中具有诊断和治疗潜力的差异表达基因以及潜在的微小RNA(miRNA)。
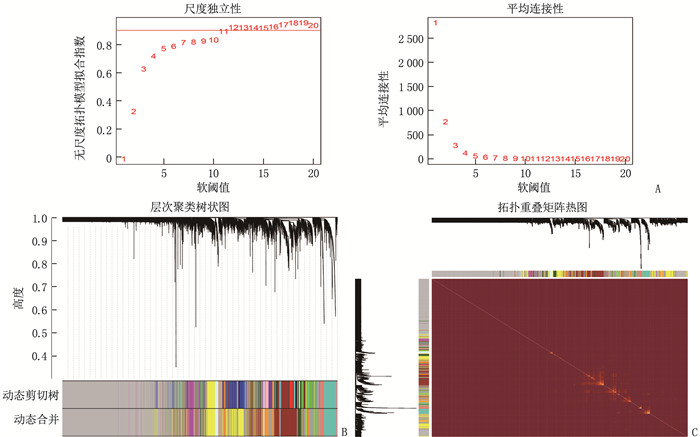
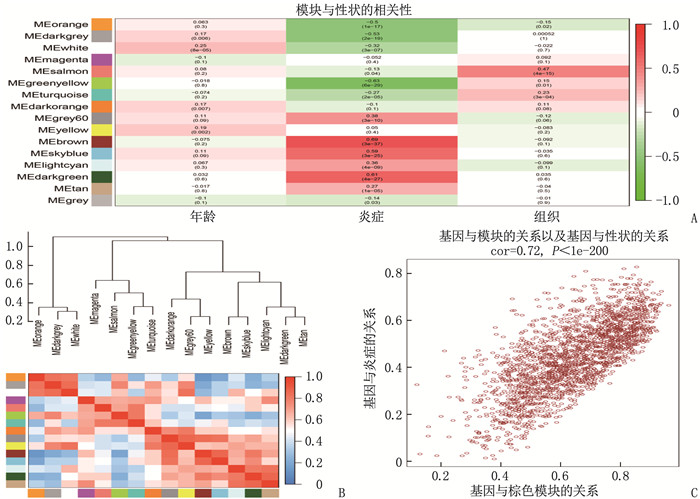
方法采用加权基因共表达网络分析法对GEO数据库中的芯片原始数据进行筛选。获取UC相关差异表达基因进行富集分析。根据关键基因, 预测与差异表达基因相关的潜在miRNA, 并构建基因-miRNA调控网络。
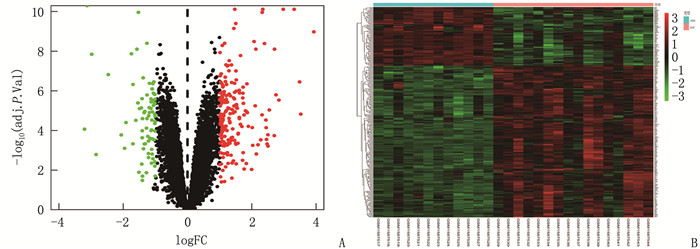
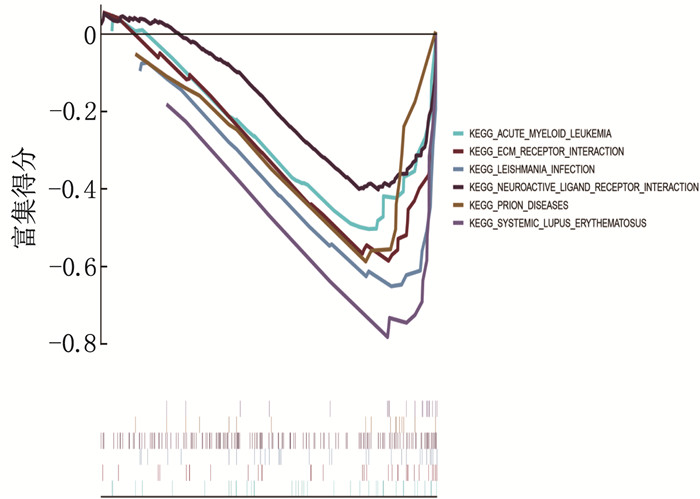
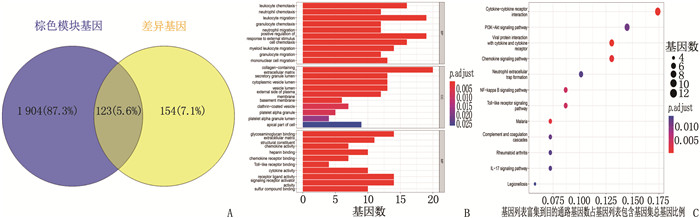
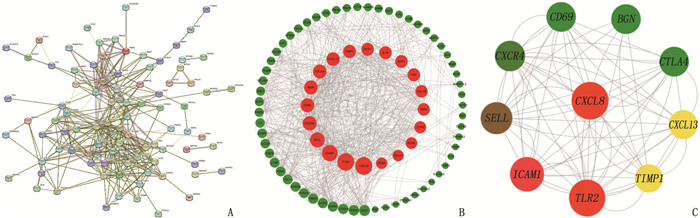
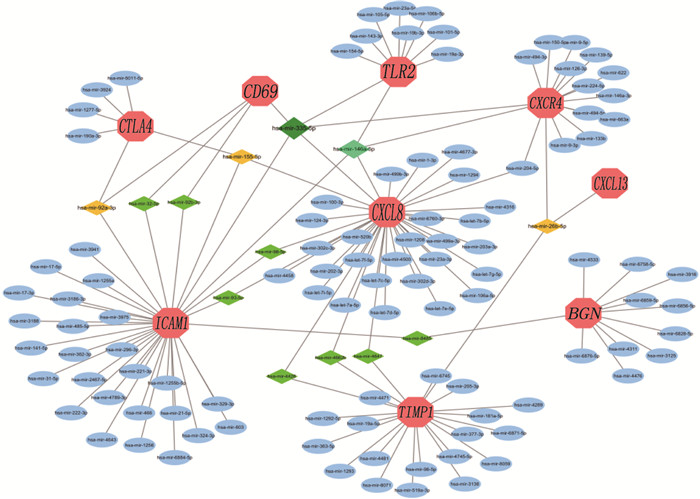
结果共筛选出277个差异表达基因,其中有200个基因上调, 77个基因下调。基因集富集分析(GSEA)显示,主要富集通路是神经活性配体受体相互作用、利什曼原虫感染、朊病毒病害以及心电图受体相互作用等通路。基因本体论(GO)分析结果显示,主要参与趋化因子活性、肝素结合、趋化因子受体结合等条目。京都基因与基因组百科全书(KEGG)分析结果显示,主要富集通路为细胞因子受体相互作用通路、磷脂酰肌醇-3激酶/蛋白激酶B(PI3K-AKT)信号通路、趋化因子信号通路、核转录因子kappa B(NF-κB)信号通路富集通路等。筛选出10个枢纽基因,分别是C-X-C趋化因子配体8(CXCL8)、Toll样受体2(TLR2)、细胞间黏附分子1(ICAM1)、选择素L(SELL)、趋化因子受体4(CXCR4)、细胞毒性T淋巴细胞相关抗原(CTLA4)、细胞分化抗原69(CD69)、双糖链蛋白多糖(BGN)、C-X-C趋化因子配体13(CXCL13)、金属蛋白酶抑制剂1(TIMP1)。鉴定出12个潜在的关键miRNAs, 分别为hsa-mir-335-5p、hsa-mir-146a-5p、hsa-mir-92a-3p、hsa-mir-155-5p、hsa-mir-26b-5p、hsa-mir-4426、hsa-mir-4462b、hsa-mir-4647、hsa-mir-32-5p、hsa-mir-92b-3p、hsa-mir-98-5p和hsa-mir-93-5p。
结论本研究共筛选出277个差异表达基因可能参与UC的发生发展,鉴定出10个枢纽基因和12个miRNAs或可作为UC的生物标志物。
-
关键词:
- 溃疡性结肠炎 /
- 加权基因共表达网络 /
- miRNA-基因调控网络 /
- 生物信息学
Abstract:ObjectiveTo analyze differentially expressed genes and potential microRNA (miRNAs) with diagnostic and therapeutic potential in ulcerative colitis (UC) based on bioinformatics.
MethodsThe chip raw data in GEO database was screened by weighted gene coexpression network analysis. UC related differentially expressed genes were obtained for enrichment analysis. Potential miRNAs associated with differentially expressed genes were predicted based on key genes, and gene-miRNA regulatory networks were constructed.
ResultsA total of 277 differentially expressed genes were screened, of which 200 genes were up-regulated and 77 genes were down-regulated. Gene set enrichment analysis (GSEA) showed that the main enrichment pathways were neuroactive ligand-receptor interaction, leishmania infection, prion disease and electrocardiogram receptor interaction. The results of gene ontology (GO) analysis showed that it was mainly involved in chemokine activity, heparin binding as well as chemokine receptor binding and other items. The Kyoto Encyclopedia of Genes and Genomes (KEGG) analysis showed that the main enrichment pathways were cytokine receptor interaction pathway, phosphatidylinositol-3 kinase/protein kinase B(PI3K-AKT) signaling pathway, chemokine signaling pathway as well as nuclear transcription factor kappa B(NF-κB) signaling pathway and other pathway. A total of 10 hub genes were screened: C-X-C chemokine ligand 8 (CXCL8), Toll-like receptor 2 (TLR2), intercellular adhesion molecule-1 (ICAM-1), selectin L (SELL), C-X-C chemokine receptor type 4 (CXCR4), cytotoxic T lymphocyte associated antigen 4 (CTLA4), cluster of differentiation 69 (CD69), and Biglycan (BGN), C-X-C chemokine ligand 13 (CXCL13), tissue inhibitor of metalloproteinases 1(TIMP1). A total of 12 potentially key miRNAs were identified, they were respectively hsa-mir-335-5p, hsa-mir-146a-5p, hsa-mir-92a-3p, hsa-mir-155-5p, hsa-mir-26b-5p, hsa-mir-4426, hsa-mir-4462b, hsa-mir-4647, hsa-mir-32-5p, hsa-mir-92b-3p, hsa-mir-98-5p and hsa-mir-93-5p, respectively.
ConclusionIn this study, a total of 277 differentially expressed genes are screened for possible involvement in the development of UC, and 10 hub genes and 12 miRNAs are identified as possible biomarkers for UC.
-
胎儿窘迫可在宫内缺氧基础上诱发胎儿酸中毒,是造成胎儿神经系统损伤的产科常见疾病[1]。胎儿窘迫的致病因素较复杂,可能与母体血液含氧量低、胎盘循环功能障碍和胎盘本身发育不良等因素有关,其中最直接的因素是脐带绕颈[2]。临床诊断胎儿窘迫的金标准是胎儿动脉血气分析和酸碱度测量,但其具有创伤大、技术难度大和可操作性弱等不足[3]。多普勒超声具有辐射小、可视化和无创等优势,已成为围产儿诊断的主要技术手段。临床研究[4]显示,脐带绕颈可引起胎儿窘迫,且与脐带缠绕周数和松紧度有直接联系。胎儿窘迫与胎儿主动脉血流动力学指标水平改变有一定相关性[5], 而超声检测可有效判断胎儿脐动脉(UA)和大脑中动脉(MCA)等主要动脉血供情况[6]。本研究采用超声检测UA和MCA血流,预测妊娠晚期脐带绕颈患儿呼吸窘迫的临床价值。
1. 资料与方法
1.1 一般资料
选取2016年2月—2019年5月产检和足月分娩符合纳入和排除标准的385例晚期妊娠孕妇为研究对象,根据妊娠结局和胎儿窘迫诊断标准,将孕妇分成窘迫组(n=102) 和正常组(n=283)。2组受试者年龄、孕周、胎盘分级及体质量指数(BMI)等基线资料比较,差异无统计学意义(P>0.05), 具有可比性,见表 1。本研究经医院伦理委员会批准。纳入标准: ①所有胎儿均经超声及妊娠结局确认为胎儿脐带绕颈; ②病历资料齐全者; ③可耐受多普勒超声检测者; ④胎儿为单胎,且孕妇为初产妇; ⑤孕妇及其家属签订知情同意书。排除标准: ①合并患有恶性肿瘤者; ②合并患有精神疾病者; ③有肝、肾及心等重要脏器官损伤者; ④先天性畸形胎儿; ⑤不配合者。胎儿窘迫评定标准[7]: ①新生儿出生后1 min即可应用Apgar评分进行评定,分值不超过7分; ②胎盘分级为Ⅱ~Ⅲ级,且胎儿心脏监护有异常状况; ③新生儿头皮血酸碱度小于7.20; ④胎心监护出现异常减速情况。符合上述条件之一者即可判定为胎儿窘迫。
表 1 2组受试者一般资料比较(x±s)[n(%)]组别 n 年龄/岁 体质量指数/(kg/m2) 孕周/周 胎盘分级 Ⅱ级 Ⅲ级 窘迫组 102 27.61±2.56 27.25±2.01 38.34±0.35 45(44.12) 57(55.88) 正常组 283 28.15±2.49 27.56±1.84 38.27±0.40 154(54.42) 129(45.58) 1.2 方法
孕35周后,采用彩色多普勒超声每周对孕妇开展检查,应用Voluson E8 TruScanTM型号彩色多普勒超声诊断仪,探头为4C-D凸阵探头,频率为2.0~5.0 MHz, 并应用内置软件行参数分析等操作。产妇排空膀胱后,静息状态下平卧或侧卧,由高年资超声医师进行超声数据采集。超声常规检查包括胎儿头围、腹围、羊水及胎盘等项目,并确定受检胎儿是否存在脐带绕颈、发育是否良好及胎盘有无异常等情况。应用多普勒超声检测待产胎儿MCA和UA等主要动脉血管。探头移至脐带,于脐血流和胎盘入口处选择合适的取样点检测UA血流动力学指标,包括收缩期峰值流速和舒张末期流速比值(S/D)、搏动指数(PI)及阻力指数(RI); 选取标准双顶径测定平面后,将凸阵探头往颅底移动,找到成双蝶骨大翼测定MCA的S/D、PI和RI。主动脉血管至少截取5个心跳周期频谱,连续检测3次取平均值,并计算各动脉S/D、PI和RI值,3次测量数据变异度不得超过10%。
以胎儿血气分析和酸碱度等为金标准[7], 绘制UA-RI、MCA-RI及UA/MCA-RI的受试者工作特征(ROC)曲线,三者均以ROC曲线临界值为基准, UA-RI和UA/MCA-RI超过临界值即可判定为胎儿窘迫,而MCA-RI小于临界值即可判定为胎儿窘迫。
1.3 统计学分析
采用SPSS 25.0对数据进行处理,计数资料以[n(%)]表示,行χ2检验; 计量资料以(x±s)表示,行t检验。以主动脉血流动力学指标作为检验变量,以有无胎儿窘迫为状态标量,以敏感度为Y轴,以“1-特异度”为X轴绘制ROC曲线, P < 0.05为差异有统计学意义。
2. 结果
2.1 2组受试者UA血流动力学参数比较
2组受试者UA的S/D和PI值比较,差异无统计学意义(P>0.05); 窘迫组RI值高于正常组,差异有统计学意义(P < 0.05), 见表 2。
表 2 2组受试者UA的血流动力学参数比较(x±s)组别 S/D PI RI 窘迫组(n=102) 2.35±0.46 0.85±0.13 0.72±0.13* 正常组(n=283) 2.29±0.43 0.82±0.17 0.57±0.10 S/D: 收缩期峰值流速和舒张末期流速比值; PI: 搏动指数;
RI: 阻力指数。与正常组比较, *P < 0.05。2.2 2组MCA血流动力学参数比较
2组受试者MCA的S/D和PI比较,差异无统计学意义(P>0.05); 窘迫组RI值低于正常组,差异有统计学意义(P < 0.05), 见表 3。
表 3 2组受试者MCA血流动力学参数比较(x±s)组别 S/D PI RI 窘迫组(n=102) 4.21±1.01 1.66±0.13 0.81±0.13* 正常组(n=283) 4.06±1.08 1.65±0.17 0.94±0.24 S/D: 收缩期峰值流速和舒张末期流速比值;
PI: 搏动指数; RI: 阻力指数。与正常组比较, *P < 0.05。2.3 2组UA和MCA血流动力学参数比值比较
2组受试者MCA和UA的S/D比值(UA/MCA-S/D)以及MCA和UA的PI比值(UA/MCA-PI)比较,差异无统计学意义(P>0.05); 窘迫组UA/MCA-RI值高于正常组,差异有统计学意义(P < 0.05), 见表 4。
表 4 2组受试者UA和MCA血流动力学参数比值比较(x±s)组别 UA/MCA-S/D UA/MCA-PI UA/MCA-RI 窘迫组(n=102) 0.55±0.12 0.51±0.09 0.89±0.22* 正常组(n=283) 0.56±0.13 0.49±0.11 0.60±0.12 UA/MCA-S/D: MCA和UA的S/D比值;
UA/MCA-PI: MCA和UA的PI比值;
UA/MCA-RI: MCA和UA的RI比值。
与正常组比较, *P < 0.05。2.4 不同血流动力学参数的检验效能分析
以UA-RI、MCA-RI及UA/MCA-RI作为检验变量,有无胎儿窘迫为状态标量,以敏感度为Y轴,以“1-特异度”为X轴绘制ROC曲线(见图 1)。根据ROC曲线, UA-RI诊断的临界值为0.67, 对应的敏感度为74.51%, 特异度为85.16%, ROC曲线下面积为0.798 (95%CI: 0.750~0.846); MCA-RI诊断的临界值为0.86, 对应的敏感度为77.45%, 特异度为84.45%, ROC曲线下面积为0.802 (95%CI: 0.758~0.846); UA/MCA-RI诊断的临界值为0.71, 对应的敏感度为90.20%, 特异度为91.87%, ROC曲线下面积为0.902 (95%CI: 0.832~0.972)。UA/MCA-RI敏感度和特异度均高于MCA-RI和UA-RI诊断(P < 0.05), 见表 5。
表 5 UA-RI、MCA-RI和UA/MCA-RI诊断胎儿窘迫的效能比较诊断指标 敏感度/% 特异度/% 阳性预测值/% 阴性预测值/% 约登指数 Kappa UA-RI 74.51 85.16 64.41 90.26 0.597 0.823 MCA-RI 77.45 84.45 64.23 91.22 0.619 0.826 UA/MCA-RI 90.20 91.87 80.00 96.30 0.821 0.914 3. 讨论
胎儿窘迫是胎儿在子宫内因急慢性缺氧引发的围产期并发症,可使胎儿出现生长发育缓慢、胎动减少甚至死亡等不良事件[8]。流行病学研究[9]显示,脐带绕颈是胎儿急性窘迫发生的直接因素,约30%的脐带绕颈胎儿患有胎儿窘迫综合征。胎儿血气指标和酸碱度分析是胎儿窘迫诊断的金标准,为胎儿出生后的诊断方式,因而临床诊断有一定局限性[10]。胎儿通过脐带与母体进行氧气供给、营养物质输送及代谢产物回流等,当母体氧气供给和胎儿需求失衡时,会诱发胎儿宫内缺氧等症状[11]。
胎盘是母体与胎儿物质和气体交换的主要载体,脐带是连接胎儿和胎盘的主要枢纽,脐带中UA是母体与胎儿氧气、营养物质等供应和交换的唯一途径,因而UA血流分析已成为临床诊断胎儿疾病的重要手段。胎儿正常发育过程中,胎盘绒毛血管不断分支,绒毛直径减小,绒毛内毛细血管体积变大,血管阻力下降,血流灌注水平提升,因而UA的S/D、PI及RI等血流动力学参数呈下降趋势[12]。胎儿脐带绕颈会对胎儿正常的供氧状态产生一定的影响,典型血流动力学变化则为RI等参数显著提高,因而RI、S/D及PI可作为预测胎儿窘迫的发生、发展的有效指标[13]。
本研究结果显示, 2组受试者UA的S/D和PI比较,差异无统计学意义(P>0.05), 而窘迫组RI值高于正常组。UA-RI诊断的临界值为0.67, 其对应的敏感度为74.51%, 特异度为85.16%, ROC曲线下面积为0.798 (95%CI: 0.750~0.846), 其敏感度较低,分析认为, UA血流动力学可直接反映胎儿体内循环和宫内血流状况,但因受羊水、胎动及脐带超声取样位置等因素影响,其检测值与实际值存在一定偏差,同时UA的血流状况不仅与胎儿本身有关,还与母体血运有关,因而其应用于预测胎儿窘迫有一定局限性[14]。研究[15]发现,各种原因导致胎儿宫内窘迫会造成血流动力学紊乱,主要表现为血管阻力增大,系统灌注减少以及血管收缩,母体血液携氧能力降低,损害胎儿氧供应。张平丽等[16]应用超声预测胎儿窘迫结果发现,党UA-RI截断值>0.68时,其对应的敏感度和特异度与本研究结果相近。
研究[17]表明,血流指标是临床判定围产儿缺血、缺氧症状的重要指标,当胎儿缺氧时,脑部血管扩张,增加大脑血氧供给。路炜等[18]研究表明,随着胎儿中枢神经系统的发育和健全, MCA血管直径不断增大,其RI阻力值不断降低。肖迎聪等[19]研究发现,妊娠晚期胎儿MCA的血流动力学指标水平呈下降趋势,当宫内缺氧时, MCA血管舒张, S/D、PI和RI下降。本研究结果发现, 2组受试者MCA的S/D和PI差异无统计学意义(P>0.05), 而窘迫组RI值低于正常组。MCA-RI诊断的临界值为0.86, 其对应的敏感度为77.45%, 特异度为84.45%, ROC曲线下面积为0.802 (95%CI: 0.758~0.846), 分析原因为在胎儿宫内缺氧早期,胎儿MCA各血流动力学参数均降低,随着病情进展,宫内缺氧持续2 min以上,机体代偿作用会削弱,进而影响正常判断。研究[20]发现, MCA的S/D、PI、RI会因胎儿窘迫程度和时间有所不同,早期或轻度MCA-RI可能降低,但缺氧严重时会升高,与本研究结果基本一致。
本研究发现,窘迫组UA/MCA-RI值高于正常组,且其诊断的临界值为0.71, 其对应的敏感度为90.20%, 特异度为91.87%, ROC曲线下面积为0.902 (95%CI: 0.832~0.972), UA/MCA-RI敏感性和特异性均高于MCA-RI和UA-RI诊断(P < 0.05), 证实两者联合诊断可提高诊断效能,从而全面真实反映胎儿血供情况。罗兵等[21]研究对超声检测MCA、UA及肾动脉等主要供血动脉相关指标联合诊断胎儿窘迫的诊断效能和诊断价值开展了分析,说明超声检查在产前诊断的重要性和作用,在以往研究中相对少见,为临床早期诊断胎儿窘迫提供了相关依据。
-
-
[1] 李军祥, 陈誩. 溃疡性结肠炎中西医结合诊疗共识意见(2017年)[J]. 中国中西医结合消化杂志, 2018, 26(2): 105-111, 120. [2] 吴开春, 梁洁, 冉志华, 等. 炎症性肠病诊断与治疗的共识意见(2018年·北京)[J]. 中国实用内科杂志, 2018, 38(9): 796-813. [3] 张雪莹, 单海燕, 薄淑萍. 隔药灸神阙八阵穴联合角调五音疗法治疗溃疡性结肠炎伴焦虑抑郁状态效果观察[J]. 天津中医药大学学报, 2019, 38(1): 38-41. [4] FEUERSTEIN J D, CHEIFETZ A S. Ulcerative colitis: epidemiology, diagnosis, and management[J]. Mayo Clin Proc, 2014, 89(11): 1553-1563. doi: 10.1016/j.mayocp.2014.07.002
[5] HE X X, LI Y H, YAN P G, et al. Relationship between clinical features and intestinal microbiota in Chinese patients with ulcerative colitis[J]. World J Gastroenterol, 2021, 27(28): 4722-4737. doi: 10.3748/wjg.v27.i28.4722
[6] LUO R, HUO L, ZHANG J, et al. Meta-analysis on causes of ulcerative colitis[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2015, 36(12): 1419-1423.
[7] 李娜, 陶弘武, 柳越冬, 等. 基于生物信息学的溃疡性结肠炎免疫细胞的浸润模式分析[J]. 中国免疫学杂志, 2020, 36(24): 2966-2970, 2975. [8] CHEN H M, WU X H, XU C J, et al. Dichotomous roles of neutrophils in modulating pathogenic and repair processes of inflammatory bowel diseases[J]. Precis Clin Med, 2021, 4(4): 246-257. doi: 10.1093/pcmedi/pbab025
[9] RABE H, MALMQUIST M, BARKMAN C, et al. Distinct patterns of naive, activated and memory T and B cells in blood of patients with ulcerative colitis or Crohn's disease[J]. Clin Exp Immunol, 2019, 197(1): 111-129. doi: 10.1111/cei.13294
[10] CHOWDHURY D, CHOI Y E, BRAULT M E. Charity begins at home: non-coding RNA functions in DNA repair[J]. Nat Rev Mol Cell Biol, 2013, 14(3): 181-189. doi: 10.1038/nrm3523
[11] HU B C, WANG X, HU S F, et al. MiR-21-mediated radioresistance occurs via promoting repair of DNA double strand breaks[J]. J Biol Chem, 2017, 292(8): 3531-3540. doi: 10.1074/jbc.M116.772392
[12] LAM J K, CHOW M Y, ZHANG Y, et al. siRNA versus miRNA as therapeutics for gene silencing[J]. Mol Ther Nucleic Acids, 2015, 4(9): e252.
[13] 胡敏, 王朴, 潘素跃, 等. 基于生物信息学方法探讨特应性皮炎免疫浸润机制及相关中药预测[J]. 中国免疫学杂志, 2023: 1-24. doi: 10.3969/j.issn.1000-484X.2023.01.001 [14] ZHOU G Y, SOUFAN O, EWALD J, et al. NetworkAnalyst 3. 0: a visual analytics platform for comprehensive gene expression profiling and meta-analysis[J]. Nucleic Acids Res, 2019, 47(W1): W234-W241. doi: 10.1093/nar/gkz240
[15] 苏晓路, 董弛, 张静, 等. 溃疡性结肠炎临床病理特点及鉴别诊断[J]. 生物医学转化, 2022, 3(2): 66-74. [16] VENY M, FERNÁNDEZ-CLOTET A, PANÉS J. Controlling leukocyte trafficking in IBD[J]. Pharmacol Res, 2020, 159: 105050. doi: 10.1016/j.phrs.2020.105050
[17] LIU J Q, LIU J, TONG X L, et al. Network pharmacology prediction and molecular docking-based strategy to discover the potential pharmacological mechanism of Huai Hua san against ulcerative colitis[J]. Drug Des Devel Ther, 2021, 15: 3255-3276. doi: 10.2147/DDDT.S319786
[18] ZHU Y F, YANG S H, ZHAO N, et al. CXCL8 chemokine in ulcerative colitis[J]. Biomedecine Pharmacother, 2021, 138: 111427. doi: 10.1016/j.biopha.2021.111427
[19] HA H, DEBNATH B, NEAMATI N. Role of the CXCL8-CXCR1/2 axis in cancer and inflammatory diseases[J]. Theranostics, 2017, 7(6): 1543-1588. doi: 10.7150/thno.15625
[20] 李冬璇, 韩秋菊, 张建. TLR2免疫调节作用的研究进展[J]. 现代免疫学, 2022, 42(1): 82-85. [21] BUI T M, WIESOLEK H L, SUMAGIN R. ICAM-1: a master regulator of cellular responses in inflammation, injury resolution, and tumorigenesis[J]. J Leukoc Biol, 2020, 108(3): 787-799. doi: 10.1002/JLB.2MR0220-549R
[22] LIU Z H, YAGO T, ZHANG N, et al. L-selectin mechanochemistry restricts neutrophil priming in vivo[J]. Nat Commun, 2017, 8: 15196. doi: 10.1038/ncomms15196
[23] SILVA-CARDOSO S C, TAO W Y, ANGIOLILLI C, et al. CXCL4 links inflammation and fibrosis by reprogramming monocyte-derived dendritic cells in vitro[J]. Front Immunol, 2020, 11: 2149. doi: 10.3389/fimmu.2020.02149
[24] HU W T, FANG T Y, ZHOU M X, et al. Identification of hub genes and immune infiltration in ulcerative colitis using bioinformatics[J]. Sci Rep, 2023, 13(1): 6039. doi: 10.1038/s41598-023-33292-y
[25] HU W T, FANG T Y, CHEN X Q. Identification of differentially expressed genes and miRNAs for ulcerative colitis using bioinformatics analysis[J]. Front Genet, 2022, 13: 914384. doi: 10.3389/fgene.2022.914384
[26] WANG Y, ZHUANG H, JIANG X H, et al. Unveiling the key genes, environmental toxins, and drug exposures in modulating the severity of ulcerative colitis: a comprehensive analysis[J]. Front Immunol, 2023, 14: 1162458. doi: 10.3389/fimmu.2023.1162458
[27] XU W Q, ZHANG Z W, YAO L H, et al. Exploration of shared gene signatures and molecular mechanisms between periodontitis and nonalcoholic fatty liver disease[J]. Front Genet, 2022, 13: 939751. doi: 10.3389/fgene.2022.939751
[28] HOU Y, QIAO S J, LI M, et al. The gene signature of tertiary lymphoid structures within ovarian cancer predicts the prognosis and immunotherapy benefit[J]. Front Genet, 2022, 13: 1090640.
[29] ZHOU J, LIU J L, GAO Y Y, et al. miRNA-based potential biomarkers and new molecular insights in ulcerative colitis[J]. Front Pharmacol, 2021, 12: 707776. doi: 10.3389/fphar.2021.707776
[30] LUO J, WANG Y J, LAN D F, et al. Differential expression of serum microRNAs in glucocorticoid-resistant patients with ulcerative colitis[J]. Int J Clin Exp Pathol, 2018, 11(2): 936-946.
[31] WANG Y, WANG N, CUI L L, et al. Long non-coding RNA MEG3 alleviated ulcerative colitis through upregulating miR-98-5p-sponged IL-10[J]. Inflammation, 2021, 44(3): 1049-1059. doi: 10.1007/s10753-020-01400-z
[32] CHEN Z P, GU Q L, CHEN R C. MiR-146a-5p regulates autophagy and NLRP3 inflammasome activation in epithelial barrier damage in the in vitro cell model of ulcerative colitis through the RNF8/Notch1/mTORC1 pathway[J]. Immunobiology, 2023, 228(4): 152386. doi: 10.1016/j.imbio.2023.152386
[33] PATHAK S, GRILLO A R, SCARPA M, et al. MiR-155 modulates the inflammatory phenotype of intestinal myofibroblasts by targeting SOCS1 in ulcerative colitis[J]. Exp Mol Med, 2015, 47(5): e164. doi: 10.1038/emm.2015.21
[34] WU C P, BI Y J, LIU D M, et al. Hsa-miR-375 promotes the progression of inflammatory bowel disease by upregulating TLR4[J]. Eur Rev Med Pharmacol Sci, 2019, 23(17): 7543-7549.
[35] YUAN Y F, LI N, FU M Y, et al. Identification of critical modules and biomarkers of ulcerative colitis by using WGCNA[J]. J Inflamm Res, 2023, 16: 1611-1628. doi: 10.2147/JIR.S402715
-
期刊类型引用(2)
1. 黄建国. 彩色多普勒血流显像技术对脐带绕颈胎儿围生期结局的预测效能探究. 现代医用影像学. 2024(03): 560-564 .  百度学术
百度学术
2. 王晶晶,白燕平,段燕丽. 组建快速反应小组开通绿色通道对胎儿窘迫患者妊娠结局的影响. 中国医药导报. 2024(15): 180-182+185 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
