Establishment and validation of an individualized risk prediction nomogram model for gestational diabetes mellitus in pregnant women with hypothyroidism
-
摘要:目的
建立个体化预测甲状腺功能减退孕妇发生妊娠期糖尿病的风险预测Nomogram模型并验证。
方法选取甲状腺功能减退孕产妇160例作为研究对象,其中合并妊娠期糖尿病患者(观察组)85例,血糖正常患者(对照组)75例。比较2组患者的年龄、孕次、产次以及孕前体质量指数、甲状腺过氧化物酶抗体(TPOAb)、胰岛素抵抗指数(HOMA-IR)、胰岛β细胞功能指数(HOMA-β)、游离四碘甲腺原氨酸(FT4)、游离三碘甲腺原氨酸(FT3)和促甲状腺激素(TSH)。采用多因素分析法分析甲状腺功能减退孕妇发生妊娠期糖尿病的危险因素。采用Nomogram模型预测甲状腺功能减退孕妇发生妊娠期糖尿病的风险。采用受试者工作特征(ROC)曲线评估Nomogram模型对状腺功能减退孕妇发生妊娠期糖尿病的预测价值。
结果观察组患者的年龄、孕次、产次以及孕前体质量指数、TPOAb、HOMA-IR、HOMA-β高于对照组,孕前FT4、FT3、TSH低于对照组,差异有统计学意义(P < 0.05)。多因素分析显示,较高的年龄、孕次、产次以及孕前体质量指数、TPOAb、HOMA-IR、HOMA-β和较低的孕前FT4、FT3、TSH均是甲状腺功能减退孕妇发生妊娠期糖尿病的危险因素。Nomogram模型预测显示,较高的年龄(28~31岁)、孕次(2次以上)、产次(1次以上)和孕前体质量指数(24.00 kg/m2以上)、TPOAb(>421.33 IU/mL)、HOMA-IR(>2.21)、HOMA-β(>115.66)以及较低的孕前FT4(<0.33 ng/dL)、FT3(<1.65 pg/mL)、TSH(<0.26 mIU/mL)均是甲状腺功能减退孕妇发生妊娠期糖尿病的危险因素。ROC曲线分析显示, Nomogram模型预测甲状腺功能减退孕妇发生妊娠期糖尿病的曲线下面积为0.785, 预测效能较好。
结论风险预测Nomogram模型在个体化预测甲状腺功能减退孕妇发生妊娠期糖尿病中的价值较高。
-
关键词:
- Nomogram模型 /
- 甲状腺功能减退 /
- 妊娠期糖尿病 /
- 胰岛素抵抗指数 /
- 促甲状腺激素
Abstract:ObjectiveTo establish and validate an individualized risk prediction nomogram model for the occurrence of gestational diabetes mellitus in pregnant women with hypothyroidism.
MethodsA total of 160 pregnant women with hypothyroidism were selected as the study subjects, including 85 patients with gestational diabetes mellitus (observation group) and 75 patients with normal blood glucose levels (control group). The age, gravidity, parity as well as pre-pregnancy body mass index, thyroid peroxidase antibody (TPOAb), homeostatic model assessment of insulin resistance (HOMA-IR), homeostatic model assessment of beta-cell function (HOMA-β), free thyroxine (FT4), free triiodothyronine (FT3) and thyroid stimulating hormone (TSH) were compared between the two groups. Multivariable analysis was used to analyze the risk factors for gestational diabetes mellitusin pregnant women with hypothyroidism. The nomogram model was used to predict the risk of gestational diabetes mellitus in pregnant women with hypothyroidism. The receiver operating characteristic (ROC) curve was used to evaluate the predictive value of the nomogram model for gestational diabetes mellitus in pregnant women with hypothyroidism.
ResultsThe age, gravidity, parity as well as pre-pregnancy body mass index, TPOAb, HOMA-IR and HOMA-β were higher in the observation group than in the control group, while pre-pregnancy FT4, FT3 and TSH were lower (P < 0.05). Multivariable analysis showed that older age, gravidity, parity as well as pre-pregnancy body mass index, TPOAb, HOMA-IR and HOMA-β, and lower pre-pregnancy FT4, FT3 and TSH were risk factors for gestational diabetes mellitusin pregnant women with hypothyroidism. The nomogram model prediction showed that older age (28 to 31 years), gravidity (more than 2 times), parity (more than 1 time) as well as pre-pregnancy body mass index (above 24.00 kg/m2), TPOAb (> 421.33 IU/mL), HOMA-IR (> 2.21) and HOMA-β (> 115.66), and lower pre-pregnancy FT4 (< 0.33 ng/dL), FT3 (< 1.65 pg/mL) and TSH (< 0.26 mIU/mL) were risk factors for gestational diabetes mellitus in pregnant women with hypothyroidism. ROC curve analysis showed that the area under the curve of the nomogram model for predicting gestational diabetes mellitus in pregnant women with hypothyroidism was 0.785, indicating good predictive performance.
ConclusionThe risk prediction nomogram model has high value in individualized prediction of gestational diabetes mellitus in pregnant women with hypothyroidism.
-
妊娠期糖尿病是孕产妇较为常见的并发症之一,也是导致不良妊娠结局的重要原因之一[1-2]。因此,在临床实践中有效预测并及时干预妊娠期糖尿病对改善患者预后具有重要意义[3]。研究[4]表明,多种因素与妊娠期糖尿病的发生显著相关,主要包括妊娠期葡萄糖代谢异常、胰岛素抵抗以及胰岛素分泌异常。甲状腺功能减退可能会影响血液中葡萄糖和脂肪酸水平,但目前关于甲状腺功能减退与妊娠期糖尿病的相关性及其预测模型的研究相对较少[5]。研究[6]显示,随着甲状腺功能减退,生长激素水平会升高,而长期高水平的生长激素会导致胰岛素受体敏感性下降。本研究建立个体化预测甲状腺功能减退孕妇发生妊娠期糖尿病风险的Nomogram模型,为临床诊断提供参考。
1. 资料与方法
1.1 一般资料
本研究采用前瞻性研究设计,选取2021年1—12月在本院诊断并治疗的甲状腺功能减退孕产妇160例作为研究对象。患者年龄为21~31岁,平均(25.66±2.59)岁; 孕周为22~30周,平均(26.54±2.91)周; 孕次为0~3次,平均(1.26±0.32)次; 产次为0~2次,平均为(1.09±0.12)次。其中,合并妊娠期糖尿病患者(观察组)85例,血糖正常患者(对照组)75例。所有患者均签署知情同意书。本研究经伦理委员会论证通过。
纳入标准: ①妊娠期糖尿病诊断标准者, 在孕期24~28周,进行75 g口服葡萄糖耐量试验(OGTT), 其空腹血糖或1 h后血糖或2 h后血糖异常[7]; ②年龄40岁以下者; ③经B超确定怀孕者; ④孕期诊断甲状腺功能减退(甲减),入组时表现为甲状腺功能水平异常降低者。排除标准: ①感染性疾病者; ②肿瘤患者; ③精神疾病者; ④孕前糖尿病者; ⑤经临床评估有心、脑、肾、胎盘等受损者。
1.2 方法
所有患者入组后均进行静脉采血4 mL, 15 000 r/min离心15 min后,取上清液。采用全自动生化仪对患者的空腹血糖、糖化血红蛋白(HbA1c)进行检测,采用化学发光法对患者的甲状腺过氧化物酶抗体(TPOAb)、血清游离四碘甲腺原氨酸(FT4)、游离三碘甲腺原氨酸(FT3)和促甲状腺激素(TSH)水平进行检测。胰岛素抵抗水平: 通过胰岛素抵抗指数(HOMA-IR)、胰岛β细胞功能指数(HOMA-β)进行评估。HOMA-IR=空腹胰岛素含量×空腹血糖含量/22.5。HOMA-β= 20×空腹胰岛素/(空腹血糖含量-3.5)。
记录所有患者的孕次、产次、孕前摄入碘含量、接受教育年限、自然流产史和孕期合并症等情况。
1.3 观察指标
比较2组患者的孕次、产次、接受教育年限、自然流产史、孕前空腹血糖、HbA1c、TPOAb、FT4、FT3以及TSH水平。
1.4 统计学分析
采用SPSS 26.0软件进行数据分析,所有计量资料均符合正态分布,采用(x±s)表示,行独立样本t检验,计量资料采用[n(%)]表示,行卡方检验。采用多因素Logistic分析法筛选妊娠期糖尿病发病的影响因素。采用Nomogram模型预测甲状腺功能减退患者发生妊娠期糖尿病的危险因素。采用受试者工作特征(ROC)曲线评估Nomogram模型对甲状腺功能减退患者发生妊娠期糖尿病风险的预测价值。P < 0.05表示差异有统计学意义。
2. 结果
2.1 妊娠期糖尿病的单因素分析
观察组患者年龄、孕次、产次、孕前体质量指数、孕前TPOAb、孕前HOMA-IR和孕前HOMA-β高于对照组,孕前FT4、孕前FT3、孕前TSH低于对照组,差异有统计学意义(P < 0.05), 见表 1。
表 1 妊娠期糖尿病的单因素分析(x±s)指标 观察组(n=85) 对照组(n=75) t P 年龄/岁 27.38±3.16 22.49±3.72 8.898 < 0.001 孕次/次 2.75±0.82 1.54±0.22 13.081 < 0.001 产次/次 2.06±0.37 1.08±0.27 19.284 < 0.001 孕前体质量指数/(kg/m2) 25.44±1.84 24.03±1.17 5.851 < 0.001 接受教育年限/年 13.65±3.32 13.68±2.81 0.062 0.951 自然流产次数/次 1.21±0.78 1.22±0.67 0.087 0.931 孕前空腹血糖/(mmol/L) 6.08±1.36 6.11±1.09 0.155 0.877 孕前HbA1c/% 6.17±1.02 6.27±1.47 0.494 0.622 孕前TPOAb/(IU/mL) 421.39±22.98 218.94±23.85 54.504 < 0.001 孕前FT4/(ng/dL) 0.34±0.11 0.45±0.02 5.101 < 0.001 孕前FT3/(pg/mL) 1.65±0.12 2.47±0.33 12.456 < 0.001 孕前TSH/(mIU/mL) 0.29±0.01 2.99±1.87 11.184 < 0.001 孕前HOMA-IR 2.24±0.23 1.02±0.77 13.211 < 0.001 孕前HOMA-β 115.66±3.89 69.14±3.11 83.962 < 0.001 HbA1c: 糖化血红蛋白; TPOAb: 甲状腺过氧化物酶抗体; FT4: 游离四碘甲腺原氨酸; FT3: 游离三碘甲腺原氨酸; TSH: 促甲状腺激素; HOMA-IR: 胰岛素抵抗指数; HOMA-β: 胰岛β细胞功能指数。 2.2 妊娠期糖尿病的多因素分析
多因素分析显示,较高的年龄、孕次、产次、孕前体质量指数、孕前TPOAb、孕前HOMA-IR、孕前HOMA-β以及较低的孕前FT4、孕前FT3、孕前TSH是甲状腺功能减退孕妇发生妊娠期糖尿病的危险因素(P < 0.05), 见表 2、表 3。
表 2 赋值表指标 赋值 年龄/岁 实际值 孕次/次 实际值 产次/次 实际值 孕前体质量指数/(kg/m2) 实际值 孕前TPOAb/(IU/mL) 实际值 孕前FT4/(ng/dL) 实际值 孕前FT3/(pg/mL) 实际值 孕前TSH/(mIU/mL) 实际值 孕前HOMA-IR 实际值 孕前HOMA-β 实际值 表 3 妊娠期糖尿病的多因素分析因素 β S. E. Wald P OR 95%CI 年龄 1.018 2.361 1.322 0.001 1.019 1.009~1.926 孕次 1.062 3.269 1.333 0.002 1.632 1.331~2.320 产次 0.369 4.139 1.691 < 0.001 1.089 1.002~2.065 孕前体质量指数 1.302 2.541 1.025 < 0.001 1.002 1.001~1.568 孕前TPOAb 1.022 2.521 1.002 < 0.001 1.259 1.023~1.599 孕前FT4 1.262 3.251 1.332 < 0.001 0.541 0.023~0.947 孕前FT3 1.003 4.110 1.741 < 0.001 0.225 0.200~0.521 孕前TSH 1.047 5.119 1.025 < 0.001 0.210 0.025~0.574 孕前HOMA-IR 1.552 6.521 1.302 < 0.001 1.336 1.098~1.521 孕前HOMA-β 1.669 4.201 1.587 < 0.001 1.417 1.052~1.977 2.3 Nomogram模型预测甲状腺功能减退孕妇发生妊娠期糖尿病的危险因素
Nomogram模型预测显示,较高的年龄(28~31岁)、孕次(2次以上)、产次(1次以上)、孕前体质量指数(24 kg/m2以上)、孕前TPOAb(>421.33 IU/mL)、孕前HOMA-IR(>2.21)、孕前HOMA-β(>115.66), 较低的孕前FT4(<0.33 ng/dL)、孕前FT3(<1.65 pg/mL)、孕前TSH(<0.26 mIU/mL)均是甲状腺功能减退孕妇发生妊娠期糖尿病的危险因素。见图 1。
2.4 ROC曲线分析
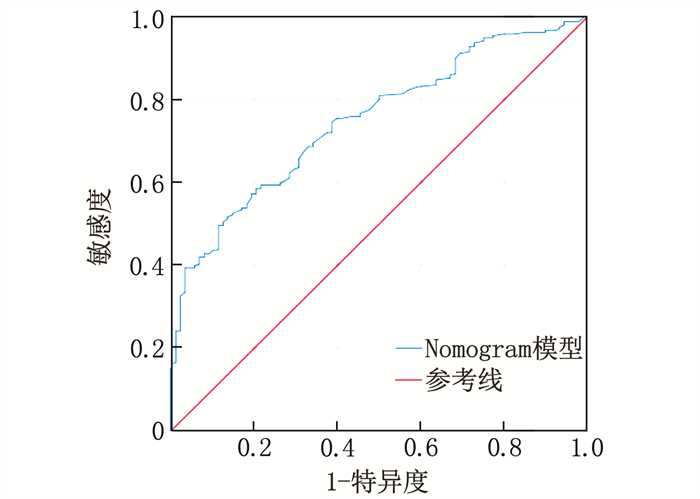
ROC曲线分析显示, Nomogram模型预测甲状腺功能减退孕妇发生妊娠期糖尿病的曲线下面积为0.785, 预测效能较好,见图 2。
3. 讨论
妊娠期糖尿病是临床上较为常见的妊娠期并发症之一,可对孕产妇和新生儿健康构成严重威胁[8]。研究[9]表明,妊娠期糖尿病与多种不良妊娠结局显著相关。产后,特别是在产后3~6年内,超重或肥胖的风险显著增加。不合理的孕期膳食、高龄、不良孕产史、高体质量指数和分娩巨大儿都是导致妊娠期糖尿病发生的危险因素[10]。在该病的进展过程中,随着孕期对葡萄糖需求量的增加,机体的胰岛素抵抗和分泌异常成为引起代谢异常的影响因素[11]。在孕期女性代谢异常发生时,其激素水平也显著波动,并成为其代谢异常的危险因素。内分泌异常主要包括性激素和生长激素水平异常。当甲状腺功能异常时,机体促性腺激素和促性腺激素释放激素的分泌量过高,会对婴幼儿产生严重影响。同时,在长期促性腺激素和促性腺激素释放激素过高的刺激下,机体代谢能力发生显著变化,胰岛素敏感性显著降低,可增加机体糖尿病发生风险[12-13]。在甲状腺功能减退孕妇的健康教育中,临床营养师通常建议加强营养指导,必要时及时检测孕妇甲状腺功能和血糖水平,并在整个孕期适当补充甲状腺素,以有效预防妊娠期糖尿病的发生[14]。
随着年龄增长,机体甲状腺功能和胰岛素分泌功能可能会出现显著退化[15]。随着孕次和产次增加,患者机体受到性激素波动影响也随之升高,而机体性激素波动水平异常是临床上影响患者发生妊娠期胰岛素功能异常和胰岛素分泌异常的重要因素[16]。在性激素过度影响下,机体下丘脑性激素轴的功能发生显著偏差,对糖脂代谢调控功能显著降低,其也是导致机体妊娠期糖尿病发生的重要危险因素[17]。本研究结果显示,在Nomogram模型预测中得出的截断值可作为临床预测甲状腺功能低下孕妇发生妊娠期糖尿病的重要参考[18]。随着机体甲状腺功能降低,胰岛细胞和多种蛋白质合成细胞的能力以及新陈代谢功能发生显著改变。同时,在炎性反应和多种代谢产物的应激作用下,局部病灶部位的微循环障碍风险逐渐升高,这也是孕妇发生妊娠期糖尿病的重要危险因素。但妊娠期糖尿病的发生受遗传因素的影响较大,不同地区、不同人种的遗传基因多态性也是造成其妊娠期糖尿病发生的重要影响因素。本研究仍存在局限性: 研究中模型的验证存在一定单一性,需要结合多种因素进行多中心分析,后续还需开展多中心、大样本研究进一步验证。
综上所述,风险预测Nomogram模型在个体化预测甲状腺功能减退孕妇发生妊娠期糖尿病方面具有一定优势,其可作为临床诊断的参考工具之一。
-
表 1 妊娠期糖尿病的单因素分析(x±s)
指标 观察组(n=85) 对照组(n=75) t P 年龄/岁 27.38±3.16 22.49±3.72 8.898 < 0.001 孕次/次 2.75±0.82 1.54±0.22 13.081 < 0.001 产次/次 2.06±0.37 1.08±0.27 19.284 < 0.001 孕前体质量指数/(kg/m2) 25.44±1.84 24.03±1.17 5.851 < 0.001 接受教育年限/年 13.65±3.32 13.68±2.81 0.062 0.951 自然流产次数/次 1.21±0.78 1.22±0.67 0.087 0.931 孕前空腹血糖/(mmol/L) 6.08±1.36 6.11±1.09 0.155 0.877 孕前HbA1c/% 6.17±1.02 6.27±1.47 0.494 0.622 孕前TPOAb/(IU/mL) 421.39±22.98 218.94±23.85 54.504 < 0.001 孕前FT4/(ng/dL) 0.34±0.11 0.45±0.02 5.101 < 0.001 孕前FT3/(pg/mL) 1.65±0.12 2.47±0.33 12.456 < 0.001 孕前TSH/(mIU/mL) 0.29±0.01 2.99±1.87 11.184 < 0.001 孕前HOMA-IR 2.24±0.23 1.02±0.77 13.211 < 0.001 孕前HOMA-β 115.66±3.89 69.14±3.11 83.962 < 0.001 HbA1c: 糖化血红蛋白; TPOAb: 甲状腺过氧化物酶抗体; FT4: 游离四碘甲腺原氨酸; FT3: 游离三碘甲腺原氨酸; TSH: 促甲状腺激素; HOMA-IR: 胰岛素抵抗指数; HOMA-β: 胰岛β细胞功能指数。 表 2 赋值表
指标 赋值 年龄/岁 实际值 孕次/次 实际值 产次/次 实际值 孕前体质量指数/(kg/m2) 实际值 孕前TPOAb/(IU/mL) 实际值 孕前FT4/(ng/dL) 实际值 孕前FT3/(pg/mL) 实际值 孕前TSH/(mIU/mL) 实际值 孕前HOMA-IR 实际值 孕前HOMA-β 实际值 表 3 妊娠期糖尿病的多因素分析
因素 β S. E. Wald P OR 95%CI 年龄 1.018 2.361 1.322 0.001 1.019 1.009~1.926 孕次 1.062 3.269 1.333 0.002 1.632 1.331~2.320 产次 0.369 4.139 1.691 < 0.001 1.089 1.002~2.065 孕前体质量指数 1.302 2.541 1.025 < 0.001 1.002 1.001~1.568 孕前TPOAb 1.022 2.521 1.002 < 0.001 1.259 1.023~1.599 孕前FT4 1.262 3.251 1.332 < 0.001 0.541 0.023~0.947 孕前FT3 1.003 4.110 1.741 < 0.001 0.225 0.200~0.521 孕前TSH 1.047 5.119 1.025 < 0.001 0.210 0.025~0.574 孕前HOMA-IR 1.552 6.521 1.302 < 0.001 1.336 1.098~1.521 孕前HOMA-β 1.669 4.201 1.587 < 0.001 1.417 1.052~1.977 -
[1] 王玲玲, 郭志国, 陶晓明, 等. 亚甲基四氢叶酸还原酶基因多态性及甲状腺功能与妊娠期糖尿病的相关性[J]. 中国实验诊断学, 2021, 25(6): 825-829. doi: 10.3969/j.issn.1007-4287.2021.06.009 [2] BOZDAG H, AKDENIZ E. Does severe vitamin D deficiency impact obstetric outcomes in pregnant women with thyroid autoimmunity[J]. J Matern Fetal Neonatal Med, 2020, 33(8): 1359-1369.
[3] BIRRU R L, LIANG H W, FAROOQ F, et al. A pathway level analysis of PFAS exposure and risk of gestational diabetes mellitus[J]. Environ Health, 2021, 20(1): 63.
[4] KENT N L, YOUNG S L, AKISON L K, et al. Is the link between elevated TSH and gestational diabetes mellitus dependant on diagnostic criteria and thyroid antibody status: a systematic review and meta-analysis[J]. Endocrine, 2021, 74(1): 38-49.
[5] 王丽, 侯艳萍, 贾广珠. 妊娠期糖尿病孕妇血清甲状腺激素水平与剖宫产术后感染风险的关系[J]. 中国妇幼保健, 2020, 35(23): 4471-4474. [6] 赵玲玲. 甲状腺功能减退对妊娠期糖尿病孕妇糖代谢及胰岛素敏感性的影响[J]. 中国妇幼保健, 2020, 35(4): 634-636. [7] 肖进, 李国敏, 田倩. 妊娠期糖尿病孕妇血清PLGF、TPOAb、HbA1c水平与母婴结局[J]. 中国计划生育学杂志, 2021, 29(8): 1627-1631. [8] 袁清操, 仝俊瑶, 邹密, 等. 妊娠期低甲状腺素血症对妊娠期并发症及不良结局的影响[J]. 实用妇产科杂志, 2021, 37(4): 302-306. [9] 金辉, 陈方圆, 吴跃跃, 等. 妊娠早中期持续孤立性低甲状腺素血症对妊娠期并发症及不良结局的影响[J]. 中华内分泌代谢杂志, 2022, 38(1): 19-23. doi: 10.3760/cma.j.cn311282-20210710-00445 [10] 李艳艳, 赵旭敏. 妊娠期亚临床甲减TPOAb阴性孕妇不同时间左甲状腺素钠片治疗对妊娠结局及幼儿神经功能影响[J]. 中国计划生育学杂志, 2021, 29(7): 1383-1387. [11] 郑皓宇, 胥东, 施蒙娜, 等. 妊娠期甲状腺功能减退症孕妇不同时期治疗效果及妊娠结局[J]. 中国计划生育学杂志, 2021, 29(1): 61-64. [12] 李萍, 崔金晖, 李玲, 等. 甲状腺功能减退妇女早孕期促甲状腺素达标与否与妊娠期糖尿病发生的关系[J]. 中华糖尿病杂志, 2021, 13(11): 1075-1080. doi: 10.3760/cma.j.cn115791-20210418-00217 [13] SHAHID M M, THOUHIDUR RAHMAN K M T, GOMES R R, et al. Association of gestational diabetes mellitus and thyroid status during pregnancy: a cross-sectional study in a tertiary health care center of Bangladesh[J]. Gynecol Endocrinol, 2021, 37(4): 312-314.
[14] 王海燕, 穆庆芬, 马生秀. 妊娠早期甲状腺功能减退与妊娠期糖尿病及糖代谢指标的关系[J]. 中国妇产科临床杂志, 2020, 21(1): 43-45. [15] DUCARME G, DESROYS DU ROURE V, LE THUAUT A, et al. Subclinical hypothyroidism is not associated with neonatal morbidity in women with gestational diabetes mellitus: a case-control study[J]. Arch Gynecol Obstet, 2021, 303(5): 1153-1159.
[16] 林海玲, 王利果. 甲状腺功能减退对妊娠期糖尿病患者糖脂代谢、心功能及妊娠结局的影响[J]. 中国妇幼保健, 2020, 35(8): 1386-1389. [17] RADOSA J C, RADOSA M P, ZIMMERMANN J S M, et al. Incidence of and risk factors for vaginal cuff dehiscence following total laparoscopic hysterectomy: a monocentric hospital analysis[J]. Arch Gynecol Obstet, 2021, 304(2): 447-454.
[18] 林晶, 陈宇清, 陈蕾. 妊娠期糖尿病妇女甲状腺功能与胰岛素抵抗及胰岛β细胞功能的相关性[J]. 现代妇产科进展, 2021, 30(8): 593-596. -
期刊类型引用(13)
1. 丁海英,王素锐. 前馈控制理论指导的护理在新生儿黄疸蓝光照射中的应用. 临床医学工程. 2023(10): 1457-1458 .  百度学术
百度学术
2. 李妍. 多元化个性化护理干预在静脉采血患儿中的应用效果. 妇儿健康导刊. 2023(14): 162-164 .  百度学术
百度学术
3. 廖兵兵. 临床护理路径模式对新生儿静脉留置针致静脉炎发生率的影响. 航空航天医学杂志. 2022(03): 365-368 .  百度学术
百度学术
4. 杨爱华. 前馈控制护理对注意缺陷多动障碍患儿的影响. 齐鲁护理杂志. 2022(07): 149-152 .  百度学术
百度学术
5. 沈永珍,刘宴伟,黄晓睿,龙小球. 基于前馈控制的护理措施对新生儿静脉输液外渗风险因素的预防研究. 海南医学. 2022(11): 1493-1496 .  百度学术
百度学术
6. 刘静,张海惠,李锦红. 前馈控制护理在儿童1型糖尿病合并糖尿病酮症酸中毒中的应用. 海南医学. 2022(13): 1765-1768 .  百度学术
百度学术
7. 皮凌月. 基于前馈控制理论的护理干预对白血病PICC患者深静脉血栓的预防作用. 国际护理学杂志. 2022(12): 2249-2252 .  百度学术
百度学术
8. 付琛,李金荣,马颖源. 前馈控制护理在胸腔镜肺癌根治术麻醉复苏康复中的应用. 齐鲁护理杂志. 2022(22): 33-35 .  百度学术
百度学术
9. 卞国芳,杨凤. 基于前馈控制的母乳口腔护理预防早产儿喂养不耐受研究. 中国医药导报. 2021(25): 193-196 .  百度学术
百度学术
10. 王钰梅,郑春香. 思维导图引导前馈控制护理在小儿外周静脉输液中的应用. 中国医学创新. 2021(36): 103-106 .  百度学术
百度学术
11. 刘新娥,丘林珍. 前馈控制的围术期护理干预在膀胱癌行膀胱全切腹壁尿路造口患者中的应用效果. 泌尿外科杂志(电子版). 2021(03): 113-115 .  百度学术
百度学术
12. 刘欢,王青. 新生儿静脉留置针治疗期间基于失效模式与效应分析模式的护理管理研究. 实用临床医药杂志. 2020(18): 113-115 .  本站查看
本站查看
13. 李艳. 实施前馈控制对提升静脉用药调配中心质量的影响. 实用医技杂志. 2020(08): 1120-1121 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
