Analysis in risk factors of postoperative recurrence of patients with refractory epilepsy and establishment of a risk prediction model
-
摘要:目的
探讨难治性癫痫患者术后复发的危险因素并构建预测模型。
方法回顾性收集2021年6月—2022年10月在本院接受外科手术治疗的280例难治性癫痫患者的临床资料,术后均随访1年。根据复发情况分为未复发组238例和复发组42例。难治性癫痫患者术后复发的危险因素采用单因素、多因素Logistic回归分析法分析; 绘制受试者工作特征(ROC)曲线分析预测模型对难治性癫痫患者术后复发的预测价值。
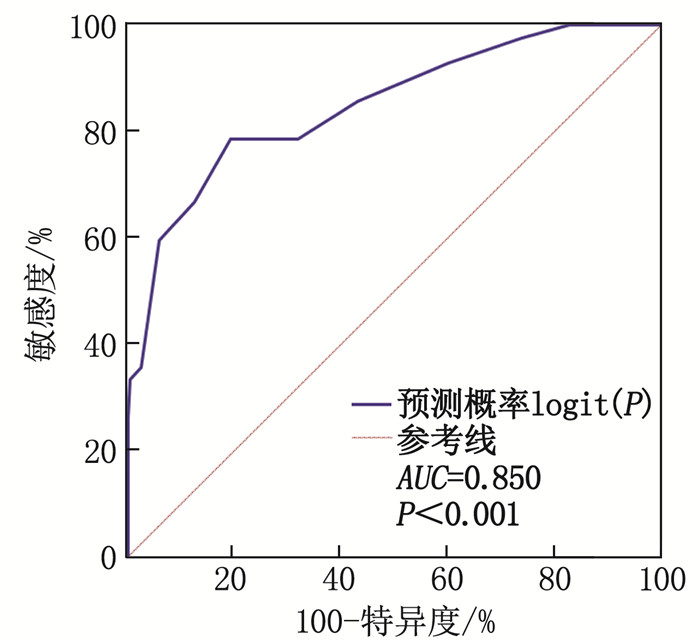
结果多因素Logistic回归分析结果显示,病程>5年、术前病灶定位与手术部位不完全一致、血清维生素B6水平低、血清单核细胞趋化蛋白-1(MCP-1)水平高均是难治性癫痫术后复发的危险因素(OR=2.705、2.314、1.790、2.284, P<0.05)。构建回归模型并按照预测概率logit(P)绘制难治性癫痫术后复发的ROC曲线,当logit(P)>14.52时,曲线下面积(AUC)为0.850, 敏感度为78.57%, 特异度为80.67%。
结论难治性癫痫患者经外科手术治疗后复发的危险因素包括病程>5年、术前病灶定位与手术部位不完全一致、血清维生素B6水平低、血清MCP-1水平高,据此构建的难治性癫痫术后复发的回归模型预测价值较高,可对术后复发的高危群体进行针对性干预,降低其复发风险。
Abstract:ObjectiveTo explore the risk factors for postoperative recurrence in patients with refractory epilepsy and establish a predictive model.
MethodsClinical materials of 280 refractory epilepsy patients with surgical treatment in the hospital from June 2021 to October 2022 were retrospectively collected, with a follow-up of one year after surgery. These patients were divided into non-recurrence group with 238 cases and recurrence group with 42 cases according to their recurrence status. The risk factors for postoperative recurrence in refractory epilepsy patients were analyzed by univariate and multivariate Logistic regression analyses; the receiver operating characteristic (ROC) curve was drawn to evaluate the predictive value of the model for postoperative recurrence in refractory epilepsy patients.
ResultsMultivariate Logistic regression analysis showed that disease duration exceeding 5 years, incomplete concordance between the preoperative localization of the lesion and thesurgical site, low serum vitamin B6 level, and high level of serum monocyte chemoattractant protein-1 (MCP-1) were the significant risk factors for postoperative recurrence in refractory epilepsy patients (OR=2.705, 2.314, 1.790 and 2.284, P < 0.05). A regression model was built based on these findings, and an ROC curve for predicting postoperative recurrence in refractory epilepsy patients was plotted based on the predicted probability logit(P). When logit(P) exceeded 14.52, the area under the curve (AUC) was 0.850, with a sensitivity of 78.57% and a specificity of 80.67%.
ConclusionIn refractory epilepsy patients with surgical treatment, disease duration exceeding 5 years, incomplete concordance between the preoperative localization of the lesion and the surgical site, low serum vitamin B6 level, and elevated MCP-1 level are identified as risk factors for postoperative recurrence. The established regression model for predicting postoperative recurrence in refractory epilepsy patients demonstrates a high predictive value, and can be utilized to identify populations with high-risk of recurrence and guide targeted interventions to reduce the risk of recurrence.
-
Keywords:
- refractory epilepsy /
- surgery /
- recurrence /
- risk factors /
- prediction model /
- intervention strategies
-
支气管哮喘简称哮喘,是以气道重塑及慢性炎症为主要病理特点的一种常见呼吸系统疾病[1], 其中气道平滑肌细胞(ASMC)的过度增殖及凋亡不足是气管重构的重要原因,可继发难治性哮喘,危害严重[2]。微小RNA(miRNA)是一类非编码小RNA, 可通过转录后调控干扰其靶基因mRNA表达或抑制其转录,广泛参与细胞分化、增殖、凋亡及免疫等多种生物学进程,研究[3-4]显示,多种miRNA在哮喘发生与发展中发挥重要作用。微小RNA-455-3p(miR-455-3p)是一种与糖尿病肾病、乳腺癌等多种癌症以及肺动脉高压等炎症性疾病密切相关的miRNA[5-6]。Toll样受体4(TLR4)是一种高度保守的天然免疫受体家族的成员,其表达水平与哮喘ASMC增殖、凋亡及功能状态密切相关。研究[7]显示, miR-455-3p可靶向TLR4基因调节多种细胞损伤及炎症反应。本研究探讨miR-455-3p与TLR4的靶向关系及其对哮喘大鼠ASMC生物学活性及炎症因子分泌功能的影响,现报告如下。
1. 材料与方法
1.1 实验动物
6~8周龄无特定病原体(SPF)级健康雄性SD大鼠12只,体质量190~220 g, 生产许可证号SCXK(粤)2016-0041, 由南方医科大学提供。
1.2 主要试剂及仪器
胎牛血清(FBS,货号10099-145)、DMEM/F-12培养基(货号12634010)购自美国Gibco公司; miR-455-3p NC(阴性对照)、miR-455-3p mimic、pcDNA(空质粒)、pcDNA-TLR4(TLR4过表达质粒)和miR-455-3p、U6、TLR4、GAPDH引物均由吉玛生物科技有限公司合成; 卵清蛋白(OVA,货号A5503)、四甲基偶氮唑蓝(MTT)试剂盒(货号11465007001)购自美国Sigma公司; 原位末端标记法(TUNEL)试剂盒(货号11684795910)购自Roche公司; BCA蛋白定量试剂盒(货号P0010S)购自上海碧云天有限公司; miRNA提取试剂盒(货号AM1561)、LipofectamineⓇ2000转染试剂盒(货号11668)、兔源一抗anti-TLR4(货号14-9924-82)、anti-GAPDH(货号PA1-16777)、二抗羊抗兔IgG(货号A-11008)均购自美国Invitrogen公司; 大鼠肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒(货号ab236712)、白细胞介素-6(IL-6)ELISA试剂盒(货号ab234570)均购自英国Abcam公司; MODEL550型酶标仪购自美国Bio-Rad公司; Forma Steri-Cycle i160 CO2培养箱购自美国Thermo Fisher公司; ix75荧光显微镜购自日本Olympus公司。
1.3 方法
1.3.1 哮喘大鼠模型建立
参考文献[8]方法,随机选取6只大鼠,于实验第1、8天向大鼠皮下注射含OVA 10 mg和氢氧化铝凝胶200 mg的混合物1 mL, 同时腹腔注射灭活百日咳杆菌5×109个,第15天雾化吸入2% OVA磷酸盐缓冲液50 mL, 30 min/次, 1次/d, 持续1周。其余6只正常大鼠给予等量生理盐水(代替OVA)进行同等处理。哮喘模型建立成功标准为大鼠出现烦躁不安,呼吸加深、加快,弓背,严重者甚至出现伸颈、喘息状、大小便失禁等。
1.3.2 实时荧光定量聚合酶链反应(qRT-PCR)检测大鼠肺组织miR-455-3p表达水平
分别取6只哮喘大鼠(模型组)和6只正常大鼠(正常对照组),腹腔注射3%戊巴比妥纳麻醉,留取血液置于4 ℃冰箱用于后续ELISA检测,开胸取双肺组织,分别称取0.5 g(其余肺组织置于-80 ℃冰箱用于后续实验),使用RNA提取试剂盒提取肺组织总RNA并检测其浓度,然后使用逆转录试剂盒合成cDNA, 并以cDNA为模板,按照qRT-PCR试剂盒说明书配置聚合酶链反应(PCR)反应体系,反应程序为95 ℃预变性10 min, 95 ℃变性15 s, 60 ℃退火60 s, 72 ℃延伸2 min, 设置45个循环。以U6作为内参,根据2-△△Ct算法进行miR-455-3p表达量的计算与分析。miR-455-3p上游引物序列5′-GCAGUCCAUGGGCAUAUACAC-3′, 下游引物序列5′-GUGUAUAUGCCCAUGGACUGCUU-3′; U6上游引物序列5′-CTCGCTTCGGCAGCACA-3′, 下游引物序列5′-AACGCTTCACGAATTTGCGT-3′。
1.3.3 ELISA检测大鼠肺组织及血清中炎性因子含量
取上述置于4 ℃冰箱的2组大鼠血液各2 mL和-80 ℃冰箱的肺组织各0.05 g, 按照TNF-α、IL-6 ELISA试剂盒检测说明书检测哮喘大鼠和正常大鼠血清与肺组织中TNF-α、IL-6含量。
1.3.4 ASMC分离、培养及鉴定
取上述置于-80 ℃冰箱的肺组织,低温融化后,于解剖显微镜下分离支气管平滑肌,剪碎后置于含胶原酶2 mg/mL、木瓜蛋白酶3 mg/mL、胰蛋白酶2 mg/mL的D-Hank′s液中,置于37 ℃、5%CO2培养箱中消化1 h, 以100目不锈钢筛网过滤后, 800转/min离心10 min, 弃上清,添加于含20%FBS、1%青链霉素的DMEM/F-12培养基中,置于37 ℃、5%CO2培养箱中培养,采用免疫组化染色法鉴定ASMC α-肌动蛋白表达。选取分离成功的ASMC(第4~8代)用于后续试验。
1.3.5 双荧光素酶报告基因实验
以pmir-GLO质粒为载体,构建与miR-455-3p种子区结合的TLR4基因3′UTR野生型(WT-TLR4)和突变型(MUT-TLR4)双荧光报告重组质粒,之后采用脂质体转染法分别将miRNA(miR-455-3p NC或miR-455-3p mimic)和重组质粒(WT-TLR4或MUT-TLR4)共转染入正常大鼠ASMC, 于CO2培养箱继续培养,分别为miR-455-3p NC+WT-TLR4组、miR-455-3p mimics+MUT-TLR4组、miR-455-3p NC+MUT-TLR4组和miR-455-3p mimics+WT-TLR4组。每组设立6个复孔, 48 h后用PLB裂解细胞,收集细胞裂解液,离心后取上清检测荧火虫荧光素酶信号和海肾荧光素酶信号,计算其相对活性。
1.3.6 细胞炎性诱导、转染及分组
取对数生长期的哮喘大鼠ASMC接种于96孔细胞板,使用TNF-α刺激哮喘大鼠ASMC(96孔板中加入TNF-α至终浓度为20 ng/mL[9]), 使其产生炎症反应后常规培养。转染当天取出细胞于显微镜下观察细胞密度,达到70%~80%汇合率时即可进行转染。更换无血清培养基后,采用Lip2000转染法转染miR-455-3p NC(50 nmol/L,阴性对照, miR-455-3p NC组)、miR-455-3p mimic(50 nmol/L, miR-455-3p mimic组)和共转染miR-455-3p mimic与pcDNA(miR-455-3p mimic+pcDNA组)、共转染miR-455-3p mimic与pcDNA-TLR4(miR-455-3p mimic+pcDNA-TLR4组)至产生炎症反应的大鼠ASMC中,具体操作严格按照试剂盒说明书进行,孵育4~6 h后更换新鲜培养基。另设正常对照组(正常大鼠ASMC)和模型组(哮喘大鼠炎症ASMC),每组6个重复。
1.3.7 qRT-PCR检测各组ASMC中miR-455-3p、TLR4 mRNA表达
采用RNA抽提试剂盒提取各组ASMC总RNA, 反转录得到cDNA置于-20 ℃冰箱保存待用。采用qRT-PCR法扩增miR-455-3p、TLR4 mRNA目的片段。miR-455-3p引物序列及内参U6引物序列见“1.3.2”。TLR4上游引物序列5′-CGCTTTCACCTCTGCCTTCACTACAG-3′, 下游引物序列5′-ACACTACCACAATAACCTTCGGCTC-3′; 内参GAPDH上游引物序列5′-TGATTCTACCCACGGCAAGTT-3′, 下游引物序列5′-TGATGGGTTTCCCATTCATGA-3′。反应条件为95 ℃预变性15 min, 94 ℃变性15 s, 56 ℃退火30 s, 72 ℃延伸20 s, 共40个循环。采用2-△△Ct法定量分析ASMC中miR-455-3p、TLR4 mRNA相对表达水平。
1.3.8 免疫印迹法(WB)检测各组ASMC中TLR4蛋白表达
采用蛋白抽提试剂盒提取各组ASMC总蛋白,用BCA试剂盒检测蛋白浓度,置于-80 ℃保存备用。取40 μg蛋白样品,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 聚偏氟乙烯(PVDF)膜转膜,一抗(anti-TLR4抗体1:1 000, anti-GAPDH抗体1:1 000)4 ℃孵育过夜, TBST缓冲液洗膜,二抗IgG(1:20 000)室温孵育1.5 h, 洗膜,用免疫印记化学发光试剂(ECL)显色,数字化多功能图像增强化学发光系统曝片,拍照保存,分析蛋白条带灰度值。
1.3.9 MTT检测各组ASMC增殖情况
将各组大鼠ASMC于消化后计数,以1×106/mL接种于96孔细胞板,培养48 h后,添加MTT溶液(5 g/L)20 μL孵育4 h, 弃培养基后添加二甲基亚砜(DMSO)150 μL, 振荡混匀后使用酶标仪检测正常对照组、模型组、miR-455-3p NC组、miR-455-3p mimic组、miR-455-3p mimic+pcDNA组和miR-455-3p mimic+pcDNA-TLR4组ASMC光密度(OD)值,每组6个重复。
1.3.10 TUNEL法检测各组ASMC凋亡情况
将正常对照组、模型组、miR-455-3p NC组、miR-455-3p mimic组、miR-455-3p mimic+pcDNA组和miR-455-3p mimic+pcDNA-TLR4组ASMC按1×106/mL密度接种于添加盖玻片的6孔细胞板,待细胞完全汇合后收集盖玻片,以磷酸盐缓冲液(PBS)冲洗,纯丙酮固定。按照TUNEL试剂盒说明书检测各组ASMC凋亡情况,随机选取6个高倍镜下视野,计算阳性细胞百分比(即凋亡率)。
1.3.11 ELISA检测各组ASMC上清液中TNF-α、IL-6水平
收集正常对照组、模型组、miR-455-3p NC组、miR-455-3p mimic组、miR-455-3p mimic+pcDNA组和miR-455-3p mimic+pcDNA-TLR4组ASMC细胞上清液,每孔取100 μL样品,严格按照ELISA试剂盒说明书操作要求检测TNF-α、IL-6表达水平。
1.4 统计学分析
采用SPSS 25.0软件进行统计学分析。计量资料以(x±s)表示, 2组比较采用t检验,多组比较采用单因素方差分析(One-Way ANOVA), 进一步两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2. 结果
2.1 哮喘大鼠与正常大鼠肺组织中miR-455-3p表达水平
模型组大鼠肺组织中miR-455-3p表达水平为(0.33±0.04), 低于正常对照组大鼠的(0.64±0.07), 差异有统计学意义(P < 0.05)。
2.2 哮喘大鼠与正常大鼠肺组织、血清中炎性因子水平
模型组大鼠肺组织与血清中TNF-α、IL-6表达水平均高于正常对照组,差异有统计学意义(P < 0.05), 见表 1。
表 1 2组大鼠肺组织、血清中炎性因子水平比较(x±s)ng/L 组别 n 肺组织 血清 TNF-α IL-6 TNF-α IL-6 正常对照组 6 43.44±4.55 35.25±3.67 9.16±0.94 18.29±1.97 模型组 6 75.43±7.64* 48.36±4.95* 17.34±1.87* 25.43±2.64* TNF-α: 肿瘤坏死因子-α; IL-6: 白细胞介素-6。与正常对照组比较, *P < 0.05。 2.3 大鼠ASMC鉴定
显微镜下可见,正常大鼠ASMC呈梭形,细胞排列疏密相间,细胞形态正常,有较长突起(图 1A)。免疫组化染色法鉴定结果显示, α-肌动蛋白阳性反应细胞为棕黄色(图 1B), 提示ASMC分离成功,可用于后续试验。
2.4 miR-455-3p与TLR4基因靶向关系验证结果
TargetScan在线生物信息学软件预测TLR4基因3′UTR区可能包含miR-455-3p的互补序列,见图 2, 提示TLR4可能是miR-455-3p的作用靶点。双荧光素酶报告基因实验结果显示, miR-455-3p mimics+WT-TLR4组ASMC相对荧光素酶活性低于另3组,差异有统计学意义(P < 0.05), 另3组ASMC相对荧光素酶活性比较,差异无统计学意义(P>0.05), 见表 2, 提示miR-455-3p可直接靶向抑制TLR4基因表达。
表 2 荧光素酶报告基因检测miR-455-3p与TLR4的靶向关系(x±s)组别 n 相对荧光素酶活性 miR-455-3p NC+WT-TLR4组 6 1.03±0.12* miR-455-3p mimics+MUT-TLR4组 6 0.96±0.10* miR-455-3p NC+MUT-TLR4组 6 1.08±0.11* miR-455-3p mimics+WT-TLR4组 6 0.35±0.06 miR-455-3p: 微小RNA-455-3p; TLR4: Toll样受体4;
WT: 野生型; MUT: 突变型。
与miR-455-3p mimics+WT-TLR4组比较, *P < 0.05。2.5 各组大鼠ASMC中miR-455-3p、TLR4 mRNA及TLR4蛋白表达水平比较
与正常对照组比较,模型组和miR-455-3p NC组miR-455-3p表达水平降低, TLR4 mRNA、TLR4蛋白表达水平升高,差异有统计学意义(P < 0.05); 与模型组、miR-455-3p NC组比较, miR-455-3p mimic组和miR-455-3p mimic+pcDNA组miR-455-3p表达水平升高, TLR4 mRNA、TLR4蛋白表达水平降低,差异有统计学意义(P < 0.05); 与miR-455-3p mimic+pcDNA组比较, miR-455-3p mimic+pcDNA-TLR4组miR-455-3p表达水平降低, TLR4 mRNA、TLR4蛋白表达水平升高,差异有统计学意义(P < 0.05); 模型组miR-455-3p、TLR4 mRNA及TLR4蛋白表达水平与miR-455-3p NC组比较,差异无统计学意义(P>0.05); miR-455-3p mimic组miR-455-3p、TLR4 mRNA及TLR4蛋白表达水平与miR-455-3p mimic+pcDNA组比较,差异无统计学意义(P>0.05)。见表 3、图 3。
表 3 各组大鼠ASMC中miR-455-3p、TLR4 mRNA及TLR4蛋白表达水平比较(x±s)组别 n miR-455-3p TLR4 mRNA TLR4蛋白 正常对照组 6 1.07±0.11 0.98±0.10 0.07±0.01 模型组 6 0.61±0.07* 4.22±0.45* 0.30±0.05* miR-455-3p NC组 6 0.58±0.06* 4.19±0.42* 0.32±0.04* miR-455-3p mimic组 6 0.76±0.08#△ 1.93±0.21#△ 0.18±0.03#△ miR-455-3p mimic+pcDNA组 6 0.79±0.08#△ 1.95±0.20#△ 0.16±0.02#△ miR-455-3p mimic+pcDNA-TLR4组 6 0.21±0.03▲ 6.87±0.69▲ 0.67±0.08▲ 与正常对照组比较, *P < 0.05; 与模型组比较, #P < 0.05; 与miR-455-3p NC组比较, △P < 0.05;
与miR-455-3p mimic+pcDNA组比较, ▲P < 0.05。2.6 各组大鼠ASMC增殖活性和凋亡率比较
与正常对照组比较,模型组和miR-455-3p NC组ASMC增殖活性降低,凋亡率升高,差异有统计学意义(P < 0.05); 与模型组、miR-455-3p NC组比较, miR-455-3p mimic组和miR-455-3p mimic+pcDNA组ASMC增殖活性升高,凋亡率降低,差异有统计学意义(P < 0.05); 与miR-455-3p mimic+pcDNA组比较, miR-455-3p mimic+pcDNA-TLR4组ASMC增殖活性降低,凋亡率升高,差异有统计学意义(P < 0.05); 模型组ASMC增殖活性、凋亡率与miR-455-3p NC组比较,差异无统计学意义(P>0.05); miR-455-3p mimic组ASMC增殖活性、凋亡率与miR-455-3p mimic+pcDNA组比较,差异无统计学意义(P>0.05)。见图 4、表 4。
表 4 各组大鼠ASMC增殖活性(OD)、凋亡率比较(x±s)组别 n OD 凋亡率/% 正常对照组 6 0.74±0.08 6.21±0.68 模型组 6 0.49±0.07* 9.52±0.97* miR-455-3p NC组 6 0.47±0.05* 9.58±1.01* miR-455-3p mimic组 6 0.71±0.10#△ 6.56±0.67#△ miR-455-3p mimic+pcDNA组 6 0.78±0.09#△ 6.79±0.71#△ miR-455-3p mimic+pcDNA-TLR4组 6 0.34±0.06▲ 10.21±1.05▲ 与正常对照组比较, *P < 0.05; 与模型组比较, #P < 0.05; 与miR-455-3p NC组比较, △P < 0.05;
与miR-455-3p mimic+pcDNA组比较, ▲P < 0.05。2.7 各组大鼠ASMC上清液TNF-α、IL-6水平比较
模型组和miR-455-3p NC组ASMC上清液TNF-α、IL-6水平高于正常对照组, miR-455-3p mimic组和miR-455-3p mimic+pcDNA组TNF-α、IL-6水平低于模型组和miR-455-3p NC组,miR-455-3p mimic+pcDNA-TLR4组TNF-α、IL-6水平高于miR-455-3p mimic+pcDNA组,差异均有统计学意义(P < 0.05); 模型组TNF-α、IL-6水平与miR-455-3p NC组比较,差异无统计学意义(P>0.05); miR-455-3p mimic组TNF-α、IL-6水平与miR-455-3p mimic+pcDNA组比较,差异无统计学意义(P>0.05)。见表 5。
表 5 各组大鼠ASMC上清液TNF-α、IL-6水平比较(x±s)ng/L 组别 n TNF-α IL-6 正常对照组 6 421.85±47.39 10.25±1.07 模型组 6 1 224.33±127.58* 17.19±1.85* miR-455-3p NC组 6 1 221.86±135.69* 18.21±1.92* miR-455-3p mimic组 6 439.27±46.74#△ 10.98±1.11#△ miR-455-3p mimic+pcDNA组 6 487.95±49.12#△ 12.24±1.37#△ miR-455-3p mimic+pcDNA-TLR4组 6 1 363.52±149.93▲ 17.89±1.85▲ 与正常对照组比较, *P < 0.05; 与模型组比较, #P < 0.05; 与miR-455-3p NC组比较, △P < 0.05;
与miR-455-3p mimic+pcDNA组比较, ▲P < 0.05。3. 讨论
miR-455-3p是一种与人类多种疾病密切相关的小RNA, 参与多种病理生理过程的调控[10]。CHENG F等[11]报道, miR-455-3p参与骨关节炎中白细胞介素-1(IL-1)诱导的细胞凋亡和炎症反应。SUN Y等[12]研究发现, miR-455-3p在结直肠癌中发挥抑癌作用,通过靶向肿瘤蛋白翻译控制1基因抑制癌细胞增殖。另外, miR-455-3p在免疫系统中具有抗炎作用,与多发性硬化症患者的疾病严重程度高度相关,其表达与炎症预测靶点髓样分化因子88(MyD88)呈负相关[13]。由此提示, miR-455-3p在不同疾病中发挥的作用可能不尽相同。本研究结果显示,与正常大鼠比较,哮喘大鼠肺组织中miR-455-3p显著下调,且肺组织和血清中炎性因子TNF-α、IL-6水平显著升高,提示miR-455-3p可能在哮喘中发挥负调控作用。本研究通过生物学信息预测发现, miR-455-3p与TLR4存在靶向结合位点,进一步开展双荧光素酶报告基因实验进行验证,提示TLR4是miR-455-3p潜在靶基因。XU X等[7]研究发现, miR-455-3p可能通过靶向TLR4基因抑制冠心病进展。然而, miR-455-3p靶向TLR4对哮喘大鼠ASMC生物学行为及炎症因子分泌功能的影响尚需进一步研究。
TLRs是固有免疫中重要的模式识别受体家族,包含TLR1至TLR10共10个成员,其中TLR4信号通路异常激活可导致气道中性粒细胞、单核细胞及Th2淋巴细胞等产生大量炎症因子,引起气道高反应,促进哮喘发生与发展[14]。TLR4/MyD88信号通路参与调控哮喘和小鼠气道炎症的发生与发展[15]。ASMC是气道炎症的效应细胞,其过度增殖或凋亡不足与哮喘进展密切相关。相关研究[16-17]表明, TLR4表达可启动和调节哮喘气道炎症反应,进而激活下游核因子κB(NF-κB)和TNF-α、IL-6等炎性因子,参与调控ASMC增殖与凋亡,促进气道重塑。本研究用TNF-α刺激哮喘大鼠ASMC, 使其产生炎症反应,然后转染miR-455-3p NC、miR-455-3p mimic和共转染miR-455-3p mimic与pcDNA、共转染miR-455-3p mimic与pcDNA-TLR4。本研究结果显示,与正常对照组相比,模型组大鼠ASMC中miR-455-3p表达水平、ASMC增殖活性显著降低,TLR4 mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平显著升高,提示模型组细胞中miR-455-3p下调、TLR4上调,两者可能共同参与ASMC的凋亡和炎症反应; 与转染miR-455-3p NC比较,过表达miR-455-3p可使ASMC中miR-455-3p表达水平、ASMC增殖活性显著升高,TLR4 mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平显著降低,说明过表达miR-455-3p可能通过靶向抑制TLR4减少ASMC凋亡和降低炎症因子水平; 与共转染miR-455-3p mimic与pcDNA比较,共转染miR-455-3p mimic与pcDNA-TLR4可使ASMC中miR-455-3p表达水平、ASMC增殖活性显著降低, TLR4 mRNA及TLR4蛋白表达水平、凋亡率和ASMC上清液TNF-α、IL-6水平显著升高,反向验证了上调TLR4可减弱miR-455-3p对ASMC凋亡和炎症反应的抑制作用,提示过表达miR-455-3p可通过靶向抑制TLR4表达,减轻哮喘大鼠ASMC炎症反应,调节其增殖与凋亡平衡,发挥保护作用,同时过表达TLR4可消除miR-455-3p对哮喘大鼠ASMC的保护作用。
综上所述,过表达miR-455-3p可能通过靶向抑制TLR4表达,减轻哮喘大鼠ASMC炎症反应,调节其增殖与凋亡平衡,发挥重要的保护作用。但调控TLR4的miRNA众多,且影响哮喘ASCM增殖、凋亡的机制复杂,其他miRNA及信号通路是否共同参与哮喘大鼠ASMC增殖与凋亡平衡的调节尚不明确,有待进一步深入探究,且后续将继续开展动物体内实验探讨miR-455-3p对哮喘大鼠的影响。
-
表 1 难治性癫痫外科手术后复发的单因素分析(x±s)[n(%)]
因素 分类 未复发组(n=238) 复发组(n=42) χ2/t P 性别 男 125(52.52) 22(52.38) 0 0.987 女 113(47.48) 20(47.62) 病程 >5年 66(27.73) 28(66.67) 24.268 < 0.001 ≤5年 172(72.27) 14(33.33) 吸烟史 有 108(45.38) 21(50.00) 0.307 0.580 无 130(54.62) 21(50.00) 家族史 有 159(66.81) 29(69.05) 0.081 0.776 无 79(33.19) 13(30.95) 术前病灶定位与手术部位的一致性 完全一致 167(70.17) 16(38.10) 16.219 < 0.001 不完全一致 71(29.83) 26(61.90) 发作类型 单纯部分性发作 132(55.46) 18(42.86) 2.281 0.131 全身强直性发作 106(44.54) 24(57.14) 术后水肿 是 90(37.82) 28(66.67) 12.088 < 0.001 否 148(62.18) 14(33.33) 手术切除程度 部分 87(36.55) 31(73.81) 20.321 < 0.001 完全 151(63.45) 11(26.19) 血清维生素B6/(nmol/L) 53.18±6.74 45.29±6.08 7.073 < 0.001 血清单核细胞趋化蛋白-1/(ng/L) 73.16±5.29 81.39±6.47 8.933 < 0.001 表 2 赋值情况
自变量 赋值 病程 >5年=1, ≤5年=0 术前病灶定位与手术部位一致性 不完全一致=1, 一致=0 术后水肿 是=1, 否=0 手术切除程度 部分=1, 完全=1 血清维生素B6水平 原值输入 血清单核细胞趋化蛋白-1水平 原值输入 表 3 难治性癫痫外科手术后复发的多因素Logistic回归分析
影响因素 β SE Wald χ2 P OR 95%CI 病程>5年 0.995 0.367 7.350 0.007 2.705 1.317~5.553 术前病灶定位与手术部位不完全一致 0.839 0.295 8.089 0.004 2.314 1.298~4.126 术后出现水肿 1.135 0.672 2.853 0.091 3.111 0.834~11.613 手术切除程度为部分 1.103 0.591 3.483 0.062 3.013 0.946~9.596 血清维生素B6水平低 0.582 0.218 7.127 0.008 1.790 1.167~2.744 血清单核细胞趋化蛋白-1水平高 0.826 0.372 4.930 0.026 2.284 1.102~4.736 -
[1] ZARNOWSKA I M. Therapeutic use of the ketogenic diet in refractory epilepsy: what we know and what still needs to be learned[J]. Nutrients, 2020, 12(9): 2616. doi: 10.3390/nu12092616
[2] SCHAIQUEVICH P, RIVA N, MALDONADO C, et al. Clinical pharmacology of cannabidiol in refractory epilepsy[J]. Farm Hosp, 2020, 44(5): 222-229.
[3] 李欣, 王正阁, 张冰, 等. fMRI在颞叶癫痫术前定位和预后评估中的研究进展[J]. 磁共振成像, 2020, 11(8): 691-694. https://www.cnki.com.cn/Article/CJFDTOTAL-CGZC202008027.htm [4] SAN-JUAN D. Cathodal transcranial direct current stimulation in refractory epilepsy: a noninvasive neuromodulation therapy[J]. Clin Neurophysiol, 2021, 38(6): 503-508. doi: 10.1097/WNP.0000000000000717
[5] 中国抗癫痫协会. 临床诊疗指南·癫痫病分册[M]. 2版. 北京: 人民卫生出版社, 2015: 6-7. [6] KWAN P, ARZIMANOGLOU A, BERG A T, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies[J]. Epilepsia, 2010, 51(6): 1069-1077. doi: 10.1111/j.1528-1167.2009.02397.x
[7] BARBA C, BLUMCKE I, WINAWER M R, et al. Clinical features, neuropathology, and surgical outcome in patients with refractory epilepsy and brain somatic variants in the SLC35A2 gene[J]. Neurology, 2023, 100(5): e528-e542.
[8] FEYS O, GOLDMAN S, LOLLI V, et al. Diagnostic and therapeutic approaches in refractory insular epilepsy[J]. Epilepsia, 2023, 64(6): 1409-1423. doi: 10.1111/epi.17571
[9] LANGEH U, CHAWLA P, GUPTA G D, et al. A novel approach to refractory epilepsy by targeting pgperipherally and centrally: therapeutic targets and future perspectives[J]. CNS Neurol Disord Drug Targets, 2020, 19(10): 741-749.
[10] NAIMO G D, GUARNACCIA M, SPROVIERI T, et al. A systems biology approach for personalized medicine in refractory epilepsy[J]. Int Mol Sci, 2019, 20(15): 3717. doi: 10.3390/ijms20153717
[11] 石先俊, 邓静, 孙晓琴, 等. 药物难治性癫痫首次手术失败的原因分析及再次手术的疗效[J]. 中国临床神经外科杂志, 2023, 28(5): 303-306, 310. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGLC202305004.htm [12] 姜卉, 姜兵, 张伟, 等. 局灶性皮层发育不良相关难治性癫痫的手术预后影响因素分析[J]. 中国现代手术学杂志, 2023, 27(2): 139-144. https://www.cnki.com.cn/Article/CJFDTOTAL-XDSS202302012.htm [13] 薛亚飞, 景芸芸, 张玉富. 不同FCD分型所致药物难治性癫痫患者的手术预后影响因素[J]. 海南医学, 2019, 30(16): 2085-2088. https://www.cnki.com.cn/Article/CJFDTOTAL-HAIN201916014.htm [14] 李承俊, 王丰, 姚培森, 等. 局灶性皮质发育不良相关"难定位"难治性癫痫的手术疗效及影响因素分析[J]. 中华神经医学杂志, 2021, 20(8): 793-798. https://www.cnki.com.cn/Article/CJFDTOTAL-NENG201903004.htm [15] 季涛云, 王若凡, 刘庆祝, 等. 局灶起源的药物难治性癫痫性痉挛的手术预后及相关预后因素分析[J]. 中华实用儿科临床杂志, 2021, 36(17): 1333-1337. https://cpfd.cnki.com.cn/Article/CPFDTOTAL-KDXX202010001154.htm [16] 严得斌. 低级别胶质瘤相关癫痫患者术后癫痫预后分析[D]. 大连: 大连医科大学, 2019. [17] 张毛松. 成人癫痫相关的幕上低级别胶质瘤术后癫痫复发的相关因素分析[D]. 合肥: 安徽医科大学, 2019. [18] 黄军, 高安亮, 杨子茵, 等. 多脑叶癫痫的外科治疗疗效及危险因素分析[J]. 实用医院临床杂志, 2020, 17(1): 128-131. https://www.cnki.com.cn/Article/CJFDTOTAL-YYLC202001038.htm [19] 舒丽. 难治性癫痫脑叶切除术后复发风险预测模型的建立与验证[D]. 乌鲁木齐: 新疆医科大学, 2023. [20] 董晓杰, 曾宽, 田勤卿. 低级别胶质瘤合并癫痫患者手术预后相关影响因素分析[J]. 医学临床研究, 2019, 36(8): 1586-1588. [21] 程慧冉. 多模态导航辅助电生理技术应用于脑胶质瘤治疗的效果及术后复发的影响因素分析[J]. 实用癌症杂志, 2022, 37(5): 836-839, 843. https://www.cnki.com.cn/Article/CJFDTOTAL-SYAZ202205037.htm -
期刊类型引用(5)
1. 蒋志达,张斌. 通督健脑针法联合固本宣肺方辅助治疗急性脑卒中相关性肺炎疗效观察. 山西中医. 2022(01): 38-41 .  百度学术
百度学术
2. 任向利,任向杰,马雪静,刘肇玮,白玉. 血清血红蛋白清道夫受体可溶性CD163联合中性粒细胞与淋巴细胞比值预测卒中相关性肺炎患者预后的价值. 实用临床医药杂志. 2022(02): 18-22 .  本站查看
本站查看
3. 蒋和平,王劢,吴国荣,王丽东. 血清缺氧诱导因子-1α、肾上腺髓质素前体、甘胆酸水平与老年慢性阻塞性肺疾病急性加重期患者肺功能损伤进展的相关性. 实用临床医药杂志. 2022(05): 122-126 .  本站查看
本站查看
4. 许江飞,周海燕,王宽红. 急性缺血性脑卒中相关性肺炎患者耐药性分析. 河南医学高等专科学校学报. 2022(02): 135-139 .  百度学术
百度学术
5. 张莹,张倩春,姜瑜. 血清pro-ADM、pro-AVP/CPP动态监测评估ICU重症社区获得性肺炎患者预后价值分析. 实验与检验医学. 2020(06): 1153-1158 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:




 苏公网安备 32100302010246号
苏公网安备 32100302010246号
