Effect of resveratrol on endoplasmic reticulum stress and apoptosis in thyroid follicular cells induced by high iodine
-
摘要:目的
探讨白藜芦醇对高碘诱导的甲状腺滤泡细胞内质网应激和凋亡的影响。
方法体外培养甲状腺滤泡细胞系Nthy-ori 3-1, 根据不同培养方法分为正常培养组(Normal组)、高碘组(HI组)、白藜芦醇组(RES组)和高碘联合白藜芦醇组(HI+RES组)。采用CCK-8法检测各组细胞增殖活性, 采用TUNEL法检测各组细胞凋亡情况,采用实时荧光定量聚合酶链反应(PCR)检测各组细胞BIP、CHOP、IRE1 mRNA表达,采用蛋白质印迹法(Western blot)检测BIP、CHOP、IRE1蛋白表达。
结果与Normal组相比, HI组细胞培养72 h后增殖活性下降,凋亡细胞占比升高, TUNEL染色阳性细胞占比升高, BIP、CHOP、IRE1 mRNA相对表达量升高, BIP、CHOP蛋白相对表达量升高,差异有统计学意义(P < 0.001或P < 0.05); 与HI组相比, HI+RES组细胞培养72 h后增殖活性升高,凋亡细胞占比降低, TUNEL染色阳性细胞占比降低, BIP、CHOP mRNA相对表达量降低, BIP、CHOP蛋白相对表达量降低,差异有统计学意义(P < 0.001或P < 0.01)。
结论白藜芦醇对高碘诱导的甲状腺滤泡细胞具有保护效应,可显著抑制碘过量摄入引起的内质网应激和细胞凋亡。
Abstract:ObjectiveTo investigate the effect of resveratrol on endoplasmic reticulum stress and apoptosis in thyroid follicular cells induced by high iodine.
MethodsThe thyroid follicular cell line Nthy-ori 3-1 was cultured in vitro and divided into four groups based on different culture methods: normal culture group (Normal group), high iodine group (HI group), resveratrol group (RES group), and high iodine combined with resveratrol group (HI+RES group). Cell proliferation activity was detected by CCK-8 assay, cell apoptosis was detected by TUNEL assay, and the BIP, CHOP, IRE1 mRNA expressions were detected by real-time quantitative polymerase chain reaction (PCR). Western blot was used to detect the protein expressions of BIP, CHOP, and IRE1.
ResultsCompared with the Normal group, the proliferation activity of cells in the HI group decreased after 72 hours of culture, the proportion of apoptotic cells increased, the proportion of TUNEL staining positive cells increased, and the relative expressions of BIP, CHOP, IRE1 mRNA, as well as BIP and CHOP proteins were significantly elevated (P < 0.001 or P < 0.05). Compared with the HI group, the proliferation activity of cells in the HI+RES group increased after 72 hours of culture, the proportion of apoptotic cells decreased, the proportion of TUNEL staining positive cells decreased, and the relative expressions of BIP, CHOP mRNA, as well as BIP and CHOP proteins, were significantly reduced(P < 0.001 or P < 0.01).
ConclusionResveratrol exerts a protective effect on thyroid follicular cells induced by high iodine, significantly inhibiting endoplasmic reticulum stress and apoptosis caused by excessive iodine intake.
-
Keywords:
- resveratrol /
- thyroid follicular cells /
- iodine excess /
- endoplasmic reticulum stress /
- apoptosis
-
碘是合成甲状腺激素的关键微量元素,人体主要通过饮食摄取碘[1]。研究[2-3]表明,碘营养状况与甲状腺疾病风险呈U型曲线关系,即碘摄入量过低或过高均会显著增加甲状腺疾病的发生风险。研究[4-5]发现,内质网应激参与多种甲状腺疾病的病理生理过程,而碘摄入过量引起的甲状腺激素过量合成可能是诱发内质网应激的主要因素。因此,干预甲状腺细胞的内质网应激反应,有助于甲状腺相关疾病的预防和治疗。白藜芦醇(RES)是存在于葡萄、覆盆子等植物果实中的一种非黄酮类多酚天然有机化合物,具有抗炎、抗氧化作用,其已被用于肿瘤、心血管疾病的预防和辅助治疗中[6]。研究[7-8]发现,白藜芦醇能够通过缓解神经元中的内质网应激,发挥神经保护作用。然而,白藜芦醇在高碘诱导的甲状腺细胞内质网应激中的具体作用目前尚不明确。本研究探讨高碘、白藜芦醇干预对甲状腺滤泡细胞增殖、凋亡及内质网应激相关分子[免疫球蛋白重链结合蛋白(BIP)、C/EBP同源蛋白(CHOP)、肌醇依赖酶1(IRE1)]的影响,现报告如下。
1. 材料与方法
1.1 主要材料
碘化钾、白藜芦醇购自美国Sigma-Aldrich公司; DMEM培养基、胎牛血清、TRIzol细胞裂解液购自美国赛默飞世尔科技公司; CCK-8细胞增殖检测试剂盒购自日本同仁化学研究所; RIPA细胞裂解液、TUNEL细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司; 逆转录试剂盒、荧光定量聚合酶链反应(PCR)试剂盒购自北京全式金生物技术有限公司; 鼠源抗BIP抗体、抗CHOP抗体、抗IRE1抗体和抗GAPDH抗体购自美国CST公司; 辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG抗体购自美国SantaCruz公司。
1.2 细胞培养和分组
使用含体积分数10%胎牛血清的DMEM高糖培养基,对人正常甲状腺细胞系Nthy-ori 3-1进行传代培养。细胞培养于37 ℃、体积分数5%CO2的恒温人工气候箱中。将Nthy-ori 3-1细胞分为4组,分别为正常组(Normal组,正常培养条件)、高碘组(HI组,培养基含50 μmol/L碘化钾)、白藜芦醇组(RES组,培养基含10 μmol/L白藜芦醇)和高碘联合白藜芦醇干预组(HI+RES组,培养基中同时加入50 μmol/L碘化钾和10 μmol/L白藜芦醇)。
1.3 CCK-8法检测细胞增殖活性
Nthy-ori 3-1细胞经胰酶消化后离心,重悬细胞沉淀,并使用血细胞计数板进行计数,调整细胞悬液浓度为1×105个/mL,接种于96孔板中进行贴壁培养。每组细胞设置3个复孔作为对照,给药后0、24、48、72 h, 分别向各孔中加入10 μL CCK-8检测液, 37 ℃条件下继续培养1 h后,使用酶标仪检测各孔450 nm波长处光密度(OD450 nm)值。
1.4 TUNEL法检测细胞凋亡情况
将各组细胞培养于6孔板中,处理72 h后,每孔先用1 mL磷酸盐缓冲液(PBS)洗涤1次,随后加入体积分数4%的多聚甲醛溶液室温固定30 min, 充分洗涤后,加入含体积分数0.3% Triton X-100的PBS透化细胞膜,室温孵育15 min, 再用PBS洗涤2次。每孔加入200 μL TUNEL检测液,于37 ℃恒温箱中避光放置60 min, 然后加入Hoechst 33342染色液染色3 min。于荧光显微镜下观察细胞形态及凋亡细胞染色情况,并计算TUNEL染色阳性细胞占比。
1.5 总RNA提取
移除培养基上清液,用PBS洗涤细胞1次,随后加入500 μL TRIzol细胞裂解液,充分混匀,室温静置15 min后,转移至1.5 mL离心管中。向离心管中加入100 μL氯仿,震荡混匀, 12 000 r/min离心10 min。收集上层水相溶液,加入等体积异丙醇,充分混匀后, 12 000 r/min离心10 min。弃上清液,用体积分数70%乙醇溶液洗涤RNA沉淀2次,并用无核酸酶双蒸水溶解RNA沉淀。
1.6 实时荧光定量PCR检测BIP、CHOP、IRE1 mRNA表达
取1 μg总RNA, 加入逆转录酶、缓冲液和oligo dT引物,并加入双蒸水调整总体积至20 μL。反应体系: 42 ℃孵育15 min, 随后95 ℃孵育3 min, 使逆转录酶失活,得到cDNA溶液。以cDNA为模板,使用针对BIP、CHOP、IRE1基因设计的特异性引物进行实时荧光定量PCR。以GAPDH为内参基因,采用2-△△Ct法计算各组细胞中BIP、CHOP、IRE1 mRNA相对表达量。引物序列见表 1。
表 1 实时荧光定量聚合酶链反应的引物序列引物名称 方向 序列(5′-3′) BIP 正向 TGTTCAACCAATTATCAGCAAACTC 反向 TTCTGCTGTATCCTCTTCACCAGT CHOP 正向 AGAACCAGGAAACGGAAACAGA 反向 TCTCCTTCATGCGCTGCTTT IRE1 正向 CGGGAGAACATCACTGTCCC 反向 CCCGGTAGTGGTGCTTCTTA GAPDH 正向 GTCTCCTCTGACTTCAACAGCG 反向 ACCACCCTGTTGCTGTAGCCAA 1.7 蛋白质印迹法(Western blot)检测BIP、CHOP、IRE1蛋白表达
收集各组细胞,用PBS洗涤后,加入含蛋白酶抑制剂的RIPA细胞裂解液0.25 mL, 于4 ℃裂解20 min。将裂解物于4 ℃低温离心机中以12 000 r/min离心10 min, 取上清液,加入SDS上样缓冲液, 100 ℃加热10 min。取10 μL蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE), 100 V恒压电泳90 min, 随后100 V恒压转膜120 min。将转印蛋白样品的聚偏氟乙烯(PVDF)膜置于含质量分数5%脱脂奶粉溶液中封闭60 min, 然后分别加入抗BIP抗体(1∶ 2 000稀释)、抗CHOP抗体(1∶ 1 000稀释)、抗IRE1抗体(1∶ 1 000稀释)和抗GAPDH抗体(1∶ 4 000稀释)室温孵育120 min, 再加入山羊抗小鼠IgG二抗(1∶ 8 000稀释)室温孵育120 min。使用化学发光底物进行成像,再使用GelPro软件对目的蛋白的灰度值进行定量分析,并计算蛋白相对表达量。
1.8 统计学分析
采用Graphpad 8.0软件对数据进行统计学分析,计量资料以(x±s)表示,组间两两比较采用t检验, P < 0.05为差异具有统计学意义。
2. 结果
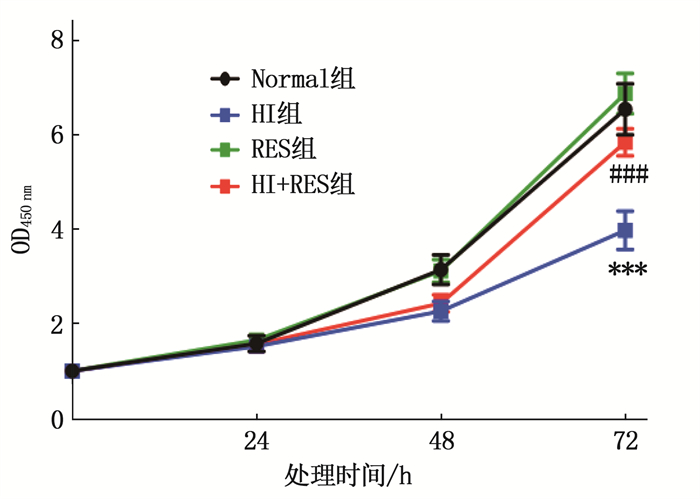
2.1 高碘、白藜芦醇对Nthy-ori 3-1细胞增殖活性的影响
处理24、48 h时, HI组细胞的增殖活性(OD450 nm)低于Normal组,但差异无统计学意义(P>0.05); 处理72 h时, HI组细胞的增殖活性低于Normal组, HI+RES组细胞的增殖活性高于HI组,差异有统计学意义(P < 0.001), 见图 1。
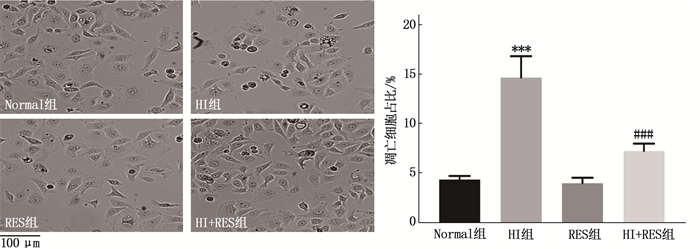
2.2 高碘、白藜芦醇对Nthy-ori 3-1细胞凋亡的影响
显微镜观察结果显示, HI组细胞经高碘处理72 h后,凋亡细胞占比高于Normal组,差异有统计学意义(P < 0.001); HI+RES组凋亡细胞占比低于HI组,差异有统计学意义(P < 0.001), 见图 2。
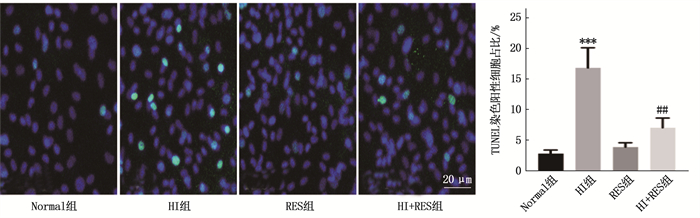
TUNEL法检测结果显示, HI组TUNEL染色阳性细胞占比高于Normal组, HI+RES组TUNEL染色阳性细胞占比低于HI组,差异有统计学意义(P < 0.001或P < 0.01), 见图 3。
2.3 高碘、白藜芦醇对Nthy-ori 3-1细胞内质网应激的影响
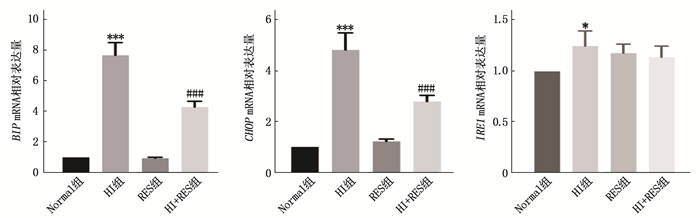
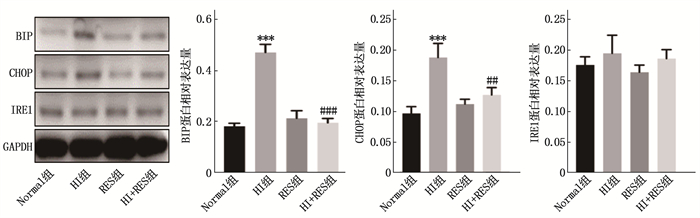
实时荧光定量PCR检测结果显示, HI组细胞BIP、CHOP、IRE1 mRNA相对表达量均高于Normal组,差异有统计学意义(P < 0.001或P < 0.05); HI+RES组BIP、CHOP mRNA相对表达量低于HI组,差异有统计学意义(P < 0.001), 但2组IRE1 mRNA相对表达量差异无统计学意义(P>0.05), 见图 4。
Western blot检测结果显示, HI组细胞BIP、CHOP蛋白相对表达量高于Normal组,差异有统计学意义(P < 0.001), 但2组IRE1蛋白相对表达量差异无统计学意义(P>0.05);HI+RES组BIP、CHOP蛋白相对表达量低于HI组,差异有统计学意义(P < 0.001或P < 0.01), 但2组IRE1蛋白相对表达量差异无统计学意义(P>0.05), 见图 5。
3. 讨论
诸多甲状腺疾病与碘直接或间接相关,碘缺乏可引发非毒性甲状腺肿、甲状腺结节和甲状腺肿瘤,碘过量则与甲状腺功能亢进症(尤其是Graves病)及甲状腺炎的发病风险增加有关,还与甲状腺毒性结节和多发性非毒性结节的出现具有相关性[2]。然而,碘异常导致甲状腺疾病的具体机制目前尚未完全明确。内质网应激是一种亚细胞层面的病理过程,其可响应蛋白折叠异常、钙离子稳态失衡[9], 并通过激活蛋白激酶R样内质网激酶(PERK)、IRE1及激活转录因子6(ATF6)等关键信号通路调控细胞内蛋白合成和细胞凋亡[10-12]。
本研究通过向细胞培养基中添加高浓度(50 μmol/L)碘化钾模拟过量碘摄入状态,结果显示,高碘环境下甲状腺滤泡细胞系Nthy-ori 3-1的增殖活性显著降低,细胞凋亡率显著升高。甲状腺激素主要由甲状腺滤泡上皮细胞合成与分泌,碘过量摄入可能加剧甲状腺激素合成压力,触发未折叠蛋白反应(UPR), 进而诱发内质网应激[4]。本研究实时荧光定量PCR和Western blot检测结果显示, HI组细胞内质网应激相关分子BIP、CHOP的mRNA及其蛋白相对表达量均显著上调,而IRE1仅mRNA相对表达量显著上调,其蛋白相对表达量则无显著变化。BIP作为内质网腔内的关键分子伴侣,在UPR激活时,其蛋白表达通常上调,有助于缓解UPR造成的压力。CHOP作为内质网应激下游的信号分子,由PERK/eIF2α/ATF4信号通路和IRE1/XBP1信号通路共同激活转录,其表达增加可引发细胞凋亡[12]。本研究结果提示,高碘处理激活了甲状腺滤泡细胞中的UPR, 而IRE1蛋白表达并未上调,这可能因为IRE1存在其他负反馈调节机制。
白藜芦醇的抗氧化、抗炎功效已在多种类型细胞和模式生物中得到验证。研究[6]发现,在神经细胞氧化损伤过程中,白藜芦醇可通过干预内质网应激进程发挥神经保护作用。本研究发现,在高碘培养的Nthy-ori 3-1细胞中同时加入白藜芦醇,可显著恢复细胞的增殖活性,并显著降低细胞凋亡率。本研究通过实时荧光定量PCR和Western blot分析进一步发现,经白藜芦醇干预后,高碘培养的细胞中内质网应激相关分子BIP、CHOP的表达均显著下调,而IRE1的表达则无显著变化,提示白藜芦醇对内质网应激的调节作用可能主要通过激活PERK或ATF6信号通路实现。研究[13-15]发现,白藜芦醇能够广泛影响线粒体、内质网等多种细胞结构的功能,并通过稳定线粒体膜电位、促进内质网钙离子释放等多种机制干预细胞的损伤和凋亡。然而,白藜芦醇的确切生物学靶点及其作用机制仍有待明确,未来需进一步开展生物学功能相关研究加以探讨。
综上所述,白藜芦醇对高碘诱导的甲状腺滤泡细胞具有保护效应,可显著抑制碘过量摄入引起的内质网应激和细胞凋亡,提示白藜芦醇可能在碘过量摄入诱发的甲状腺疾病干预中存在潜在的临床应用价值。然而,本研究数据仅基于体外细胞实验获得,后续研究亟需在动物模型层面进行深入验证,以确认白藜芦醇的体内效应及其在甲状腺疾病治疗中的可行性。
-
表 1 实时荧光定量聚合酶链反应的引物序列
引物名称 方向 序列(5′-3′) BIP 正向 TGTTCAACCAATTATCAGCAAACTC 反向 TTCTGCTGTATCCTCTTCACCAGT CHOP 正向 AGAACCAGGAAACGGAAACAGA 反向 TCTCCTTCATGCGCTGCTTT IRE1 正向 CGGGAGAACATCACTGTCCC 反向 CCCGGTAGTGGTGCTTCTTA GAPDH 正向 GTCTCCTCTGACTTCAACAGCG 反向 ACCACCCTGTTGCTGTAGCCAA -
[1] BÍLEK R, DVORÁKOVÁ M, GRIMMICHOVÁ T, et al. Iodine, thyroglobulin and thyroid gland[J]. Physiol Res, 2020, 69(Suppl 2): S225-S236.
[2] TAYLOR P N, ALBRECHT D, SCHOLZ A, et al. Global epidemiology of hyperthyroidism and hypothyroidism[J]. Nat Rev Endocrinol, 2018, 14(5): 301-316.
[3] TSAKIRIDIS I, GIOULEKA S, KOURTIS A, et al. Thyroid disease in pregnancy: a descriptive review of guidelines[J]. Obstet Gynecol Surv, 2022, 77(1): 45-62.
[4] CHEN X S, HUANG H B, LIANG B, et al. Abnormal iodine nutrition-induced ER stress upregulates MCP-1 expression through P38/MAPK signaling pathway in thyroid cells[J]. Biol Trace Elem Res, 2019, 191(1): 98-103.
[5] ZHANG X H, SHAO S S, ZHAO L F, et al. ER stress contributes to high-fat diet-induced decrease of thyroglobulin and hypothyroidism[J]. Am J Physiol Endocrinol Metab, 2019, 316(3): E510-E518.
[6] GALINIAK S, AEBISHER D, BARTUSIK-AEBISHER D. Health benefits of resveratrol administration[J]. Acta Biochim Pol, 2019, 66(1): 13-21.
[7] YAN W J, LIU R B, WANG L K, et al. Sirt3-mediated autophagy contributes to resveratrol-induced protection against ER stress in HT22 cells[J]. Front Neurosci, 2018, 12: 116.
[8] CHENG J B, XIA X H, RUI Y H, et al. The combination of 1α, 25dihydroxyvitaminD3 with resveratrol improves neuronal degeneration by regulating endoplasmic reticulum stress, insulin signaling and inhibiting tau hyperphosphorylation in SH-SY5Y cells[J]. Food Chem Toxicol, 2016, 93: 32-40.
[9] LEE W S, YOO W H, CHAE H J. ER stress and autophagy[J]. Curr Mol Med, 2015, 15(8): 735-745.
[10] CHEN X, CUBILLOS-RUIZ J R. Endoplasmic reticulum stress signals in the tumour and its microenvironment[J]. Nat Rev Cancer, 2021, 21(2): 71-88.
[11] HETZ C, SAXENA S. ER stress and the unfolded protein response in neurodegeneration[J]. Nat Rev Neurol, 2017, 13(8): 477-491.
[12] DANDEKAR A, MENDEZ R, ZHANG K Z. Cross talk between ER stress, oxidative stress, and inflammation in health and disease[J]. Methods Mol Biol, 2015, 1292: 205-214.
[13] HUANG Y J, ZHU X H, CHEN K, et al. Resveratrol prevents sarcopenic obesity by reversing mitochondrial dysfunction and oxidative stress via the PKA/LKB1/AMPK pathway[J]. Aging, 2019, 11(8): 2217-2240.
[14] ZHENG M S, BAI Y L, SUN X Y, et al. Resveratrol reestablishes mitochondrial quality control in myocardial ischemia/reperfusion injury through Sirt1/Sirt3-Mfn2-parkin-PGC-1α pathway[J]. Molecules, 2022, 27(17): 5545.
[15] RAGONESE F, MONARCA L, LUCA A D, et al. Resveratrol depolarizes the membrane potential in human granulosa cells and promotes mitochondrial biogenesis[J]. Fertil Steril, 2021, 115(4): 1063-1073.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
