Influencing factors of early neurologic deterioration in elderly patients undergoing thrombectomy for acute occlusive stroke of large intracranial vessels
-
摘要:目的
探讨高龄颅内大血管急性闭塞性卒中取栓患者发生神经功能早期恶化的相关因素。
方法回顾性分析480例高龄颅内大血管急性闭塞性卒中取栓患者的临床资料。取栓治疗后72 h内, 采用美国国立卫生研究院神经功能缺损量表(NIHSS)评估患者神经功能,并将其分为恶化组与未恶化组。比较2组基线资料,分析神经功能早期恶化的因素,绘制受试者工作特征(ROC)曲线分析风险预测价值。
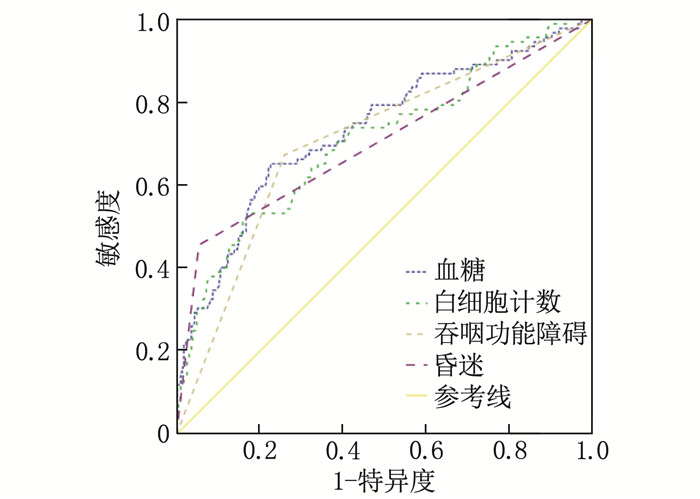
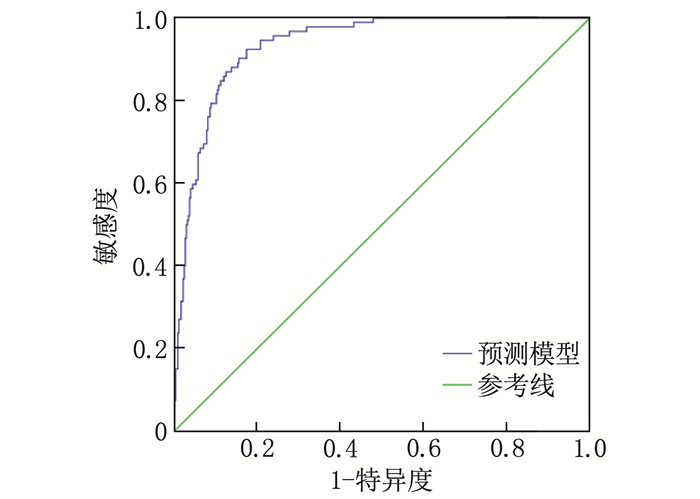
结果480例高龄颅内大血管急性闭塞性卒中取栓患者中,发生神经功能早期恶化的患者92例,占比19.17%;恶化组血糖水平、白细胞计数、吞咽功能障碍发生率、昏迷发生率高于未恶化组,差异有统计学意义(P < 0.05);Logistic回归分析显示,血糖升高(95% CI: 1.203~1.478)、白细胞计数升高(95% CI: 1.159~1.408)、吞咽功能障碍(95% CI: 7.049~31.475)、昏迷(95% CI: 8.375~43.195)是高龄颅内大血管急性闭塞性卒中取栓患者发生神经功能早期恶化的危险因素(OR>1, P < 0.05);ROC曲线结果显示,血糖、白细胞计数、吞咽功能障碍、昏迷对高龄颅内大血管急性闭塞性卒中取栓患者发生神经功能早期恶化具有一定的预测价值[曲线下面积(AUC)=0.733、0.708、0.707、0.701];ROC曲线显示模型AUC=0.934, 提示模型可靠、稳定。
结论高龄颅内大血管急性闭塞性卒中取栓患者神经功能早期恶化可能与血糖、白细胞计数、吞咽功能障碍、昏迷等因素有关,临床可早期进行风险评估,并采取相关干预措施以改善预后。
-
关键词:
- 颅内大血管急性闭塞性卒中 /
- 高龄患者 /
- 取栓治疗 /
- 神经功能早期恶化
Abstract:ObjectiveTo investigate the related factors of early neurological deterioration in elderly patients with thrombolysis for acute occlusive stroke of large intracranial vessels.
MethodsClinical materials of 480 elderly patients with thrombolysis for acute occlusive stroke of large intracranial vessels were retrospectively analyzed. The National Institutes of Health Stroke Scale (NIHSS) was used to evaluate the neurological function of patients within 72 hours after thrombectomy, and the patients were divided into deterioration group and non-deterioration group. The baseline materials were compared between the two groups, the factors of early neurological deterioration were analyzed, and the receiver operating characteristic (ROC) curve was drawn to analyze the predictive value of risk.
ResultsAmong 480 elderly patients with thrombolysis for acute occlusive stroke of large intracranial vessels, 92 cases (19.17%) had early neurological deterioration; the blood glucose level, white blood cell count, incidence of dysphagia, and incidence of coma in the deterioration group were significantly higher than those in the non-deterioration group (P < 0.05); the Logistic regression analysis showed that high level of blood glucose (95%CI, 1.203 to 1.478), high level of white blood cell count (95%CI, 1.159 to 1.408), dysphagia (95%CI, 7.049 to 31.475), and coma (95%CI, 8.375 to 43.195) were risk factors for early neurological deterioration in elderly patients with thrombolysis for acute occlusive stroke of large intracranial vessels (OR>1, P < 0.05). ROC curve results showed that blood glucose, white blood cell count, dysphagia, and coma had certain predictive value for early neurological deterioration in elderly patients with thrombolysis for acute occlusive stroke of large intracranial vessels[the area under the curve (AUC) was 0.733, 0.708, 0.707 and 0.701]; the ROC curve showed AUC was 0.934, indicating that the model was reliable and stable.
ConclusionEarly neurological deterioration in elderly patients with thrombolysis for acute occlusive stroke of large intracranial vessels may be related to factors such as blood glucose, white blood cell count, dysphagia, and coma. Early risk assessment and relevant intervention measures can be taken clinically to improve prognosis.
-
食管癌(ESCA)为中国常见的恶性肿瘤之一,其发病率及病死率均位居前5位[1-2]。目前ESCA的治疗方式仍以外科治疗为主,随着医疗水平进步,分子靶向治疗逐步显现出较强的优势[3-6]。在临床免疫及分子靶向治疗过程中,特异性靶点的探索是针对性药物研发的重中之重,而何种靶向分子具有特异性且临床治疗安全有效则一直是科研人员不断探索的热点[7-10]。赖氨酸氧化酶(Lox)是肿瘤细胞微环境中调节细胞外基质(ECM)的一个重要因子,其可作用于ECM中胶原及弹性纤维的共价键交联,对ECM的发育、成熟及稳定有重要作用[11-13]。
近年来, Lox在肿瘤发生发展中的作用逐渐成为科研热点,但其具体机制仍未明确。目前,由于生物科学的技术进步,许多基于高通量测序技术的生物信息学数据被检测并上传到公共数据库中,而使用统计学和生物信息学等多学科联合的分析方法从中提取出可以预测患者预后状况的分子标志物以及与疾病发生发展有关的分子机制则是一种重要的解决方案[14]。本研究以生物信息学为基础,通过蛋白免疫印迹(Western blot)、免疫组化等方法探索Lox在ESCA以及骨转移中的作用,现报告如下。
1. 资料与方法
1.1 数据收集与初步筛选
通过基因表达谱分析互动平台(GEPIA)网站[15](http://gepia.cancer-pku.cn/)筛选ESCA癌症组织与正常组织中表达差异有意义的基因,通过下载肿瘤与癌症基因组图谱(TCGA)中ESCA数据库并进行差异表达基因分析。
1.2 基因功能富集分析
以Lox表达平均值进行高低分组,通过基因集富集分析(GSEA)探索Lox在ESCA中参与的通路及生物学进程。
1.3 临床资料收集
选取2016年1月—2020年12月收治的食管癌患者为研究对象。纳入标准: ①经临床、影像和病理检查确诊为食管癌者; ②行食管癌手术治疗者; ③随访过程中确诊骨转移者。排除标准: ①仅有临床、影像证据,无明确病理诊断者; ②不能排除骨原发肿瘤、结核病者。收集指标包括一般人口学特征(性别、年龄、体质量指数)、食管癌部位、病理、骨转移灶部位、治疗方式、无骨转移生存时间、总生存期和生存状态。通过门诊、电话及查阅住院病历获取患者信息。
1.4 Western blot验证Lox在食管癌病灶及正常组织中的表达
① 提取组织或细胞蛋白; ②测定蛋白质水平; ③电泳,条件设定为恒压120 V, 待染料前沿移行到距离凝胶底部4~5 mm时停止(约180 min); ④电转膜仪转膜,转膜条件为恒流250 mA, 2 h; ⑤封闭, 5%脱脂牛奶室温封闭2 h; ⑥加一抗,一抗封膜后室温条件下摇1 h, 然后放入4 ℃冰箱中过夜[Lox, 美国Abcam公司, No. ab174316, 用磷酸盐缓冲液(PBS)按照1∶300的稀释比例稀释]; ⑦收一抗, PBS加Tween-20(PBST)洗膜3次, 10 min/次; ⑧二抗孵育1 h(β-actin, 美国Abcam公司, No. ab179467,用PBS按照1∶500的稀释比例稀释); ⑨洗膜, PBST洗膜5次, PBS洗膜1次, 8 min/次; ⑩显色。
1.5 免疫组化染色以及病理结果评价及判定
通过对93例石蜡包埋ESCA组织进行切片,应用免疫组织化学方法将Lox染色,实验前蜡块处理、切片,抗原修复及染色过程均相同,二氨基联苯胺(DAB)显色后立刻用苏木精将细胞核染色,氨水返蓝于质量分数为75%、85%、95%、100%酒精中浸泡切片10 min, 进行脱水,将切片放入二甲苯中浸泡10 min取出,切片、封片。
1.6 统计学方法
采用R语言、SPSS 26.0和GraphPad Prism 8.0统计软件进行数据分析,计数资料以(x±s)描述,组间比较采用χ2检验。生存曲线绘制采用Kaplan-Meier法,差异比较采用Log-rank检验,分析2组患者的总生存期(OS)。采用Cox回归比例风险模型分析Lox表达与患者预后的关系,P<0.05为差异有统计学意义。
2. 结果
2.1 生物信息学分析
将TCGA与基因型组织表达数据库(GTEx)数据下载后标准化,利用R语言进行Lox表达量分析发现,肿瘤组织中Lox呈高表达,与正常食管组织比较,差异有统计学意义(P<0.001); 根据差异基因的表达量绘制差异最显著的前9位基因以及Lox热图,结果显示Lox在食管癌患者肿瘤病灶中高于正常食管组织。见图 1。
2.2 GSEA富集分析
在GSEA富集分析中,以Lox表达平均值进行高低分组,富集分析发现Lox高表达可参与“KEGG-Basl cell carcinoma”“KEGG-mTOR signaling pathway”“KEGG-P53 signaling pathway”“KEGG-VEGF signaling pathway”“KEGG-WNT signaling pathway”的进程,差异有统计学意义(P<0.05), 这为进一步探索Lox参与的相关通路提供了重要依据。见图 2。
2.3 临床资料
共有93例患者符合纳入标准,男64例,女29例; 原发灶病理类型为鳞癌63例(67.7%), 腺癌24例(25.8%), 其他6例(6.5%); 发病部位为上段15例(16.1%), 中段56例(60.2%), 下段22例(23.7%); 食管癌接受同步放化疗者40例(43.0%), 未接受同步放化疗者53例(57.0%); 单处骨转移者47例(50.5%), 多发骨转移者46例(49.5%)。见表 1。
表 1 ESCA患者临床资料及Lox表达情况(x±s)临床资料 分类 n Lox表达 P 低表达(n=42) 高表达(n=51) 年龄/岁 66.0±8.5 65.0±11.5 0.708 性别 男 64 28 36 0.685 女 29 14 15 发病部位 上段 15 2 13 0.026 中段 56 29 27 下段 22 11 11 病理类型 鳞癌 63 30 33 0.677 腺癌 24 9 15 其他 6 3 3 脊柱转移 是 65 28 37 0.538 否 28 14 14 骨转移数目 单发 47 29 18 0.001 多发 46 13 33 2.4 Western blot
Western blot实验结果显示, ESCA正常组织中Lox表达低于肿瘤组织,见图 3。
2.5 免疫组化染色
收集患者临床病理资料,对ESCA组织及正常组织进行免疫组化染色,结果显示ESCA组织中Lox高表达患者51例,正常组织中Lox高表达者22例; 结合随访资料发现,高表达Lox的患者更倾向于多发骨转移,差异有统计学意义(P<0.05)。见图 4。
2.6 GEPIA数据库生存分析
GEPIA数据库分析显示, ESCA病灶中高表达Lox的患者较低表达Lox的患者的OS缩短,差异有统计学意义(PLog-ran k=0.047, HR=1.6), 但无病生存期(DFS)无显著差异,见图 5。
2.7 随访生存分析及Cox多因素分析
Lox低表达组与Lox高表达组无骨转移生存期及OS比较,差异有统计学意义(P<0.05), 见图 6。Lox低表达组1、2、3年的总生存率分别为77.9%、62.9%、33.1%, Lox高表达组分别为67.2%、12.2%、6.1%。多因素Cox分析显示, Lox表达是ESCA骨转移患者预后的独立影响因素(HR=1.770, 95%CI: 1.016~3.085, P=0.044), 见表 2。
表 2 ESCA患者预后的多因素Cox回归分析因素 β HR(95%CI) P 年龄 -0.017 0.983(0.961~1.006) 0.140 性别 0.722 2.058(1.104~3.839) 0.023 体质量指数 -0.030 0.970(0.896~1.051) 0.460 原发部位 0.249 1.283(0.800~2.056) 0.301 骨转移灶是否手术 0.652 1.919(1.080~3.409) 0.026 病理类型 0.179 1.196(0.777~1.842) 0.415 是否脊柱转移 0.261 1.299(0.716~2.354) 0.389 是否单发转移 -0.659 0.517(0.299~0.896) 0.019 原发灶是否同步放化疗 -0.804 0.448(0.250~0.802) 0.007 Lox表达量 0.571 1.770(1.016~3.085) 0.044 3. 讨论
研究[16-17]显示, ECM对肿瘤的发生发展起着不可或缺的作用。ECM是肿瘤微环境中最重要的组成部分,其承载肿瘤细胞周围的养分供应、免疫细胞浸润等不同职能[18-19]。Lox家族是一组分泌型铜依赖性胺氧化酶,其主要功能是催化ECM中胶原蛋白、弹性蛋白的共价交联,对ECM发育、成熟、修复及稳定起重要作用。研究[20-21]显示, Lox可以调节胰腺癌细胞侵袭转移的能力,高表达Lox的胰腺癌细胞具有更强的侵袭及转移能力,其肿瘤异质性的增强可能与自噬、EMT、抗凋亡、促进细胞增殖有关[22-23]。研究[24-25]显示,三阴性乳腺癌中Lox表达更高,低表达Lox可降低乳腺癌患者骨转移的发生率,低表达Lox的患者较高表达Lox的患者OS更高。GONZÁLEZ-CHAVARRÍA I等[26]研究发现, Lox-1与基质金属蛋白酶(MMP)-2、MMP-9表达呈正相关,高表达Lox-1可明显增强肿瘤的恶性程度。NILSSON M等[27]研究发现,高表达Lox可使非恶性前列腺上皮转变为前列腺癌,显著影响患者临床预后。本研究中,高表达Lox与食管癌骨转移呈正相关,这与既往研究[28-30]显示Lox是促进转移的主要因素的结论相符合,这也从侧面提示抑制Lox可以作为免疫治疗的新研究方向。
肿瘤的发生发展是一个多因素、多步骤的过程,骨是肿瘤转移的重要部位,约10%的癌症患者和40%的已知转移性骨病患者将出现症状性骨转移。一旦癌症扩散到骨骼,就很难治愈,其会导致疼痛、病理性骨折、高钙血症及神经压迫等骨相关事件的发生。本研究针对Lox在食管癌中的作用进行了初步的探索,通过生物信息学结合实验研究发现, Lox对于提高ESCA的侵袭转移能力有较强的作用,在大数据分析的基础上探索发现高表达Lox可能参与“KEGG-Basl cell carcinoma”“KEGG-mTOR signaling pathway”“KEGG-P53 signaling pathway”“KEGG-VEGF signaling pathway”“KEGG-WNT signaling pathway”的进程。尽管GEPIA数据库分析显示Lox的表达对于DFS无显著影响,但临床随访资料显示Lox高表达可显著降低患者无骨转移生存率及OS, 进一步证实Lox是预测食管癌患者OS的重要影响因素。
综上所述,本研究以生物信息学为基础,探索了Lox在食管癌中的表达,利用GSEA富集分析初步探索了Lox在食管癌发生发展中的相关通路,结合GEPIA及随访资料进行生存分析发现Lox可能是影响食管癌患者骨转移及预后的重要因素。
-
表 1 恶化组与未恶化组基线资料比较(x±s)[n(%)]
指标 分类 恶化组(n=92) 未恶化组(n=388) t/χ2 P 性别 男 49(53.26) 203(52.32) 0.026 0.871 女 43(46.74) 185(47.68) 年龄/岁 78.62±2.03 78.84±2.16 0.888 0.375 血糖/(mmol/L) 10.08±3.61 7.21±2.96 7.999 < 0.001 舒张压/mmHg 86.52±9.63 84.98±10.25 1.310 0.191 收缩压/mmHg 151.42±16.38 149.79±15.47 0.898 0.370 白细胞计数/(×109/L) 10.98±3.76 8.17±3.18 7.347 < 0.001 血小板计数/(×109/L) 214.32±48.62 209.73±51.24 0.780 0.436 中性粒细胞百分比/% 0.74±0.13 0.72±0.14 1.248 0.213 血红蛋白/(g/L) 139.82±12.86 141.73±13.62 1.222 0.222 责任梗死部位 前循环 51(55.43) 219(56.44) 0.301 0.861 后循环 41(44.57) 169(43.56) 吞咽功能障碍 发生 62(67.39) 101(26.03) 56.726 < 0.001 未发生 30(32.61) 287(73.97) 昏迷 发生 42(45.65) 21(5.41) 105.608 < 0.001 未发生 50(54.35) 367(94.59) 吸烟史 有 18(19.57) 82(21.13) 0.111 0.739 无 74(80.43) 306(78.87) 饮酒史 有 23(25.00) 94(24.23) 0.024 0.877 无 69(75.00) 294(75.77) 发病至入院治疗时间/h 4.62±1.42 4.78±1.51 0.924 0.356 缺血半暗带体积/mL 26.75±4.31 27.12±4.53 0.711 0.478 取栓前NIHSS评分/分 4.32±1.19 4.43±1.22 0.781 0.435 NIHSS: 美国国立卫生研究院神经功能缺损量表。 表 2 主要自变量赋值说明
变量 变量说明 赋值情况 血糖 数值变量 — 白细胞计数 数值变量 — 吞咽功能障碍 分类变量 1=发生, 0=未发生 昏迷 分类变量 1=发生, 0=未发生 表 3 高龄颅内大血管急性闭塞性卒中取栓患者发生神经功能早期恶化的多因素Logistic回归分析
指标 β 标准误 Wald χ2 P OR 95%CI 血糖 0.288 0.053 30.102 < 0.001 1.334 1.203~1.478 白细胞计数 0.245 0.050 24.274 < 0.001 1.277 1.159~1.408 吞咽功能障碍 2.701 0.382 50.064 < 0.001 14.895 7.049~31.475 昏迷 2.946 0.418 49.540 < 0.001 19.020 8.375~43.195 常量 -8.205 0.852 92.709 < 0.001 0 — 表 4 多因素预测高龄颅内大血管急性闭塞性卒中取栓患者发生神经功能早期恶化的价值
检验变量 AUC 标准误 P 95%CI cut-off值 敏感度 特异度 约登指数 血糖 0.733 0.031 < 0.001 0.672~0.795 8.305 mmol/L 0.696 0.642 0.338 白细胞计数 0.708 0.032 < 0.001 0.646~0.771 9.010×109/L 0.685 0.629 0.314 吞咽功能障碍 0.707 0.031 < 0.001 0.646~0.768 — 0.674 0.740 0.414 昏迷 0.701 0.035 < 0.001 0.633~0.769 — 0.657 0.746 0.403 -
[1] ELARJANI T, CHEN S, CAJIGAS I, et al. Pituitary apoplexy and cerebral infarction: case report and literature review[J]. World Neurosurg, 2020, 141: 73-80. doi: 10.1016/j.wneu.2020.05.276
[2] MATTHEWS A, YUI J, CHIANG E Y, et al. Cerebral Infarction due to Severe ADAMTS-13 Deficiency with Normal Hematological Parameters: a Cause of Cryptogenic Stroke[J]. J Stroke Cerebrovasc Dis, 2022, 31(6): 106431. doi: 10.1016/j.jstrokecerebrovasdis.2022.106431
[3] 李志亮, 李宇瑾, 黄燕波. 静脉溶栓桥接支架联合抽吸取栓开通颅内血管急性闭塞观察[J]. 实用中西医结合临床, 2020, 20(10): 46-47, 68. https://www.cnki.com.cn/Article/CJFDTOTAL-SZXL202010024.htm [4] KOBAYASHI Y, MORIZUMI T, NAGAMATSU K, et al. Persistent working memory impairment associated with cerebral infarction in the anterior cingulate cortex: a case report and a literature review[J]. Intern Med, 2021, 60(21): 3473-3476. doi: 10.2169/internalmedicine.6927-20
[5] CHE F L, WANG A X, JU Y, et al. Early neurological deterioration in acute ischemic stroke patients after intravenous thrombolysis with alteplase predicts poor 3-month functional prognosis - data from the Thrombolysis Implementation and Monitor of Acute Ischemic Stroke in China (TIMS-China)[J]. BMC Neurol, 2022, 22(1): 212. doi: 10.1186/s12883-022-02737-8
[6] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志, 2015, 48(4): 246-257. [7] LIN W C, HUANG C Y, LEE L F, et al. Initial national institute of health stroke scale to early predict the improvement of swallowing in patients with acute ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2019, 28(10): 104297. doi: 10.1016/j.jstrokecerebrovasdis.2019.07.013
[8] 李艳杰, 秦正良, 张新江. 急性缺血性脑卒中患者早期神经功能恶化的相关因素分析[J]. 实用临床医药杂志, 2020, 24(9): 6-9. https://www.cnki.com.cn/Article/CJFDTOTAL-XYZL202009002.htm [9] 石若南, 潘玉君. 急性缺血性脑卒中后早期神经功能恶化的危险因素分析[J]. 卒中与神经疾病, 2019, 26(5): 603-606, 610. https://www.cnki.com.cn/Article/CJFDTOTAL-ZZYS201905023.htm [10] DUAN Z W, TAO L H, YANG M, et al. Acute in-hospital blood pressure variability predicts early neurological deterioration in acute minor stroke or transient ischemic attack with steno-occlusive arterial disease[J]. J Clin Hypertens, 2020, 22(2): 205-211. doi: 10.1111/jch.13809
[11] 林琬, 林麒. 颅内动脉狭窄致缺血性脑卒中病人早期神经功能恶化的危险因素分析[J]. 中西医结合心脑血管病杂志, 2022, 20(4): 745-748. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYYY202204037.htm [12] OKAZAKI S, YAMAMOTO H, FOSTER L D, et al. Late Neurological Deterioration after Acute Intracerebral Hemorrhage: a post hoc Analysis of the ATACH-2 Trial[J]. Cerebrovasc Dis, 2020, 49(1): 26-31. doi: 10.1159/000506117
[13] CLEMENT P M J, DIRVEN L, EOLI M, et al. Impact of depatuxizumab mafodotin on health-related quality of life and neurological functioning in the phase Ⅱ EORTC 1410/INTELLANCE 2 trial for EGFR-amplified recurrent glioblastoma[J]. Eur J Cancer, 2021, 147: 1-12. doi: 10.1016/j.ejca.2021.01.010
[14] LI H, DAAI Y, WU H, et al. Predictors of Early Neurologic Deterioration in Acute Pontine Infarction[J]. Stroke, 2020, 51(2): 637-640. doi: 10.1161/STROKEAHA.119.027239
[15] BOULENOIR N, TURC G, HENON H, et al. Early neurological deterioration following thrombolysis for minor stroke with isolated internal carotid artery occlusion[J]. Eur J Neurol, 2021, 28(2): 479-490. doi: 10.1111/ene.14541
[16] NAM K W, KWON H M, LEE Y S. Different predictive factors for early neurological deterioration based on the location of single subcortical infarction: early prognosis in single subcortical infarction[J]. Stroke, 2021, 52(10): 3191-3198. doi: 10.1161/STROKEAHA.120.032966
[17] BOURCIER R, GOYAL M, MUIR K W, et al. Risk factors of unexplained early neurological deterioration after treatment for ischemic stroke due to large vessel occlusion: a post hoc analysis of the HERMES study[J]. J Neurointerv Surg, 2023, 15(3): 221-226. doi: 10.1136/neurintsurg-2021-018214
[18] IKEZAWA K, HIROSE M, MARUYAMA T, et al. Effect of early nutritional initiation on post-cerebral infarction discharge destination: A propensity-matched analysis using machine learning[J]. Nutr Diet, 2022, 79(2): 247-254. doi: 10.1111/1747-0080.12718
[19] PARK T H, LEE J K, PARK M S, et al. Neurologic deterioration in patients with acute ischemic stroke or transient ischemic attack[J]. Neurology, 2020, 95(16): e2178-e2191.
[20] DONG J, YANG X, XIANG J, et al. Hypodensities detected at 1.5~3.0 h after intracerebral hemorrhage better predicts secondary neurological deterioration[J]. J Neurol Sci, 2019, 396: 219-224. doi: 10.1016/j.jns.2018.11.032
[21] 王玮, 李悦, 徐霁华, 等. 急性缺血性脑卒中患者静脉溶栓后早期神经功能恶化的危险因素分析[J]. 中华老年心脑血管病杂志, 2019, 21(6): 618-621. https://www.cnki.com.cn/Article/CJFDTOTAL-LNXG201906018.htm





 下载:
下载:





 苏公网安备 32100302010246号
苏公网安备 32100302010246号
