Prevalence of frailty in patients with rheumatoid arthritis: a systematic review
-
摘要:目的
系统评价类风湿关节炎(RA)患者衰弱发生率。
方法系统检索有关RA患者衰弱发生率的观察性研究, 严格按照循证医学研究方法进行文献筛选、资料提取及文献质量评价。应用Stata 16.0软件进行Meta分析、Egger线性回归分析。
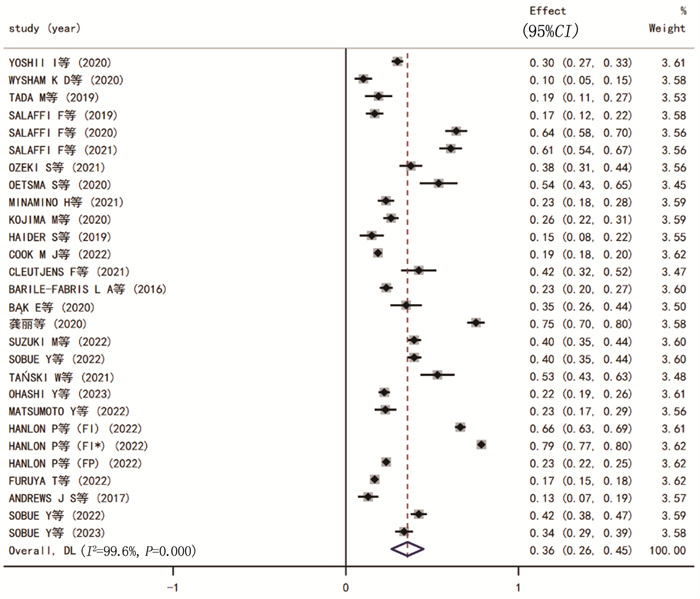
结果本研究共纳入26篇文献,总样本量22 547例。结果显示, RA患者衰弱总体发生率为36%(95%CI: 0.26~0.45, P < 0.001), 衰弱前期总体发生率为43%(95%CI: 0.36~0.50, P < 0.001)。亚组分析结果显示,女性、60岁及以上、住院、欧洲地区和基于多维度综合衰弱评估工具及特异性RA衰弱评估工具评估的RA患者衰弱发生率更高。
结论RA患者衰弱及衰弱前期总体发生率均较高,且在不同年龄、性别、研究场所、区域及采用不同评估工具类型的患者中存在差异。
Abstract:ObjectiveTo systematically evaluate the prevalence of frailty in patients with rheumatoid arthritis (RA).
MethodsA systematic search method for observational studies on the prevalence of frailty in patients with RA was conducted, and literature screening, data extraction as well as evaluation of literature quality were performed in strict accordance with evidence-based medical research methodology. Meta-analysis and Egger's linear regression analysis were performed by Stata 16.0 software.
ResultsTwenty-six literatures were included in the study, including a total sample size of 22, 547 patients. The results of the analysis showed that the total prevalence of frailty in patients with RA was 36% (95%CI, 0.26 to 0.45, P < 0.001), and the prevalence of pre-frailty was 43% (95%CI, 0.36 to 0.50, P < 0.001). The results of subgroup analysis showed that the incidence of frailty was higher in RA patients with features of female, age over 60 years old, hospitalization, living in European region and evaluation with multi-dimensional comprehensive frailty assessment tool and the specific RA frailty assessment tool.
ConclusionThe overall incidence of frailty and pre-frailty in RA patients is high, and there are differences in the incidence of frailty among patients with different ages, genders, environments, regions, and types of assessment tools.
-
Keywords:
- rheumatoid arthritis /
- frailty /
- systematic review /
- evidence based medicine
-
类风湿关节炎(RA)是一种以慢性、进行性、多关节炎为主要表现的自身免疫病,致残率高[1]。全球RA研究[2]显示其发病率为0.5%~1.0%, 中国RA发病率为0.42%, 且呈不断上升趋势,疾病负担在所有风湿病中排在首位[3]。衰弱是多因素导致的机体系统功能失调、生理储备能力下降、对不良结局易感性增加的一种多维度生物综合征,以肌少症、疲劳、运动能力下降、躯体活动减少、体质量减轻为特征[4]。衰弱患者在应激状态下可导致一系列不良结局,例如躯体功能损害、跌倒、失能、住院和死亡风险增加。随着疾病进展与年龄增长, RA反复发作可造成关节疼痛、肿胀、畸形、功能障碍、脏器损害甚至功能衰竭,患者也更容易发生衰弱[5]。此外,在炎症因子、肌少症、多重用药等协同作用下,机体发生衰弱的风险进一步增加[6]。衰弱是RA患者预后不良、生活质量下降等不良结局的重要预测因子[7], 研究[8-10]显示,合并衰弱的RA患者有更严重的疾病活动度、更差的健康功能以及更高的抑郁水平以及骨折、住院及死亡风险。本研究通过系统评价研究方法进一步明确RA患者的衰弱发生情况,以期为医护人员开展RA患者衰弱的早期评估识别及构建科学干预方案提供理论支持。
1. 资料与方法
1.1 文献纳入与排除标准
纳入标准: ①研究类型为观察性研究,包括横断面研究、队列研究和病例对照。②研究对象为≥18岁的RA患者。③暴露因素为RA[符合2010年美国风湿病学会(ACR)修订的RA诊断标准]。④结局指标为RA患者的衰弱或衰弱前发生率。排除标准: ①中文、英文以外的文献; ②未明确报告有关衰弱评估标准的文献; ③重复报道的文献; ④无法获得全文或不能提取足够信息的文献。
1.2 文献检索策略
主要通过计算机检索5种英文数据库(PubMed、EBSCO、Web of Science、Embase、CINAHL)及4种中文数据库(中国知网、万方、维普数据库和中国生物医学文献服务系统),搜集有关RA患者衰弱相关研究。中文检索词包括“类风湿关节炎/类风湿性关节/RA”“衰弱/衰弱前/衰弱综合征/老年衰弱/老年人衰弱/虚弱/脆弱”; 英文检索词包括“Arthritis Rheumatoid/Rheumatoid Arthritis/RA”“Frailty/Frail Elderly/Frailty Syndrome/Debilit*/Frail*/Elder*,Frail/Frail Elder*/Frail Older Adult*/Adult*, Frail Older/Older Adult*, Frail”。检索通过布尔逻辑运算符对以上同类主题词或自由词用“或”以及不同类主题词或自由词用“且”进行组配,并用自由词在全文中进行补充检索。检索时限为建库至2023年4月,并辅以手工检索纳入文献的重要参考文献以全面检索。
1.3 文献筛选及数据提取
由2名具备独立研究能力的研究者(经系统循证方法学培训)独立筛选文献、提取数据后进行交叉复核,若意见不一致则请第3名资深研究人员介入协商判断。文献筛选流程方法: 首先通过NoteExpress软件去重,然后检视标题、摘要完成初筛,最后全文阅读复筛。提取内容包括: ①基本信息,第一作者、发表时间、研究场所、区域。②研究对象基本特征,患者性别、年龄、病程以及纳入研究样本量。③衰弱评估工具。④研究设计类型。⑤衰弱及衰弱前发生率。
1.4 文献质量评价
由另外2名具备独立研究能力的研究人员(经系统循证方法学培训)独立评价文献质量后行交叉复核,若意见不同则邀请第3名资深研究人员介入。评价标准采用Joanna Briggs Institute(JBI)循证卫生保健中心(2016年)分析性横断面研究的真实性评价工具(包含8个方面的评价内容)和队列研究的真实性评价工具(包含11个方面的评价内容)[11]。2种评价工具均需研究者严格分析文献并遵照评价标准判断选择“是”“否”“不清楚”“不适用”,最终由研究小组讨论判定纳入或者排除。
1.5 统计学方法
采用Stata 16.0统计分析软件,统计合并RA衰弱发生率及其95%置信空间(95%CI), 通过χ2检验计算P和I2值评价研究异质性(检验水准α=0.10)。若P>0.1、I2≤50%, 提示各研究结果同质性较好,选择固定效应模型分析; P≤0.1、I2>50%, 提示各研究结果异质性较大,选择随机效应模型分析,并进一步通过亚组分析探究异质性来源及敏感性分析评价结果是否稳定。P < 0.05为差异有统计学意义。若纳入研究数量不低于20个,则采用Egger线性回归分析法,同时结合漏斗图判断研究发表偏倚,若截距α对应的P≤0.05或95%CI不包含0,则提示有发表偏倚,若截距α对应的P>0.05或95%CI包含0则提示潜在偏倚较小或可以接受[12]。
2. 结果
2.1 文献检索结果
初步检索文献合计1 634篇,其中中文文献609篇,包括中国知网56篇、维普47篇、万方229篇、中国生物医学文献服务系统277篇; 英文文献1 025篇,包括PubMed 596篇、EBSCO 49篇、Web of Science 114篇、Embase 253篇、CINAHL 13篇; 补充获取相关文献4篇; 去重后获得文献173篇。阅读标题、摘要初筛排除文献103篇,去除非中英文文献1篇,阅读全文去除研究内容不符24篇、非观察性研究4篇、会议论文摘要13篇、无可提取的指标数据2篇,最终纳入文献26篇。
2.2 纳入文献基本特征
本研究纳入文献26篇[5-8,13-34], 总样本量共计22 547例,全部诊断为成人RA患者,包括横断面研究22篇[7-8,13-21,23-20,32-34], 队列研究4篇[5-6,22,31]。其中,中文文献1篇[26], 英文文献25篇。10篇文献报道了5种单纯躯体性衰弱评估工具,包括Fried衰弱表型(FFP), 疲劳、耐力、活动能力、疾病和体质量减轻指数(FRAIL),欧洲健康老龄化初级保健衰弱指数(SHARE-FI), 心血管健康研究(CHS)衰弱表现评估和骨质疏松性骨折研究(SOF)指数; 15篇文献报道了5种多维度综合衰弱评估工具,包括Kihon清单(KCL)、Tilburg衰弱指标(TFI)、格罗宁根衰弱指标(GFI)、风湿病衰弱综合评估工具(CRAF)、埃德蒙顿衰弱量表(EFS); 1篇[6]研究同时采用FFP、衰弱指数(FI)及改良衰弱指数(mFI)。纳入文献基本特征见表 1。
表 1 纳入文献基本特征纳入文献 发表时间 研究类型 所在地区 研究场所 总样本量(男/女) 年龄/岁 病程/年 衰弱发生率/% 衰弱前发生率/% 衰弱评估工具 龚丽等[26] 2020 ① 中国 含住院 280(172/108) 68.9±3.4 12.8±2.0 75.36 — TFI YOSHII I等[13] 2020 ① 日本 门诊 739(153/586) ≥40 10.6 29.9 27.50 FRAIL WYSHAM K D等[14] 2020 ① 美国 含住院 138(21/117) 58.0±10.8 19.0±10.9 10.0 70.00 FFP TADA M等[15] 2019 ① 日本 含住院 95(24/71) 68 5.5 18.9 38.90 KCL SALAFFI F等[16] 2019 ① 意大利 门诊 210(72/138) 60.4±13.5 7.5±2.7 16.6 32.40 SHARE-FI SALAFFI F等[17] 2020 ① 意大利 含住院 219(52/167) 58.5±13.3 7.4±2.8 63.9 — CRAF OZEKI S等[18] 2021 ① 日本 门诊 210(37/173) 71.8±3.7 14.3 37.6 — KCL OETSMA S等[19] 2020 ① 荷兰 门诊 80(27/53) 74.6 ± 5.9 16.4±10.6 54.00 — GFI MINAMINO H等[20] 2021 ① 日本 门诊 306(0/306) 61.5 9.0 23.2 32.70 SOF指数 KOJIMA M等[8] 2020 ① 日本 门诊 375(52/323) 65.2±9.7 16.6±11.9 26.13 34.90 KCL HAIDER S等[21] 2019 ① 维也纳 门诊 100(34/66) 50.9±9.7 — 15 30.00 SHARE-FI CLEUTJENS F等[23] 2021 ① 荷兰 门诊 90(30/60) 69.7±7.9 — 42.2 — GFI BARILE-FABRIS L A等[24] 2016 ① 墨西哥 门诊 500(47/453) 51.3 13.2 23.4 — FFP BAK E等[25] 2020 ① 波兰 含住院 106(24/82) 65.83±5.01 — 34.9 — TFI SUZUKI M等[27] 2022 ① 日本 — 559(151/408) 67.0±13.0 11.0±10.0 39.5 33.09 KCL SOBUE Y等[28] 2022 ① 日本 含住院 538(146/392) 66.8±13.4 11.3±9.6 39.6 33.60 KCL TANSKI W等[29] 2021 ① 波兰 含住院 98(34/64) 72.6±6.5 — 53.06 — EFS OHASHI Y等[30] 2023 ① 日本 门诊 625(177/448) 67.4±13.8 11.8±9.7 22.2 — CHS衰弱表现评估 FURUYA T等[32] 2022 ① 日本 门诊 3 290(438/2 852) 62.4 15.00 16.70 62.70 FRAIL ANDREWS J S等[7] 2017 ① 美国 — 124(51/73) 58.0±10.8 19.2±10.6 12.9 69.35 FFP SOBUE Y等[33] 2022 ① 日本 含住院 424(0/424) 66.8±14.5 13.0±10.6 42.2 — KCL SOBUE Y等[34] 2023 ① 日本 含住院 323(72/251) 64.8±13.7 11.6±10.0 33.8 — KCL MATSUMOTO Y等[31] 2023 ② 日本 门诊 170(32/138) 66.2±13.1 9.97 22.94 31.76 KCL HANLON P等[6] 2022 ② 英国 SERA数据库 899(313/586) 58.3±13.3 <2 66.3 — FI UK biobank数据库 3 597(1 058/2 539) 59.5±7.1 6.6(3.0,10.7) 78.51 — mFI UK biobank数据库 3 344(998/2 346) 59.5±7.1 6.6(3.0,10.7) 23.36 53.08 FFP SALAFFI F等[5] 2021 ② 意大利 含住院 214(52/162) 60.2±12.7 7.3±2.6 60.7 — CRAF COOK M J等[22] 2022 ② 英国 — 4 894(1 507/3 387) 59.2± 7.1 — 18.6 52.70 FFP ①为横断面研究; ②为队列研究。FFP: Fried衰弱表型; FRAIL: 疲劳、耐力、活动能力、疾病和体质量减轻指数; SHARE-FI: 欧洲健康老龄化初级保健衰弱指数; CHS: 心血管健康研究; SOF: 骨质疏松性骨折研究; KCL: Kihon清单; TFI: Tilburg衰弱指标; GFI: 格罗宁根衰弱指标; CRAF: 风湿病衰弱综合评估工具; EFS: 埃德蒙顿衰弱量表; FI: 衰弱指数; mFI: 改良衰弱指数。 2.3 纳入文献质量评价结果
根据评价标准,纳入22篇横断面研究文献均清晰描述了研究对象的纳入标准、研究对象及研究场所,并采用客观标准的方法测评健康问题,明确并采取多因素分析方法等控制混杂因素,资料分析方法恰当; 其中13篇文献清晰描述了对暴露因素的测评方法,但不清楚其判定金标准的效度、内部一致性及评定者间信度; 13篇文献采用有效、可信的方法测评了结局指标,但不清楚其测评实施方法及评价者有无接受过测评工具使用方法培训。纳入4篇队列研究文献中,1篇文献研究对象并非来源于同一总体,也未阐述将研究对象分配至暴露组和非暴露组; 2篇文献没有清晰描述在暴露或研究开始时研究对象未出现观察结局; 4篇文献均报道了失访,但均无失访的原因分析描述。以上经小组讨论,2人独立评价完全符合文献质量评价标准者直接纳入,部分符合标准者根据2位评价者一致意见判断纳入,部分符合标准而2位评价者的意见不一致者则咨询第三方参与讨论和评价,最终纳入本研究。纳入文献质量评价结果见表 2、表 3。
表 2 横断面研究质量评价结果纳入研究 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 龚丽等[26] 是 是 是 是 是 是 是 是 YOSHII I等[13] 是 是 是 是 是 是 是 是 WYSHAM K D等[14] 是 是 不清楚 是 是 是 不清楚 是 TADA M等[15] 是 是 不清楚 是 是 是 不清楚 是 SALAFFI F等[16] 是 是 不清楚 是 是 是 不清楚 是 SALAFFI F等[17] 是 是 不清楚 是 是 是 不清楚 是 OZEKI S等[18] 是 是 不清楚 是 是 是 不清楚 是 OETSMA S等[19] 是 是 是 是 是 否 是 是 MINAMINO H等[20] 是 是 不清楚 是 是 是 不清楚 是 KOJIMA M等[8] 是 是 是 是 是 是 是 是 HAIDER S等[21] 是 是 是 是 是 是 是 是 CLEUTJENS F等[23] 是 是 是 是 是 否 是 是 BARILE-FABRIS L A等[24] 是 是 不清楚 是 否 否 不清楚 是 BAK E等[25] 是 是 是 是 是 是 是 是 SUZUKI M等[27] 是 是 不清楚 是 是 是 不清楚 是 SOBUE Y等[28] 是 是 不清楚 是 是 是 不清楚 是 TANSKI W等[29] 是 是 不清楚 是 是 是 不清楚 是 OHASHI Y等[30] 是 是 是 是 是 是 是 是 FURUYA T等[32] 是 是 不清楚 是 是 是 不清楚 是 ANDREWS J S等[7] 是 是 是 是 是 是 是 是 SOBUE Y等[33] 是 是 不清楚 是 是 是 不清楚 是 SOBUE Y等[34] 是 是 不清楚 是 是 否 不清楚 是 包括8个条目方面的清晰描述、测评及恰当处理: ①: 研究对象的纳入标准; ②: 研究对象及研究场所; ③: 暴露因素; ④: 健康问题; ⑤: 混杂因素; ⑥: 控制混杂因素; ⑦: 结局指标; ⑧: 资料分析方法。 表 3 队列研究质量评价结果纳入研究 1 2 3 4 5 6 7 8 9 10 11 MATSUMOTO Y等[31] 是 是 是 是 是 否 是 是 否 不清楚 是 HANLON P等[6] 否 否 不清楚 是 是 是 是 是 否 是 是 SALAFFI F等[5] 是 是 是 是 是 否 是 是 否 是 是 COOK M J等[22] 是 是 是 是 是 否 是 是 否 是 是 包括11个条目方面的清晰描述、测评及恰当处理。1: 同一研究总体; 2: 暴露因素分组; 3: 暴露因素的测评方法; 4: 混杂因素; 5: 控制混杂因素; 6: 观察结局; 7: 结局指标的测评方法; 8: 随访时间; 9: 完整随访及失访原因分析; 10: 处理失访问题; 11: 分析方法。 2.4 具体结果分析
2.4.1 RA患者衰弱总体发生率
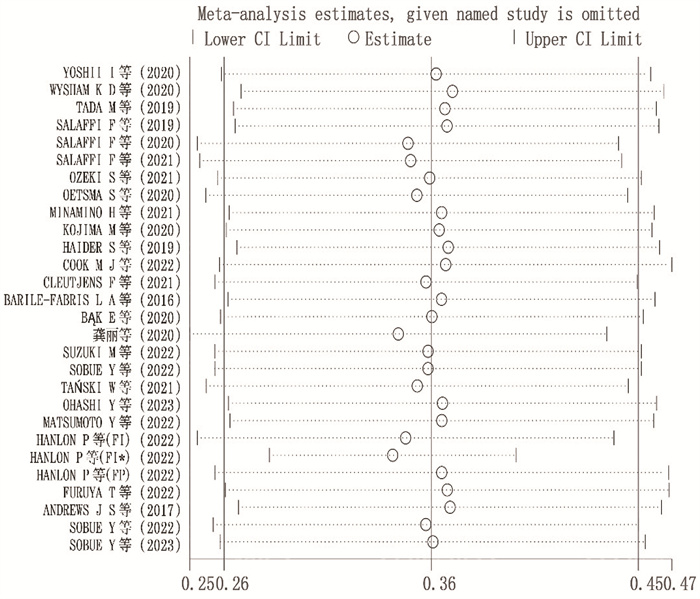
26项研究对RA患者衰弱发生率进行了描述, I2=99.6%且P < 0.001, 提示存在异质性较大,选择随机效应模型合并得出RA衰弱的总体发生率为36%(95%CI: 0.26~0.45)。RA患者衰弱发生率森林图见图 1。敏感性分析显示,剔除任意一篇文献,结果不会发生明显改变,提示分析结果较为稳定,见图 2。
2.4.2 不同亚组RA患者衰弱的发生率
因纳入研究存在较高异质性,按照性别、年龄、病程、研究场所、所在地区、采用不同衰弱评估工具等因素进行亚组分析探讨异质性来源。研究发现,RA女性患者衰弱发生率高于男性; 研究对象为60岁以上RA患者衰弱发生率高于18岁以上研究人群; 10年以上病程的RA患者衰弱的发生率略高于10年以下病程患者; 研究对象含住院的RA患者衰弱发生率高于门诊就诊患者; 基于多维度综合衰弱评估工具评估RA患者衰弱发生率总体高于单纯躯体性衰弱评估工具,其中特异性衰弱评估工具CRAF评估RA患者衰弱发生率最高,其他综合性评估工具TFI、GFI、KCL评估RA患者衰弱发生率分别为55%、48%、33%,而单纯躯体性衰弱评估工具中FFP、SHARE-FI、FRAIL评估RA患者衰弱发生率分别为18%、16%、23%; 欧洲地区RA患者衰弱发生率(41%)高于亚洲地区(33%)和北美洲地区(16%)。RA患者衰弱发生率亚组分析结果见表 4。
表 4 RA患者衰弱发生率亚组分析结果项目 分类 合并效应量 异质性检验 文献篇数/篇 衰弱发生率/% 95%CI P I2/% 性别 男 12 0.28 0.18~0.37 < 0.001 96.40 女 14 0.32 0.24~0.40 < 0.001 98.50 年龄 ≥18岁 17 0.31 0.23~0.38 < 0.001 98.70 ≥60岁 8 0.44 0.31~0.56 < 0.001 96.70 病程 ≥10年 13 0.35 0.26~0.43 < 0.001 98.50 < 10年 9 0.34 0.20~0.49 < 0.001 99.10 场所 门诊 12 0.26 0.22~0.31 < 0.001 98.00 含住院 10 0.43 0.30~0.56 < 0.001 93.20 地区 欧洲 10 0.41 0.30~0.51 < 0.001 99.10 亚洲 13 0.33 0.25~0.41 < 0.001 98.40 北美洲 3 0.16 0.07~0.25 < 0.001 90.10 评估工具 综合 17 0.46 0.35~0.58 < 0.001 99.00 CRAF 2 0.62 0.58~0.67 0.495 0 TFI 2 0.55 0.16~0.95 < 0.001 98.30 GFI 2 0.48 0.37~0.59 0.131 56.20 KCL 8 0.33 0.27~0.38 < 0.001 89.10 躯体 11 0.20 0.17~0.22 < 0.001 91.50 FFP 5 0.18 0.15~0.22 < 0.001 92.10 SHARE-FI 2 0.16 0.12~0.20 0.705 0 FRAIL 2 0.23 0.10~0.36 < 0.001 98.10 总结果 26 0.36 0.26~0.45 < 0.001 99.60 FFP: Fried衰弱表型; FRAIL: 疲劳、耐力、活动能力、疾病和体质量减轻指数; SHARE-FI: 欧洲健康老龄化初级保健衰弱指数;
KCL: Kihon清单; TFI: Tilburg衰弱指标; GFI: 格罗宁根衰弱指标; CRAF: 风湿病衰弱综合评估工具。2.4.3 RA患者衰弱前发生率
14项研究对RA患者衰弱前发生率进行了描述, I2=98.3%且P < 0.001, 提示存在较大异质性,选择随机效应模型合并得出RA衰弱前期总体发生率为43%(95%CI: 0.36~0.50)。根据文献特征针对性别、病程、研究场所等因素进行亚组分析,结果显示, RA患者衰弱前期发生率在不同性别及病程上无显著差异; 含住院RA患者的衰弱前期发生率(48%)高于门诊RA患者(36%)。RA患者衰弱前发生率亚组分析结果见表 5。
表 5 RA患者衰弱前发生率亚组分析结果项目 分类 合并效应量 异质性检验 文献篇数/篇 衰弱发生率/% 95%CI P I2/% 性别 男 8 0.46 0.37~0.56 < 0.001 93.2 女 9 0.46 0.35~0.56 < 0.001 98.6 病程 ≥10年 6 0.43 0.28~0.59 < 0.001 99.2 < 10年 6 0.43 0.32~0.55 < 0.001 96.5 场所 门诊 7 0.36 0.21~0.51 < 0.001 98.9 含住院 3 0.48 0.24~0.71 < 0.001 97.1 总结果 14 0.43 0.36~0.50 < 0.001 98.3 2.4.4 发表偏倚检测
研究选择Egger线性回归法进行定量分析以判断纳入文献是否存在发表偏倚,结果显示,截距α对应的检测统计量t=0.38, P=0.705, 95%CI为-8.410~12.260, 漏斗图显示散点分布基本上对称,提示本研究发表偏倚较小。
3. 讨论
本研究结果显示, RA衰弱总体发生率为36%, 高于骨关节炎、强直性脊柱炎、银屑病关节炎等其他风湿免疫病[35]及老年糖尿病[36], 这可能与RA疾病本身和衰弱的某些共同病理生理机制有关[37-38]。目前慢性炎症、免疫紊乱、关节肌肉功能障碍、疼痛、疲劳和心理因素之间的相互关系被认为可能是RA患者衰弱的病理生理机制[39]。RA作为一种炎症性自身免疫病,高水平的白细胞介素(IL)、肿瘤坏死因子-α(TNF-α)等重要的血清炎症因子参与疾病进展[40], 驱动与疾病有关的炎症反应,进一步造成免疫紊乱、骨骼肌减少,直接导致肌肉质量和力量下降进而驱使衰弱。此外,以慢性滑膜炎为特征的RA疾病反复活动,发生软骨破坏、骨侵蚀和关节受损甚至内脏损害多病共存,表现为关节疼痛、肿胀、功能障碍甚至畸形,严重损害机体功能。TADA M等[15]研究发现,基质金属蛋白酶3是RA患者衰弱的独立影响因素,且在RA患者中,衰弱还与疾病活动和身体功能有关,从而提出控制疾病活动对预防衰弱很重要。KOJIMA M等[8]认为衰弱在RA患者中是常见的,身体功能、疾病活动和抑郁症状与RA患者衰弱独立相关。SOBUE Y等[28]研究发现, RA患者衰弱的发生率随着机体活动能力下降程度增高而增加,即使活动能力下降早期的RA患者仍然会出现衰弱。可见仅抑制患者疾病活动可能不足以预防衰弱,强调需早期开展RA患者衰弱筛查,并根据患者的病情实施个体化干预措施。本研究还发现, RA衰弱前总体发生率为43%, 较衰弱发生率高,因此临床应同时重视RA衰弱及衰弱前的评估识别与综合干预,积极控制疾病活动并采取预防措施延缓衰弱发生。
本研究亚组分析结果发现,不同年龄、性别、研究场所、所在地区的RA患者衰弱发生率存在差异性。研究对象群体的年龄越大,衰弱发生率越高,这可能是因为随着年龄增长, RA患者的生理功能逐渐退化,对外界应激源的抵抗能力减弱,加之病程延长和疾病反复活动导致躯体功能受损甚至脏器受累[41], YOSHII I等[13]对40岁及以上RA患者的随访调查结果显示衰弱与年龄存在显著相关性, SALAFFI F等[16]研究显示RA衰弱组患者平均年龄高达68岁,且是RA患者发生衰弱的独立危险因素之一。女性RA患者衰弱的发生率高于男性,这可能是多种因素相互作用所致: 首先,女性患者体内雌激素水平随衰老逐渐下降,同时伴随机体维生素D水平减低、钙质流失增加、神经-肌肉系统调节紊乱,最终导致衰弱发生; 其次, RA女性发病率较高[2], 且研究对象中女性患者比率也较高,这可能在一定程度上导致女性患者衰弱发生率较男性高。含住院RA患者的衰弱发生率高于门诊,这可能与住院RA患者多为中重度疾病活动控制不佳、反复发作致脏器损害、多病共存有关。研究[8]表明, RA疾病活动度与衰弱的发生密切相关,高疾病活动度作为RA患者衰弱发生的独立危险因素,进一步增加了此类患者衰弱的风险,共病也被认为是RA患者衰弱发生的重要因素[16], 这可能是由于合并疾病与RA相互作用,加速器官功能的损害,并促使机体系统的生理储备功能下降。欧洲地区RA患者的衰弱发生率较高,可能与以下因素有关: 首先,欧洲地区RA患病率较高,这与遗传、环境因素和生活方式等有关[42]; 其次,欧洲地区的人口老龄化水平较高,老年人更容易患有RA并且衰弱症状更为常见。以上因素可能共同作用导致RA患者更容易发生衰弱,但具体的关联机制仍需进一步深入探究。
本研究纳入的全部文献采用5种躯体性衰弱评估工具评估,评估内容包括体质量、握力、步速、体力活动、疲乏等; 采用6种多维综合性衰弱评估工具,评估内容除单纯躯体评估指标外,还包括心理社会层面。本研究发现基于多维度综合衰弱评估工具评估RA衰弱发生率(46%)较单纯躯体衰弱评估工具(20%)更高。这可能与综合衰弱评估工具从多维度评估测量衰弱,全面揭示患者的整体健康功能状态有关。RA患者本身更容易出现焦虑、抑郁等负性情绪及活动减少、社会参与下降等各种心理社会问题,进而表现为衰弱。研究[43]显示,抑郁、认知障碍、活动减少、社会参与减少和较差的经济状态等心理社会环境因素均为衰弱发生的独立危险因素。在RA衰弱相关研究中,焦虑与衰弱在所有年龄段的受试者中均显著相关[35]; KOJIMA M等[8]对RA患者进行调查分析发现,抑郁症状同身体功能、疾病活动一样可导致RA患者衰弱发生; YOSHII I等[13]的横断面研究发现日常生活能力低、有痴呆认知障碍的RA患者衰弱程度明显更高; 此外,社会活动、疲劳亦是造成这一影响的重要因素[10,17]。本研究结果显示,采用特异性衰弱评估工具CRAF评估RA患者衰弱发生率(62%)明显高与其他综合性衰弱评估工具及躯体性衰弱评估工具,这可能与该工具本身对RA患者衰弱预测具有较好的灵敏度及特异度有关[17]。
本研究仅纳入中文、英文文献,存在潜在偏倚可能,且限于纳入研究采用的多种衰弱筛查和评估方法各具优缺点、无统一标准,未来还应进一步规范并开展多中心临床研究,深入探究不同年龄、性别、评估工具等因素对RA衰弱的影响,同时开发符合中国RA人群特征的特异性衰弱筛查与评估工具,并基于早期筛查、评估,积极制订科学干预方案,为RA患者衰弱防治管理提供理论实践依据。
本研究系统评价结果显示, RA衰弱发生率高,衰弱前期发生率高于衰弱发生率。不同年龄、性别、就诊场所、区域及采用不同评估工具的RA患者衰弱发生率均存在差异。60岁及以上、女性、住院、欧洲地区患者,以及基于多维度综合衰弱评估工具、尤其是RA特异性衰弱评估工具评估RA衰弱发生率更高。因此,医护人员应早期开展RA患者衰弱及衰弱前评估,构建并实施有针对性的科学干预方案,以期延缓衰弱发展进程,改善此类患者不良健康结局。
-
表 1 纳入文献基本特征
纳入文献 发表时间 研究类型 所在地区 研究场所 总样本量(男/女) 年龄/岁 病程/年 衰弱发生率/% 衰弱前发生率/% 衰弱评估工具 龚丽等[26] 2020 ① 中国 含住院 280(172/108) 68.9±3.4 12.8±2.0 75.36 — TFI YOSHII I等[13] 2020 ① 日本 门诊 739(153/586) ≥40 10.6 29.9 27.50 FRAIL WYSHAM K D等[14] 2020 ① 美国 含住院 138(21/117) 58.0±10.8 19.0±10.9 10.0 70.00 FFP TADA M等[15] 2019 ① 日本 含住院 95(24/71) 68 5.5 18.9 38.90 KCL SALAFFI F等[16] 2019 ① 意大利 门诊 210(72/138) 60.4±13.5 7.5±2.7 16.6 32.40 SHARE-FI SALAFFI F等[17] 2020 ① 意大利 含住院 219(52/167) 58.5±13.3 7.4±2.8 63.9 — CRAF OZEKI S等[18] 2021 ① 日本 门诊 210(37/173) 71.8±3.7 14.3 37.6 — KCL OETSMA S等[19] 2020 ① 荷兰 门诊 80(27/53) 74.6 ± 5.9 16.4±10.6 54.00 — GFI MINAMINO H等[20] 2021 ① 日本 门诊 306(0/306) 61.5 9.0 23.2 32.70 SOF指数 KOJIMA M等[8] 2020 ① 日本 门诊 375(52/323) 65.2±9.7 16.6±11.9 26.13 34.90 KCL HAIDER S等[21] 2019 ① 维也纳 门诊 100(34/66) 50.9±9.7 — 15 30.00 SHARE-FI CLEUTJENS F等[23] 2021 ① 荷兰 门诊 90(30/60) 69.7±7.9 — 42.2 — GFI BARILE-FABRIS L A等[24] 2016 ① 墨西哥 门诊 500(47/453) 51.3 13.2 23.4 — FFP BAK E等[25] 2020 ① 波兰 含住院 106(24/82) 65.83±5.01 — 34.9 — TFI SUZUKI M等[27] 2022 ① 日本 — 559(151/408) 67.0±13.0 11.0±10.0 39.5 33.09 KCL SOBUE Y等[28] 2022 ① 日本 含住院 538(146/392) 66.8±13.4 11.3±9.6 39.6 33.60 KCL TANSKI W等[29] 2021 ① 波兰 含住院 98(34/64) 72.6±6.5 — 53.06 — EFS OHASHI Y等[30] 2023 ① 日本 门诊 625(177/448) 67.4±13.8 11.8±9.7 22.2 — CHS衰弱表现评估 FURUYA T等[32] 2022 ① 日本 门诊 3 290(438/2 852) 62.4 15.00 16.70 62.70 FRAIL ANDREWS J S等[7] 2017 ① 美国 — 124(51/73) 58.0±10.8 19.2±10.6 12.9 69.35 FFP SOBUE Y等[33] 2022 ① 日本 含住院 424(0/424) 66.8±14.5 13.0±10.6 42.2 — KCL SOBUE Y等[34] 2023 ① 日本 含住院 323(72/251) 64.8±13.7 11.6±10.0 33.8 — KCL MATSUMOTO Y等[31] 2023 ② 日本 门诊 170(32/138) 66.2±13.1 9.97 22.94 31.76 KCL HANLON P等[6] 2022 ② 英国 SERA数据库 899(313/586) 58.3±13.3 <2 66.3 — FI UK biobank数据库 3 597(1 058/2 539) 59.5±7.1 6.6(3.0,10.7) 78.51 — mFI UK biobank数据库 3 344(998/2 346) 59.5±7.1 6.6(3.0,10.7) 23.36 53.08 FFP SALAFFI F等[5] 2021 ② 意大利 含住院 214(52/162) 60.2±12.7 7.3±2.6 60.7 — CRAF COOK M J等[22] 2022 ② 英国 — 4 894(1 507/3 387) 59.2± 7.1 — 18.6 52.70 FFP ①为横断面研究; ②为队列研究。FFP: Fried衰弱表型; FRAIL: 疲劳、耐力、活动能力、疾病和体质量减轻指数; SHARE-FI: 欧洲健康老龄化初级保健衰弱指数; CHS: 心血管健康研究; SOF: 骨质疏松性骨折研究; KCL: Kihon清单; TFI: Tilburg衰弱指标; GFI: 格罗宁根衰弱指标; CRAF: 风湿病衰弱综合评估工具; EFS: 埃德蒙顿衰弱量表; FI: 衰弱指数; mFI: 改良衰弱指数。 表 2 横断面研究质量评价结果
纳入研究 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 龚丽等[26] 是 是 是 是 是 是 是 是 YOSHII I等[13] 是 是 是 是 是 是 是 是 WYSHAM K D等[14] 是 是 不清楚 是 是 是 不清楚 是 TADA M等[15] 是 是 不清楚 是 是 是 不清楚 是 SALAFFI F等[16] 是 是 不清楚 是 是 是 不清楚 是 SALAFFI F等[17] 是 是 不清楚 是 是 是 不清楚 是 OZEKI S等[18] 是 是 不清楚 是 是 是 不清楚 是 OETSMA S等[19] 是 是 是 是 是 否 是 是 MINAMINO H等[20] 是 是 不清楚 是 是 是 不清楚 是 KOJIMA M等[8] 是 是 是 是 是 是 是 是 HAIDER S等[21] 是 是 是 是 是 是 是 是 CLEUTJENS F等[23] 是 是 是 是 是 否 是 是 BARILE-FABRIS L A等[24] 是 是 不清楚 是 否 否 不清楚 是 BAK E等[25] 是 是 是 是 是 是 是 是 SUZUKI M等[27] 是 是 不清楚 是 是 是 不清楚 是 SOBUE Y等[28] 是 是 不清楚 是 是 是 不清楚 是 TANSKI W等[29] 是 是 不清楚 是 是 是 不清楚 是 OHASHI Y等[30] 是 是 是 是 是 是 是 是 FURUYA T等[32] 是 是 不清楚 是 是 是 不清楚 是 ANDREWS J S等[7] 是 是 是 是 是 是 是 是 SOBUE Y等[33] 是 是 不清楚 是 是 是 不清楚 是 SOBUE Y等[34] 是 是 不清楚 是 是 否 不清楚 是 包括8个条目方面的清晰描述、测评及恰当处理: ①: 研究对象的纳入标准; ②: 研究对象及研究场所; ③: 暴露因素; ④: 健康问题; ⑤: 混杂因素; ⑥: 控制混杂因素; ⑦: 结局指标; ⑧: 资料分析方法。 表 3 队列研究质量评价结果
纳入研究 1 2 3 4 5 6 7 8 9 10 11 MATSUMOTO Y等[31] 是 是 是 是 是 否 是 是 否 不清楚 是 HANLON P等[6] 否 否 不清楚 是 是 是 是 是 否 是 是 SALAFFI F等[5] 是 是 是 是 是 否 是 是 否 是 是 COOK M J等[22] 是 是 是 是 是 否 是 是 否 是 是 包括11个条目方面的清晰描述、测评及恰当处理。1: 同一研究总体; 2: 暴露因素分组; 3: 暴露因素的测评方法; 4: 混杂因素; 5: 控制混杂因素; 6: 观察结局; 7: 结局指标的测评方法; 8: 随访时间; 9: 完整随访及失访原因分析; 10: 处理失访问题; 11: 分析方法。 表 4 RA患者衰弱发生率亚组分析结果
项目 分类 合并效应量 异质性检验 文献篇数/篇 衰弱发生率/% 95%CI P I2/% 性别 男 12 0.28 0.18~0.37 < 0.001 96.40 女 14 0.32 0.24~0.40 < 0.001 98.50 年龄 ≥18岁 17 0.31 0.23~0.38 < 0.001 98.70 ≥60岁 8 0.44 0.31~0.56 < 0.001 96.70 病程 ≥10年 13 0.35 0.26~0.43 < 0.001 98.50 < 10年 9 0.34 0.20~0.49 < 0.001 99.10 场所 门诊 12 0.26 0.22~0.31 < 0.001 98.00 含住院 10 0.43 0.30~0.56 < 0.001 93.20 地区 欧洲 10 0.41 0.30~0.51 < 0.001 99.10 亚洲 13 0.33 0.25~0.41 < 0.001 98.40 北美洲 3 0.16 0.07~0.25 < 0.001 90.10 评估工具 综合 17 0.46 0.35~0.58 < 0.001 99.00 CRAF 2 0.62 0.58~0.67 0.495 0 TFI 2 0.55 0.16~0.95 < 0.001 98.30 GFI 2 0.48 0.37~0.59 0.131 56.20 KCL 8 0.33 0.27~0.38 < 0.001 89.10 躯体 11 0.20 0.17~0.22 < 0.001 91.50 FFP 5 0.18 0.15~0.22 < 0.001 92.10 SHARE-FI 2 0.16 0.12~0.20 0.705 0 FRAIL 2 0.23 0.10~0.36 < 0.001 98.10 总结果 26 0.36 0.26~0.45 < 0.001 99.60 FFP: Fried衰弱表型; FRAIL: 疲劳、耐力、活动能力、疾病和体质量减轻指数; SHARE-FI: 欧洲健康老龄化初级保健衰弱指数;
KCL: Kihon清单; TFI: Tilburg衰弱指标; GFI: 格罗宁根衰弱指标; CRAF: 风湿病衰弱综合评估工具。表 5 RA患者衰弱前发生率亚组分析结果
项目 分类 合并效应量 异质性检验 文献篇数/篇 衰弱发生率/% 95%CI P I2/% 性别 男 8 0.46 0.37~0.56 < 0.001 93.2 女 9 0.46 0.35~0.56 < 0.001 98.6 病程 ≥10年 6 0.43 0.28~0.59 < 0.001 99.2 < 10年 6 0.43 0.32~0.55 < 0.001 96.5 场所 门诊 7 0.36 0.21~0.51 < 0.001 98.9 含住院 3 0.48 0.24~0.71 < 0.001 97.1 总结果 14 0.43 0.36~0.50 < 0.001 98.3 -
[1] 耿研, 谢希, 王昱, 等. 类风湿关节炎诊疗规范[J]. 中华内科杂志, 2022, 61(1): 51-59. doi: 10.3760/cma.j.cn112138-20210616-00426 [2] ALMUTAIRI K, NOSSENT J, PREEN D, et al. The global prevalence of rheumatoid arthritis: a meta-analysis based on a systematic review[J]. Rheumatol Int, 2021, 41(5): 863-877. doi: 10.1007/s00296-020-04731-0
[3] 田新平, 李梦涛, 曾小峰. 我国类风湿关节炎诊治现状与挑战: 来自中国类风湿关节炎2019年年度报告[J]. 中华内科杂志, 2021, 60(7): 593-598. doi: 10.3760/cma.j.cn112138-20210207-00113 [4] DENT E, MORLEY J E, CRUZ-JENTOFT A J, et al. Physical frailty: ICFSR international clinical practice guidelines for identification and management[J]. J Nutr Health Aging, 2019, 23(9): 771-787. doi: 10.1007/s12603-019-1273-z
[5] SALAFFI F, ANGELIS R D, FARAH S, et al. Frailty as a novel predictor of achieving comprehensive disease control (CDC) in rheumatoid arthritis[J]. Clin Rheumatol, 2021, 40(12): 4869-4877. doi: 10.1007/s10067-021-05744-1
[6] HANLON P, MORTON F, SIEBERT S, et al. Frailty in rheumatoidrmdopen-2021-002111 arthritis and its relationship with disease activity, hospitalisation and mortality: a longitudinal analysis of the Scottish Early Rheumatoid Arthritis cohort and UK Biobank[J]. RMD Open, 2022, 8(1): e002111. doi: 10.1136/rmdopen-2021-002111
[7] ANDREWS J S, TRUPIN L, YELIN E H, et al. Frailty and reduced physical function go hand in hand in adults with rheumatoid arthritis: a US observational cohort study[J]. Clin Rheumatol, 2017, 36(5): 1031-1039. doi: 10.1007/s10067-017-3541-9
[8] KOJIMA M, KOJIMA T, WAGURI-NAGAYA Y, et al. Depression, physical function, and disease activity associated with frailty in patients with rheumatoid arthritis[J]. Mod Rheumatol, 2021, 31(5): 979-986. doi: 10.1080/14397595.2020.1838402
[9] LI G W, CHEN M S, LI X Y, et al. Frailty and risk of osteoporotic fractures in patients with rheumatoid arthritis: Data from the Ontario Best Practices Research Initiative[J]. Bone, 2019, 127: 129-134. doi: 10.1016/j.bone.2019.06.006
[10] ANDREWS J S, TRUPIN L, WYSHAM K D, et al. The impact of frailty on changes in physical function and disease activity among adults with rheumatoid arthritis[J]. ACR Open Rheumatol, 2019, 1(6): 366-372. doi: 10.1002/acr2.11051
[11] 胡雁, 郝玉芳. 循证护理学[M]. 2版. 北京: 人民卫生出版社, 2018: 1-32. [12] 曾宪涛, 任学群. 应用STATA做Meta分析[M]. 2版. 北京: 中国协和医科大学出版社, 2017: 71-73. [13] YOSHII I, KONDO M. Clinical characteristics of frailty in Japanese rheumatoid arthritis patients[J]. J Frailty Aging, 2020, 9(3): 158-164.
[14] WYSHAM K D, SHOBACK D M, ANDREWS J S, et al. Sex differences in frailty and its association with low bone mineral density in rheumatoid arthritis[J]. Bone Rep, 2020, 12: 100284. doi: 10.1016/j.bonr.2020.100284
[15] TADA M, YAMADA Y, MANDAI K, et al. Correlation between frailty and disease activity in patients with rheumatoid arthritis: Data from the CHIKARA study[J]. Geriatr Gerontol Int, 2019, 19(12): 1220-1225. doi: 10.1111/ggi.13795
[16] SALAFFI F, CARLO M D, FARAH S, et al. Prevalence of frailty and its associated factors in patients with rheumatoid arthritis: a cross-sectional analysis[J]. Clin Rheumatol, 2019, 38(7): 1823-1830. doi: 10.1007/s10067-019-04486-5
[17] SALAFFI F, CARLO M D, FARAH S, et al. The Comprehensive Rheumatologic Assessment of Frailty (CRAF): development and validation of a multidimensional frailty screening tool in patients with rheumatoid arthritis[J]. Clin Exp Rheumatol, 2020, 38(3): 488-499.
[18] OZEKI S, TAKEUCHI K, YASUOKA M, et al. Comparison of frailty associated factors between older adult patients with rheumatoid arthritis and community dwellers[J]. Arch Gerontol Geriatr, 2021, 96: 104455. doi: 10.1016/j.archger.2021.104455
[19] OETSMA S, BOONEN A, STARMANS M, et al. Validation of two frailty questionnaires in older patients with rheumatoid arthritis: a cross-sectional study[J]. Clin Exp Rheumatol, 2020, 38(3): 523-528.
[20] MINAMINO H, KATSUSHIMA M, TORⅡ M, et al. Habitual fish intake negatively correlates with prevalence of frailty among patients with rheumatoid arthritis[J]. Sci Rep, 2021, 11(1): 5104. doi: 10.1038/s41598-021-84479-0
[21] HAIDER S, GRABOVAC I, BERNER C, et al. Frailty in seropositive rheumatoid arthritis patients of working age: a cross-sectional study[J]. Clin Exp Rheumatol, 2019, 37(4): 585-592.
[22] COOK M J, VERSTAPPEN S M M, LUNT M, et al. Increased frailty in individuals with osteoarthritis and rheumatoid arthritis and the influence of comorbidity: an analysis of the UK biobank cohort[J]. Arthritis Care Res, 2022, 74(12): 1989-1996. doi: 10.1002/acr.24747
[23] CLEUTJENS F, VAN MOERBEKE A, BOONEN A, et al. Frailty in relation to psycho-social factors in elderly patients with rheumatoid arthritis: a cross-sectional mixed qualitative-quantitative study[J]. Int J Rheum Dis, 2021, 24(6): 766-773. doi: 10.1111/1756-185X.14110
[24] BARILE-FABRIS L A, PÉREZ-CRISTOBAL M, MERLOS-LÓPEZ R J, et al. Frailty syndrome in patients with rheumatoid arthritis[J]. Rev Med Inst Mex Seguro Soc, 2016, 54(Suppl 2): S210-S215.
[25] BAK E, MŁYNARSKA A, MARCISZ C, et al. Factors that affect the assessment of the quality of life of rheumatoid arthritis patients depending on the prevalence of frailty syndrome[J]. Health Qual Life Outcomes, 2020, 18(1): 216. doi: 10.1186/s12955-020-01472-3
[26] 龚丽, 门雪妍, 曹冰莹. 老年类风湿关节炎病人衰弱现状及影响因素[J]. 护理研究, 2020, 34(19): 3506-3508. doi: 10.12102/j.issn.1009-6493.2020.19.029 [27] SUZUKI M, ASAI, SOBUE Y, et al. Influence of frailty on patient global assessment in rheumatoid arthritis[J]. Geriatr Gerontol Int, 2022, 22(5): 399-404. doi: 10.1111/ggi.14375
[28] SOBUE Y, SUZUKI M, OHASHI Y, et al. Relationship between locomotive syndrome and frailty in rheumatoid arthritis patients by locomotive syndrome stage[J]. Mod Rheumatol, 2022, 32(3): 546-553. doi: 10.1093/mr/roab024
[29] TANSKI W, WÓJCIGA J, JANKOWSKA-POLANSKA B. Association between malnutrition and quality of life in elderly patients with rheumatoid arthritis[J]. Nutrients, 2021, 13(4): 1259. doi: 10.3390/nu13041259
[30] OHASHI Y, TAKAHASHI N, SOBUE Y, et al. Factors associated with frailty in rheumatoid arthritis patients with decreased renal function[J]. Mod Rheumatol, 2023, 33(2): 323-329. doi: 10.1093/mr/roac018
[31] MATSUMOTO Y, TADA M, YAMADA Y, et al. The bioimpedance phase angle may be associated with frailty in rheumatoid arthritis patients: Results from a prospective, cohort study[J]. Mod Rheumatol, 2023, 33(4): 732-738. doi: 10.1093/mr/roac078
[32] FURUYA T, OH K, IKARI K, et al. Factors associated with frailty in Japanese patients with rheumatoid arthritis: results from the Institute of Rheumatology Rheumatoid Arthritis cohort study[J]. Clin Rheumatol, 2022, 41(2): 405-410. doi: 10.1007/s10067-021-05938-7
[33] SOBUE Y, SUZUKI M, OHASHI Y, et al. Validation of grip strength as a measure of frailty in rheumatoid arthritis[J]. Sci Rep, 2022, 12(1): 21090. doi: 10.1038/s41598-022-21533-5
[34] SOBUE Y, SUZUKI M, OHASHI Y, et al. Relationship between frailty and methotrexate discontinuation due to adverse events in rheumatoid arthritis patients[J]. Clin Rheumatol, 2023, 42(8): 2069-2077. doi: 10.1007/s10067-023-06639-z
[35] LIEBER S B, NAVARRO-MILLÁN I, RAJAN M, et al. Prevalence of frailty in ankylosing spondylitis, psoriatic arthritis, and rheumatoid arthritis: data from a national claims dataset[J]. ACR Open Rheumatol, 2022, 4(4): 300-305. doi: 10.1002/acr2.11388
[36] 高倩倩, 梅凡, 赵黎, 等. 老年糖尿病患者衰弱发生率的系统评价[J]. 中华护理杂志, 2021, 56(5): 686-693. doi: 10.3761/j.issn.0254-1769.2021.05.007 [37] FRIED L P, FERRUCCI L, DARER J, et al. Untangling the concepts of disability, frailty, and comorbidity: implications for improved targeting and care[J]. J Gerontol A Biol Sci Med Sci, 2004, 59(3): 255-263. doi: 10.1093/gerona/59.3.M255
[38] 王婷婷, 马慧珍, 邓小岚, 等. 血常规中炎症指标与衰弱及衰弱前期的关系[J]. 实用临床医药杂志, 2022, 26(19): 87-91. doi: 10.7619/jcmp.20221443 [39] SALAFFI F, MATTEO A D, FARAH S, et al. Inflammaging and frailty in immune-mediated rheumatic diseases: how to address and score the issue[J]. Clin Rev Allergy Immunol, 2023, 64(2): 206-221.
[40] 袁红丽, 王娴, 汪秀梅, 等. 类风湿关节炎患者血清及关节液血管生成素样蛋白4、白细胞介素-17、核因子κB受体活化因子配体的临床意义[J]. 实用临床医药杂志, 2022, 8(17): 57-62. doi: 10.7619/jcmp.20220103 [41] 陈娟, 谢军, 孙媛媛, 等. 老年衰弱患者焦虑、抑郁、生活质量状况的分析[J]. 实用临床医药杂志, 2019, 23(4): 73-77. doi: 10.7619/jcmp.201904022 [42] FINCKH A, GILBERT B, HODKINSON B, et al. Global epidemiology of rheumatoid arthritis[J]. Nat Rev Rheumatol, 2022, 18(10): 591-602.
[43] WANG X R, HU J J, WU D P. Risk factors for frailty in older adults[J]. Medicine, 2022, 101(34): e30169. doi: 10.1097/MD.0000000000030169




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
