Bibliometric analysis of cognitive dysfunction after aneurysmal subarachnoid hemorrhage
-
摘要:目的
基于文献计量学分析探讨动脉瘤性蛛网膜下腔出血(aSAH)后认知功能障碍领域的研究热点及研究趋势。
方法利用VoSviewer、CiteSpace和R语言Bibliometrix包等工具,对Web of Science核心合集(WoSCC)数据库中检索得到的aSAH后认知功能障碍相关文献(时间范围1991年1月1日—2023年12月31日)进行文献计量学分析。
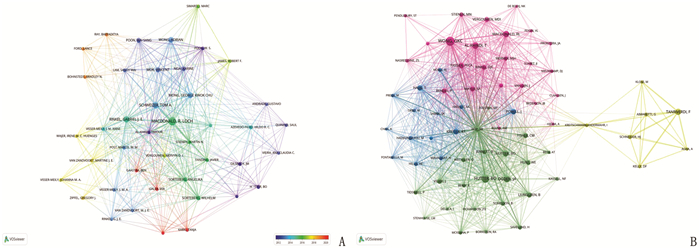
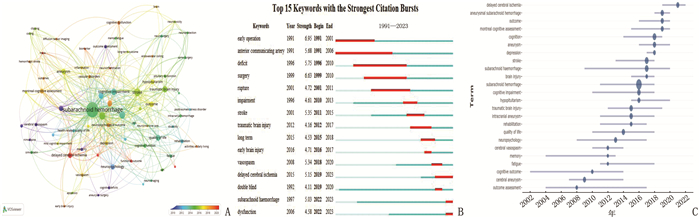
结果本研究基于检索策略共筛选出262篇文献,涉及44个国家、443所机构和1 328位作者。美国是发文量最多的国家(72篇),也是参与国际协作最多的国家; 多伦多大学是发文量最多的机构(18篇)。Neurosurgery、World Neurosurgery是目前该领域发文量最高的期刊,发文量均为15篇; 发表在Stroke的文献共被引频次最高,被引用1 222次。MACDONALD R L是该领域发文量最高的作者(17篇), WONG G K C是共被引频次最高的作者(179次)。目前关于aSAH后认知功能的研究热点集中于aSAH后认知功能障碍、早期脑损伤(EBI)、迟发性脑缺血(DCI)及脑血管痉挛(CV)方面。aSAH后DCI对认知功能障碍的影响机制是该领域的研究趋势之一。
结论目前, aSAH后认知功能障碍领域的研究热点集中于EBI、CV及DCI等病理生理过程, aSAH后病理生理改变的机制研究仍是该领域未来的研究热点。
-
关键词:
- 动脉瘤性蛛网膜下腔出血 /
- 认知功能障碍 /
- 文献计量学 /
- 可视化分析 /
- 迟发性脑缺血
Abstract:ObjectiveTo explore the research hotspots and trends in the field of cognitive dysfunction after aneurysmal subarachnoid hemorrhage (aSAH) based on bibliometric analysis.
MethodsTools such as VoSviewer, CiteSpace, and the R language Bibliometrix package were utilized to conduct a bibliometric analysis of literature related to cognitive dysfunction after aSAH retrieved from the Web of Science Core Collection (WoSCC) database, spanning from January 1, 1991, to December 31, 2023.
ResultsA total of 262 articles involving 44 countries, 443 institutions, and 1, 328 authors were screened based on the search strategy. The United States was the country with the highest number of articles (72) and the most international collaboration. The University of Toronto was the most productive institution (18 articles). Neurosurgery and World Neurosurgery were the journals with the highest number of publications in this field, each contributing 15 articles. The articles published in Stroke were the highest in total citation frequency, with 1, 222 citations. MACDONALD R L was the most prolific author in this field (17 articles), while WONG G K C had the highest co-citation frequency (179 times). Currently, the research hotspots in cognitive dysfunction after aSAH focused on early brain injury (EBI), delayed cerebral ischemia (DCI), and cerebral vasospasm (CV). The mechanism of DCI's impact on cognitive dysfunction after aSAH represented one of the research trends in this field.
ConclusionThe current research hotspots in the field of cognitive dysfunction after aSAH concentrate on pathophysiological processes such as EBI, CV, and DCI. The exploration of mechanisms underlying pathophysiological changes after aSAH remains a focal point for future research in this area.
-
手术具有创伤性,可一定程度损伤大脑生理屏障,为病原菌进入颅内提供条件,进而引发术后颅内感染[1-2]。固有淋巴细胞(ILCs)亚群又称先天淋巴细胞,在黏膜屏障处大量表达,参与多种免疫调节反应,是免疫系统对抗病原体的第一道防线[3-4]。根据细胞因子表达谱不同, ILCs可分为ILC1、ILC2和ILC3这3大类[5], ILC1分泌干扰素-γ(IFN-γ)以应答白细胞介素(IL)-12、IL-18和IL-15, 主要针对胞内细菌与寄生虫感染; ILC2响应IL-25、IL-33分泌2型细胞因子,如IL-5、IL-13, 可有效防御寄生虫感染及过敏反应; ILC3响应IL-23、IL-1β产生IL-22、IL-17, 被认为是Th17的先天对应物,参与抗宿主细菌和真菌感染的过程[6-7]。目前,鲜有研究系统性分析外周血ILCs亚群及其活化因子在高血压性基底节区脑出血患者术后颅内感染过程中的作用。本研究检测高血压性基底节区脑出血术后患者外周血ILCs亚群及其活化因子水平,分析各指标与术后颅内感染严重程度的关系及其对预后的预测价值,现报告如下。
1. 资料与方法
1.1 一般资料
基于1∶1倾向评分匹配法,选取安徽省庐江县人民医院2019年11月—2022年11月收治的105例高血压性基底节区脑出血术后颅内感染患者(感染组)和105例未感染患者(未感染组)作为研究对象。纳入标准: ①符合《高血压性脑出血中国多学科诊治指南》[8]中的高血压性脑出血诊断标准,并经脑部核磁共振成像(MRI)和计算机断层扫描(CT)检查确诊脑出血,出血位于基底节区者; ②感染组患者符合术后颅内感染诊断标准[9]; ③发病至入院时间<24 h者; ④于庐江县人民医院行微创血肿清除术者。排除标准: ①存在脑卒中病史者; ②肝、肾等重要脏器功能不全者; ③术前存在感染者。本研究获得安徽省庐江县人民医院伦理委员会批准,且所有患者对本研究知情同意。2组患者一般资料比较,差异无统计学意义(P>0.05), 见表 1。
表 1 感染组和未感染组患者一般资料比较(x±s)[n(%)]一般资料 分类 未感染组(n=105) 感染组(n=105) χ2/t P 性别 男 59(56.19) 58(55.24) 0.019 0.890 女 46(43.81) 47(44.76) 年龄/岁 58.11±5.86 56.87±5.77 1.555 0.122 体质量指数/(kg/m2) 22.42±2.20 22.60±2.30 0.588 0.557 高血压病程/年 8.26±3.13 8.66±3.34 0.895 0.372 出血量/mL 43.55±4.45 43.87±4.12 0.531 0.596 糖尿病史 40(38.10) 43(40.95) 0.179 0.672 1.2 方法
1.2.1 分组方法
依据感染程度判断标准[10],将感染组患者分为轻度感染组33例、中度感染组50例和重度感染组22例; 依据治疗后6个月格拉斯哥预后评分(GOS)[11], 将感染组患者分为预后不良组52例和预后良好组53例, GOS总分1~5分, <4分为预后不良, ≥4分为预后良好。
1.2.2 外周血ILCs亚群、IL-12、IL-33、IL-1β水平检测
于患者入院24 h内采集2管外周血,每管3 mL。一管利用密度梯度离心提取外周血单个核细胞(PBMC), 向阴性对照管中加入150 μL PBMC, 另取150 μL PBMC至预先加入抗体Lin-APC、CD11b-APC、CD11c-APC、FcεRIa-APC、CD123-APC、CD127(IL-7Rα)-PerCP/Cy 5.5、CD161-AF 700、CD336 (NKp44)-PE、CD117(C-kit)-BV421、CD45-FITC、CD294(CRTH2)-PE/Cy7的流式管中,用流式细胞术(南充实维仪器有限公司)检测ILCs亚群(ILC1、ILC2、ILC3)水平。另一管离心分离取上清液,采用酶联免疫吸附测定(ELISA)法检测血清IL-12、IL-33、IL-1β水平。试剂盒均购于天津科维诺生物科技有限公司。
1.3 统计学分析
应用SPSS 23.0软件和MedCalc18.2.1软件对数据进行分析,计量资料以(x±s)表示, 2组间比较采用独立样本t检验,多组间比较行单因素方差分析,组间多重比较采用LSD-t检验; 计数资料以[n(%)]描述,比较行χ2检验; 采用Spearman相关分析探讨各指标与颅内感染程度的相关性,绘制受试者工作特征(ROC)曲线评估各指标对患者不良预后的预测价值。检验水准为α=0.05, 双侧P<0.05表示差异有统计学意义。
2. 结果
2.1 感染组与未感染组外周血ILCs亚群、IL-12、IL-33和IL-1β水平比较
感染组ILC2、ILC3水平低于未感染组, IL-12、IL-33、IL-1β水平高于未感染组,差异有统计学意义(P<0.05); 2组ILC1水平比较,差异无统计学意义(P>0.05), 见表 2。
表 2 感染组与未感染组外周血ILCs亚群、IL-12、IL-33和IL-1β水平比较(x±s)组别 n ILC1/% ILC2/% ILC3/% IL-12/(ng/L) IL-33/(ng/L) IL-1β/(ng/L) 未感染组 105 21.21±3.64 28.41±5.11 18.81±4.13 78.51±16.57 926.49±161.78 20.13±3.31 感染组 105 21.93±3.21 17.26±2.62 9.60±2.31 138.90±21.11 1 225.31±161.47 33.31±4.47 t 1.520 19.898 19.946 23.052 13.397 24.267 P 0.130 <0.001 <0.001 <0.001 <0.001 <0.001 ILC1: 固有淋巴细胞-1; ILC2: 固有淋巴细胞-2; ILC3: 固有淋巴细胞-3; IL-12: 白细胞介素-12;
IL-33: 白细胞介素-33; IL-1β: 白细胞介素-1β。2.2 不同颅内感染程度患者外周血ILCs亚群、IL-12、IL-33、IL-1β水平比较
颅内感染患者的ILC2、ILC3水平随着感染程度的增加而下降, IL-12、IL-33、IL-1β水平随着感染程度的增加而上升,差异有统计学意义(P<0.05); 不同颅内感染程度患者的ILC1水平比较,差异无统计学意义(P>0.05), 见表 3。
表 3 不同颅内感染程度患者外周血ILCs亚群、IL-1β、IL-12和IL-33水平比较(x±s)组别 n ILC1/% ILC2/% ILC3/% IL-12/(ng/L) IL-33/(ng/L) IL-1β/(ng/L) 轻度感染组 33 21.06±3.04 19.58±1.92 11.50±1.40 124.80±24.76 1 136.52±173.54 30.46±4.05 中度感染组 50 22.10±3.32 17.01±1.70* 9.09±2.14* 139.37±12.59* 1 220.25±111.29* 33.31±3.57* 重度感染组 22 22.84±3.02 14.34±2.00*# 7.90±1.84*# 158.95±13.02*# 1 370.01±141.21*# 37.60±3.53*# F 2.220 54.599 27.800 25.403 18.512 24.321 P 0.114 <0.001 <0.001 <0.001 <0.001 <0.001 与轻度感染组比较, *P<0.05; 与中度感染组比较, #P<0.05。 2.3 颅内感染患者外周血ILC2、ILC3、IL-12、IL-33、IL-1β水平与感染程度的相关性分析
Spearman相关分析结果显示,颅内感染患者外周血ILC2、ILC3水平均与感染严重程度呈负相关(r=-0.721、-0.596, P<0.001), 外周血IL-12、IL-33、IL-1β水平均与感染严重程度呈正相关(r=0.576、0.483、0.553, P<0.001), 见图 1。
2.4 预后不良组与预后良好组外周血ILCs亚群、IL-12、IL-33、IL-1β水平比较
预后不良组ILC2、ILC3水平低于预后良好组, IL-12、IL-33、IL-1β水平高于预后良好组,差异有统计学意义(P<0.05); 2组ILC1水平比较,差异无统计学意义(P>0.05), 见表 4。
表 4 预后不良组与预后良好组外周血ILCs亚群、IL-12、IL-33、IL-1β水平比较(x±s)组别 n ILC1/% ILC2/% ILC3/% IL-12/(ng/L) IL-33/(ng/L) IL-1β/(ng/L) 预后不良组 52 22.23±3.25 15.88±2.24 8.61±2.11 148.10±16.20 1 316.82±122.47 35.14±4.07 预后良好组 53 21.63±3.17 18.62±2.23 10.56±2.09 129.87±21.59 1 135.54±144.37 31.52±4.15 t 0.953 6.270 4.755 4.887 6.932 4.516 P 0.343 <0.001 <0.001 <0.001 <0.001 <0.001 2.5 外周血ILC2、ILC3、IL-12、IL-33、IL-1β水平对颅内感染患者预后不良的预测价值分析
ROC曲线分析结果显示,外周血ILC2、ILC3、IL-12、IL-33、IL-1β单独预测患者预后不良的曲线下面积(AUC)分别为0.809、0.765、0.758、0.847、0.724, 5项指标联合预测的AUC为0.930, 特异度为84.91%, 均大于或高于单项指标的AUC、特异度,见图 2、表 5。
表 5 外周血ILC2、ILC3、IL-12、IL-33、IL-1β水平对患者预后不良的预测效能指标 AUC 敏感度/% 特异度/% 95%CI 截断值 P ILC2/% 0.809 71.15 77.36 0.720~0.879 17.00 <0.001 ILC3/% 0.756 67.31 81.13 0.662~0.834 9.04 <0.001 IL-12/(ng/L) 0.758 71.15 71.70 0.665~0.837 140.75 <0.001 IL-33/(ng/L) 0.847 92.31 71.70 0.764~0.910 1 198.75 <0.001 IL-1β/(ng/L) 0.724 88.46 49.06 0.628~0.807 30.89 <0.001 各指标联合 0.930 86.54 84.91 0.864~0.971 — <0.001 3. 讨论
高血压性脑出血是致死率和致残率均较高的一种脑血管疾病,基底节区是常见出血部位,患者会出现意识不清、偏瘫等症状,病情严重时可能存在死亡风险[12]。随着临床微创技术的发展,血肿微创清除术在高血压性脑出血中应用广泛,但术后易出现颅内感染,加重患者病情,对疾病预后产生不利影响。既往研究[13]显示,颅内感染是高血压性脑出血术后的一种严重并发症,早期识别感染并有效干预是抑制病情恶化和改善患者预后的重要前提。传统监测指标如体温、血象和脑脊液指标通常在临床症状明显或炎症反应发展到一定程度时才有异常表现,在早期识别方面缺乏一定敏感性。既往研究[14-15]显示,黏膜免疫系统是机体抵抗病原微生物感染的第一道防线,而黏膜免疫系统除上皮细胞组织外,还包含效应细胞类的免疫细胞,其中ILCs是主要存在于黏膜中的一类效应细胞,共同参与上皮屏障的保护和修复作用。由此提示,在上皮屏障系统受到炎性攻击时, ILCs能较快地识别并分泌各类因子进行免疫调节,其或可作为颅内感染的早期识别指标。
本研究结果显示,与未感染组比较,感染组ILC2、ILC3水平显著降低, IL-12、IL-33和IL-1β水平显著升高,提示ILCs亚群占比失衡与患者术后感染存在关联。ILC1包含自然杀伤(NK)细胞, NK细胞作为Th1细胞的先天对应物,当暴露于IL-12、IL-15和IL-18时,可产生IFN-γ驱动巨噬细胞和树突细胞的增殖和刺激,对抗细胞内病原体[16]。ILC2受转录因子GATA3和维甲酸相关孤核受体α的调控,在IL-25、IL-33等刺激下可分泌IL-4、IL-5等Th2型细胞因子,通过血液淋巴循环抵达远端器官进而发挥作用,参与多种生理、病理生物学过程(例如诱导2型炎症,病原菌感染引发免疫反应,维持和重建屏障系统等)[17]。IL-12可能通过激活ILC1产生IFN-γ, 从而激活免疫细胞抵抗病原菌的入侵[18]。CHANG Y N等[19]研究显示, ILC2在抵御流感病毒感染中起着关键作用,其分泌的Th2型细胞因子参与机体免疫应答反应。由此推测,本研究中IL-12、IL-33水平升高可能与患者颅内感染引发的免疫炎性反应有关。ILC3既参与机体的固有免疫应答,又与CD4+ T细胞相互作用调节获得性免疫应答[15], 可感知由微生物刺激髓系细胞产生的细胞因子IL-23、IL-1β信号,分泌IL-22, 诱导肠上皮细胞产生抗菌肽和抗病毒蛋白,促进肠干细胞增殖,进而保护机体免受感染损伤,维持黏膜完整性,参与黏膜免疫[20-21]。由此推测,患者感染病原菌后可刺激细胞因子IL-1β分泌,进而活化ILC3产生IL-22促进受损脑黏膜组织修复,恢复脑黏膜屏障的完整性,发挥抗感染作用。本研究中,感染组ILC2和ILC3水平显著低于未感染组患者,推测可能因为患者处于感染初期,受多种机制影响抑制免疫病理相关的ILC2和ILC3水平,而IL-12、IL-33和IL-1β水平代偿性升高发挥抗感染作用。本研究还发现,感染患者ILC2、ILC3水平随着感染程度的增加而下降, IL-12、IL-33和IL-1β水平随着感染程度的增加而上升,且与颅内感染严重程度具有相关性,表明感染程度越严重,机体免疫反应越激烈。分析可能原因,随着感染进程的发展,免疫反应越来越强烈,刺激机体分泌IL-12、IL-33和IL-1β, 而过量IL-12、IL-33和IL-1β可在一定程度上抑制ILC2、ILC3的产生。由此提示,外周血ILC2、ILC3、IL-12、IL-33和IL-1β或可作为临床诊断高血压性基底节区脑出血术后并发颅内感染的重要生物学指标。
既往研究[22]显示,激活ILCs活性可增强机体对病原体感染的抵抗和清除作用,而抑制ILCs活性或其效应分子可辅助治疗慢性感染性疾病。另有研究[23]提出,临床可考虑通过免疫治疗抑制相关干扰信号来提高机体固有免疫反应,消除感染病原,提升临床疗效,改善患者预后。本研究结果还显示,与预后良好组比较,预后不良组ILC2、ILC3水平显著降低,IL-12、IL-33和IL-1β水平显著升高。ROC曲线分析结果显示,ILC2、ILC3、IL-1β、IL-12和IL-33对患者预后均具有预测价值,且其联合预测患者预后的AUC、特异度均大于或高于单独预测,因此临床或可通过联合检测多项指标准确预测患者预后情况。
综上所述,高血压性基底节区脑出血术后颅内感染患者外周血ILC2、ILC3水平下降, IL-12、IL-33、IL-1β水平上升,且其水平与感染严重程度有关。密切关注此类患者外周血ILCs亚群和IL-12、IL-33、IL-1β水平,有利于早期识别术后颅内感染,且对患者预后具有一定预测价值。
-
表 1 aSAH后认知功能障碍相关文献发文量排名前10位的国家
排名 国家 所属洲 发文量/篇 1 美国 北美洲 72 2 中国 亚洲 31 3 德国 欧洲 27 4 加拿大 北美洲 23 5 英格兰 欧洲 22 6 荷兰 欧洲 18 7 瑞士 欧洲 17 8 意大利 欧洲 14 9 瑞典 欧洲 11 10 日本 亚洲 8 表 2 aSAH后认知功能障碍相关文献发文量排名前10位的研究机构
排名 机构名称 所在国家 发文量/篇 1 多伦多大学 加拿大 18 2 圣迈克尔医院 加拿大 14 3 香港中文大学 中国 13 4 乌得勒支大学医学中心 荷兰 11 5 梅奥诊所 美国 7 6 乌得勒支大学 荷兰 7 7 约翰霍普金斯大学 美国 6 8 日内瓦大学医院 瑞士 6 9 奥斯陆大学 挪威 6 10 苏黎世大学 瑞士 5 表 3 aSAH后认知功能障碍相关文献发文量排名前10位的期刊
排名 期刊 发文量/篇 分区(影响因子) 1 Neurosurgery 15 Q1(4.8) 2 World Neurosurgery 15 Q3(2.1) 3 Acta Neurochirurgica 11 Q2(2.4) 4 Stroke 10 Q1(8.8) 5 Journal of the Neurological Sciences 9 Q2(3.8) 6 Journal of Neurosurgery 8 Q1(4.6) 7 Journal of Neurology Neurosurgery and Psychiatry 7 Q1(10.7) 8 Frontiers in Neurology 5 Q2(3.9) 9 Journal of Neurosurgical Anesthesiology 5 Q1(3.7) 10 Journal of Stroke & Cerebrovascular Diseases 4 Q3(2.4) 表 4 aSAH后认知功能障碍相关文献共被引频次排名前10位的期刊
排名 共被引期刊 共被引频次/次 分区(影响因子) 1 Stroke 1 222 Q1(8.8) 2 Neurosurgery 952 Q1(4.8) 3 J Neurosurg 766 Q1(4.6) 4 Neurology 431 Q1(10.3) 5 J Neurol Neurosur Ps 412 Q1(10.7) 6 Acta Neurochir 320 Q2(2.4) 7 J Neurosurg Anesth 305 Q1(3.7) 8 Lancet 273 Q1(118.1) 9 J Neurotraum 223 Q2(4.6) 10 Neurocrit Care 223 Q2(3.5) 表 5 aSAH后认知功能障碍相关文献发文量排名前12位的作者和排名前10位的共被引作者
排名 作者 发文量/篇 共被引作者 被引频次/次 1 MACDONALD R L 17 WONG G K C 179 2 SCHWEIZER T A 10 HUTTER B O 140 3 RINKEL GABRIEL J E 9 TANRIVERDI F 96 4 WONG ADRIAN 8 OGDEN J A 94 5 WONG G K C 8 AL-KHINDI T 89 6 MOK VINCENT 7 MACDONALD R L 84 7 POON WAI SANG 6 HÜTTER B O 74 8 NGAI KARINE 5 KREITER K T 64 9 LANIER WILLIAM L 5 PASSIER PECA 63 10 PASTERNAK JEFFREY J 5 VERGOUWEN MDI 62 11 SORTEBERG ANGELIKA 5 — — 12 SORTEBERG WILHELM 5 — — 表 6 被引频次排名前15位的文献信息
排名 第一作者 发表年度 期刊 被引频次/次 主要研究内容 1 AL-KHINDI T 2010 Stroke 85 aSAH后的认知功能结局 2 KREITER K T 2002 Stroke 55 aSAH后认知功能障碍的预测因素 3 OGDEN J A 1993 Neurosurgery 54 aSAH后认知记忆障碍及恢复的前瞻性研究 4 HUTTER B O 1993 Neurosurgery 53 aSAH后神经心理缺陷 5 MAYER S A 2002 Neurology 45 aSAH后的整体和特异性认知障碍结果 6 HUNT W E 1968 Journal of Neurosurgery 44 颅内动脉瘤手术干预时间及相关的手术风险 7 FISHER C M 1980 Neurosurgery 42 计算机断层扫描可视化CV与蛛网膜下腔出血的关系 8 JENNETT B 1975 Lancet 40 严重脑损伤后的预后评估 9 LJUNGGREN B 1985 Journal of Neurosurgery 40 aSAH后及早期手术后无神经功能缺损患者的认知障碍 10 WONG G K C 2012 Journal of Neurology, Neurosurgery & Psychiatry 36 aSAH后认知障碍的患病率、危险因素与3个月后结局的相关性 11 HUTTER B O 1995 British Journal of Neurosurgery 34 aSAH后的生活质量和认知缺陷 12 RINKEL G J E 2011 Lancet Neurology 34 aSAH患者的长期预后 13 HADJIVASSILIOU M 2001 Neurology 33 aSAH: 夹闭或栓塞术后的认知结局和功能损伤 14 TIDSWELL P 1995 Neurology 33 动脉瘤破裂后的认知结果与瘤体部位和围术期并发症的关系 15 NASREDDINE Z S 2005 Journal of the American Geriatrics Society 31 蒙特利尔认知评估量表的验证性研究 -
[1] 王拥军, 李子孝, 谷鸿秋, 等. 中国卒中报告2020(中文版)(1)[J]. 中国卒中杂志, 2022, 17(5): 433-447. doi: 10.3969/j.issn.1673-5765.2022.05.001 [2] MACDONALD R L, SCHWEIZER T A. Spontaneous subarachnoid haemorrhage[J]. Lancet, 2017, 389(10069): 655-666. doi: 10.1016/S0140-6736(16)30668-7
[3] BUUNK A M, SPIKMAN J M, METZEMAEKERS J D M, et al. Return to work after subarachnoid hemorrhage: the influence of cognitive deficits[J]. PLoS One, 2019, 14(8): e0220972. doi: 10.1371/journal.pone.0220972
[4] NUSSBAUM E S, MIKOFF N, PARANJAPE G S. Cognitive deficits among patients surviving aneurysmal subarachnoid hemorrhage. A contemporary systematic review[J]. Br J Neurosurg, 2021, 35(4): 384-401. doi: 10.1080/02688697.2020.1859462
[5] WANG B, XING D, ZHU Y Y, et al. The state of exosomes research: a global visualized analysis[J]. Biomed Res Int, 2019, 2019: 1495130.
[6] SYNNESTVEDT M B, CHEN C M, HOLMES J H. CiteSpace Ⅱ: visualization and knowledge discovery in bibliographic databases[J]. AMIA Annu Symp Proc, 2005, 2005: 724-728.
[7] YEUNG A W K, TZVETKOV N T, BALACHEVA A A, et al. Lignans: quantitative analysis of the research literature[J]. Front Pharmacol, 2020, 11: 37. doi: 10.3389/fphar.2020.00037
[8] LI C, OJEDA-THIES C, RENZ N, et al. The global state of clinical research and trends in periprosthetic joint infection: a bibliometric analysis[J]. Int J Infect Dis, 2020, 96: 696-709. doi: 10.1016/j.ijid.2020.05.014
[9] 李云峰, 向萍, 杨业春. 《中国医院统计》论文研究热点和前沿演化分析[J]. 中国医院统计, 2023, 30(6): 469-475, 480. doi: 10.3969/j.issn.1006-5253.2023.06.015 [10] 梁若飞, 王远传, 唐晓平. 基于Web of Science数据库的动脉瘤性蛛网膜下腔出血患者认知功能障碍研究的文献计量学分析[J]. 医学信息, 2023, 36(8): 17-23. doi: 10.3760/cma.j.issn.1000-8039.2023.08.126 [11] AL-KHINDI T, MACDONALD R L, SCHWEIZER T A. Cognitive and functional outcome after aneurysmal subarachnoid hemorrhage[J]. Stroke, 2010, 41(8): e519-e536.
[12] SCHWEIZER T A, AL-KHINDI T, MACDONALD R L. Mini-Mental State Examination versus Montreal Cognitive Assessment: rapid assessment tools for cognitive and functional outcome after aneurysmal subarachnoid hemorrhage[J]. J Neurol Sci, 2012, 316(1/2): 137-140.
[13] SHELDON S, MACDONALD R L, SCHWEIZER T A. Free recall memory performance after aneurysmal subarachnoid hemorrhage[J]. J Int Neuropsychol Soc, 2012, 18(2): 334-342. doi: 10.1017/S1355617711001780
[14] MAHER M, CHURCHILL N W, DE OLIVEIRA MANOEL A L, et al. Altered resting-state connectivity within executive networks after aneurysmal subarachnoid hemorrhage[J]. PLoS One, 2015, 10(7): e0130483. doi: 10.1371/journal.pone.0130483
[15] EAGLES M E, TSO M K, MACDONALD R L. Cognitive impairment, functional outcome, and delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage[J]. World Neurosurg, 2019, 124: e558-e562. doi: 10.1016/j.wneu.2018.12.152
[16] WONG G K C, WONG R, MOK V, et al. Rivastigmine for cognitive impairment after spontaneous subarachnoid haemorrhage: a pilot study[J]. J Clin Pharm Ther, 2009, 34(6): 657-663. doi: 10.1111/j.1365-2710.2009.01056.x
[17] WONG G K C, WONG R, MOK V, et al. Natural history and medical treatment of cognitive dysfunction after spontaneous subarachnoid haemorrhage: review of current literature with respect to aneurysm treatment[J]. J Neurol Sci, 2010, 299(1/2): 5-8.
[18] WONG G K C, LAM S, NGAI K, et al. Evaluation of cognitive impairment by the Montreal Cognitive Assessment in patients with aneurysmal subarachnoid haemorrhage: prevalence, risk factors and correlations with 3 month outcomes[J]. J Neurol Neurosurg Psychiatry, 2012, 83(11): 1112-1117. doi: 10.1136/jnnp-2012-302217
[19] ROST N S, BRODTMANN A, PASE M P, et al. Post-stroke cognitive impairment and dementia[J]. Circ Res, 2022, 130(8): 1252-1271. doi: 10.1161/CIRCRESAHA.122.319951
[20] WATSON E, DING D L, KHATTAR N K, et al. Neurocognitive outcomes after aneurysmal subarachnoid hemorrhage: identifying inflammatory biomarkers[J]. J Neurol Sci, 2018, 394: 84-93. doi: 10.1016/j.jns.2018.06.021
[21] OSGOOD M L. Aneurysmal subarachnoid hemorrhage: review of the pathophysiology and management strategies[J]. Curr Neurol Neurosci Rep, 2021, 21(9): 50. doi: 10.1007/s11910-021-01136-9
[22] COULIBALY A P, PROVENCIO J J. Aneurysmal subarachnoid hemorrhage: an overview of inflammation-induced cellular changes[J]. Neurotherapeutics, 2020, 17(2): 436-445. doi: 10.1007/s13311-019-00829-x
[23] LUCKE-WOLD B P, LOGSDON A F, MANORANJAN B, et al. Aneurysmal subarachnoid hemorrhage and neuroinflammation: a comprehensive review[J]. Int J Mol Sci, 2016, 17(4): 497. doi: 10.3390/ijms17040497
[24] WU F, LIU Z C, LI G L, et al. Inflammation and oxidative stress: potential targets for improving prognosis after subarachnoid hemorrhage[J]. Front Cell Neurosci, 2021, 15: 739506. doi: 10.3389/fncel.2021.739506
[25] LIU Q L, HOU C K, ZHANG H, et al. Impaired meningeal lymphatic vessels exacerbate early brain injury after experimental subarachnoid hemorrhage[J]. Brain Res, 2021, 1769: 147584. doi: 10.1016/j.brainres.2021.147584
[26] LEE K S, CHARI A, MOTIWALA M, et al. Effectiveness of cerebrospinal fluid lumbar drainage among patients with aneurysmal subarachnoid hemorrhage: an updated systematic review and meta-analysis[J]. World Neurosurg, 2024, 183: 246-253. e12. doi: 10.1016/j.wneu.2024.01.062
[27] PROVENCIO J J, SWANK V, LU H Y, et al. Neutrophil depletion after subarachnoid hemorrhage improves memory via NMDA receptors[J]. Brain Behav Immun, 2016, 54: 233-242. doi: 10.1016/j.bbi.2016.02.007
[28] ISLAM R, VRIONIS F, HANAFY K A. Microglial TLR4 is critical for neuronal injury and cognitive dysfunction in subarachnoid hemorrhage[J]. Neurocritical Care, 2022, 37(3): 761-769. doi: 10.1007/s12028-022-01552-w
[29] CHLOROGIANNIS D D, ALOIZOU A M, MAVRIDIS T, et al. Evolving frontiers: endovascular strategies for the treatment of delayed cerebral ischemia[J]. Rev Neurosci, 2024, 35(4): 463-472. doi: 10.1515/revneuro-2023-0148
[30] HOH B L, KO N U, AMIN-HANJANI S, et al. 2023 guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American heart association/american stroke association[J]. Stroke, 2023, 54(7): e314-e370.
[31] WILLMS J F, BOSS J M, HUO S F, et al. Intraparenchymal near-infrared spectroscopy for detection of delayed cerebral ischemia in poor-grade aneurysmal subarachnoid hemorrhage[J]. J Neurosci Methods, 2024, 406: 110113. doi: 10.1016/j.jneumeth.2024.110113
[32] WANG X, GAN Q, YOU C, et al. Effect of statin treatment in patients with aneurysmal subarachnoid hemorrhage: a network meta-analysis[J]. Neurocrit Care, 2024, 41(1): 49-58. doi: 10.1007/s12028-024-01957-9
[33] FEULNER J, WEIDINGER C S, DÖRFLER A, et al. Early intravenous magnesium sulfate and its impact on cerebral vasospasm as well as delayed cerebral ischemia in aneurysmal subarachnoid hemorrhage: a retrospective matched case-control analysis[J]. World Neurosurg, 2024, 186: e106-e113. doi: 10.1016/j.wneu.2024.03.062
[34] LI J W, REN S H, REN J R, et al. Nimodipine improves cognitive impairment after subarachnoid hemorrhage in rats through IncRNA NEAT1/miR-27a/MAPT axis[J]. Drug Des Devel Ther, 2020, 14: 2295-2306. doi: 10.2147/DDDT.S248115
[35] LI Y B, CUI R Y, LIU S B, et al. The efficacy and safety of post-stroke cognitive impairment therapies: an umbrella review[J]. Front Pharmacol, 2023, 14: 1207075. doi: 10.3389/fphar.2023.1207075
[36] JULIAN N, GAUGAIN S, LABEYRIE M A, et al. Systemic tolerance of intravenous milrinone administration for cerebral vasospasm secondary to non-traumatic subarachnoid hemorrhage[J]. J Crit Care, 2024, 82: 154807. doi: 10.1016/j.jcrc.2024.154807
[37] 沈胜利, 段鸿洲, 李良, 等. 蛛网膜下腔出血后认知功能障碍的研究进展[J]. 中华神经医学杂志, 2020, 19(4): 344-348. doi: 10.3760/cma.j.cn115354-20191010-00583 [38] TÖLLI A, HÖYBYE C, BELLANDER B M, et al. Impact of pituitary dysfunction on cognitive and global outcome after traumatic brain injury and aneurysmal subarachnoid haemorrhage[J]. J Rehabil Med, 2019, 51(4): 264-272. doi: 10.2340/16501977-2531
[39] REIJMER Y D, VAN DEN HEERIK M S, HEINEN R, et al. Microstructural white matter abnormalities and cognitive impairment after aneurysmal subarachnoid hemorrhage[J]. Stroke, 2018, 49(9): 2040-2045. doi: 10.1161/STROKEAHA.118.021622
[40] QIU J Y, GAO S Q, CHEN Y S, et al. OXCT1 regulates hippocampal neurogenesis and alleviates cognitive impairment via the Akt/GSK-3β/β-catenin pathway after subarachnoid hemorrhage[J]. Brain Res, 2024, 1827: 148758. doi: 10.1016/j.brainres.2024.148758




 下载:
下载:







 苏公网安备 32100302010246号
苏公网安备 32100302010246号
