Construction and application of a risk prediction model for lower limb deep vein thrombosis in patients with aneurysmal subarachnoid hemorrhage
-
摘要:目的
探讨动脉瘤性蛛网膜下腔出血(aSAH)患者下肢深静脉血栓(DVT)形成风险预测模型的构建与应用。
方法选取250例aSAH患者为研究对象,根据是否形成下肢深静脉血栓将患者分为DVT组(n=45)和非DVT组(n=205)。收集2组患者的一般资料,并比较2组患者的常规实验室指标。采用多因素Logistic回归分析筛选aSAH患者发生DVT的风险因素,建立aSAH后DVT的列线图预测模型并通过受试者工作特征(ROC)曲线分析模型的区分能力,采用临床决策曲线分析列线图的临床实用性。
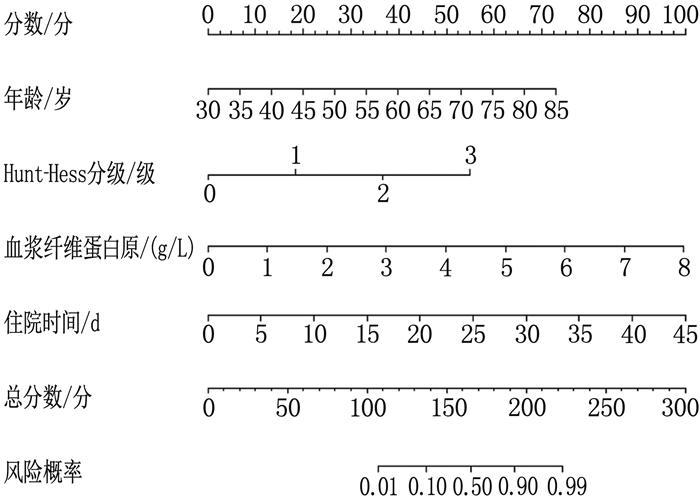
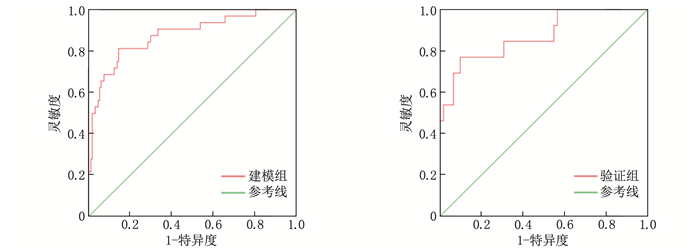
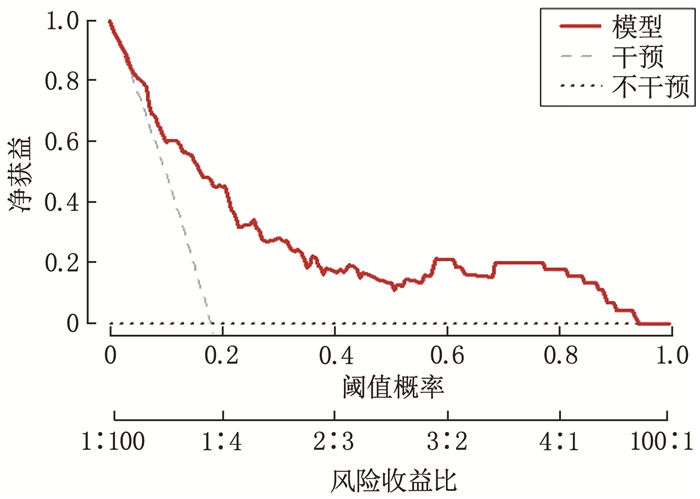
结果DVT组年龄、高血压史、格拉斯哥昏迷量表(GCS)评分、Hunt-Hess分级、住院时间与非DVT组患者比较,差异有统计学意义(P < 0.05)。DVT组血浆纤维蛋白原水平高于非DVT组患者,差异有统计学意义(P < 0.05), 其他指标与非DVT组比较,差异无统计学意义(P>0.05)。多因素Logistic回归分析结果表明,年龄、Hunt-Hess分级、住院时间以及血浆纤维蛋白原水平是aSAH患者发生DVT的影响因素(P < 0.05)。ROC曲线表明,列线图在建模组和验证组中均表现出良好预测性能,曲线下面积(AUC)分别为0.875(95%CI: 0.802~0.948)和0.872(95%CI: 0.757~0.987)。临床决策曲线分析表明,列线图预测aSAH患者发生DVT在大范围阈值中均有较高的净收益。
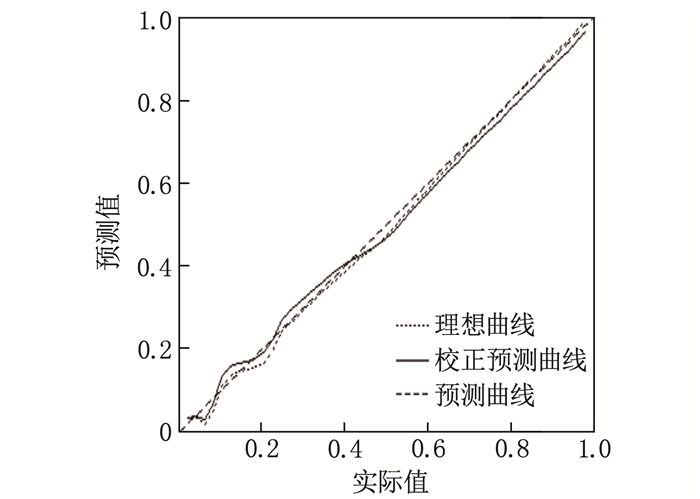
结论aSAH患者的年龄、Hunt-Hess分级、住院时间以及血浆纤维蛋白原水平是发生DVT的影响因素。本研究建立的预测aSAH后发生的DVT列线图模型具有良好的区分能力、校准度和临床应用价值,可以更好地识别高风险患者,便于为患者提供个性化的预防和治疗策略。
-
关键词:
- 脉瘤性蛛网膜下腔出血 /
- 深静脉血栓 /
- 风险预测模型 /
- 列线图 /
- 影响因素
Abstract:ObjectiveTo investigate the construction and application of a risk prediction model for deep vein thrombosis (DVT) in patients with aneurysmal subarachnoid hemorrhage (aSAH).
MethodsA total of 250 patients with aSAH were enrolled in this study and divided into DVT (n=45) and non-DVT groups (n=205) based on the occurrence of DVT. General information and routinelaboratory indicators were collected and compared between the two groups. Multivariate Logistic regression analysis was performed to identify risk factors for DVT in aSAH patients. A nomogram prediction model for DVT after aSAH was established and its discriminative ability was evaluated using the receiver operating characteristic (ROC) curve. The clinical utility of the nomogram was assessed by decision curve analysis.
ResultsStatistically significant differences were observed in age, history of hypertension, Glasgow Coma Scale (GCS) score, Hunt-Hess grade and length of hospital stay between the DVT and non-DVT groups (P < 0.05). The plasma fibrinogen level was significantly higher in the DVT group compared to the non-DVT group (P < 0.05), while no significant differences were found for other indicators (P>0.05). Multivariate Logistic regression analysis revealed that age, Hunt-Hess grade, length of hospital stay, and plasma fibrinogen level were influencing factors of the occurrence of DVT in aSAH patients(P < 0.05). ROC analysis showed that the nomogram exhibited good predictive performance in both the modeling and validation groups, with areas under the curve (AUCs) of 0.875 (95%CI, 0.802 to 0.948) and 0.872 (95%CI, 0.757 to 0.987), respectively. Decision curve analysis indicated that the nomogram provided a high net benefit for predicting DVT in aSAH patients across a wide range of threshold probabilities.
ConclusionAge, Hunt-Hess grade, length of hospital stay, and plasma fibrinogen level are influential factors for DVT in aSAH patients. The nomogram in predicting DVT after aSAH demonstrates good discriminative ability, calibration degree, and clinical application value. This model can better identify high-risk patients and provide individualized prevention and treatment strategies.
-
结直肠癌又称大肠癌,包括结肠癌和直肠癌,是消化道最常见的恶性肿瘤,具有较高的发病率和病死率。调查[1]显示,不良的生活习惯和不合理的饮食结构可能会破坏肠道微生物稳态,增加结直肠癌的发生风险。相关研究[2]称,淋巴结转移的发生可能会促进结直肠癌的复发,而20%~25%的结直肠癌患者可能在首次确诊时即被发现有转移。因此,有效控制淋巴结转移才能降低结直肠癌的复发风险。淋巴结转移过程可能与病灶及其周围血管生成有关,且新生血管是癌细胞转移的条件之一,故控制病灶及其周围血管生成可以有效抑制癌症发展[3]。研究[4-5]显示,血管内皮生长因子(VEGF)可促进血管生成,微血管密度(MVD)可对血管生成程度进行可视化观察,两者或可作为诊断血管生成的重要指标。此外,血管生成和癌细胞浸润迁移的微环境中还伴有一定的炎症反应,例如高迁移率蛋白族1(HMGB1)作为一种炎性介质可能也参与了血管生成过程。本研究观察结直肠癌患者癌组织中HMGB1、VEGF和MVD表达情况,并探讨HMGB1与VEGF、MVD的相关性,以期为临床诊治结直肠癌提供一定参考。
1. 对象与方法
1.1 研究对象
选择2020年1月—2021年11月唐山市协和医院收治的89例结直肠癌患者作为研究对象。纳入标准: ①经病理学检验确诊结肠癌或直肠癌者; ②参照《世界卫生组织消化系统肿瘤分类(2019年版)》[6], 肿瘤分型为腺癌者; ③参照美国癌症联合会TNM分期系统(第8版)[7], 癌症分期为ⅡB~ⅢC期者; ④预计生存期>1年,美国东部肿瘤协作组(ECOG)体力状况评分≤2分,卡氏功能状态评分(KPS)≥60分者; ⑤对本研究知情同意者。排除标准: ①有其他部位肿瘤史、肿瘤家族史者; ②近期接受结直肠癌系统性治疗者; ③近期服用影响免疫系统和凝血造血系统的药物者; ④有严重实质性组织器官功能损伤或凝血造血功能障碍者; ⑤合并认知障碍或精神性疾病者。
1.2 主要材料与仪器
HMGB1一抗为兔多克隆HMGB1抗体,购于上海碧云天生物技术有限公司,货号AF0180; VEGF一抗为鼠单克隆VEGF抗体, MVD可用CD34阳性表达情况表示, CD34一抗为鼠单克隆抗体,VEGF、CD34抗体均购于北京中杉金桥生物技术有限公司,货号分别为ZM-0265、ZM-0046。二抗、链霉亲和素-生物素复合物及显色剂为二步法通用试剂盒(小鼠/兔超敏聚合物法检测系统),购于北京中杉金桥生物技术有限公司,货号PV-8000D。牛血清白蛋白购于北京中杉金桥生物技术有限公司,货号ZLI-9027。主要仪器包括脱水机(型号EXCELSIORES, 赛默飞)、包埋机(型号Arcadia H,徕卡)、手动轮转式石蜡切片机(型号RM2245,徕卡)、展片机(型号ZPJ-IA, 爱华)、烤片机(型号KPJ-IA, 爱华)和生物显微镜(型号BX53, 奥林巴斯)。
1.3 组织染色方法
取结直肠癌患者手术切除的癌组织及癌旁组织,用10%中性甲醛固定,石蜡包埋,切成厚度为4 μm的多张切片。在同源组织切片中随机选取1张作为阴性对照,使用二甲苯和梯度乙醇(100%乙醇5 min, 100%乙醇5 min, 90%乙醇5 min, 80%乙醇3 min, 70%乙醇2 min)对所有切片进行脱蜡,用清水冲洗2次后,加入乙二胺四乙酸(EDTA)缓冲溶液(pH值8.0)中,高压锅修复抗原,暴露抗原位点,用磷酸盐缓冲溶液冲洗2次, 5 min/次,用免疫组化笔画出染色范围,使用牛血清白蛋白封闭切片中非特异性的抗原位点,加入一抗,阴性对照切片不加抗体,与其他阳性对照切片一同放置于4 ℃环境下过夜。切片用磷酸盐缓冲溶液冲洗3次, 5 min/次,加入二抗, 37 ℃下孵育30 min, 重复磷酸盐缓冲溶液冲洗操作,加入链霉亲和素-生物素复合物(用磷酸盐缓冲溶液稀释100倍),再重复磷酸盐缓冲溶液冲洗操作,加入显色剂,清水冲洗后用苏木素复染30 s, 最后与脱蜡过程相反操作逆浓度梯度脱水,用中性树胶封片。
1.4 染色观察方法
① HMGB1和VEGF的染色观察: HMGB1主要分布于细胞核, VEGF主要分布于细胞核和细胞质,染色程度可分为无色(0分)、淡棕色(1分)、棕色(2分)、棕褐色(3分),染色范围可分为<5%(0分)、5%~<20%(1分)、20%~<50%(2分)、≥50%(3分),阳性评分=染色程度评分+染色范围评分[8], 评分越高表示阳性程度越高。② MVD的染色观察: CD34分布于细胞质,细胞质内出现棕黄色颗粒即为阳性。先在低倍镜下寻找到新生血管最密集区,然后切换至200倍视野,选取5个视野,按照MVD计数标准(明显着色的单个内皮细胞或细胞丛,或管腔直径小于50 μm的管状结构,均计数为1条微血管)对微血管染色数目进行计数,取平均值作为该切片样本的MVD结果[9]。
1.5 统计学处理
采用SPSS 21.0统计学软件进行数据处理,符合正态分布的计量资料以(x±s)表示,比较采用独立样本t检验或配对t检验; 不符合正态分布的计量资料以[M(P25, P75)]表示,比较采用Mann-Whitney U检验或Wilcoxon检验; 计数资料以[n(%)]表示,采用χ2检验。利用受试者工作特征(ROC)曲线计算HMGB1、VEGF和MVD诊断结直肠癌淋巴结转移情况的最佳截断值,采用Pearson相关性分析探讨HMGB1与VEGF、MVD的相关性,并建立线性回归方程。P<0.05表示差异有统计学意义。
2. 结果
2.1 结直肠癌患者癌组织与癌旁组织中HMGB1、VEGF和MVD表达情况比较
根据是否发生淋巴结转移,将89例结直肠癌患者分为转移组32例和未转移组57例。2组患者癌组织中的HMGB1阳性评分、VEGF阳性评分和MVD均高于癌旁组织,差异有统计学意义(P<0.05); 转移组患者癌组织、癌旁组织中的HMGB1阳性评分、VEGF阳性评分和MVD均高于未转移组,差异有统计学意义(P<0.05)。见表 1。
表 1 2组患者癌组织与癌旁组织中HMGB1、VEGF和MVD表达情况比较(x±s)[M(P25, P75)]指标 转移组(n=32) 未转移组(n=57) 癌组织 癌旁组织 癌组织 癌旁组织 HMGB1阳性评分/分 5.00(5.00, 5.00)*# 4.00(4.00, 4.00)# 4.00(4.00, 4.00)* 2.00(2.00, 2.00) VEGF阳性评分/分 4.00(4.00, 4.00)*# 4.00(3.00, 4.00)# 3.00(3.00, 4.00)* 2.00(1.00, 2.00) MVD/(条/视野) 47.28±5.15*# 32.09±4.98# 21.40±6.28* 12.44±2.28 HMGB1: 高迁移率蛋白族1; VEGF: 血管内皮生长因子; MVD: 微血管密度。
与癌旁组织比较, *P<0.05; 与未转移组比较, #P<0.05。2.2 最佳截断值
ROC曲线结果显示,癌组织中HMGB1、VEGF和MVD诊断淋巴结转移的最佳截断值分别为阳性评分4.5分、阳性评分3.5分和平均每个200倍视野32.5条,即HMGB1阳性评分>4.5分、VEGF阳性评分>3.5分、MVD平均每个200倍视野>32.5条可视为高表达, HMGB1阳性评分≤4.5分、VEGF阳性评分≤3.5分、MVD平均每个200倍视野≤32.5条可视为低表达。见表 2。
表 2 癌组织中HMGB1、VEGF和MVD诊断结直肠癌患者淋巴结转移的最佳截断值指标 AUC P 约登指数 最佳截断值 HMGB1阳性评分/分 0.860 0.049 0.743 4.5 VEGF阳性评分/分 0.850 0.040 0.636 3.5 MVD/(条/视野) 0.971 0.018 0.853 32.5 HMGB1: 高迁移率蛋白族1; VEGF: 血管内皮生长因子;
MVD: 微血管密度。2.3 单因素分析
根据癌组织中VEGF阳性表达情况,将89例结直肠癌患者分为VEGF高表达组(阳性评分>3.5分)50例和VEGF低表达组(阳性评分≤3.5分)39例; 根据癌组织中MVD, 将89例结直肠癌患者分为MVD高表达组(平均每个200倍视野>32.5条)32例和MVD低表达组(平均每个200倍视野≤32.5条)57例。VEGF高表达组与VEGF低表达组、MVD高表达组与MVD低表达组在性别、年龄、体质量指数、病程、肿瘤最大直径、肿瘤部位、肿瘤分型方面比较,差异均无统计学意义(P>0.05); VEGF高表达组、MVD高表达组淋巴结转移者占比、HMGB1高表达者占比均分别高于VEGF低表达组、MVD低表达组,差异有统计学意义(P<0.05)。见表 3。
表 3 结直肠癌患者VEGF、MVD表达情况的单因素分析(x±s)[M(P25, P75)][n(%)]指标 分类 VEGF χ2/t/Z P MVD χ2/t/Z P 高表达组(n=50) 低表达组(n=39) 高表达组(n=32) 低表达组(n=57) 性别 男 32(64.00) 24(61.54) 0.057 0.811 20(62.50) 36(63.16) 0.004 0.951 女 18(36.00) 15(38.46) 12(37.50) 21(36.84) 年龄/岁 65.13±12.61 65.74±12.70 0.226 0.822 65.66±13.09 65.37±12.42 0.103 0.918 体质量指数/(kg/m2) 21.09±1.09 21.16±1.29 0.283 0.778 21.15±1.26 21.12±1.17 0.099 0.921 病程/年 5.00(4.00, 6.00) 5.00(4.00, 5.00) 0.194 0.846 5.00(4.00, 5.00) 5.00(4.00, 5.00) 1.147 0.251 肿瘤最大直径/cm 4.45±2.07 5.06±1.88 1.439 0.154 5.11±1.91 4.61±2.01 1.139 0.258 肿瘤部位 结肠 31(62.00) 18(46.15) 4.153 0.125 20(62.50) 29(50.88) 1.942 0.379 直肠 19(38.00) 19(48.72) 12(37.50) 26(45.61) 结肠+直肠 0 2(5.13) 0 2(3.51) 肿瘤分期 ⅡB~ⅡC期 16(32.00) 20(51.28) 3.382 0.066 11(34.38) 25(43.86) 0.765 0.382 ⅢA~ⅢC期 34(68.00) 19(48.72) 21(65.63) 32(56.14) 肿瘤分型 中分化腺癌 41(82.00) 31(79.49) 5.181 0.159 26(81.25) 46(80.70) 1.546 0.672 黏液腺癌 1(2.00) 4(10.26) 1(3.13) 4(7.02) 中分化腺癌+黏液腺癌 8(16.00) 3(7.69) 5(15.63) 6(10.53) 低分化腺癌 0 1(2.56) 0 1(1.75) 转移情况 转移 31(62.00) 1(2.56) 33.612 <0.001 29(90.63) 3(5.26) 64.851 <0.001 未转移 19(38.00) 38(97.44) 3(9.37) 54(94.74) HMGB1 高表达 27(54.00) 3(7.69) 21.026 <0.001 25(78.13) 5(8.77) 44.114 <0.001 低表达 23(46.00) 36(92.31) 7(21.88) 52(91.23) HMGB1: 高迁移率蛋白族1; VEGF: 血管内皮生长因子; MVD: 微血管密度。 2.4 癌组织中HMGB1与VEGF、MVD的相关性分析
相关性分析结果显示,结直肠癌患者癌组织中HMGB1阳性评分与VEGF阳性评分、MVD呈正相关(r=0.470、0.594, P<0.001)。
2.5 癌组织中HMGB1与VEGF、MVD的回归性分析
以癌组织中HMGB1阳性评分为因变量,以癌组织中VEGF阳性评分和MVD为自变量,分别建立癌组织中HMGB1与VEGF、MVD的线性回归方程。方程为yVEGF=2.459+0.516xHMGB1和yMVD=-17.365+13.502xHMGB1, 即HMGB1阳性评分每增加1分, VEGF阳性评分将增加0.516分, MVD将增加13.502条/视野。见表 4。
表 4 结直肠癌患者癌组织中HMGB1与VEGF、MVD的回归性分析模型 Durbin-Watson统计量 调整后R2 未标准化回归系数 标准误 标准化回归系数 t P VEGF 常量 1.302 0.212 2.459 0.380 — 6.472 <0.001 HMGB1 0.516 0.104 0.470 4.965 <0.001 MVD 常量 0.615 0.345 -17.365 7.167 — 2.423 0.017 HMGB1 13.502 1.962 0.594 6.882 <0.001 HMGB1: 高迁移率蛋白族1; VEGF: 血管内皮生长因子; MVD: 微血管密度。 3. 讨论
结直肠癌淋巴结转移可能导致肿瘤发展或疾病复发,其转移过程伴随着血管生成和炎性反应[10]。HMGB1是一种结构相对保守的核蛋白,在炎症反应中发挥促炎性介质的作用,其还可作为一种促血管生成因子,促进新血管生成。相关研究[11]称,结直肠癌患者癌组织中HMGB1升高会激活内皮细胞VEGF, 从而促进血管生成。另有研究[12]报道,高浓度HMGB1对缺血性疾病实验动物模型具有较好的治疗效果,提示HMGB1可以刺激内皮细胞释放VEGF等血管生成因子,并增强内皮细胞增殖和迁移能力,有效促进动脉血管生成。内皮细胞是血管内壁的主要结构,在血管生成和淋巴结转移中发挥重要作用[13]。癌症患者体内HMGB1过表达可能活化病灶及其周围内皮细胞,导致周围血管生成和淋巴结转移。
本研究结果显示,转移组患者癌组织与癌旁组织中的HMGB1阳性评分、VEGF阳性评分和MVD均高于未转移组,且转移组、未转移组患者癌组织中的HMGB1阳性评分、VEGF阳性评分和MVD均高于癌旁组织,差异有统计学意义(P<0.05)。分析可能原因,癌细胞在原发灶增殖后进入淋巴管和血管中,附着于内皮细胞游走至近端或远端,实现淋巴结转移,同时癌细胞具有较强的营养掠夺能力和侵袭能力,而新血管生成能在一定程度上增加癌细胞增殖分化所需的营养供给。
本研究中, ROC曲线分析结果显示,癌组织中HMGB1、VEGF和MVD诊断淋巴结转移的最佳截断值分别为阳性评分4.5分、阳性评分3.5分和平均每个200倍视野32.5条; VEGF高表达组、MVD高表达组淋巴结转移者占比、HMGB1高表达者占比均分别高于VEGF低表达组、MVD低表达组,差异有统计学意义(P<0.05); 癌组织中HMGB1阳性评分与VEGF阳性评分、MVD呈正相关,线性回归方程为yVEGF=2.459+0.516xHMGB1和yMVD=-17.365+13.502xHMGB1。HMGB1与血管生成相关指标VEGF、MVD均显著相关,进一步说明HMGB1表达可能影响结直肠癌患者病灶及其周围新血管的生成,促进淋巴结转移。HMGB1在胞外能激活细胞外信号调节激酶和信号通路,促进内皮细胞生长、增殖和新血管生成,在胞内能与内皮细胞溶酶体融合,诱导内皮糖蛋白释放而推动细胞增殖,促进血管生成。血管生成情况可用MVD值进行量化[14], MVD较高的恶性肿瘤患者癌组织中HMGB1呈高表达,其中结直肠癌患者体内HMGB1和VEGF均呈高表达状态。VEGF具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移与增殖和血管形成等作用,而HMGB1具有一定程度的促血管生成作用,这类促血管生成因子可促进结直肠癌病灶及其周围血管生成,增加淋巴结转移的发生风险。另外,随着炎症与免疫环境的失衡,结直肠癌肿瘤间质中出现活化M2型巨噬细胞,该类型细胞活化可能会诱导癌组织周围正常细胞发生上皮间质转化,促进癌细胞侵袭、浸润和肿瘤血管生成。恶性肿瘤动物模型研究[15]显示, HMGB1过表达会诱导巨噬细胞从M1型转化为M2型,而后者也会释放HMGB1, 进一步加剧炎症反应。同时,过度炎症反应还会诱导内皮细胞释放VEGF等促血管生成因子,进一步促进血管生成。因此, HMGB1过表达可能促进炎症反应,加速血管生成,推动淋巴结转移。
综上所述,结直肠癌患者癌组织中HMGB1、VEGF、MVD均呈高表达状态,且HMGB1表达与VEGF、MVD显著相关。临床医师通过HMGB1检测结果可在一定程度上评估结直肠癌患者肿瘤部位血管新生情况,可有效预防淋巴结转移。
-
表 1 2组患者一般资料比较(x±s)[n(%)]
一般资料 DVT组(n=45) 非DVT组(n=205) χ2t/ P 年龄/岁 63.2±5.8 54.2±8.9 8.467 < 0.001 性别 0.011 0.916 男 23(51.1) 103(50.2) 女 22(48.9) 102(49.8) 体质量指数/(kg/m2) 23.5±2.2 23.8±2.4 0.960 0.338 入院收缩压/mmHg 145.2±15.5 147.4±17.2 0.814 0.417 入院舒张压/mmHg 88.4±7.7 89.1±8.4 0.512 0.609 高血压 28(62.2) 83(40.5) 7.061 0.008 糖尿病 5(11.1) 24(11.7) 0.013 0.910 高脂血症 4(8.9) 21(10.2) 0.075 0.784 冠心病 3(6.7) 18(8.8) 0.214 0.643 饮酒史 16(35.6) 78(38.1) 0.098 0.755 吸烟史 20(44.4) 81(39.5) 0.373 0.542 格拉斯哥昏迷量表评分/分 13.2±2.7 10.2±2.1 6.929 < 0.001 Hunt-Hess分级 101.097 < 0.001 Ⅰ级 4(8.9) 55(26.8) Ⅱ级 11(24.4) 127(62.0) Ⅲ级 9(20.0) 21(10.2) Ⅳ级 21(46.7) 2(1.0) 住院时间/d 24.3±8.0 13.5±6.2 8.397 < 0.001 1 mmHg=0.133 kPa。 表 2 2组患者常规实验室指标比较(x±s)
指标 DVT组(n=45) 非DVT组(n=205) t/χ2 P 白细胞计数/(×109/L) 23.2±4.3 24.1±5.0 1.118 0.265 红细胞计数/(×1012/L) 4.5±1.5 4.6±1.7 0.253 0.801 血红蛋白/(g/L) 136.7±15.2 137.1±14.4 0.180 0.857 血小板计数/(×109/L) 214.1±30.9 218.3±31.6 0.807 0.420 甘油三酯/(mmol/L) 1.3±0.3 1.3±0.4 0.536 0.593 总胆固醇/(mmol/L) 4.5±0.9 4.5±0.9 0.266 0.791 低密度脂蛋白胆固醇/(mmol/L) 3.1±0.5 3.0±0.6 0.661 0.509 高密度脂蛋白胆固醇/(mmol/L) 1.5±0.3 1.5±0.3 0.797 0.426 血糖/(mmol/L) 5.6±1.1 5.5±1.2 0.785 0.433 肌酐/(mmol/L) 52.9±10.8 53.0±11.5 0.069 0.945 血浆纤维蛋白原/(g/L) 4.5±1.8 2.5±1.5 7.624 < 0.001 表 3 Logistic回归分析aSAH患者发生DVT的影响因素
变量 赋值 β SE Wald OR 95%CI P 年龄 实测值 0.883 0.217 16.558 2.418 1.580~3.700 < 0.001 高血压 0=无, 1=有 0.634 0.363 3.050 1.885 0.925~3.840 0.081 GCS评分 实测值 0.581 0.299 3.776 1.788 0.995~3.212 0.052 Hunt-Hess分级 0=Ⅰ级, 1=Ⅱ级, 2=Ⅲ级, 3=Ⅳ级 1.352 0.357 14.342 3.865 1.920~7.781 5 < 0.001 住院时间 实测值 1.021 0.289 12.481 2.776 1.575~4.891 < 0.001 血浆纤维蛋白原 实测值 0.905 0.262 11.931 2.472 1.479~4.131 < 0.001 -
[1] CHUNG D Y, ABDALKADER M, NGUYEN T N. Aneurysmal subarachnoid hemorrhage[J]. Neurol Clin, 2021, 39(2): 419-442. doi: 10.1016/j.ncl.2021.02.006
[2] NEIFERT S N, CHAPMAN E K, MARTINI M L, et al. Aneurysmal subarachnoid hemorrhage: the last decade[J]. Transl Stroke Res, 2021, 12(3): 428-446. doi: 10.1007/s12975-020-00867-0
[3] TAWK R G, HASAN T F, D'SOUZA C E, et al. Diagnosis and treatment of unruptured intracranial aneurysms and aneurysmal subarachnoid hemorrhage[J]. Mayo Clin Proc, 2021, 96(7): 1970-2000. doi: 10.1016/j.mayocp.2021.01.005
[4] ADDEPALLI A, BENTON J, ZHU S Y, et al. Risk of ipsilateral deep vein thrombosis after use of AngioSeal closure device in aneurysmal subarachnoid hemorrhage patients[J]. World Neurosurg, 2020, 134: e162-e165. doi: 10.1016/j.wneu.2019.09.170
[5] KOLE M J, WESSELL A P, UGILIWENEZA B, et al. Low-dose intravenous heparin infusion after aneurysmal subarachnoid hemorrhage is associated with decreased risk of delayed neurological deficit and cerebral infarction[J]. Neurosurgery, 2021, 88(3): 523-530. doi: 10.1093/neuros/nyaa473
[6] CRONIN M, DENGLER N, KRAUSS E S, et al. Completion of the updated caprini risk assessment model (2013 version)[J]. Clin Appl Thromb Hemost, 2019, 25: 1076029619838052. doi: 10.1177/1076029619838052
[7] WANG Y, SHI Y, DONG Y, et al. Clinical risk factors of asymptomatic deep venous thrombosis in patients with acute stroke[J]. Clin Appl Thromb Hemost, 2019, 25: 1076029619868534. doi: 10.1177/1076029619868534
[8] HOH B L, KO N U, AMIN-HANJANI S, et al. 2023 guideline for the management of patients with aneurysmal subarachnoid hemorrhage: a guideline from the American heart association/american stroke association[J]. Stroke, 2023, 54(7): e314-e370.
[9] 中华医学会外科学分会血管外科学组. 深静脉血栓形成的诊断和治疗指南(第三版)[J]. 中国血管外科杂志: 电子版, 2017, 9(4): 250-257. doi: 10.3969/j.issn.1674-7429.2017.04.003 [10] YANG X L, CAO L, ZHANG T T, et al. More is less: effect of ICF-based early progressive mobilization on severe aneurysmal subarachnoid hemorrhage in the NICU[J]. Front Neurol, 2022, 13: 951071. doi: 10.3389/fneur.2022.951071
[11] KILGORE C B, NAIR S K, RAN K R, et al. Venous thromboembolism in aneurysmal subarachnoid hemorrhage: risk factors and timing of chemoprophylaxis[J]. Clin Neurol Neurosurg, 2023, 231: 107822. doi: 10.1016/j.clineuro.2023.107822
[12] YUAN Y, CHEN J J, ZHANG Y X, et al. Exploration of risk factors for poor prognosis of non-traumatic non-aneurysmal subarachnoid hemorrhage[J]. Biomolecules, 2022, 12(7): 948. doi: 10.3390/biom12070948
[13] KONAR S, FLOREZ-PERDOMO W, GARCIA-BALLESTAS E, et al. Blood pressure variability and prognosis in aneurysmal subarachnoid hemorrhage: a systematic review and meta-analysis[J]. J Neurosurg Sci, 2023, 67(1): 10-17.
[14] SUNG P H, CHIANG H J, YANG Y H, et al. Nationwide study on the risk of unprovoked venous thromboembolism in non-traumatic osteonecrosis of femoral head[J]. Int Orthop, 2018, 42(7): 1469-1478. doi: 10.1007/s00264-018-3866-2
[15] FURIO E, GARCÍA-FUSTER M J, REDON J, et al. CX3CR1/CX3CL1 axis mediates platelet-leukocyte adhesion to arterial endothelium in younger patients with a history of idiopathic deep vein thrombosis[J]. Thromb Haemost, 2018, 118(3): 562-571. doi: 10.1055/s-0038-1629897
[16] CAI W X, ZHANG R, WANG Y J, et al. Predictors and outcomes of deep venous thrombosis in patients with acute ischemic stroke: results from the Chinese Stroke Center Alliance[J]. Int Angiol, 2023, 42(6): 503-511.
[17] GERALDINI F, CASSAI A D, CORREALE C, et al. Predictors of deep-vein thrombosis in subarachnoid hemorrhage: a retrospective analysis[J]. Acta Neurochir, 2020, 162(9): 2295-2301. doi: 10.1007/s00701-020-04455-x
[18] DU Y Q, TANG J, ZHANG Z X, et al. Correlation of interleukin-18 and high-sensitivity C-reactive protein with perioperative deep vein thrombosis in patients with ankle fracture[J]. Ann Vasc Surg, 2019, 54: 282-289. doi: 10.1016/j.avsg.2018.06.013
[19] 盛昌, 贺爱兰, 万凌燕, 等. 普通外科恶性肿瘤患者术后下肢深静脉血栓形成预测模型的构建[J]. 中国普通外科杂志, 2023, 32(6): 850-858. [20] SHRESTHA R, RAYAMAJHI S, SHRESTHA S, et al. Peripheral leukocytosis and clinical outcomes after aneurysmal subarachnoid hemorrhage[J]. Cureus, 2022, 14(7): e26778.
[21] 姬培培, 伍艳春, 张庆英, 等. 动脉瘤性蛛网膜下腔出血手术治疗后患者的不良预后因素评估[J]. 中国医药, 2021, 16(12): 1813-1817. [22] ZHANG Z Y, ZHAO Y, LIU Y B, et al. Effect of stress-induced hyperglycemia after non-traumatic non-aneurysmal subarachnoid hemorrhage on clinical complications and functional outcomes[J]. CNS Neurosci Ther, 2022, 28(6): 942-952. doi: 10.1111/cns.13826
-
期刊类型引用(1)
1. 赵得堡,孙星,刘越,屈中玉. 肝细胞癌患者血清PTPN3、VEGF、IRX5、HOTAIR的表达水平及其与病理特征和预后的相关性. 海南医学. 2024(15): 2200-2205 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号
