Relationships of expression of high mobility group box 1 protein and toll-like receptor 4 in patients with clinical characteristics of refractory epilepsy and their predictive value
-
摘要:目的
探讨高迁移率族蛋白B1(HMGB1)、Toll样受体4(TLR4)表达与难治性癫痫患者临床特征相关性以及预测价值。
方法回顾性分析84例难治性癫痫患者临床资料并将其纳入观察组。同期选择35例行颅内减压术的高颅内压患者作为对照组。采用免疫组织化学法检测HMGB1、TLR4表达情况,采用尼氏染色法观察组织形态,同时分析相关实验结果。
结果观察组HMGB1和TLR4表达高于对照组,差异有统计学意义(P < 0.05)。观察组HMGB1、TLR4蛋白条带的光密度值与内参β-actin条带光密度值高于对照组,差异有统计学意义(P < 0.05)。TLR4表达强度与癫痫发作频率、发作持续时间、病程、发作类型有关,而HMGB1表达强度与癫痫发作频率、发作持续时间、病程有关。病灶组织中, TLR4表达与HMGB1的表达呈正相关,提示两者存在协同作用。受试者工作特征(ROC)曲线分析显示, TLR4蛋白、HMGB1蛋白预测难治性癫痫的曲线下面积(AUC)分别为0.888、0.923。
结论HMGB1、TLR4在难治性癫痫患者病灶中呈高表达,且两者表达强度呈正相关,能够在一定程度上预测疾病发生、发展情况,为难治性癫痫的诊疗提供了新的生物标志物。
Abstract:ObjectiveTo investigate the correlations of the expression of high mobility group box 1 protein (HMGB1) and toll-like receptor 4 (TLR4) with the clinical characteristics of patients with refractory epilepsy, as well as their predictive value.
MethodsA retrospective analysis was conducted on the clinical data of 84 patients with refractory epilepsy, and they were included in observation group. During the same period, 35 patients with intracranial hypertension undergoing craniectomy for decompression were selected as control group. Immunohistochemistry was used to detect the expressions of HMGB1 and TLR4, while Nissl staining was applied to observe tissue morphology. The relevant experimental results were analyzed simultaneously.
ResultsThe expression levels of HMGB1 and TLR4 in the observation group were significantly higher than those in the control group (P < 0.05). The optical density values of HMGB1 and TLR4 protein bands as well as internal reference β-actin bands in the observation group were significantly higher than those of the control group (P < 0.05). The intensity of TLR4 expression was correlated with seizure frequency, seizure duration, disease duration, and seizure type, while the intensity of HMGB1 expression was correlated with seizure frequency, seizure duration, and disease duration. In the lesion tissues, the expression of TLR4 was positively correlated with the expression of HMGB1, suggesting a synergistic effect between them. Receiver Operating Characteristic (ROC) curve analysis revealed that the areas under the curve (AUCs) for TLR4 and HMGB1 proteins in predicting refractory epilepsy were 0.888 and 0.923, respectively.
ConclusionHMGB1 and TLR4 are highly expressed in the lesions of patients with refractory epilepsy, and their expression intensities are positively correlated. They can predict the occurrence and development of the disease to a certain extent, providing new biomarkers for the diagnosis and treatment of refractory epilepsy.
-
难治性癫痫是一种常见的神经系统疾病,治疗以手术切除术最为普遍,但术后仍有部分患者未能有效控制癫痫发作[1-2]。准确预测难治性癫痫的发生与发展对于指导临床治疗至关重要。研究[3]指出,高迁移率族蛋白1(HMGB1)、Toll样受体4(TLR4)可能与难治性癫痫的发病机制及进展存在关联。HMGB1作为一种核蛋白,在感染、组织损伤及炎症等病理条件下,可从细胞核释放至胞外,参与炎症反应及免疫应答。TLR4是与免疫系统紧密关联的受体[4], 其异常活化可诱发神经元损伤及炎症反应。通过监测HMGB1与TLR4的表达水平,临床医生能更精准地评估患者手术适应证及预后。然而,关于HMGB1与TLR4在难治性癫痫患者病灶中的具体表达及其与疾病进展关系的研究尚不充分,且结果间存在差异。本研究探讨HMGB1及TLR4与难治性癫痫患者临床特征的相关性及其预测价值,以期深入理解2种生物标志物的作用机制,并为临床诊疗提供更加精准的指导。
1. 资料与方法
1.1 一般资料
回顾性分析2020年3月—2023年3月收治的84例难治性癫痫患者临床资料,并将其纳入观察组。84例患者中,男56例,女28例; 平均年龄(60.67±4.78)岁; 癫痫发作频率(2.13±0.12)次/周,发作持续时间(5.23±2.12) min; 病程2~19个月,平均(10.24±3.14)个月; 发作类型为全面性强直阵挛31例,非全面性强直阵挛53例。此外,选择同期35例行颅内减压术的高颅内压患者作为对照组。所有标本均在取出后30 min内储存于冰箱内。观察组纳入标准: ①术前均进行头皮视频脑电图与术中皮层脑电图检查,确诊为难治性癫痫者; ②符合国际抗癫痫联盟所制定的难治性癫痫标准[5]者; ③临床资料齐全者; ④首次手术,且无神经系统肿瘤病史和感染系统病史者。对照组纳入标准: ①同期进行颞叶切除、大骨瓣减压的重型颅脑损伤者; ②无神经系统肿瘤史、癫痫病史、感染性疾病者; ③临床资料齐全者。排除并发心血管疾病和恶性肿瘤者。
1.2 方法
观察组术中打开硬脑膜,取得麻醉师配合,减少麻醉药物剂量,采用皮层脑电检测仪器进行脑电监测,脑电图出现异常部位即致病灶脑组织,需手术切除,将病理标本留取足够的前提下,取直径为1 cm白质、灰质的脑组织标本各3份。对照组术中留取灰质、白质非功能区正常脑组织标本各3份,保存于冰箱(-20 ℃)中冷冻待测。
标本包埋后行连续切片,厚度为3 μm, 置于防脱剂预处理后的载玻璃片上,滴加比例为1∶ 20的HMGB1及TLR4单克隆抗体4 ℃过夜。磷酸盐缓冲液(PBS)清洗后,滴加生物素,且标记二抗羊抗兔免疫球蛋白G(IgG), 室温孵育20 min, 采用PBS清洗。首先,取出组织后需立即用乙醇、Carnoy固定液或中性福尔马林溶液进行固定。随后,制作7~10 μm的石蜡切片并脱蜡。采用碱性染料如焦油紫或甲苯胺蓝染色25~50 min, 使尼氏体着色。之后,采用乙醇分化并用梯度乙醇脱水。最后,滴入二甲苯使切片透明,中性树胶封固后,即可在显微镜下观察神经元的尼氏体结构。需要注意的是,尼氏体在离体后易溶解,因此需及时固定组织。完成染色的标本应存放在避光处,以防褪色。加辣根过氧化物酶标记链美卵白素工作液,在室温下孵育15 min, DAB显色剂给予显色、冲洗,苏木精复染,常规乙醇脱水,二甲苯透明,中性树胶封片后在显微镜下观察, PBS液替代一抗染色作为阴性对照。尼氏染色法具体如下: 首先,取出组织后需立即用乙醇、Carnoy固定液或中性福尔马林溶液进行固定。随后,制作7~10 μm的石蜡切片并脱蜡。采用碱性染料如焦油紫或甲苯胺蓝染色25~50 min, 使尼氏体着色。之后,用乙醇分化并用梯度乙醇脱水。最后,二甲苯使切片透明,中性树胶封固后,即可在显微镜下观察神经元的尼氏体结构。完成染色的标本应存放在避光处,以防褪色。蛋白表达标准: 无染色细胞以0分表示; 阳性细胞占比不足25%以1分表示; 阳性细胞占比为25%~50%以2分表示; 阳性细胞占比>50%~75%以3分表示; 阳性细胞占比>75%~100%以4分表示。染色强度以细胞染色深度进行评分,无染色以0分表示; 浅棕色以1分表示; 深棕色以2分表示。采用半定量积分法,将2项指标评分乘积作为最终得分, 0分为阴性(-); 1~4分为低表达(+); 5~8分为高表达(++)。
1.3 统计学处理
采用SPSS 21.0统计学软件处理数据,计数资料以[n(%)]表示,行χ2检验,经Spearman法分析TLR4表达与HMGB1表达的相关性; 计量资料采用(x±s)表示,行t检验, TLR4蛋白、HMGB1蛋白预测效能均采用受试者工作特征(ROC)曲线进行分析,以α=0.05为检验水准, P < 0.05为差异有统计学意义。
2. 结果
2.1 2组HMGB1、TLR4表达情况比较
观察组HMGB1、TLR4阳性颗粒表达较多,且多集中在胞膜上; 对照组阳性颗粒表达少。观察组HMGB1、TLR4阳性表达水平高于对照组,差异有统计学意义(P < 0.05), 见表 1。
表 1 2组HMGB1、TLR4表达情况比较[n(%)]组别 n HMGB1表达情况 TLR4表达情况 阳性 阴性 阳性 阴性 观察组 84 73(86.90)* 11(13.10) 71(84.52)* 13(15.48) 对照组 35 15(42.86) 20(57.14) 8(22.86) 27(77.14) HMGB1: 高迁移率族蛋白B1; TLR4: Toll样受体4。与对照组比较, * P < 0.05。 2.2 Spearman相关性分析
病灶组织中, TLR4与HMGB1表达呈正相关,提示两者存在协同作用,见表 2。
表 2 TLR4与HMGB1在难治性癫痫患者病灶组织中表达的相关性例 HMGB1表达情况 n TLR4表达情况 - + ++ n 84 13 38 33 - 11 9 2 0 + 40 2 25 13 ++ 33 2 11 20 2.3 2组HMGB1、TLR4蛋白水平比较
蛋白印迹法结果表明,观察组HMGB1、TLR4蛋白条带的光密度值与内参β-actin条带光密度值高于对照组,差异有统计学意义(P < 0.05), 见表 3。
表 3 2组HMGB1、TLR4蛋白相对含量比较(x±s)组别 n TLR4/β-actin HMGB1/β-actin 观察组 84 0.35±0.12* 1.35±0.30* 对照组 35 0.21±0.01 0.92±0.19 与对照组比较, * P < 0.05。 2.4 临床因素与病灶组织中TLR4表达的关系
TLR4表达强度与年龄、性别无关,与癫痫发作频率、发作持续时间、病程、癫痫发作类型有关(P < 0.05), 见表 4。
表 4 临床因素与病灶组织中TLR4表达的关系分析[n(%)]临床因素 分类 TLR4表达 χ2 P 阳性(n=71) 阴性(n=13) 性别 男 49(69.01) 7(53.85) 1.138 0.286 女 22(30.99) 6(40.15) 癫痫病程 ≤10年 20(28.17) 10(76.92) 11.376 < 0.001 >10年 51(71.83) 3(23.08) 年龄 < 60岁 38(53.52) 7(53.85) 0.001 0.983 ≥60岁 33(46.48) 6(46.15) 癫痫发作频率 ≤1次/周 39(54.93) 12(92.31) 6.436 0.011 >1次/周 32(45.07) 1(7.69) 癫痫发作持续时间 ≤5 min 34(47.89) 11(84.62) 5.959 0.015 >5 min 37(52.11) 2(15.38) 癫痫发作类型 全面性强直阵挛发作 30(42.25) 1(7.69) 5.637 0.018 非全面性强直阵挛发作 41(57.75) 12(92.31) 2.5 临床因素与病灶组织中HMGB1表达关系的分析
HMGB1表达强度与年龄、性别、癫痫发作类型无关,与癫痫发作频率、发作持续时间、病程有关(P < 0.05), 见表 5。
表 5 临床各因素与病灶组织中HMGB1表达的关系分析[n(%)]临床因素 分类 HMGB1表达 χ2 P 阳性(n=73) 阴性(n=11) 性别 男 47(64.38) 9(81.82) 1.308 0.253 女 26(35.62) 2(18.18) 癫痫病程 ≤10年 20(27.40) 10(90.91) 16.795 < 0.001 >10年 53(72.60) 1(9.09) 年龄 < 60岁 41(56.16) 4(36.36) 1.507 0.220 ≥60岁 32(43.84) 7(63.64) 癫痫发作频率 ≤1次/周 40(54.79) 11(100.00) 8.190 0.004 >1次/周 33(45.21) 0 癫痫发作持续时间 ≤5 min 35(47.95) 10(90.91) 7.095 0.008 >5 min 38(52.05) 1(9.09) 癫痫发作类型 全面性强直阵挛发作 29(39.73) 2(18.18) 1.906 0.167 非全面性强直阵挛发作 44(60.27) 9(81.82) 2.6 ROC曲线分析
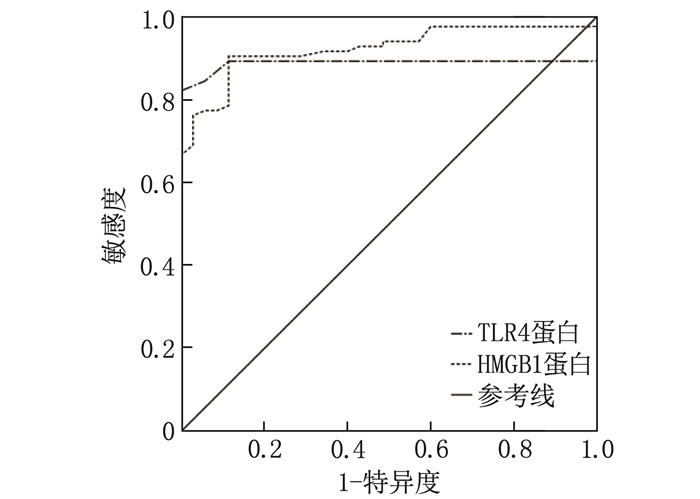
ROC曲线分析结果显示, TLR4蛋白、HMGB1蛋白预测难治性癫痫的曲线下面积分别为0.888、0.923, 见表 6、图 1。
表 6 TLR4、HMGB1预测难治性癫痫患者的效能分析变量 曲线下面积 SE P 95%CI Cut-off 约登指数 敏感度/% 特异度/% TLR4蛋白 0.888 0.034 < 0.001 0.822~0.954 0.25 0.821 82.1 100.0 HMGB1蛋白 0.923 0.025 < 0.001 0.875~0.971 1.13 0.791 90.5 88.6 3. 讨论
癫痫是一种神经系统疾病,具体症状包括短暂意识丧失、肢体抽搐及口唇咀嚼动作等。难治性癫痫是指经药物治疗后仍无法得到有效控制的癫痫发作[6], 发作频率高,持续时间长,对患者日常生活及工作能力造成显著影响。致病灶切除术作为一种手术治疗手段[7-8], 旨在通过切除或消除引发癫痫发作的特定致病灶达到控制癫痫发作的目的。此手术方法通常适用于那些药物治疗无效的患者。切除致病灶可有效减少或消除异常神经元活动,从而实现对癫痫发作的控制。评估致病灶切除术的远期疗效至关重要。鉴于难治性癫痫的复杂性,在选择手术治疗方案时,必须全面考量患者的个体差异、手术潜在风险及预期预后效果。了解远期效果可以帮助医生和患者更好地决策是否进行手术,以及对手术后的预后进行预测和管理。
HMGB1是一种核蛋白[9], 在损伤及炎症反应中发挥关键作用。该蛋白能从细胞核释放至细胞外,参与炎症反应及免疫应答过程。癫痫发作时, HMGB1的表达水平上升,可见其与神经元的损伤及炎症反应紧密相关。TLR4则是与免疫系统紧密关联的受体[10],其过度活化可加剧神经元的损伤与炎症反应。在难治性癫痫患者中, TLR4的表达水平亦显著增加。本研究发现,观察组HMGB1与TLR4的阳性表达较对照组更显著,表明难治性癫痫患者中的2种蛋白的表达水平较高。HMGB1作为促炎细胞因子,在炎症反应中扮演重要角色。难治性癫痫患者可能经历更为复杂且持久的神经炎症反应,从而导致HMGB1表达水平上升。相比之下,高颅内压患者多为颅内损伤或脑出血等急性疾病所致,其病理生理过程并不以持久的神经炎症反应为主要特征。难治性癫痫患者可能伴有免疫系统的异常活化,进而促使TLR4表达增加,而高颅内压患者的病理生理改变主要源于颅内压力增高,并非直接关联于免疫系统的异常激活。本研究还观察到观察组HMGB1与TLR4的阳性颗粒多集中于胞膜上,提示2种蛋白可能与胞膜相关的信号通路存在关联,并可能参与免疫炎症反应及神经元损伤的过程。
HMGB1和TLR4的高表达通常与细胞损伤、炎症反应和免疫系统异常激活相关[11-12], 通过评价其相对含量,可以反映炎症状态的程度和激活程度。本研究显示,观察组HMGB1和TLR4蛋白条带、β-actin蛋白条带光密度值高于对照组,说明难治性癫痫患者的细胞可能受到了损伤或炎症刺激,导致HMGB1和TLR4释放和表达增高,同时β-actin表达亦有所增加。可能原因是HMGB1作为一种促炎分子,可以在神经系统损伤或炎症过程中释放。难治性癫痫可能伴随着慢性炎症反应的增强,导致HMGB1的释放和表达增加。β-actin是一个结构蛋白[13], 在细胞骨架的形成和维持中起到重要作用。难治性癫痫患者可能存在细胞代谢异常,导致β-actin表达水平改变。
TLR4作为免疫系统中的重要受体,参与病原体识别与免疫调节,其表达强度受多种因素的影响。本研究中,癫痫发作频率、发作持续时间、病程和发作类型与TLR4的表达强度存在显著相关性。具体机制分析如下: ①免疫激活。癫痫发作触发神经元剧烈活动与异常放电,可能诱发免疫系统响应。免疫细胞及因子的释放入脑组织,进而促进TLR4表达上调。此免疫激活过程与癫痫的发作频率、持续时间及病程密切相关。②炎症反应。癫痫发作与神经炎症反应密切相关。免疫细胞激活释放的细胞因子与趋化因子等炎性介质,能调节TLR4表达。不同癫痫发作类型可能伴随特异性炎症过程,从而对TLR4表达产生差异化影响。③神经元损伤与修复。癫痫发作可致神经元损伤乃至细胞死亡[14], 激活神经元修复机制。TLR4在神经系统具有修复与再生潜力[15],参与调控神经元生长与修复。因此,癫痫的发作频率、持续时间和病程可能会影响神经元的损伤和修复过程,从而影响TLR4的表达,但确切的机制仍然需要进一步的研究深入探讨TLR4表达与癫痫的关系。
HMGB1的表达强度受到多种因素的影响。本研究显示, HMGB1表达强度与年龄、性别无关,但与癫痫发作频率、发作持续时间和病程有关。具体原因为: ①炎症反应。癫痫发作时,大脑神经元活动异常,并且产生炎症反应。HMGB1在炎症过程中起到促炎作用,可以激活免疫细胞,增强炎性细胞因子的释放,进而导致炎症反应的加剧。②神经元损伤。癫痫发作会导致神经元的损伤和细胞死亡。HMGB1能够通过与其他细胞外分子结合,促进炎症细胞的迁移和活化,导致细胞死亡进程的加剧。③免疫调节。HMGB1在免疫调节中起重要作用,可以影响免疫细胞的活化、迁移和细胞因子的产生。在癫痫中,免疫系统的异常活化与疾病的发展相关。HMGB1可能通过调节免疫反应进一步影响癫痫的发作频率、持续时间和病程。
本研究结果显示, TLR4蛋白和HMGB1蛋白在预测难治性癫痫方面具有较高的准确度,表明TLR4蛋白和HMGB1蛋白在难治性癫痫的发生、发展过程中扮演重要角色,主要原因可能为TLR4蛋白和HMGB1蛋白的曲线下面积值表明其在预测疾病发生、发展时具有很高的准确性,具体机制需要进一步研究来验证和阐明。本研究创新点与创新价值在于揭示了HMGB1和TLR4在难治性癫痫中的重要角色,为理解难治性癫痫患者提供了新视角,为疾病的诊疗提供了一定参考依据,以更准确地判断病情,制订更有效的治疗方案。
综上所述, HMGB1、TLR4在难治性癫痫患者致痫病灶组织中呈高表达,且两者表达强度呈正相关,能够在一定程度上预测疾病发生、发展。本研究选取的样本量有限,后续应扩大样本量进行更深入的研究。
-
表 1 2组HMGB1、TLR4表达情况比较[n(%)]
组别 n HMGB1表达情况 TLR4表达情况 阳性 阴性 阳性 阴性 观察组 84 73(86.90)* 11(13.10) 71(84.52)* 13(15.48) 对照组 35 15(42.86) 20(57.14) 8(22.86) 27(77.14) HMGB1: 高迁移率族蛋白B1; TLR4: Toll样受体4。与对照组比较, * P < 0.05。 表 2 TLR4与HMGB1在难治性癫痫患者病灶组织中表达的相关性
例 HMGB1表达情况 n TLR4表达情况 - + ++ n 84 13 38 33 - 11 9 2 0 + 40 2 25 13 ++ 33 2 11 20 表 3 2组HMGB1、TLR4蛋白相对含量比较(x±s)
组别 n TLR4/β-actin HMGB1/β-actin 观察组 84 0.35±0.12* 1.35±0.30* 对照组 35 0.21±0.01 0.92±0.19 与对照组比较, * P < 0.05。 表 4 临床因素与病灶组织中TLR4表达的关系分析[n(%)]
临床因素 分类 TLR4表达 χ2 P 阳性(n=71) 阴性(n=13) 性别 男 49(69.01) 7(53.85) 1.138 0.286 女 22(30.99) 6(40.15) 癫痫病程 ≤10年 20(28.17) 10(76.92) 11.376 < 0.001 >10年 51(71.83) 3(23.08) 年龄 < 60岁 38(53.52) 7(53.85) 0.001 0.983 ≥60岁 33(46.48) 6(46.15) 癫痫发作频率 ≤1次/周 39(54.93) 12(92.31) 6.436 0.011 >1次/周 32(45.07) 1(7.69) 癫痫发作持续时间 ≤5 min 34(47.89) 11(84.62) 5.959 0.015 >5 min 37(52.11) 2(15.38) 癫痫发作类型 全面性强直阵挛发作 30(42.25) 1(7.69) 5.637 0.018 非全面性强直阵挛发作 41(57.75) 12(92.31) 表 5 临床各因素与病灶组织中HMGB1表达的关系分析[n(%)]
临床因素 分类 HMGB1表达 χ2 P 阳性(n=73) 阴性(n=11) 性别 男 47(64.38) 9(81.82) 1.308 0.253 女 26(35.62) 2(18.18) 癫痫病程 ≤10年 20(27.40) 10(90.91) 16.795 < 0.001 >10年 53(72.60) 1(9.09) 年龄 < 60岁 41(56.16) 4(36.36) 1.507 0.220 ≥60岁 32(43.84) 7(63.64) 癫痫发作频率 ≤1次/周 40(54.79) 11(100.00) 8.190 0.004 >1次/周 33(45.21) 0 癫痫发作持续时间 ≤5 min 35(47.95) 10(90.91) 7.095 0.008 >5 min 38(52.05) 1(9.09) 癫痫发作类型 全面性强直阵挛发作 29(39.73) 2(18.18) 1.906 0.167 非全面性强直阵挛发作 44(60.27) 9(81.82) 表 6 TLR4、HMGB1预测难治性癫痫患者的效能分析
变量 曲线下面积 SE P 95%CI Cut-off 约登指数 敏感度/% 特异度/% TLR4蛋白 0.888 0.034 < 0.001 0.822~0.954 0.25 0.821 82.1 100.0 HMGB1蛋白 0.923 0.025 < 0.001 0.875~0.971 1.13 0.791 90.5 88.6 -
[1] FEJA M, MELLER S, DEKING L S, et al. OV329, a novel highly potent γ-aminobutyric acid aminotransferase inactivator, induces pronounced anticonvulsant effects in the pentylenetetrazole seizure threshold test and in amygdala-kindled rats[J]. Epilepsia, 2021, 62(12): 3091-3104. doi: 10.1111/epi.17090
[2] 李承俊, 王丰, 姚培森, 等. 局灶性皮质发育不良相关"难定位" 难治性癫痫的手术疗效及影响因素分析[J]. 中华神经医学杂志, 2021, 20(8): 793-798. doi: 10.3760/cma.j.cn115354-20201210-00959 [3] 姚娟, 钱忆家, 翁柠, 等. 平肝止痫复方联合卡马西平干预HMGB1/TLR4信号炎症通路的相关作用研究[J]. 辽宁中医杂志, 2022, 49(2): 191-198, 后插8. [4] 陈小妮, 谭会会, 殷艳玲, 等. 原发性癫痫患者血清BAFF、HMGB1、TLR4的表达水平及其临床意义[J]. 海南医学, 2023, 34(4): 550-553. [5] 中国医师协会神经内科医师分会癫痫疾病专业委员会. 中国基因性全面性癫痫临床诊治实践指南[J]. 中华神经医学杂志, 2020, 19(10): 973-976. doi: 10.3760/cma.j.cn115354-20200529-00424 [6] WATSON G D R, AFRA P, BARTOLINI L, et al. A journey into the unknown: an ethnographic examination of drug-resistant epilepsy treatment and management in the United States[J]. Epilepsy Behav, 2021, 124: 108319. doi: 10.1016/j.yebeh.2021.108319
[7] MCALLISTER-WILLIAMS R H, BULMER S, NEWTON K, et al. Assessment for vagus nerve stimulation in patients with difficult-to-treat depression: a model from the Newcastle Regional Affective Disorders Service (RADS)[J]. J Affect Disord, 2021, 280(Pt A): 315-318.
[8] 季涛云, 王若凡, 刘庆祝, 等. 局灶起源的药物难治性癫痫性痉挛的手术预后及相关预后因素分析[J]. 中华实用儿科临床杂志, 2021, 36(17): 1333-1337. doi: 10.3760/cma.j.cn101070-20200505-00769 [9] 李冬梅, 陈巧彬, 陈琅, 等. FPS-ZM1和mNGF对癫痫幼鼠脑内HMGB1和TRX表达的影响[J]. 福建医科大学学报, 2021, 55(6): 513-516. doi: 10.3969/j.issn.1672-4194.2021.06.010 [10] 黄亮, 张思磊, 朱作磊, 等. 微小RNA-542-3p和Toll样受体4在癫痫患者血浆中的表达及临床意义[J]. 脑与神经疾病杂志, 2022, 30(4): 241-245. [11] 李东秀, 潘彩芬. 血清高迁移率族蛋白B1水平与小儿热性惊厥临床特征及转为癫痫的相关性[J]. 临床和实验医学杂志, 2021, 20(9): 927-931. doi: 10.3969/j.issn.1671-4695.2021.09.009 [12] 屈会霞, 袁小锋, 屈昕. 长链非编码RNA核富含丰富的转录本1对癫痫模型海马神经元凋亡的影响和作用机制[J]. 中国儿童保健杂志, 2021, 29(11): 1193-1197, 1212. doi: 10.11852/zgetbjzz2021-0402 [13] 黄凌锋, 廉荣镇, 肖能, 等. 癫痫患儿血清α-突触核蛋白和热休克蛋白70的表达及临床意义[J]. 国际检验医学杂志, 2021, 42(13): 1545-1548, 1553. doi: 10.3969/j.issn.1673-4130.2021.13.003 [14] 李倩, 顾晶晶. 成年难治性癫痫患者行激光间质热疗术后疗效观察与护理[J]. 护士进修杂志, 2022, 37(11): 1043-1045. [15] 金超, 董琰, 张双, 等. 药物联合方案治疗小儿癫痫临床疗效及其对高迁移率族蛋白-1、Toll样受体4水平影响[J]. 临床军医杂志, 2022, 50(6): 636-638, 641.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号