Expression levels of serum secreted frizzled-related protein 5, heat shock protein 60 and solute carrier family 16 member 11 in patients with gestational diabetes mellitus and their relationships with insulin resistance
-
摘要:目的
探讨分泌性卷曲相关蛋白-5(sFRP5)、热休克蛋白60(HSP60)、溶质载体家族16成员11(SLC16A11)在妊娠期糖尿病(GDM)患者血清中的表达及其与胰岛素抵抗的关系。
方法选取2022年1月—2023年12月在本院就诊的120例GDM患者为研究组,另选取同期120例健康孕妇为对照组。检测血清sFRP5、HSP60、SLC16A11表达水平; 检测并计算胰岛素抵抗相关指标[空腹血糖(FBG)、空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)]的水平; 采用Pearson法分析血清sFRP5、HSP60、SLC16A11与胰岛素抵抗的相关性; 采用Logistic回归分析法与受试者工作特征(ROC)曲线分析血清sFRP5、HSP60、SLC16A11与GDM的相关性。
结果研究组血清sFRP5表达低于对照组,血清HSP60、SLC16A11、FBG、FINS、HOMA-IR高于对照组,差异有统计学意义(P < 0.05)。Pearson相关性分析显示,血清sFRP5与HSP60、SLC16A11、FBG、FINS、HOMA-IR呈负相关(P < 0.05); 血清HSP60与SLC16A11、FBG、FINS、HOMA-IR呈正相关(P < 0.05); 血清SLC16A11与FBG、FINS、HOMA-IR呈正相关(P < 0.05)。多因素Logistic回归分析显示, HSP60、SLC16A11、FBG、FINS、HOMA-IR是妊娠期患者发生GDM的影响因素,sFRP5是保护因素(P < 0.05)。血清sFRP5、HSP60、SLC16A11联合诊断妊娠期患者发生GDM的曲线下面积(AUC)为0.924, 3项指标联合诊断价值优于各指标单独诊断(P均 < 0.05)。
结论GDM患者血清sFRP5水平降低,HSP60、SLC16A11水平升高; 3项指标均为妊娠期患者发生GDM的影响因素,且与胰岛素抵抗相关; 3项指标联合对GDM具有较高的诊断效能。
-
关键词:
- 分泌性卷曲相关蛋白-5 /
- 热休克蛋白60 /
- 溶质载体家族16成员11 /
- 妊娠期糖尿病 /
- 胰岛素抵抗
Abstract:ObjectiveTo investigate the expression levels of secreted frizzled-related protein 5 (sFRP5), heat shock protein 60 (HSP60) and solute carrier family 16 member 11 (SLC16A11) in serum of patients with gestational diabetes mellitus (GDM) and their relationships with insulin resistance.
MethodsA total of 120 GDM patients in the hospital from January 2022 to December 2023 were selected as study group, and another 120 healthy pregnant women in the same period were selected as control group. The expression levels of serum sFRP5, HSP60 and SLC16A11 were detected; the levels of insulin resistance-related indicators[fasting blood glucose (FBG), fasting insulin (FINS), and homeostasis model assessment of insulin resistance (HOMA-IR)]were measured and calculated; the Pearson's correlation method was used to analyze the correlations of serum sFRP5, HSP60 and SLC16A11 with insulin resistance; the Logistic regression andysis and receiver operating characteristic (ROC) curve analysis were used to assess the relationships of serum sFRP5, HSP60 and SLC16A11 with GDM.
ResultsThe serum sFRP5 expression in the study group was significantly lower than that in the control group, while the serum HSP60, SLC16A11, FBG, FINS and HOMA-IR levels were significantly higher than those in the control group (P < 0.05). Pearson's correlation analysis showed that serum sFRP5 was negatively correlated with HSP60, SLC16A11, FBG, FINS and HOMA-IR (P < 0.05); serum HSP60 was positively correlated with SLC16A11, FBG, FINS and HOMA-IR (P < 0.05); serum SLC16A11 was positively correlated with FBG, FINS and HOMA-IR (P < 0.05). Multivariate Logistic regression analysis revealed that HSP60, SLC16A11, FBG, FINS and HOMA-IR were risk factors for GDM in pregnant patients, while sFRP5 was a protective factor (P < 0.05). The area under the curve (AUC) for the combined diagnosis of GDM in pregnant patients by serum sFRP5, HSP60 and SLC16A11 was 0.924, indicating that the combined diagnostic value of three indicators was superior to that of each individual indicator (all P < 0.05).
ConclusionGDM patients exhibit decreased serum sFRP5 level and increased HSP60 and SLC16A11 levels; three indicators are factors influencing the occurrence of GDM in pregnant patients, and are associated with insulin resistance; the combination of three indicators exhibits high diagnostic efficacy for GDM.
-
GDM(GDM)发病率逐年升高且呈年轻化趋势, 相关研究[1-2]显示孕妇机体血糖过高易出现生殖道和宫内感染,而葡萄糖能促进体内胎儿蛋白质和脂肪合成,出现巨大儿、先天畸形等风险升高,还会导致新生儿红细胞增多、低血糖等并发症的风险升高,导致子代心血管疾病、2型糖尿病风险升高,威胁母婴健康。目前GDM的发病机制尚不明确,有学者[3-4]认为可能与遗传、糖脂代谢、胰岛素抵抗以及炎症反应等有关,胰岛素抵抗被认为是GDM发病的关键因素,其不仅会导致患者血糖升高,还会使胎儿生长环境血糖升高,从而导致不良妊娠结局的发生。
分泌性卷曲相关蛋白-5(sFRP5)是脂肪因子的一种,具有抗炎作用,在糖脂代谢的过程中具有重要作用[5]。研究[6]发现在动物实验中,提高sFRP5水平会导致胰岛素的敏感性增加,刺激脂肪的合成和葡萄糖的摄入。热休克蛋白60(HSP60)是急性时相期蛋白的一种,其在2型糖尿病患者中水平明显升高,且高血糖刺激发生氧化应激、线粒体功能异常,刺激分泌HSP60, 导致HSP60水平增高[7]。HSP60还会刺激免疫细胞释放炎症因子,从而影响机体的代谢[8]。溶质载体家族16成员11( SLC16A11 )是一种新型的糖尿病风险基因, SLC16A11 表达升高可能会导致脂质代谢指标发生变化,特别是甘油三酯升高最为明显,而甘油三酯在糖尿病发生发展中发挥重要作用,因此推测 SLC16A11 可以通过对脂质代谢的调控刺激糖尿病、肥胖等发生发展[9]。本研究探讨GDM患者血清sFRP5、HSP60、 SLC16A11 水平与胰岛素抵抗的关系,现报告如下。
1. 资料与方法
1.1 一般资料
选取2022年1月—2023年12月在本院就诊的120例GDM患者为研究组。纳入标准: ①符合GDM诊断标准[10] [24~28周行75 g糖耐量试验,空腹血糖(FBG)≥5.1 mmol/L, 餐后1 h血糖(1 h BG)≥10.0 mmol/L, 餐后2 h血糖(2 h BG)≥8.5 mmol/L, 符合其中1项即可确诊]者; ②自然受孕且为单胎妊娠者; ③孕前无糖尿病者; ④患者临床资料完整; ⑤签署知情承诺书者。排除标准: ①孕前合并高血压、高血脂等患者; ②有精神疾病史者; ③有先天性疾病者(心脏病等); ④合并其他恶性肿瘤者。另选取同期健康孕妇(单胎妊娠)120例为对照组。本研究获得本院伦理委员会批准(批号: 2024-168-01)。
1.2 方法
1.2.1 血清sFRP5、HSP60检测
入院时采集外周静脉血, 4 000 r/min离心15 min后保存血清备用,采用酶联免疫吸附法检测sFRP5、HSP60水平,试剂盒分别购自美国R&D、上海江莱公司。
1.2.2 SLC16A11 检测
所有患者采集血清后,使用Trizol试剂(北京凯诗源)提取总RNA, 使用NanoDrop ND-12000分光光度计评估总RNA浓度和纯度,使用M-MLV反转录试剂盒反转录成cDNA, 以cDNA为模板,采用实时荧光定量聚合酶链反应(qRT-PCR)仪检测样本中 SLC16A11 表达水平,内参为GAPDH, 引物序列见表 1。qRT-PCR反应体系共20 μL, 采用2-△△Ct方法计算血清 SLC16A11 表达。
表 1 qRT-PCR引物序列基因 正向引物5′-3′ 反向引物5′-3′ SLC16A11 AACCAGCGCATGGACAGTTA GACTTGACCACCGAACCCAT GAPDH CAGCCGCATCTTCTTGTGC GGTAACCAGGCGTCCGATA 1.2.3 胰岛素抵抗相关指标
采用血糖仪检测空腹血糖(FBG); 采用全自动电化学发光分析仪检测空腹胰岛素(FINS); 采用稳态模型评估胰岛素抵抗指数(HOMA-IR), HOMA-IR =FPG×FINS/22.5。
1.2.4 临床资料的收集
收集所有入选孕妇的一般资料,包括年龄、孕次、产次、体质量指数(BMI)、孕周、舒张压、收缩压等。
1.3 统计学分析
采用SPSS 25.0软件分析数据。计量资料以(x ±s)表示,比较行t检验; 计数资料以[n(%)]表示,比较行χ2检验。采用Pearson法分析血清sFRP5、HSP60、 SLC16A11 与胰岛素抵抗的相关性。采用Logistic回归分析法分析GDM的影响因素。绘制受试者工作特征(ROC)曲线分析血清sFRP5、HSP60、 SLC16A11 对妊娠期患者发生GDM的预测价值。P < 0.05为差异有统计学意义。
2. 结果
2.1 2组一般资料比较
2组年龄、孕次、产次、BMI、孕周、舒张压、收缩压等一般资料比较,差异无统计学意义(P>0.05)。见表 2。
表 2 2组一般资料比较(x ±s)一般资料 研究组(n=120) 对照组(n=120) 年龄/岁 28.18±5.67 28.84±5.34 孕次/次 1.63±0.51 1.67±0.52 产次/次 0.89±0.19 0.86±0.22 体质量指数/(kg/m2) 24.52±5.06 24.37±5.14 孕周/周 26.43±1.52 26.19±1.67 舒张压/mmHg 83.27±5.92 82.65±6.07 收缩压/mmHg 119.04±11.47 117.46±10.68 1 mmHg=0.133 kPa 2.2 2组患者血清sFRP5、HSP60、 SLC16A11 比较
研究组血清sFRP5表达低于对照组,血清HSP60、 SLC16A11 表达高于对照组,差异有统计学意义(P < 0.05)。见表 3。
表 3 2组患者血清sFRP5、HSP60、 SLC16A11 比较(x ±s)组别 n sFRP5/(ng/mL) HSP60/(ng/mL) SLC16A11 研究组 120 9.54±1.62* 49.63±6.29* 1.38±0.27* 对照组 120 13.98±3.27 38.71±5.02 1.01±0.21 sFRP5: 分泌性卷曲相关蛋白-5; HSP60: 热休克蛋白60;
SLC16A11 : 溶质载体家族16成员11。与对照组比较, * P < 0.05。2.3 2组患者胰岛素抵抗相关指标比较
研究组FBG、FINS、HOMA-IR高于对照组,差异有统计学意义(P < 0.05)。见表 4。
表 4 2组患者胰岛素抵抗相关指标比较(x ±s)组别 n FBG/(mmol/L) FINS/(mmol/L) HOMA-IR 研究组 120 5.83±1.02* 5.36±0.71* 1.39±0.23* 对照组 120 4.18±0.61 3.95±0.64 0.74±0.15 FBG: 空腹血糖; FINS: 空腹胰岛素; HOMA-IR: 胰岛素抵抗指数。
与对照组比较, * P < 0.05。2.4 血清sFRP5、HSP60、SLC16A11与胰岛素抵抗相关指标的相关性
Pearson相关性分析显示,血清sFRP5与HSP60、 SLC16A11 、FBG、FINS、HOMA-IR呈负相关(P < 0.05); 血清HSP60与 SLC16A11 、FBG、FINS、HOMA-IR呈正相关(P < 0.05); 血清 SLC16A11 与FBG、FINS、HOMA-IR呈正相关(P < 0.05)。见表 5。
表 5 血清sFRP5、HSP60、SLC16A11与胰岛素抵抗相关指标的相关性指标 sFRP5 HSP60 SLC16A11 r P r P r P FBG -0.559 < 0.01 0.574 < 0.01 0.586 < 0.01 FINS -0.511 < 0.01 0.552 < 0.01 0.524 < 0.01 HOMA-IR -0.573 < 0.01 0.547 < 0.01 0.558 < 0.01 sFRP5 — — -0.538 < 0.01 -0.562 < 0.01 HSP60 -0.538 < 0.01 — — 0.573 < 0.01 SLC16A11 -0.562 < 0.01 0.573 < 0.01 — — 2.5 妊娠期发生GDM的影响因素分析
以妊娠期是否发生GDM作为因变量(是=1, 否=0), 以sFRP5、HSP60、 SLC16A11 和FBG、FINS、HOMA-IR相关指标作为自变量(均为实测值),多因素Logistic回归分析显示, HSP60、 SLC16A11 、FBG、FINS、HOMA-IR是妊娠期患者发生GDM的影响因素(P < 0.05), sFRP5是保护因素(P < 0.05)。见表 6。
表 6 妊娠期发生GDM的影响因素分析指标 β SE Wald P OR 95%CI sFRP5 -0.851 0.359 5.619 0.018 0.427 0.211~0.863 HSP60 0.671 0.218 9.471 0.002 1.956 1.276~2.999 SLC16A11 0.796 0.271 8.621 0.003 2.216 1.302~3.769 FBG 0.390 0.427 10.590 0.001 4.013 1.738~9.267 FINS 1.490 0.502 8.807 0.003 4.436 1.658~11.866 HOMA-IR 0.878 0.312 7.926 0.005 2.407 1.306~4.437 2.6 血清sFRP5、HSP60、 SLC16A11 对妊娠期患者发生GDM的诊断价值
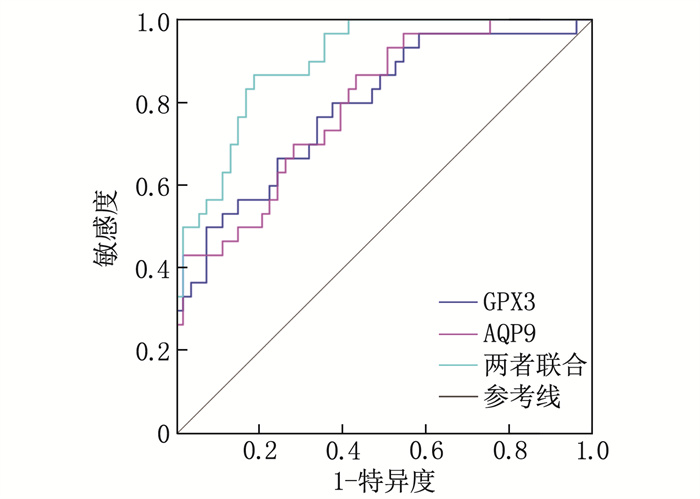
ROC曲线显示,血清sFRP5、HSP60、 SLC16A11 诊断妊娠期患者发生GDM的曲线下面积(AUC)依次为0.757、0.800、0.804, 3项指标联合诊断的AUC为0.924; 3项指标联合诊断的价值优于各指标单独诊断(Z联合vs sFRP5=2.708、Z联合vs HSP60=2.645、Z联合vs SLC16A11=2.517, P均 < 0.05), 见表 7、图 1。
表 7 血清sFRP5、HSP60、 SLC16A11 对妊娠期患者发生GDM的诊断价值变量 AUC 95%CI 灵敏度/% 特异度/% 截断值 sFRP5 0.757 0.693~0.821 71.03 82.31 11.08 ng/mL HSP60 0.800 0.742~0.858 75.37 79.49 45.87 ng/mL SLC16A11 0.804 0.749~0.859 76.25 78.87 1.26 联合预测 0.924 0.892~0.956 92.01 76.34 — 3. 讨论
GDM是妊娠期常见的并发症,不同地区、不同人群的发病率差异较大[11]。GDM会导致母婴出现代谢性疾病或者心脑血管疾病等各种并发症及不良妊娠结局,从而威胁母婴的生命安全,还会增加孕妇自身以及后代在后期发生糖尿病和高血压等多种疾病的风险[12]。GDM的发生机制暂不明确,但有研究[13]表明其与胰岛素抵抗和分泌缺陷有关,孕期的女性生理变化明显,在孕中晚期能够分泌出较多的胰岛素拮抗因子,降低胰岛素生物利用度,若机体不能分泌更多胰岛素来调节,则会引发GDM,糖脂代谢也会出现紊乱,从而影响母婴健康。
sFRP5是糖蛋白激素的一种由脂肪细胞分泌,参与多种代谢性疾病(肥胖症、糖尿病等)的调控,具有抗炎作用,可以抑制Wnt信号通路激活。研究[14]表明sFRP5水平降低会导致脂肪组织发生炎症反应,已明确其在动脉粥样硬化、2型糖尿病等疾病中发挥重要作用。sFRP5不仅可以抑制炎症因子释放,还对炎症细胞浸润有抑制作用,可以通过Wnt/JNK通路抑制脂肪的氧化应激,当脂肪功能异常时,Wnt活化从而抑制sFRP5水平,促进炎症因子水平升高,导致氧化应激的发生[15]。刘敏等[16]研究表明,GDM患者sFRP5降低可能是因Wnt通路中的LRP5发生突变,会导致肥胖和糖尿病的发生,而sFRP5对Wnt通路具有抑制作用,有利于胰岛素抵抗的改善和敏感性的增加。有研究[17]表明老年2型糖尿病患者血清sFRP5水平更低,且与视网膜病变呈负相关。本研究结果显示,研究组血清sFRP5较低,血清sFRP5是影响患者发生GDM的保护因素,提示其在GDM发生发展中发挥作用。ROC曲线显示,血清sFRP5诊断妊娠期患者发生GDM的AUC为0.757, 提示其对妊娠期患者发生GDM有一定的预测价值。
HSP是应激蛋白的一种,外界刺激生物体后会产生HSP, 免疫系统将其视为外源分子,会刺激免疫反应的发生,其根据分子质量、功能、结构可分为HSP40、HSP60、HSP90、sHSP等,其中HSP60主要存在于线粒体中[18]。有研究[19-20]表明HSP60可由脂肪组织分泌,并与脂肪细胞特异性结合,进一步刺激HSP60的释放,参与心血管、免疫、排泄和神经系统的各种病理过程,并与肥胖和伴随疾病有关。2型糖尿病患者常会伴随脂代谢紊乱、肥胖等,均是慢性炎症的一种,脂肪组织刺激影响内分泌功能,促进白细胞介素-6、抵抗素等多种因子的释放,从而引起氧化应激的发生,导致血清HSP60水平升高[21]。HSP60作为2型糖尿病的潜在靶点,可用于推进新药物的开发[22]。本研究结果显示,研究组血清HSP60升高,且血清HSP60是影响患者发生GDM的危险因素,提示其在GDM发生发展中发挥作用。ROC曲线显示,血清HSP60诊断妊娠期患者发生GDM的AUC为0.800, 提示其对GDM有一定的预测价值。
SLC16A11 基因位于细胞膜和内质网上,丙酮酸为运输底物,动物实验[23]表明干扰 SLC16A11 的表达可以降低高脂饮食小鼠骨骼肌中甘油三酯的水平,这可能降低 SLC16A11 的表达,促进胰岛素通路的传导,促进骨骼肌转运摄取葡萄糖,从而改善血糖水平,提示 SLC16A11 在糖尿病的发生中具有重要作用。本研究结果显示, GDM患者 SLC16A11 高表达是患者发生GDM的影响危险因素,提示其在GDM的发生中发挥重要作用, SLC16A11 预测GDM发生风险的AUC为0.804, 提示其对GDM有一定的预测价值。
胰岛素抵抗是妊娠期女性发生GDM的重要病理基础,可以抑制机体器官组织对胰岛素的敏感性,从而导致糖脂代谢以及内环境异常[24]。FBG为人体糖代谢的指标, FINS可以反映空腹状态下人体胰岛素水平,通过计算可获得HOMA-IR, 从而评估机体对胰岛素的敏感程度[25]。本研究结果显示, GDM患者FBG、FINS、HOMA-IR较高,提示GDM患者胰岛素的分泌功能出现异常,胰岛素的敏感性降低,从而导致胰岛素抵抗的发生。相关性分析显示, sFRP5与FBG、FINS、HOMA-IR呈负相关, HSP60、 SLC16A11 与FBG、FINS、HOMA-IR呈正相关,表明血清sFRP5、HSP60、 SLC16A11 与胰岛素抵抗密切相关。进一步分析发现, 3项指标联合诊断妊娠期患者发生GDM的AUC为0.924, 优于各指标单独预测。本研究的局限性: 未探讨sFRP5、HSP60、 SLC16A11 对GDM患者胰岛素抵抗的具体调控机制、样本量不足等,后续将会扩大样本量、增加动物实验以对本研究结果进行验证。
综上所述, GDM患者血清sFRP5水平降低, HSP60、 SLC16A11 升高, 3项指标均为妊娠期患者发生GDM的影响因素,且与胰岛素抵抗相关。3项指标联用对GDM具有较高的诊断效能。
-
表 1 qRT-PCR引物序列
基因 正向引物5′-3′ 反向引物5′-3′ SLC16A11 AACCAGCGCATGGACAGTTA GACTTGACCACCGAACCCAT GAPDH CAGCCGCATCTTCTTGTGC GGTAACCAGGCGTCCGATA 表 2 2组一般资料比较(x ±s)
一般资料 研究组(n=120) 对照组(n=120) 年龄/岁 28.18±5.67 28.84±5.34 孕次/次 1.63±0.51 1.67±0.52 产次/次 0.89±0.19 0.86±0.22 体质量指数/(kg/m2) 24.52±5.06 24.37±5.14 孕周/周 26.43±1.52 26.19±1.67 舒张压/mmHg 83.27±5.92 82.65±6.07 收缩压/mmHg 119.04±11.47 117.46±10.68 1 mmHg=0.133 kPa 表 3 2组患者血清sFRP5、HSP60、 SLC16A11 比较(x ±s)
组别 n sFRP5/(ng/mL) HSP60/(ng/mL) SLC16A11 研究组 120 9.54±1.62* 49.63±6.29* 1.38±0.27* 对照组 120 13.98±3.27 38.71±5.02 1.01±0.21 sFRP5: 分泌性卷曲相关蛋白-5; HSP60: 热休克蛋白60;
SLC16A11 : 溶质载体家族16成员11。与对照组比较, * P < 0.05。表 4 2组患者胰岛素抵抗相关指标比较(x ±s)
组别 n FBG/(mmol/L) FINS/(mmol/L) HOMA-IR 研究组 120 5.83±1.02* 5.36±0.71* 1.39±0.23* 对照组 120 4.18±0.61 3.95±0.64 0.74±0.15 FBG: 空腹血糖; FINS: 空腹胰岛素; HOMA-IR: 胰岛素抵抗指数。
与对照组比较, * P < 0.05。表 5 血清sFRP5、HSP60、SLC16A11与胰岛素抵抗相关指标的相关性
指标 sFRP5 HSP60 SLC16A11 r P r P r P FBG -0.559 < 0.01 0.574 < 0.01 0.586 < 0.01 FINS -0.511 < 0.01 0.552 < 0.01 0.524 < 0.01 HOMA-IR -0.573 < 0.01 0.547 < 0.01 0.558 < 0.01 sFRP5 — — -0.538 < 0.01 -0.562 < 0.01 HSP60 -0.538 < 0.01 — — 0.573 < 0.01 SLC16A11 -0.562 < 0.01 0.573 < 0.01 — — 表 6 妊娠期发生GDM的影响因素分析
指标 β SE Wald P OR 95%CI sFRP5 -0.851 0.359 5.619 0.018 0.427 0.211~0.863 HSP60 0.671 0.218 9.471 0.002 1.956 1.276~2.999 SLC16A11 0.796 0.271 8.621 0.003 2.216 1.302~3.769 FBG 0.390 0.427 10.590 0.001 4.013 1.738~9.267 FINS 1.490 0.502 8.807 0.003 4.436 1.658~11.866 HOMA-IR 0.878 0.312 7.926 0.005 2.407 1.306~4.437 表 7 血清sFRP5、HSP60、 SLC16A11 对妊娠期患者发生GDM的诊断价值
变量 AUC 95%CI 灵敏度/% 特异度/% 截断值 sFRP5 0.757 0.693~0.821 71.03 82.31 11.08 ng/mL HSP60 0.800 0.742~0.858 75.37 79.49 45.87 ng/mL SLC16A11 0.804 0.749~0.859 76.25 78.87 1.26 联合预测 0.924 0.892~0.956 92.01 76.34 — -
[1] YE W R, LUO C, HUANG J, et al. Gestational diabetes mellitus and adverse pregnancy outcomes: systematic review and meta-analysis[J]. BMJ, 2022, 377: e067946.
[2] HILDÉN K, HANSON U, PERSSON M, et al. Gestational diabetes and adiposity are independent risk factors for perinatal outcomes: a population based cohort study in Sweden[J]. Diabet Med, 2019, 36(2): 151-157. doi: 10.1111/dme.13843
[3] ZHANG Y H, CHEN Y Y, QU H M, et al. Methylation of HIF3A promoter CpG islands contributes to insulin resistance in gestational diabetes mellitus[J]. Mol Genet Genomic Med, 2019, 7(4): e00583. doi: 10.1002/mgg3.583
[4] SERT U Y, OZGU-ERDINC A S. Gestational diabetes mellitus screening and diagnosis[J]. Adv Exp Med Biol, 2021, 1307: 231-255.
[5] LI Y, TIAN M Y, YANG M L, et al. Central Sfrp5 regulates hepatic glucose flux and VLDL-triglyceride secretion[J]. Metabolism, 2020, 103: 154029. doi: 10.1016/j.metabol.2019.154029
[6] 朱伟, 郑世霞, 柯琳秋, 等. SFRP5对小鼠肝癌细胞系Hepa1-6糖代谢的影响[J]. 基础医学与临床, 2018, 38(9): 1268-1273. [7] ZHANG D L, LIU H, ZHANG Y M, et al. Heat shock protein 60 (HSP60) modulates adiponectin signaling by stabilizing adiponectin receptor[J]. Cell Commun Signal, 2020, 18(1): 60. doi: 10.1186/s12964-020-00546-5
[8] WU X X, GUO J Y, CHEN Y L, et al. The 60-kDa heat shock protein regulates energy rearrangement and protein synthesis to promote proliferation of multiple myeloma cells[J]. Br J Haematol, 2020, 190(5): 741-752. doi: 10.1111/bjh.16569
[9] HIDALGO B A, SOFER T, QI Q B, et al. Associations between SLC16A11 variants and diabetes in the Hispanic Community Health Study/Study of Latinos (HCHS/SOL)[J]. Sci Rep, 2019, 9(1): 843. doi: 10.1038/s41598-018-35707-7
[10] 中华医学会妇产科学分会产科学组, 中华医学会围产医学分会妊娠合并糖尿病协作组. 妊娠合并糖尿病诊治指南(2014)[J]. 中华妇产科杂志, 2014, 49(8): 561-569. [11] XIE J W, LI L, XING H Y. Metabolomics in gestational diabetes mellitus: a review[J]. Clin Chim Acta, 2023, 539: 134-143. doi: 10.1016/j.cca.2022.12.005
[12] DŁUSKI D F, WOLINSKA E, SKRZYPCZAK M. Epigenetic changes in gestational diabetes mellitus[J]. Int J Mol Sci, 2021, 22(14): 7649. doi: 10.3390/ijms22147649
[13] JOHNS E C, DENISON F C, NORMAN J E, et al. Gestationaldiabetes mellitus: mechanisms, treatment, and complications[J]. Trends Endocrinol Metab, 2018, 29(11): 743-754. doi: 10.1016/j.tem.2018.09.004
[14] 王志强, 吴剑华, 庄伟, 等. 利拉鲁肽对耐克罗米芬多囊卵巢综合征患者氧化应激, 胰岛素抵抗及血清SFRP5, IL-34水平的影响[J]. 中国妇产科临床杂志, 2023, 24(3): 307-309. [15] 姜瑞丰, 施妙君, 鄢巨振. 维持性血液透析患者血清Shp5、Klotho水平变化及其与钙磷代谢的关系[J]. 广东医学, 2020, 41(2): 152-155. [16] 刘敏, 缪华珍. GDM患者miRNA-125b、SFRP5、SerpinBl变化及益生菌联合胰岛素治疗效果[J]. 中国计划生育杂志, 2023, 31(10): 2354-2358. [17] 方云艳, 秦雯, 王小蓓, 等. 血清sFRP5与老年2型糖尿病患者视网膜病变的相关性[J]. 国际检验医学杂志, 2023, 44(21): 2602-2606. [18] 刘莉芳, 赵桁, 张云良, 等. 2型糖尿病患者血清Nesfatin-1、HSP60与下肢血管病变的相关性研究[J]. 中国动脉硬化杂志, 2021, 29(11): 965-970. [19] 马聆桦, 李江恒, 钟柳育, 等. 高龄孕产妇临床特征及孕检对妊娠风险的影响[J]. 实用临床医药杂志, 2022, 26(9): 50-53. doi: 10.7619/jcmp.20214722 [20] TIMOFEEV Y S, KISELEV A R, DZHIOEVA O N, et al. Heat shock proteins (HSPs) and cardiovascular complications of obesity: searching for potential biomarkers[J]. Curr Issues Mol Biol, 2023, 45(12): 9378-9389. doi: 10.3390/cimb45120588
[21] ALUKSANASUWAN S, SUEKSAKIT K, FONG-NGERN K, et al. Role of HSP60 (HSPD1) in diabetes-induced renal tubular dysfunction: regulation of intracellular protein aggregation, ATP production, and oxidative stress[J]. FASEB J, 2017, 31(5): 2157-2167. doi: 10.1096/fj.201600910RR
[22] ZIMBONE S, DI ROSA M C, CHIECHIO S, et al. Exploring the role of Hsp60 in Alzheimer's disease and type 2 diabetes: suggestion for common drug targeting[J]. Int J Mol Sci, 2023, 24(15): 12456. doi: 10.3390/ijms241512456
[23] 张坦, 漆正堂, 丁树哲. SLC16A11调控小鼠骨骼肌Akt/GLUT4通路的研究及运动对SLC16A11和GLUT4表达的影响[J]. 中国运动医学杂志, 2022, 41(1): 43-51. [24] THILAK S, RAJENDRA A, GANESH V. Association of obesity and insulin resistance to gestational diabetes mellitus[J]. Bioinformation, 2023, 19(2): 211-214. doi: 10.6026/97320630019211
[25] 陈辰, 陈亚军, 戴楠, 等. 妊娠期糖尿病患者孕早期糖脂代谢状态的研究[J]. 中国妇幼保健, 2018, 33(15): 3445-3447.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号