Correlations of the expression of silencing information regulatory factor 2-related enzyme-1 and colony-stimulating factor 1 receptors with clinical features and prognosis in patients with colon cancer
-
摘要:目的
探讨沉默信息调节因子2相关酶1(SIRT1)和集落刺激因子1受体(CSF1R)表达与结肠癌患者临床特征及预后的关系。
方法收集148例结肠癌患者术中切除的结肠癌组织标本及癌旁组织标本。分析结肠癌患者的临床病理特征。采用免疫组织化学法检测SIRT1和CSF1R的表达; 采用Spearman相关分析法分析SIRT1与CSF1R的相关性; 采用Kaplan-Meier法分析SIRT1、CSF1R表达与患者预后的关系; 采用多因素Cox回归分析法分析结肠癌患者预后的影响因素。
结果与癌旁组织相比,结肠癌组织中SIRT1蛋白表达降低, CSF1R蛋白表达升高,差异有统计学意义(P < 0.05)。SIRT1与CSF1R蛋白表达与结肠癌患者的淋巴结转移、神经侵袭、浸润深度情况相关(P < 0.05)。SIRT1与CSF1R蛋白表达呈负相关(r=-0.536, P < 0.05)。SIRT1高表达结肠癌患者3年生存率高于SIRT1低表达患者,差异有统计学意义(P < 0.05)。CSF1R高表达结肠癌患者3年生存率低于CSF1R低表达患者,差异有统计学意义(P < 0.05)。淋巴结转移、浸润深度、神经侵袭、SIRT1、CSF1R是结肠癌患者预后的影响因素(P < 0.05)。
结论结肠癌患者癌组织中SIRT1表达显著下调, CSF1R表达显著上调,且与患者淋巴结转移、神经侵袭、浸润深度等临床病理特征密切相关,检测其水平对预测患者预后生存情况具有重要价值。
-
关键词:
- 沉默信息调节因子2相关酶1 /
- 集落刺激因子1受体 /
- 结肠癌 /
- 临床病理特征 /
- 预后
Abstract:ObjectiveTo investigate the correlations of the expression of silent information regulator 2 homolog 1 (SIRT1) and colony-stimulating factor 1 receptor (CSF1R) with the clinical characteristics and prognosis of patients with colon cancer.
MethodsColon cancer tissue specimens and paracancer tissue specimens were collected from 148 patients with colon cancer. The clinical and pathological features of the patients were analyzed. Immunohistochemistry was used to detect the expression of SIRT1 and CSF1R; the Spearman's correlation analysis was employed to assess the correlation between SIRT1 and CSF1R; the Kaplan-Meier analysis was conducted to evaluate the associations of the expression of SIRT1 and CSF1R with patients' prognosis; the multivariate Cox regression analysis was performed to identify prognostic factors in colon cancer patients.
ResultsCompared with the adjacent tissues, the expression of SIRT1 protein in colon cancer tissues was significantly decreased, and the expression of CSF1R protein was significantly increased (P < 0.05). The expressions of SIRT1 and CSF1R protein were correlated with lymph node metastasis, nerve invasion and invasion depth in patients with colon cancer (P < 0.05). The protein expressions of SIRT1 and CSF1R were negatively correlated (r=-0.536, P < 0.05). The 3-year survival rate of patients with high SIRT1 expression was significantly higher than that of patients with low SIRT1 expression (P < 0.05). The 3-year survival rate of patients with high CSF1R expression was significantly lower than that of patients with low CSF1R expression (P < 0.05). The 3-year survival rate of patients with high SIRT1 expression was significantly higher than that of patients with low SIRT1 expression (P < 0.05).
ConclusionIn colon cancer, SIRT1 expression is significantly downregulated, whereas CSF1R expression is upregulated, and both are closely related to the clinical and pathological features such as lymph node metastasis, neural invasion, and tumor infiltration depth. Detection of these biomarkers may have important value in predicting patients' prognosis and survival.
-
结肠黏膜是免疫调节的重要屏障和主要部位,慢性感染或炎症引起的免疫激活会增加癌症风险[1]。目前,结肠癌是世界范围内发病率和病死率较高的恶性肿瘤之一[2-3]。在过去几十年间,许多国家结肠癌患者治疗后有一定改善,但存在肿瘤转移和耐药性等问题,导致约50%的结肠癌患者发生肿瘤复发,预后不良[4]。因此,识别与结肠癌预后相关的生物标志物,并积极采取干预措施,对提高结肠癌的治疗效果具有重要意义。沉默信息调节因子2相关酶1(SIRT1)是目前研究最为广泛的SIRT蛋白,与新陈代谢、基因组稳定性及肿瘤发生等多种生物学过程密切相关[5]。集落刺激因子1受体(CSF1R)可调节小胶质细胞和巨噬细胞增殖、迁移、分化和存活,以及介导脑病、缺血损伤、白血病、细胞瘤、肠道肿瘤等多种疾病的发生与发展[6-7]。然而,目前关于SIRT1和CSF1R在结肠癌中的表达情况尚未明确。本研究检测结肠癌患者的SIRT1、CSF1R表达水平,分析其与临床病理特征及预后的相关性,以期为改善结肠癌患者预后提供依据。
1. 对象与方法
1.1 研究对象
收集2018年5月—2020年1月在本院手术的148例结肠癌患者术中切除的结肠癌组织标本及癌旁组织标本。纳入标准: ①符合结肠癌诊断标准[8]者; ②术中成功获取结肠癌组织标本,并保存完整者; ③自愿签署知情同意书者。排除标准: ①其他部位恶性肿瘤者; ②接受过放疗、化疗或手术等治疗者; ③处于妊娠期者; ④病例或随访资料不完整者。本研究经本院医学伦理委员会批准(201801-008)。
1.2 方法
1.2.1 免疫组织化学法检测SIRT1、CSF1R表达
将石蜡包埋组织样本制成4 μm厚的切片,脱蜡水化后,在含3%(体积分数) H2O2的甲醇溶液中孵育30 min, 用10%(体积分数)的山羊血清进行封闭, 10 min后分别加SIRT1和CSF1R抗体, 4 ℃孵育12 h, 加入二抗孵育30 min, 苏木精复染,脱水封片镜检。
1.2.2 判定结果
3名病理科医师采用半定量评分法对肠癌组织和癌旁组织SIRT1和CSF1R蛋白染色结果进行评分,统计阳性细胞比例(< 25%、25%~50%、>50%~75%、>75%分别计0、1、2、3分)×染色强度(无染色、浅黄色、黄褐色、棕褐色分别计0、1、2、3分), ≤3分为低表达,>3分为高表达。
1.2.3 随访
以电话及门诊复查的方式对结肠癌患者进行为期3年的随访,记录患者的生存时间(术后至患者死亡或最终随访截止时间)。
1.3 统计学分析
采用SPSS 25.0软件进行数据分析。SIRT1和CSF1R在结肠癌组织和癌旁组织中的表达行χ2检验; 采用Spearman相关分析法分析SIRT1和CSF1R蛋白在结肠癌组织中的相关性; 采用Kaplan-Meier法分析SIRT1和CSF1R表达与患者预后的关系; 采用多因素Cox回归分析法分析结肠癌患者预后的影响因素。P < 0.05表示差异有统计学意义。
2. 结果
2.1 SIRT1、CSF1R在结肠癌组织和癌旁组织中的表达
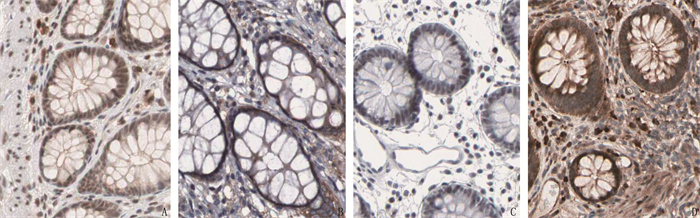
与癌旁组织相比,结肠癌组织中SIRT1蛋白表达降低, CSF1R蛋白表达升高,差异有统计学意义(P < 0.05)。见表 1、图 1。
表 1 SIRT1和CSF1R蛋白在结肠癌组织和癌旁组织中的表达情况[n(%)]组织类型 n SIRT1 CSF1R 高表达 低表达 高表达 低表达 癌旁组织 148 99(66.89) 49(33.11) 53(35.81) 95(64.19) 结肠癌组织 148 43(29.05)* 105(70.95)* 112(75.68)* 36(24.32)* 与癌旁组织相比, * P < 0.05。 2.2 SIRT1和CSF1R蛋白表达与患者临床病理特征的关系
SIRT1和CSF1R蛋白表达与结肠癌患者的神经侵袭、淋巴结转移、浸润深度相关(P < 0.05); 与TNM分期、肿瘤直径、性别、年龄无关(P>0.05)。见表 2。
表 2 SIRT1和CSF1R蛋白与临床病理特征的关系[n(%)]临床病理特征 分类 n SIRT1低表达(n=105) SIRT1高表达(n=43) χ2 P CSF1R低表达(n=36) CSF1R高表达(n=112) χ2 P 年龄 < 60岁 52 39(37.14) 13(80.23) 0.639 0.424 16(44.44) 36(32.14) 1.809 0.179 ≥60岁 96 66(62.86) 30(69.77) 20(55.56) 76(67.86) 性别 男 81 56(53.33) 25(58.14) 0.284 0.594 23(63.89) 58(51.79) 1.611 0.204 女 67 49(46.67) 18(41.86) 13(36.11) 54(48.21) 肿瘤直径 < 5 cm 69 45(42.86) 24(55.81) 2.058 0.151 19(52.78) 50(44.64) 0.714 0.395 ≥5 cm 79 60(57.14) 19(44.17) 17(47.22) 62(55.36) TNM分期 Ⅰ~Ⅱ期 85 55(52.38) 30(69.77) 3.772 0.052 25(69.44) 60(53.57) 2.808 0.094 Ⅲ~Ⅳ期 63 50(47.62) 13(30.23) 11(30.56) 52(46.43) 淋巴结转移 否 91 57(54.29) 34(79.07) 7.913 0.005 29(80.56) 62(55.36) 7.305 0.007 是 57 48(45.71) 9(20.93) 7(19.44) 50(44.64) 神经侵袭 有 43 38(36.19) 5(11.63) 8.929 0.003 4(11.11) 39(34.82) 7.430 0.006 无 105 67(63.81) 38(88.37) 32(88.89) 73(65.18) 浸润深度 T1~T2期 77 45(42.86) 32(74.42) 12.175 < 0.001 8(22.22) 69(61.61) 16.931 < 0.001 T3~T4期 71 60(57.14) 11(25.58) 28(77.78) 43(38.39) 2.3 SIRT1与CSF1R蛋白在结肠癌组织中的相关性分析
SIRT1与CSF1R蛋白在结肠癌组织中的表达呈负相关(r=-0.536, P < 0.05), 见表 3。
表 3 SIRT1和CSF1R蛋白在结肠癌组织中的相关性SIRT1 CSF1R r P 高表达(n=112) 低表达(n=36) 高表达(n=43) 23 20 -0.536 < 0.001 低表达(n=105) 89 16 2.4 SIRT1和CSF1R蛋白表达与结肠癌患者预后的关系
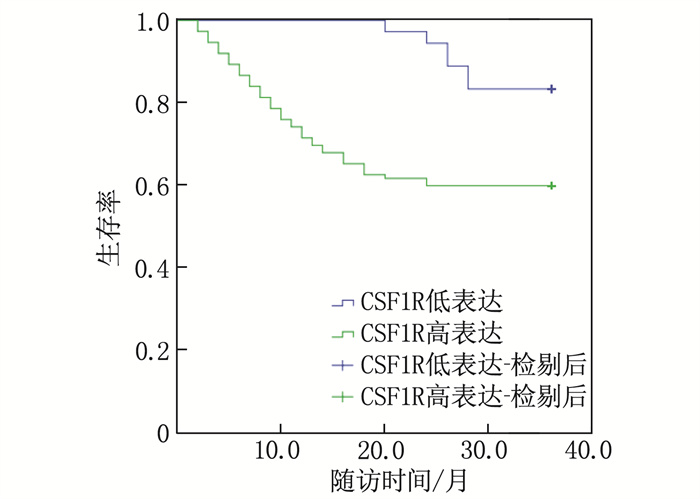
SIRT1高表达结肠癌患者的3年生存率为81.40%(35/43), 高于SIRT1低表达患者的59.05% (62/105), 差异有统计学意义(Log-rank χ2=8.313, P=0.004); CSF1R高表达结肠癌患者的3年生存率为59.82%(67/112), 低于CSF1R低表达患者的83.33%(30/36), 差异有统计学意义(Log-rank χ2=7.641, P=0.006)。见图 2、3。
2.5 结肠癌患者预后的影响因素
以结肠癌患者是否死亡为因变量(否=0, 是=1), 以SIRT1(SIRT1高表达=0, SIRT1低表达=1)、CSF1R(CSF1R高表达=1, CSF1R低表达=0)、淋巴结转移状态(是=1, 否=0)、神经侵袭(无=0, 有=1)、浸润深度(T1~T2期=0, T3~T4期=1)为自变量,进行多因素Cox回归分析。结果显示,淋巴结转移、神经侵袭、浸润深度、SIRT1、CSF1R是结肠癌患者预后的影响因素(P < 0.05)。见表 4。
表 4 结肠癌患者预后的影响因素因素 B SE Wald P HR 95%CI SIRT1 -0.304 0.096 10.015 0.002 0.738 0.614~0.891 CSF1R 1.267 0.412 9.452 0.002 3.549 1.583~7.958 淋巴结转移 0.922 0.364 6.420 0.011 2.515 1.232~5.133 神经侵袭 1.619 0.223 7.704 0.006 1.857 1.199~2.875 浸润深度 0.755 0.296 6.509 0.011 2.128 1.191~3.801 3. 讨论
结肠癌是全球最常见的消化系统恶性肿瘤之一。肥胖、糖尿病、炎症性肠病、不良生活习惯(如吸烟、过量饮酒、高摄入红肉和加工肉制品)以及既往疾病史被认为是结直肠癌的危险因素,导致其发病率上升[9-10]。随着医疗水平的提高,结肠癌患者的发病率和病死率有所下降,但仍有部分患者在治疗5年内出现复发或转移[11]。因此,除了检测目前已知的与临床和病理特征相关的预后和生存因素外,迫切需要可靠的新型分子标志物,以改进结肠癌患者的个性化治疗策略。
SIRT1是在哺乳动物中发现的SIRT蛋白,通过介导组蛋白和非组蛋白靶蛋白的脱乙酰化作用,发挥广泛的生物学功能[12]。研究[13]发现,癌细胞介导的SIRT1低表达可诱导肌肉NF-κB信号通路活化,增强下游活性氧物质生成相关基因的表达,促进癌症发展。SIRT1在骨骼肌中的稳定表达可缓解癌症引起的肌肉萎缩。研究[14]表明, SIRT1在胃癌组织中的表达显著降低。SIRT1低表达水平患者的预后较差, SIRT1通过调控其靶点FoxO3和AMPK抑制胃癌患者耐药性,调控其表达可以提高患者生存率。研究[15]发现, SIRT1可通过去乙酰化调节结肠癌的肿瘤活性,在结肠癌中SIRT1可以作为肿瘤抑制剂。本研究发现,结肠癌组织中SIRT1表达水平显著低于癌旁组织, 148例结肠癌组织标本中, SIRT1低表达105例,提示SIRT1可能通过介导结肠癌癌细胞的增殖、活性氧生成等过程,进而导致结肠癌的发生。
CSF1R为一种跨膜酪氨酸激酶受体,表达于单核细胞、粒细胞、组织巨噬细胞、树突状细胞及破骨细胞等,介导多种重要生理功能。研究[16]发现,在阿尔茨海默病中,小胶质细胞通过CSF1R信号传导参与斑块形成。抑制CSF1R可持久稳定地减少小胶质细胞数量,进而阻止斑块形成并调控海马神经元相关基因表达,在阿尔茨海默病中发挥重要作用。研究[17]发现, CSF1R参与巨噬细胞/小胶质细胞增殖、极化,抑制其表达可以抑制胶质瘤生长。研究[18]表明,甲基化是影响CSF1R表达的重要调控机制,而CSF1R低甲基化与肝癌患者不良的临床病理特征相关,其可能是肝癌的潜在免疫治疗靶点。研究[19]显示,在原发性结直肠癌肿瘤侵入前检测到CSF1R高表达,并与CPG的甲基化有关,通过促进结直肠癌的增殖、侵袭、迁移、上皮-间充质转化,参与疾病进展。本研究发现, CSF1R在结肠癌组织中呈高表达,且高表达患者3年生存率较低,提示CSF1R可能通过介导下游基因甲基化等过程,促进癌细胞增殖,或可作为预测结肠癌发生和预后的潜在生物标志物。进一步相关性分析显示, SIRT1和CSF1R蛋白在结肠癌组织中的表达具有负相关性,SIRT1与CSF1R蛋白在结直肠癌组织中的表达呈负相关。SIRT1、CSF1R、淋巴结转移、神经侵袭、浸润深度是结肠癌患者预后的影响因素,提示SIRT1与CSF1R可能通过调控结直肠癌的进展,影响淋巴结转移、神经侵犯及肿瘤浸润深度等病理特征。临床实践中,应密切监测这些指标,以优化患者的预后。
综上所述,结肠癌患者癌组织中SIRT1表达显著下调, CSF1R表达显著上调,且与淋巴结转移、神经侵袭、浸润深度等临床病理特征密切相关,检测其水平对评估患者预后具有重要价值。
-
表 1 SIRT1和CSF1R蛋白在结肠癌组织和癌旁组织中的表达情况[n(%)]
组织类型 n SIRT1 CSF1R 高表达 低表达 高表达 低表达 癌旁组织 148 99(66.89) 49(33.11) 53(35.81) 95(64.19) 结肠癌组织 148 43(29.05)* 105(70.95)* 112(75.68)* 36(24.32)* 与癌旁组织相比, * P < 0.05。 表 2 SIRT1和CSF1R蛋白与临床病理特征的关系[n(%)]
临床病理特征 分类 n SIRT1低表达(n=105) SIRT1高表达(n=43) χ2 P CSF1R低表达(n=36) CSF1R高表达(n=112) χ2 P 年龄 < 60岁 52 39(37.14) 13(80.23) 0.639 0.424 16(44.44) 36(32.14) 1.809 0.179 ≥60岁 96 66(62.86) 30(69.77) 20(55.56) 76(67.86) 性别 男 81 56(53.33) 25(58.14) 0.284 0.594 23(63.89) 58(51.79) 1.611 0.204 女 67 49(46.67) 18(41.86) 13(36.11) 54(48.21) 肿瘤直径 < 5 cm 69 45(42.86) 24(55.81) 2.058 0.151 19(52.78) 50(44.64) 0.714 0.395 ≥5 cm 79 60(57.14) 19(44.17) 17(47.22) 62(55.36) TNM分期 Ⅰ~Ⅱ期 85 55(52.38) 30(69.77) 3.772 0.052 25(69.44) 60(53.57) 2.808 0.094 Ⅲ~Ⅳ期 63 50(47.62) 13(30.23) 11(30.56) 52(46.43) 淋巴结转移 否 91 57(54.29) 34(79.07) 7.913 0.005 29(80.56) 62(55.36) 7.305 0.007 是 57 48(45.71) 9(20.93) 7(19.44) 50(44.64) 神经侵袭 有 43 38(36.19) 5(11.63) 8.929 0.003 4(11.11) 39(34.82) 7.430 0.006 无 105 67(63.81) 38(88.37) 32(88.89) 73(65.18) 浸润深度 T1~T2期 77 45(42.86) 32(74.42) 12.175 < 0.001 8(22.22) 69(61.61) 16.931 < 0.001 T3~T4期 71 60(57.14) 11(25.58) 28(77.78) 43(38.39) 表 3 SIRT1和CSF1R蛋白在结肠癌组织中的相关性
SIRT1 CSF1R r P 高表达(n=112) 低表达(n=36) 高表达(n=43) 23 20 -0.536 < 0.001 低表达(n=105) 89 16 表 4 结肠癌患者预后的影响因素
因素 B SE Wald P HR 95%CI SIRT1 -0.304 0.096 10.015 0.002 0.738 0.614~0.891 CSF1R 1.267 0.412 9.452 0.002 3.549 1.583~7.958 淋巴结转移 0.922 0.364 6.420 0.011 2.515 1.232~5.133 神经侵袭 1.619 0.223 7.704 0.006 1.857 1.199~2.875 浸润深度 0.755 0.296 6.509 0.011 2.128 1.191~3.801 -
[1] RUAN H, LEIBOWITZ B J, ZHANG L, et al. Immunogenic cell death in colon cancer prevention and therapy[J]. Mol Carcinog, 2020, 59(7): 783-793. doi: 10.1002/mc.23183
[2] 齐荣暄, 刘格良, 穆俊芳, 等. 结肠癌免疫相关基因筛选和预后模型建立[J]. 实用临床医药杂志, 2023, 27(14): 63-71, 77. doi: 10.7619/jcmp.20231576 [3] WEN J, MIN X J, SHEN M Q, et al. ACLY facilitates colon cancer cell metastasis by CTNNB1[J]. J Exp Clin Cancer Res, 2019, 38(1): 401. doi: 10.1186/s13046-019-1391-9
[4] GUPTA R, BHATT L K, JOHNSTON T P, et al. Colon cancer stem cells: potential target for the treatment of colorectal cancer[J]. Cancer Biol Ther, 2019, 20(8): 1068-1082. doi: 10.1080/15384047.2019.1599660
[5] ALVES-FERNANDES D K, JASIULIONIS M G. The role of SIRT1 on DNA damage response and epigenetic alterations in cancer[J]. Int J Mol Sci, 2019, 20(13): 3153. doi: 10.3390/ijms20133153
[6] HAGAN N, KANE J L, GROVER D, et al. CSF1R signaling is a regulator of pathogenesis in progressive MS[J]. Cell Death Dis, 2020, 11(10): 904. doi: 10.1038/s41419-020-03084-7
[7] LIU F T, BOUZNAD N, KALLER M, et al. Csf1r mediates enhancement of intestinal tumorigenesis caused by inactivation of Mir34a[J]. Int J Biol Sci, 2022, 18(14): 5415-5437. doi: 10.7150/ijbs.75503
[8] 中华人民共和国国家卫生和计划生育委员会. 结肠癌规范化诊疗指南(试行)[J]. 中国医学前沿杂志: 电子版, 2013, 5(8): 50-55. doi: 10.3969/j.issn.1674-7372.2013.08.011 [9] ROSLAN N H, MAKPOL S, MOHD YUSOF Y A. A review on dietary intervention in obesity associated colon cancer[J]. Asian Pac J Cancer Prev, 2019, 20(5): 1309-1319. doi: 10.31557/APJCP.2019.20.5.1309
[10] 邓龙廉, 孙海滨, 恩日乐图, 等. 列线图预测结直肠癌淋巴结转移的研究进展[J]. 实用临床医药杂志, 2023, 27(5): 143-148. doi: 10.7619/jcmp.20223328 [11] LI X Y, WEN D C, LI X K, et al. Identification of an immune signature predicting prognosis risk and lymphocyte infiltration in colon cancer[J]. Front Immunol, 2020, 11: 1678. doi: 10.3389/fimmu.2020.01678
[12] YANG Y S, LIU Y, WANG Y W, et al. Regulation of SIRT1 and its roles in inflammation[J]. Front Immunol, 2022, 13: 831168. doi: 10.3389/fimmu.2022.831168
[13] DASGUPTA A, SHUKLA S K, VERNUCCI E, et al. SIRT1-NOX4 signaling axis regulates cancer cachexia[J]. J Exp Med, 2020, 217(7): e20190745. doi: 10.1084/jem.20190745
[14] AN Y F, WANG B, WANG X, et al. SIRT1 inhibits chemoresistance and cancer stemness of gastric cancer by initiating an AMPK/FOXO3 positive feedback loop[J]. Cell Death Dis, 2020, 11(2): 115. doi: 10.1038/s41419-020-2308-4
[15] JUNG T Y, JIN G R, KOO Y B, et al. Deacetylation by SIRT1 promotes the tumor-suppressive activity of HINT1 by enhancing its binding capacity for β-catenin or MITF in colon cancer and melanoma cells[J]. Exp Mol Med, 2020, 52(7): 1075-1089. doi: 10.1038/s12276-020-0465-2
[16] SPANGENBERG E, SEVERSON P L, HOHSFIELD L A, et al. Sustained microglial depletion with CSF1R inhibitor impairs parenchymal plaque development in an Alzheimer's disease model[J]. Nat Commun, 2019, 10(1): 3758. doi: 10.1038/s41467-019-11674-z
[17] RAO R, HAN R, OGUREK S, et al. Glioblastoma genetic drivers dictate the function of tumor-associated macrophages/microglia and responses to CSF1R inhibition[J]. Neuro Oncol, 2022, 24(4): 584-597. doi: 10.1093/neuonc/noab228
[18] CUI B, FAN X X, ZHOU D Z, et al. CSF1R methylation is a key regulatory mechanism of tumor-associated macrophages in hepatocellular carcinoma[J]. Oncol Lett, 2020, 20(2): 1835-1845. doi: 10.3892/ol.2020.11726
[19] SHI X L, KALLER M, ROKAVEC M, et al. Characterization of a p53/miR-34a/CSF1R/STAT3 feedback loop in colorectal cancer[J]. Cell Mol Gastroenterol Hepatol, 2020, 10(2): 391-418. doi: 10.1016/j.jcmgh.2020.04.002




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
