Fatigue development trajectory and its influencing factors in middle-aged and elderly patients with stroke
-
摘要:目的
分析中老年脑卒中患者疲劳发展的轨迹类别并探讨其影响因素。
方法采用便利抽样法选取泸州市人民医院2021年1月—2023年1月住院的230例中老年脑卒中患者作为研究对象, 使用研究人员自行编制的一般资料调查表、疲劳严重程度量表(FSS)、匹兹堡睡眠质量指数(PSQI)、Beck抑郁量表(BDI)调查患者入院后2 d及出院后3、6个月的社会人口学资料和临床资料、疲劳、睡眠质量以及抑郁情况。采用潜变量增长模型拟合患者疲劳发展的类别轨迹,采用无序多分类Logistic回归模型分析疲劳发展轨迹类别的影响因素。
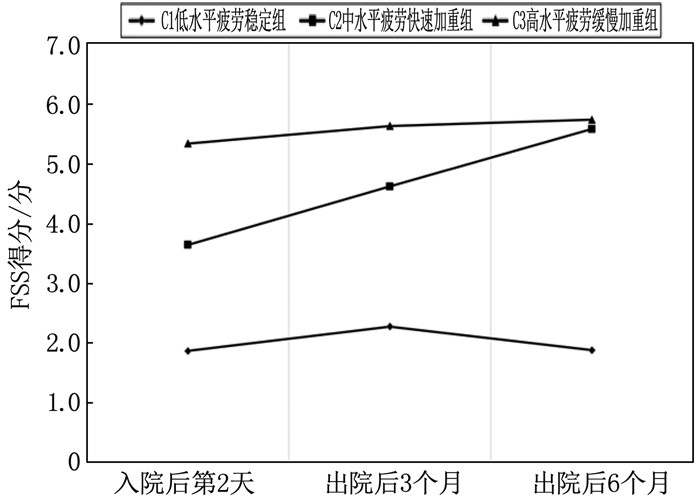
结果中老年脑卒中患者疲劳发展轨迹共呈现3个潜在类别,即低水平疲劳稳定组(33.04%)、中水平疲劳快速加重组(42.17%)和高水平疲劳缓慢加重组(24.79%)。无序多分类Logistic回归分析结果显示,年龄、婚姻状态、受教育程度、疾病严重程度、日常活动能力(ADL)评分、PSQI评分、BDI评分是中老年脑卒中患者疲劳发展轨迹的影响因素(均P < 0.05)。
结论中老年脑卒中患者疲劳发展轨迹具有群体异质性,护理人员应了解不同患者疲劳的演变特征,根据患者症状表现实施针对性的管理措施,改善患者健康结局。
Abstract:ObjectiveTo analyze the trajectory categories of fatigue development in middle-aged and elderly stroke patients and explore its influencing factors.
MethodsA convenient sampling method was used to select 230 middle-aged and elderly stroke patients in the Luzhou People's Hospital from January 2021 to January 2023 as the research subjects. A self-compiled general information-questionnaire, the Fatigue Severity Scale (FSS), the Pittsburgh Sleep Quality Index (PSQI), and the Beck Depression Inventory (BDI) were used to investigate the sociodemographic and clinical data, fatigue, sleep quality, and depression status of patients at 2 days after admission and 3 and 6 months after discharge. The latent growth curve model was used to fit the categories and trajectories of fatigue development, and the unordered multinomial Logistic regression model was used to analyze the influencing factors of trajectory categories of fatigue development.
ResultsThe fatigue development trajectory of middle-aged and elderly stroke patients showed three potential categories, namely the low-level fatigue stability group (33.04%), the medium-level fatigue rapid aggravation group (42.17%), and the high-level fatigue slow aggravation group (24.79%). The results of unordered multinomial Logistic regression analysis showed that age, marital status, education level, disease severity, the Activity of Daily Living (ADL) score, PSQI score, and BDI score were the influencing factors of fatigue development trajectory in middle-aged and elderly stroke patients (all P < 0.05).
ConclusionThe fatigue development trajectory of middle-aged and elderly stroke patients is heterogeneous. Nurses should understand the evolution characteristics of fatigue in different patients and implement targeted management measures according to patients'symptoms to improve their health outcomes.
-
阿尔茨海默病(AD)是一种以β-淀粉样蛋白沉积和微管相关蛋白tau异常为特征的进行性神经退行性疾病,临床上表现为记忆和认知功能障碍、语言和行为能力缺失,患者后期表现出严重的失忆症和运动功能减弱,最终导致死亡[1]。尽管AD的特征性病理改变已明确,但靶向这些病理蛋白的药物疗效欠佳,因此进一步筛查有效靶点非常必要。本研究基于生物信息学分析筛选影响AD发生的核心基因和相关信号通路,现报告如下。
阿尔茨海默病(AD)是一种以β-淀粉样蛋白沉积和微管相关蛋白tau异常为特征的进行性神经退行性疾病,临床上表现为记忆和认知功能障碍、语言和行为能力缺失,患者后期表现出严重的失忆症和运动功能减弱,最终导致死亡[1]。尽管AD的特征性病理改变已明确,但靶向这些病理蛋白的药物疗效欠佳,因此进一步筛查有效靶点非常必要。本研究基于生物信息学分析筛选影响AD发生的核心基因和相关信号通路,现报告如下。
1. 数据与方法
1. 数据与方法
1.1 数据来源
以“Alzheimer′s disease”为关键词搜索基因表达综合(GEO)数据库,并下载GSE227221[2]和GSE162873[3]这2个RNA-seq原始数据集。其中, GSE227221数据集包含217个AD组织样本和226个对照神经组织样本, GSE162873数据集则包含8个AD组织样本。所有样本均从原始资料库下载,且病理资料完整。
1.1 数据来源
以“Alzheimer′s disease”为关键词搜索基因表达综合(GEO)数据库,并下载GSE227221[2]和GSE162873[3]这2个RNA-seq原始数据集。其中, GSE227221数据集包含217个AD组织样本和226个对照神经组织样本, GSE162873数据集则包含8个AD组织样本。所有样本均从原始资料库下载,且病理资料完整。
1.2 生物信息学分析方法
1.2 生物信息学分析方法
1.2.1 差异表达基因(DEGs)的筛选与分析
将GSE227221和GSE162873数据集导入GEO2R在线分析软件(该软件为交互式在线工具,能够比较2组或多组GEO序列数据,明确实验条件下哪些基因发生了显著变化)中,筛选出AD组织样本和正常脑组织样本之间的DEGs, 筛选标准为log2(FC)>1(FC为差异倍数)和P<0.05。
1.2.1 差异表达基因(DEGs)的筛选与分析
将GSE227221和GSE162873数据集导入GEO2R在线分析软件(该软件为交互式在线工具,能够比较2组或多组GEO序列数据,明确实验条件下哪些基因发生了显著变化)中,筛选出AD组织样本和正常脑组织样本之间的DEGs, 筛选标准为log2(FC)>1(FC为差异倍数)和P<0.05。
1.2.2 DEGs的疾病本体论(DO)、基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析
使用R软件DOSE包对DEGs进行DO基因富集分析。利用在线数据分析工具DAVID对筛选后的DEGs进行GO功能分析,包括生物学过程、细胞成分和分子功能共3个方面的内容,这有助于理解这些DEGs的生物学功能及其在细胞中的定位。利用在线分析工具DAVID进行KEGG通路富集分析,明确这些DEGs在生物学过程中的角色及其参与的生物学通路。分析结果以柱状图和气泡图形式展示, P<0.05表示差异有统计学意义。
1.2.2 DEGs的疾病本体论(DO)、基因本体论(GO)和京都基因与基因组百科全书(KEGG)富集分析
使用R软件DOSE包对DEGs进行DO基因富集分析。利用在线数据分析工具DAVID对筛选后的DEGs进行GO功能分析,包括生物学过程、细胞成分和分子功能共3个方面的内容,这有助于理解这些DEGs的生物学功能及其在细胞中的定位。利用在线分析工具DAVID进行KEGG通路富集分析,明确这些DEGs在生物学过程中的角色及其参与的生物学通路。分析结果以柱状图和气泡图形式展示, P<0.05表示差异有统计学意义。
1.2.3 枢纽基因的筛选与分析
将筛选出的DEGs导入STRING在线数据库,进行蛋白质交互作用分析。STRING数据库提供了蛋白质之间已知和预测的相互作用信息,这些信息来源于共轭、实验室测试、共表达以及文献记录。本研究利用Cytoscape(版本3.7.2)软件构建蛋白质-蛋白质相互作用(PPI)网络。通过MCODE插件进行枢纽基因筛选,设置参数为关联程度阈值(Degree Cutoff)=2, 节点评分阈值(Node Score Cutoff)=0.2, 最小核心阈值(K-Core)=2, 最大深度(Max Depth)=100。这些参数有助于确定网络内高度相互连接的区域。
1.2.3 枢纽基因的筛选与分析
将筛选出的DEGs导入STRING在线数据库,进行蛋白质交互作用分析。STRING数据库提供了蛋白质之间已知和预测的相互作用信息,这些信息来源于共轭、实验室测试、共表达以及文献记录。本研究利用Cytoscape(版本3.7.2)软件构建蛋白质-蛋白质相互作用(PPI)网络。通过MCODE插件进行枢纽基因筛选,设置参数为关联程度阈值(Degree Cutoff)=2, 节点评分阈值(Node Score Cutoff)=0.2, 最小核心阈值(K-Core)=2, 最大深度(Max Depth)=100。这些参数有助于确定网络内高度相互连接的区域。
1.2.4 核心基因的筛选
根据MCODE评分,对枢纽基因进一步分析并筛选出核心基因。筛选条件为MCODE评分>10, 且评分由高到低排序。选取排名前6位的基因作为核心基因,推测其可能在AD的发生、进展及细胞凋亡过程中发挥关键作用。
1.2.4 核心基因的筛选
根据MCODE评分,对枢纽基因进一步分析并筛选出核心基因。筛选条件为MCODE评分>10, 且评分由高到低排序。选取排名前6位的基因作为核心基因,推测其可能在AD的发生、进展及细胞凋亡过程中发挥关键作用。
2. 结果
2. 结果
2.1 DEGs的筛选与分析
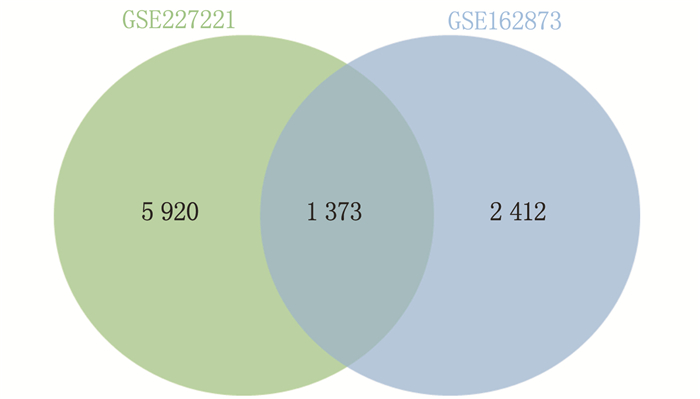
本研究从GSE227221和GSE162873数据集中共筛选出9 705个相关基因,其中GSE227221数据集筛选出7 293个相关基因, GSE162873数据集筛选出3 785个相关基因。将这2个数据集筛选出的基因取交集,共筛选出1 373个DEGs, 这些基因具有相同变化趋势,见图 1。
2.1 DEGs的筛选与分析
本研究从GSE227221和GSE162873数据集中共筛选出9 705个相关基因,其中GSE227221数据集筛选出7 293个相关基因, GSE162873数据集筛选出3 785个相关基因。将这2个数据集筛选出的基因取交集,共筛选出1 373个DEGs, 这些基因具有相同变化趋势,见图 1。
2.2 DO基因富集分析、GO基因富集分析和KEGG通路富集分析结果
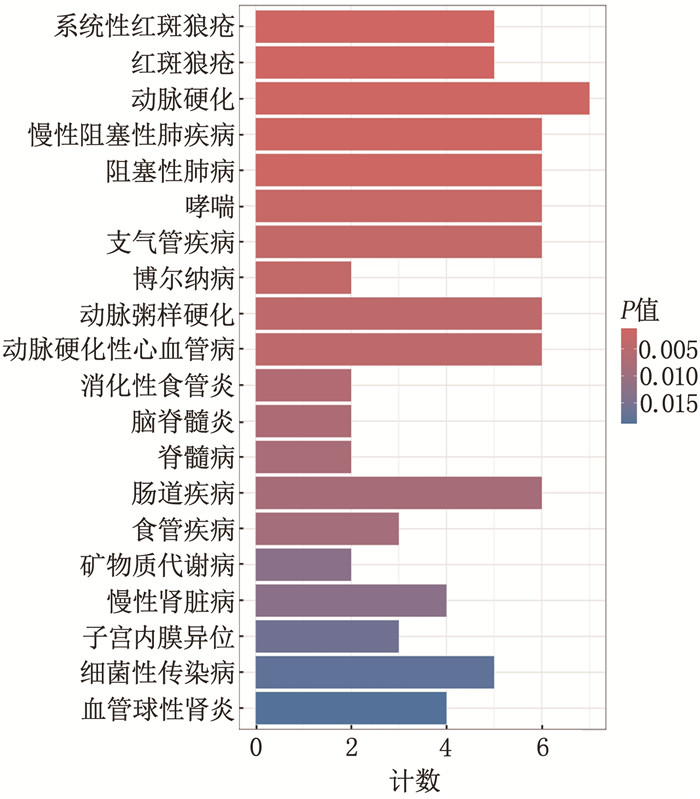
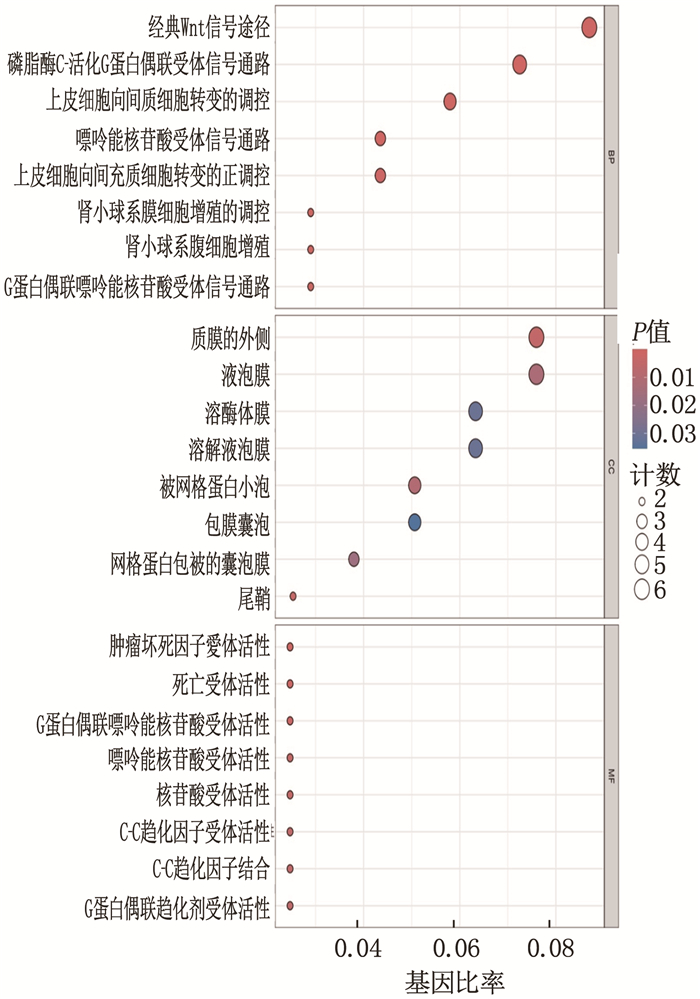
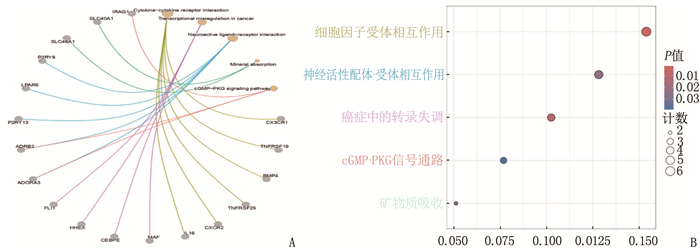
DO基因富集分析结果显示,这些DEGs与系统性红斑狼疮、红斑狼疮和动脉硬化这3种疾病最为相关,见图 2。GO功能富集分析结果显示,这些DEGs主要富集于3条信号通路,即经典Wnt信号通路、磷脂酶C-活化G蛋白质-耦合受体通路和等离子体外侧膜通路,见图 3。KEGG信号通路富集分析结果显示,这些DEGs主要富集于以下通路,包括细胞因子-细胞因子受体相互作用、神经元活性配体-受体相互作用、癌症相关的转录失调,见图 4。
2.2 DO基因富集分析、GO基因富集分析和KEGG通路富集分析结果
DO基因富集分析结果显示,这些DEGs与系统性红斑狼疮、红斑狼疮和动脉硬化这3种疾病最为相关,见图 2。GO功能富集分析结果显示,这些DEGs主要富集于3条信号通路,即经典Wnt信号通路、磷脂酶C-活化G蛋白质-耦合受体通路和等离子体外侧膜通路,见图 3。KEGG信号通路富集分析结果显示,这些DEGs主要富集于以下通路,包括细胞因子-细胞因子受体相互作用、神经元活性配体-受体相互作用、癌症相关的转录失调,见图 4。
2.3 枢纽基因的筛选与分析
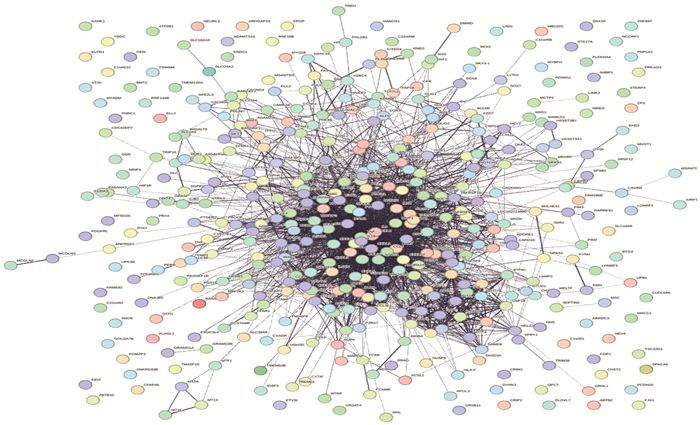
将DEGs导入STRING数据库,并利用Cytoscape软件构建PPI网络,该网络包含114个节点蛋白和76条边,见图 5。采用MCODE插件分析并挖掘网络中与AD诊断相关的基因,筛选出显著的相互作用模块,称为枢纽基因。本研究筛选出的枢纽基因网络包含61条边及20个节点蛋白,进一步筛选出的共同枢纽基因为 GIMAP1、GIMAP4、GIMAP5、GIMAP6、GIMAP7 及 GIMAP1-GIMAP5 。
2.3 枢纽基因的筛选与分析
将DEGs导入STRING数据库,并利用Cytoscape软件构建PPI网络,该网络包含114个节点蛋白和76条边,见图 5。采用MCODE插件分析并挖掘网络中与AD诊断相关的基因,筛选出显著的相互作用模块,称为枢纽基因。本研究筛选出的枢纽基因网络包含61条边及20个节点蛋白,进一步筛选出的共同枢纽基因为 GIMAP1、GIMAP4、GIMAP5、GIMAP6、GIMAP7 及 GIMAP1-GIMAP5 。
2.4 核心基因的筛选
应用Cytoscape软件中的MCODE插件,筛选条件设定为MCODE评分>10, 并按评分由高至低排序,选取前6个基因作为本研究的核心基因,即 GIMAP1、GIMAP4、GIMAP5、GIMAP6、GIMAP7 及 GIMAP1-GIMAP5 , 见图 6。
2.4 核心基因的筛选
应用Cytoscape软件中的MCODE插件,筛选条件设定为MCODE评分>10, 并按评分由高至低排序,选取前6个基因作为本研究的核心基因,即 GIMAP1、GIMAP4、GIMAP5、GIMAP6、GIMAP7 及 GIMAP1-GIMAP5 , 见图 6。
3. 讨论
痴呆是一种以记忆力、语言能力、执行能力和空间视觉能力进行性下降为特征的临床综合征,最终可导致个性和行为改变,丧失生活自理能力。目前, AD是痴呆的主要病因(占60%~80%)[4],这一现象部分归因于人口老龄化。据估计,全球范围内AD每年影响超过5 000万老年人,同时间接影响数千万AD患者配偶的生活,造成沉重的家庭负担和社会负担[5]。AD的发病机制尚未完全阐明。一小部分AD患者发病与3个基因的显性突变有关,分别为淀粉样前体蛋白(APP)、早老素1(PSEN1)和早老素2(PSEN2), 这些患者通常在65岁前发病[6]。大多数患者呈现散发趋势,发病年龄超过65岁。尽管AD没有明显的遗传性,但已有证据支持存在多种遗传风险因素,例如载脂蛋白E的E4等位基因存在于约16%的AD患者中。针对β-淀粉样蛋白开发的药物仅能缓解症状[7], 因此寻找新的治疗靶点至关重要。
本研究基于生物信息学分析对2个数据集的基因进行比对,共筛选出参与AD发生和进展的1 373个相同趋势的DEGs, 并筛选验证出核心基因GIMAP。人GIMAP基因全称GTP酶免疫相关蛋白,定位于第7号染色体,大小约为500 kb,包含7个功能性基因(GIMAP1、GIMAP2、GIMAP4、GIMAP5、GIMAP6、GIMAP7、GIMAP8)和1个假基因[8]。该基因此前被称为免疫相关核苷酸结合蛋白(IANs), 是一种小的GTP结合分子,具有共同的“AIG”GTP结合域,存在于高等植物和多细胞动物[9]。哺乳动物GIMAP基因(小鼠存在8个亚型,人类存在7个亚型[10])紧密聚集在一个单染色体位置上,这些基因优先表达于造血细胞和淋巴细胞,但近年来有研究[10]提示这些基因亦可表达于非血液细胞。本研究生物信息学分析也发现, GIMAP5 基因在AD神经组织中异常表达,提示AD与血液细胞或免疫细胞之间可能存在某种联系。
早在上世纪50年代,人们就观察到免疫功能异常与痴呆之间可能存在某种联系。1953年, GROSCH H[11]报道1名9岁女孩在接种咳嗽疫苗后,出现皮质下痴呆伴运动功能障碍。然而,随后的70年间,学者们并未发现痴呆或AD与免疫功能之间的确切关联。虽然免疫细胞对神经细胞有吞噬现象,可能对神经细胞造成免疫损伤[12-13],但并未发现这种损伤与AD病理改变如神经纤维缠结及Tau蛋白异常之间的直接联系。
GIMAP蛋白与GTPase在氨基末端序列相似,均包含鸟嘌呤核苷酸结合域[14-15]。这些蛋白大多参与了淋巴细胞的维持与发展。在小鼠模型中, GIMAP5的缺陷导致外周T细胞、B细胞和自然杀伤细胞(NK细胞)的数量减少[16-17]。GIMAP1对T细胞增殖的维持和B细胞功能的成熟至关重要[18-19]。GIMAP4可能促进T细胞的凋亡[20]。敲除GIMAP6使得Jurkat细胞系对凋亡诱导剂变得敏感[21]。鉴于GIMAP基因家族对维持免疫细胞功能的重要性[22], GIMAP基因的异常会导致免疫细胞功能障碍,从而减少免疫细胞对老化及异常神经元的清除和吞噬,增加痴呆或AD的发病风险。
本研究对筛选出的DEGs进行3种类型的富集分析,包括DO基因富集分析、GO功能富集分析和KEGG信号通路富集分析。DO基因富集分析结果显示,这些DEGs主要富集于系统性红斑狼疮、红斑狼疮和动脉硬化这3种疾病,而这3种疾病均与免疫功能异常有关[23-25]。系统性红斑狼疮和红斑狼疮均为自身免疫性疾病,与免疫功能异常关系密切,尽管动脉硬化与免疫功能异常无直接关系,但近年来的研究显示免疫功能异常参与动脉硬化的病理过程。GO功能富集分析结果显示, DEGs主要富集于经典Wnt信号通路、磷脂酶C-活化G蛋白质-耦合受体通路和等离子体外侧膜通路。值得注意的是,这3条信号通路均与GIMAP基因有关,存在一定的调控关系。KEGG信号通路富集分析结果显示,排名前3位的疾病通路分别为细胞因子-细胞因子受体相互作用、神经元活性配体-受体相互作用、癌症相关的转录失调。由此提示, AD与GIMAP基因及这些通路之间存在某种联系。
综上所述, GIMAP基因是AD发病的核心基因,其可能处于AD其他病理改变的上游。鉴于GIMAP基因与免疫功能维持的紧密关系,本研究推测AD是一种由免疫功能紊乱导致的疾病。
3. 讨论
痴呆是一种以记忆力、语言能力、执行能力和空间视觉能力进行性下降为特征的临床综合征,最终可导致个性和行为改变,丧失生活自理能力。目前, AD是痴呆的主要病因(占60%~80%)[4],这一现象部分归因于人口老龄化。据估计,全球范围内AD每年影响超过5 000万老年人,同时间接影响数千万AD患者配偶的生活,造成沉重的家庭负担和社会负担[5]。AD的发病机制尚未完全阐明。一小部分AD患者发病与3个基因的显性突变有关,分别为淀粉样前体蛋白(APP)、早老素1(PSEN1)和早老素2(PSEN2), 这些患者通常在65岁前发病[6]。大多数患者呈现散发趋势,发病年龄超过65岁。尽管AD没有明显的遗传性,但已有证据支持存在多种遗传风险因素,例如载脂蛋白E的E4等位基因存在于约16%的AD患者中。针对β-淀粉样蛋白开发的药物仅能缓解症状[7], 因此寻找新的治疗靶点至关重要。
本研究基于生物信息学分析对2个数据集的基因进行比对,共筛选出参与AD发生和进展的1 373个相同趋势的DEGs, 并筛选验证出核心基因GIMAP。人GIMAP基因全称GTP酶免疫相关蛋白,定位于第7号染色体,大小约为500 kb,包含7个功能性基因(GIMAP1、GIMAP2、GIMAP4、GIMAP5、GIMAP6、GIMAP7、GIMAP8)和1个假基因[8]。该基因此前被称为免疫相关核苷酸结合蛋白(IANs), 是一种小的GTP结合分子,具有共同的“AIG”GTP结合域,存在于高等植物和多细胞动物[9]。哺乳动物GIMAP基因(小鼠存在8个亚型,人类存在7个亚型[10])紧密聚集在一个单染色体位置上,这些基因优先表达于造血细胞和淋巴细胞,但近年来有研究[10]提示这些基因亦可表达于非血液细胞。本研究生物信息学分析也发现, GIMAP5 基因在AD神经组织中异常表达,提示AD与血液细胞或免疫细胞之间可能存在某种联系。
早在上世纪50年代,人们就观察到免疫功能异常与痴呆之间可能存在某种联系。1953年, GROSCH H[11]报道1名9岁女孩在接种咳嗽疫苗后,出现皮质下痴呆伴运动功能障碍。然而,随后的70年间,学者们并未发现痴呆或AD与免疫功能之间的确切关联。虽然免疫细胞对神经细胞有吞噬现象,可能对神经细胞造成免疫损伤[12-13],但并未发现这种损伤与AD病理改变如神经纤维缠结及Tau蛋白异常之间的直接联系。
GIMAP蛋白与GTPase在氨基末端序列相似,均包含鸟嘌呤核苷酸结合域[14-15]。这些蛋白大多参与了淋巴细胞的维持与发展。在小鼠模型中, GIMAP5的缺陷导致外周T细胞、B细胞和自然杀伤细胞(NK细胞)的数量减少[16-17]。GIMAP1对T细胞增殖的维持和B细胞功能的成熟至关重要[18-19]。GIMAP4可能促进T细胞的凋亡[20]。敲除GIMAP6使得Jurkat细胞系对凋亡诱导剂变得敏感[21]。鉴于GIMAP基因家族对维持免疫细胞功能的重要性[22], GIMAP基因的异常会导致免疫细胞功能障碍,从而减少免疫细胞对老化及异常神经元的清除和吞噬,增加痴呆或AD的发病风险。
本研究对筛选出的DEGs进行3种类型的富集分析,包括DO基因富集分析、GO功能富集分析和KEGG信号通路富集分析。DO基因富集分析结果显示,这些DEGs主要富集于系统性红斑狼疮、红斑狼疮和动脉硬化这3种疾病,而这3种疾病均与免疫功能异常有关[23-25]。系统性红斑狼疮和红斑狼疮均为自身免疫性疾病,与免疫功能异常关系密切,尽管动脉硬化与免疫功能异常无直接关系,但近年来的研究显示免疫功能异常参与动脉硬化的病理过程。GO功能富集分析结果显示, DEGs主要富集于经典Wnt信号通路、磷脂酶C-活化G蛋白质-耦合受体通路和等离子体外侧膜通路。值得注意的是,这3条信号通路均与GIMAP基因有关,存在一定的调控关系。KEGG信号通路富集分析结果显示,排名前3位的疾病通路分别为细胞因子-细胞因子受体相互作用、神经元活性配体-受体相互作用、癌症相关的转录失调。由此提示, AD与GIMAP基因及这些通路之间存在某种联系。
综上所述, GIMAP基因是AD发病的核心基因,其可能处于AD其他病理改变的上游。鉴于GIMAP基因与免疫功能维持的紧密关系,本研究推测AD是一种由免疫功能紊乱导致的疾病。
-
表 1 中老年脑卒中患者疲劳发展轨迹模型适配指标拟合结果
类别 AIC BIC aBIC Entropy PLMR PBLRT 类别概率 1 7 096.938 7 063.542 6 708.934 — — — — 2 6 886.836 6 922.936 6 701.097 0.756 < 0.001 < 0.001 0.52/0.48 3 6 854.934 6 877.930 6 700.305 0.892 < 0.001 < 0.001 0.33/0.42/0.25 4 6 821.032 6 794.239 6 692.303 0.811 0.134 0.013 0.38/0.48/0.05/0.09 5 6 781.833 6 728.005 6 605.304 0.817 0.274 0.025 0.47/0.30/0.25/0.24/0.14 AIC: 赤池信息准则; BIC: 贝叶斯信息准则; aBIC: 样本校正的BIC; Entropy: 熵值; LMR: 罗-梦戴尔-鲁本校正似然比检验;
BLRT: 基于Bootstraped的似然比检验。表 1 中老年脑卒中患者疲劳发展轨迹模型适配指标拟合结果
类别 AIC BIC aBIC Entropy PLMR PBLRT 类别概率 1 7 096.938 7 063.542 6 708.934 — — — — 2 6 886.836 6 922.936 6 701.097 0.756 < 0.001 < 0.001 0.52/0.48 3 6 854.934 6 877.930 6 700.305 0.892 < 0.001 < 0.001 0.33/0.42/0.25 4 6 821.032 6 794.239 6 692.303 0.811 0.134 0.013 0.38/0.48/0.05/0.09 5 6 781.833 6 728.005 6 605.304 0.817 0.274 0.025 0.47/0.30/0.25/0.24/0.14 AIC: 赤池信息准则; BIC: 贝叶斯信息准则; aBIC: 样本校正的BIC; Entropy: 熵值; LMR: 罗-梦戴尔-鲁本校正似然比检验;
BLRT: 基于Bootstraped的似然比检验。表 2 中老年脑卒中患者疲劳轨迹类别的单因素分析(n=230)(x ± s)[n(%)]
因素 分类 总体 C1低水平疲劳稳定组(n=76) C2中水平疲劳快速加重组(n=97) C3高水平疲劳缓慢加重组(n=57) 统计量 P 年龄/岁 62.2±10.8 57.3±9.4 63.2±10.1 64.4±9.8 23.293 < 0.001 性别 男 156(67.8) 47(61.8) 68(70.1) 41(71.9) 4.283 0.141 女 74(32.2) 29(38.2) 29(29.9) 16(28.1) BMI < 18.5 kg/m2 3(1.3) 0 2(2.1) 1(1.7) 3.246 0.188 18.5~ < 24.0 kg/m2 83(36.1) 26(34.2) 28(28.9) 29(50.9) 24.0~ < 28.0 kg/m2 104(45.2) 24(31.6) 53(54.6) 27(47.4) ≥28.0 kg/m2 40(17.4) 26(34.2) 14(14.4) 0 婚姻状况 已婚 186(80.9) 46(60.5) 85(87.6) 55(96.5) 7.389 0.025 未婚/离异/丧偶 44(19.1) 30(39.5) 12(12.4) 2(3.5) 受教育程度 小学及以下 86(37.4) 42(55.3) 21(21.7) 23(40.4) 30.283 < 0.001 初中 53(23.0) 11(14.5) 24(24.7) 18(31.6) 高中/中专 51(22.2) 13(17.0) 27(27.8) 11(19.2) 大专及以上 40(17.4) 10(13.2) 25(25.8) 5(8.8) 居住方式 独居 36(15.7) 9(11.8) 11(11.3) 16(28.1) 3.245 0.211 配偶/子女 194(84.3) 67(88.2) 86(88.7) 41(71.9) 人均月收入 ≤1 000元人民币 90(39.1) 37(48.7) 24(24.7) 29(50.9) 3.345 0.243 >1 000~3 000元人民币 82(36.7) 22(28.9) 38(39.2) 22(38.6) >3 000~5 000元人民币 34(14.8) 10(13.2) 19(19.6) 5(8.8) >5 000元人民币 24(10.4) 7(9.2) 16(16.5) 1(1.7) 慢性病情况 0种 54(23.5) 26(34.2) 21(21.6) 7(12.3) 7.384 < 0.001 1种 98(42.6) 21(27.6) 48(49.5) 29(50.9) ≥2种 78(33.9) 29(38.2) 28(28.9) 21(36.8) 卒中类型 出血性 27(11.7) 6(7.9) 15(15.5) 6(10.5) 1.493 0.321 缺血性 203(88.3) 70(92.1) 82(84.5) 51(89.5) 卒中部位 左侧 88(38.3) 12(15.8) 42(43.3) 34(59.6) 2.831 0.276 右侧 84(36.5) 32(42.1) 36(37.1) 16(28.1) 双侧 58(25.2) 32(42.1) 19(19.6) 7(12.3) NIHSS评分/分 8.4±2.2 6.3±1.1 9.5±2.4 10.3±2.6 6.293 < 0.001 ADL评分/分 17.7±4.1 20.3±5.4 16.7±4.6 15.3±3.1 18.392 < 0.001 PSQI评分/分 6.9±3.6 5.3±0.7 6.3±0.8 8.3±0.6 7.293 < 0.001 BDI评分/分 9.6±7.6 5.0±2.6 9.3±2.2 11.2±3.4 8.394 < 0.001 表 2 中老年脑卒中患者疲劳轨迹类别的单因素分析(n=230)(x ± s)[n(%)]
因素 分类 总体 C1低水平疲劳稳定组(n=76) C2中水平疲劳快速加重组(n=97) C3高水平疲劳缓慢加重组(n=57) 统计量 P 年龄/岁 62.2±10.8 57.3±9.4 63.2±10.1 64.4±9.8 23.293 < 0.001 性别 男 156(67.8) 47(61.8) 68(70.1) 41(71.9) 4.283 0.141 女 74(32.2) 29(38.2) 29(29.9) 16(28.1) BMI < 18.5 kg/m2 3(1.3) 0 2(2.1) 1(1.7) 3.246 0.188 18.5~ < 24.0 kg/m2 83(36.1) 26(34.2) 28(28.9) 29(50.9) 24.0~ < 28.0 kg/m2 104(45.2) 24(31.6) 53(54.6) 27(47.4) ≥28.0 kg/m2 40(17.4) 26(34.2) 14(14.4) 0 婚姻状况 已婚 186(80.9) 46(60.5) 85(87.6) 55(96.5) 7.389 0.025 未婚/离异/丧偶 44(19.1) 30(39.5) 12(12.4) 2(3.5) 受教育程度 小学及以下 86(37.4) 42(55.3) 21(21.7) 23(40.4) 30.283 < 0.001 初中 53(23.0) 11(14.5) 24(24.7) 18(31.6) 高中/中专 51(22.2) 13(17.0) 27(27.8) 11(19.2) 大专及以上 40(17.4) 10(13.2) 25(25.8) 5(8.8) 居住方式 独居 36(15.7) 9(11.8) 11(11.3) 16(28.1) 3.245 0.211 配偶/子女 194(84.3) 67(88.2) 86(88.7) 41(71.9) 人均月收入 ≤1 000元人民币 90(39.1) 37(48.7) 24(24.7) 29(50.9) 3.345 0.243 >1 000~3 000元人民币 82(36.7) 22(28.9) 38(39.2) 22(38.6) >3 000~5 000元人民币 34(14.8) 10(13.2) 19(19.6) 5(8.8) >5 000元人民币 24(10.4) 7(9.2) 16(16.5) 1(1.7) 慢性病情况 0种 54(23.5) 26(34.2) 21(21.6) 7(12.3) 7.384 < 0.001 1种 98(42.6) 21(27.6) 48(49.5) 29(50.9) ≥2种 78(33.9) 29(38.2) 28(28.9) 21(36.8) 卒中类型 出血性 27(11.7) 6(7.9) 15(15.5) 6(10.5) 1.493 0.321 缺血性 203(88.3) 70(92.1) 82(84.5) 51(89.5) 卒中部位 左侧 88(38.3) 12(15.8) 42(43.3) 34(59.6) 2.831 0.276 右侧 84(36.5) 32(42.1) 36(37.1) 16(28.1) 双侧 58(25.2) 32(42.1) 19(19.6) 7(12.3) NIHSS评分/分 8.4±2.2 6.3±1.1 9.5±2.4 10.3±2.6 6.293 < 0.001 ADL评分/分 17.7±4.1 20.3±5.4 16.7±4.6 15.3±3.1 18.392 < 0.001 PSQI评分/分 6.9±3.6 5.3±0.7 6.3±0.8 8.3±0.6 7.293 < 0.001 BDI评分/分 9.6±7.6 5.0±2.6 9.3±2.2 11.2±3.4 8.394 < 0.001 表 3 中老年脑卒中患者疲劳轨迹类别的无序多分类Logistic分析(n=230)
自变量 C1对比C2 C1对比C3 β P OR(95%CI) β P OR(95%CI) 年龄 0.734 0.025 1.233(1.098~2.983) 1.293 0.001 2.934(1.283~4.036) 婚姻状况(以已婚为参照) 未婚/离异/丧偶 0.876 0.003 2.366(1.012~4.847) 1.934 0.083 4.393(0.022~6.036) 受教育程度(以大专及以上为参照) 小学及以下 0.844 0.066 2.383(0.835~6.934) 2.934 0.027 7.492(4.936~11.930) 初中 0.368 0.736 1.238(0.408~4.036) 1.934 0.075 4.036(0.348~12.037) 高中/中专 0.896 0.118 2.934(0.749~6.037) 1.847 0.288 6.034(0.749~6.037) 慢病情况(以0种为参照) 1种 0.676 0.395 2.843(0.834~7.935) 1.394 0.003 4.034(1.034~9.038) ≥2种 0.662 0.431 1.937(0.385~7.937) 0.935 0.877 1.034(0.932~17.947) NIHSS评分 0.745 0.010 2.835(1.023~7.034) 1.023 0.004 5.023(1.035~6.036) ADL评分 -2.632 0.002 0.734(0.129~0.996) -2.034 0.001 0.443(0.304~0.499) PSQI评分 2.384 0.014 3.495(1.934~5.036) 2.394 0.002 5.934(2.203~5.036) BDI评分 1.283 0.006 3.293(1.239~19.034) 2.034 0.003 7.003(3.034~18.035) C1: 低水平疲劳稳定; C2: 中水平疲劳快速加重; C3: 高水平疲劳缓慢加重; NIHSS: 美国国立卫生研究院卒中量表;
ADL: 日常活动能力; PSQI: 匹兹堡睡眠质量指数; BDI: Beck抑郁量表。表 3 中老年脑卒中患者疲劳轨迹类别的无序多分类Logistic分析(n=230)
自变量 C1对比C2 C1对比C3 β P OR(95%CI) β P OR(95%CI) 年龄 0.734 0.025 1.233(1.098~2.983) 1.293 0.001 2.934(1.283~4.036) 婚姻状况(以已婚为参照) 未婚/离异/丧偶 0.876 0.003 2.366(1.012~4.847) 1.934 0.083 4.393(0.022~6.036) 受教育程度(以大专及以上为参照) 小学及以下 0.844 0.066 2.383(0.835~6.934) 2.934 0.027 7.492(4.936~11.930) 初中 0.368 0.736 1.238(0.408~4.036) 1.934 0.075 4.036(0.348~12.037) 高中/中专 0.896 0.118 2.934(0.749~6.037) 1.847 0.288 6.034(0.749~6.037) 慢病情况(以0种为参照) 1种 0.676 0.395 2.843(0.834~7.935) 1.394 0.003 4.034(1.034~9.038) ≥2种 0.662 0.431 1.937(0.385~7.937) 0.935 0.877 1.034(0.932~17.947) NIHSS评分 0.745 0.010 2.835(1.023~7.034) 1.023 0.004 5.023(1.035~6.036) ADL评分 -2.632 0.002 0.734(0.129~0.996) -2.034 0.001 0.443(0.304~0.499) PSQI评分 2.384 0.014 3.495(1.934~5.036) 2.394 0.002 5.934(2.203~5.036) BDI评分 1.283 0.006 3.293(1.239~19.034) 2.034 0.003 7.003(3.034~18.035) C1: 低水平疲劳稳定; C2: 中水平疲劳快速加重; C3: 高水平疲劳缓慢加重; NIHSS: 美国国立卫生研究院卒中量表;
ADL: 日常活动能力; PSQI: 匹兹堡睡眠质量指数; BDI: Beck抑郁量表。 -
[1] CHEN Z H, JIANG B, RU X J, et al. Mortality of stroke and its subtypes in China: results from a nationwide population-based survey[J]. Neuroepidemiology, 2017, 48(3/4): 95-102.
[2] KJEVERUD A, ØSTLIE K, SCHANKE A K, et al. Trajectories of fatigue among stroke patients from the acute phase to 18 months post-injury: a latent class analysis[J]. PLoS One, 2020, 15(4): e0231709. doi: 10.1371/journal.pone.0231709
[3] ENGLISH C, SIMPSON D B, BILLINGER S A, et al. A roadmap for research in post-stroke fatigue: Consensus-based core recommendations from the third Stroke Recovery and Rehabilitation Roundtable[J]. Int J Stroke, 2024, 19(2): 133-144. doi: 10.1177/17474930231189135
[4] CHALOS V, VAN DER ENDE N A M, LINGSMA H F, et al. National institutes of health stroke scale: an alternative primary outcome measure for trials of acute treatment for ischemic stroke[J]. Stroke, 2020, 51(1): 282-290. doi: 10.1161/STROKEAHA.119.026791
[5] MAHONEY F I, BARTHEL D W. Functional evaluation: the barthel index[J]. Md State Med J, 1965, 14: 61-65.
[6] KRUPP L B, LAROCCA N G, MUIR-NASH J, et al. The fatigue severity scale. Application to patients with multiple sclerosis and systemic lupus erythematosus[J]. Arch Neurol, 1989, 46(10): 1121-1123. doi: 10.1001/archneur.1989.00520460115022
[7] 吴春薇, 王得新. 疲劳严重度量表中译本应用于脑梗死患者的临床与评价[J]. 中华物理医学与康复杂志, 2007, 29(9): 608-611. doi: 10.3760/j.issn:0254-1424.2007.09.009 [8] BUYSSE D J, REYNOLDS C F 3rd, MONK T H, et al. The Pittsburgh Sleep Quality Index: a new instrument for psychiatric practice and research[J]. Psychiatry Res, 1989, 28(2): 193-213. doi: 10.1016/0165-1781(89)90047-4
[9] 刘贤臣, 唐茂芹, 胡蕾, 等. 匹兹堡睡眠质量指数的信度和效度研究[J]. 中华精神科杂志, 1996, 29(2): 103-107. [10] BECK A T, EPSTEIN N, BROWN G, et al. An inventory for measuring clinical anxiety: psychometric properties[J]. J Consult Clin Psychol, 1988, 56(6): 893-897. doi: 10.1037/0022-006X.56.6.893
[11] 吴才智, 马娜, 黄婷婷, 等. 知觉压力与大学生自杀意念: 心理复原力和抑郁的链式中介作用[J]. 西安交通大学学报: 医学版, 2024, 45(3): 371-375. [12] BECK A T, GUTH D, STEER R A, et al. Screening for major depression disorders in medical inpatients with the Beck Depression Inventory for Primary Care[J]. Behav Res Ther, 1997, 35(8): 785-791. doi: 10.1016/S0005-7967(97)00025-9
[13] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性卒中诊治指南2023[J]. 中华神经科杂志, 2024, 57(6): 523-559. doi: 10.3760/cma.j.cn113694-20240410-00221 [14] 薛荣, 张开利, 陈保云, 等. 中老年脑卒中患者多维衰弱发展轨迹及其影响因素研究[J]. 护理学报, 2024, 31(6): 6-12. [15] 李晓青, 程磊, 周云庆, 等. 社区脑卒中患者居家康复工作流程的现状与改良[J]. 中华全科医师杂志, 2017, 16(3): 190-194. [16] 貌雯靖, 罗颖, 詹杰, 等. 脑卒中后疲劳严重程度的影响因素分析[J]. 中西医结合心脑血管病杂志, 2024, 22(9): 1675-1677. [17] KWON S, JIN C, CHO S Y, et al. Analysis of factors affecting post-stroke fatigue: an observational, cross-sectional, retrospective chart review study[J]. Healthcare, 2021, 9(11): 1586. doi: 10.3390/healthcare9111586
[18] LINDER S M, BISCHOF-BOCKBRADER A, DAVIDSON S, et al. The utilization of forced-rate cycling to facilitate motor recovery following stroke: a randomized clinical trial[J]. Neurorehabil Neural Repair, 2024, 38(4): 291-302. doi: 10.1177/15459683241233577
[19] HINKLE J L, BECKER K J, KIM J S, et al. Poststroke fatigue: emerging evidence and approaches to management: a scientific statement for healthcare professionals from the American heart association[J]. Stroke, 2017, 48(7): e159-e170.
[20] ZHANG X X, FANG H J, MA D, et al. Risk factors and imaging mechanisms of fatigue after mild ischemic stroke: an exploratory study from a single Chinese center[J]. Front Neurol, 2021, 12: 649021.
[21] DUNCAN F, LEWIS S J, GREIG C A, et al. Exploratory longitudinal cohort study of associations of fatigue after stroke[J]. Stroke, 2015, 46(4): 1052-1058.
[22] RAHAMATALI M, DE BONT N, VALET M, et al. Post-stroke fatigue: how it relates to motor fatigability and other modifiable factors in people with chronic stroke[J]. Acta Neurol Belg, 2021, 121(1): 181-189.




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
