Effect of lncRNA JHDM1D-AS1 targeting microRNA-421 on hydrogen peroxide induced oxidative damage of cardiomyocytes
-
摘要:目的
探讨长链非编码RNA组蛋白去甲基化酶1同系物D反义RNA1(lncRNA JHDM1D-AS1)靶向微小RNA-421(miR-421)对过氧化氢(H2O2)诱导的心肌细胞(H9C2细胞)氧化损伤的影响。
方法将H9C2细胞分为对照(Con)组、H2O2组、H2O2+pcDNA组、H2O2+pcDNA-JHDM1D-AS1组、H2O2+anti-miR-NC组、H2O2+anti-miR-421组、H2O2+pcDNA- JHDM1D-AS1+miR-NC组、H2O2+pcDNA-JHDM1D-AS1+miR-421组。采用实时荧光定量PCR(RT-qPCR)检测JHDM1D-AS1和miR-421表达。采用比色法测定H9C2细胞中超氧化物歧化酶(SOD)活性、丙二醛(MDA)水平以及培养液中乳酸脱氢酶(LDH)水平。采用流式细胞术评估H9C2细胞凋亡率。JHDM1D-AS1和miR-421的靶向关系通过双荧光素酶报告基因法验证。
结果与Con组比较, H2O2组H9C2细胞JHDM1D-AS1水平、SOD活性降低, MDA水平、LDH水平、细胞凋亡率、miR-421水平升高,差异均有统计学意义(P < 0.05)。与H2O2+pcDNA组比较, H2O2+pcDNA-JHDM1D-AS1组H9C2细胞SOD活性升高, miR-421表达水平、MDA水平、LDH水平、细胞凋亡率降低,差异有统计学意义(P < 0.05)。与H2O2+anti-miR-NC组比较, H2O2+anti-miR-421组H9C2细胞SOD活性升高, MDA水平、LDH水平、细胞凋亡率降低,差异有统计学意义(P < 0.05)。miR-421是JHDM1D-AS1的靶基因。与H2O2+pcDNA-JHDM1D-AS1+miR-NC组比较, H2O2+pcDNA-JHDM1D-AS1+miR-421组H9C2细胞SOD活性降低, MDA水平、LDH水平、细胞凋亡率升高,差异有统计学意义(P < 0.05)。
结论lncRNA JHDM1D-AS1通过靶向下调miR-421表达抑制细胞凋亡和氧化应激,减轻H2O2诱导的心肌细胞氧化损伤。
Abstract:ObjectiveTo investigate the effect of long non-coding RNA Jumonji C domain containing histone demethylase 1 homolog D antisense RNA1 (lncRNA JHDM1D-AS1) targeting microRNA-421 (miR-421) on hydrogen peroxide (H2O2) induced oxidative damage in cardiomyocytes (H9C2 cells).
MethodsH9C2 cells were divided into control (Con) group, H2O2 group, H2O2+pcDNA group, H2O2+pcDNA-JHDM1D-AS1 group, H2O2+anti-miR-NC group, H2O2+anti-miR-421 group, H2O2+pcDNA-JHDM1D-AS1+miR-NC group, and H2O2+pcDNA-JHDM1D-AS1+miR-421 group. The expressions of JHDM1D-AS1 and miR-421 were detected by real-time fluorescent quantitative PCR (RT-qPCR). The superoxide dismutase (SOD) activity, malondialdehyde (MDA) level, and lactate dehydrogenase (LDH) level in the culture medium of H9C2 cells were measured by colorimetry. Flow cytometry was used to evaluate the apoptosis rate of H9C2 cells. The targeting relationship between JHDM1D-AS1 and miR-421 was verified by dual luciferase reporter gene assay.
ResultsCompared with the Con group, the H2O2 group showed decreased levels of JHDM1D-AS1 and SOD activity, and increased levels of MDA, LDH, apoptosis rate, and miR-421 in H9C2 cells, with significant between-group differences (P < 0.05). Compared with the H2O2+pcDNA group, the H2O2+pcDNA-JHDM1D-AS1 group exhibited increased SOD activity and decreased miR-421 expression level, MDA level, LDH level, and apoptosis rate in H9C2 cells, with significant between-group differences (P < 0.05). Compared with the H2O2+anti-miR-NC group, the H2O2+anti-miR-421 group showed increased SOD activity and decreased MDA level, LDH level, and apoptosis rate in H9C2 cells, with significant between-group differences (P < 0.05). MiR-421 was identified as a target gene of JHDM1D-AS1. Compared with the H2O2+pcDNA-JHDM1D-AS1+miR-NC group, the H2O2+pcDNA-JHDM1D-AS1+miR-421 group exhibited decreased SOD activity and increased MDA level, LDH level, and apoptosis rate in H9C2 cells, with significant between-group differences (P < 0.05).
ConclusionLncRNA JHDM1D-AS1 inhibits apoptosis and oxidative stress by targeting and downregulating miR-421 expression, thereby alleviating H2O2-induced oxidative damage in cardiomyocytes.
-
急性心肌梗死(AMI)是全球范围内导致死亡的首要原因,恢复血供是防止氧供失衡所致心功能障碍的最有效治疗方法之一,但再灌注时血供恢复和再氧作用将导致细胞内活性氧过度积累,加剧心肌组织氧化损伤。深入了解心肌氧化损伤机制对预防和治疗心脏病具有重要意义。长链非编码RNA(lncRNA)主要通过结合微小RNA(miRNA)来调节基因表达[1]。研究[2-3]证实, lncRNA表达失调可加速缺血再灌注(I/R)损伤等多种心血管疾病进展。组蛋白去甲基化酶1同系物D反义RNA1(JHDM1D-AS1)是一种新发现的保护性lncRNA, 研究[4]发现过氧化氢(H2O2)处理后牙周膜干细胞凋亡率与JHDM1D-AS1水平呈负相关, JHDM1D-AS1通过抑制DnaJ热休克蛋白家族(Hsp40)成员C10种属(DNAJC10)表达减轻H2O2诱导的牙周膜干细胞凋亡。JHDM1D-AS1还通过上调miR-101-3p表达抑制臂丛神经损伤所致神经元凋亡和炎症反应, 具有神经保护作用[5], 但在心肌细胞氧化损伤中的作用未见报道。
研究[6-7]显示miRNA是内源性的、可调节短链RNA, 其通过调控靶基因的翻译和表达来调节细胞增殖、分化和凋亡, 其中miR-421参与调节心肌细胞线粒体碎裂、凋亡以及缺氧复氧诱导心肌细胞氧化损伤。长链非编码RNA牛磺酸上调基因1(lncRNA TUG1)通过靶向下调miR-421改善心肌I/R损伤[8]。靶基因预测显示miR-421是JHDM1D-AS1的潜在靶点,但JHDM1D-AS1是否通过靶向miR-421调控心肌细胞氧化损伤尚未可知。本研究以H2O2刺激心肌细胞H9C2在体外模拟心肌I/R损伤[9], 探讨JHDM1D-AS1是否靶向miR-421调控H2O2诱导H9C2细胞氧化应激和凋亡, 现报告如下。
1. 材料与方法
1.1 主要材料
心肌细胞H9C2购自美国ATCC; FITC-Annexin V/碘化丙啶凋亡检测试剂盒、逆转录试剂盒、胰蛋白酶、磷酸缓冲液、脱脂奶粉、Trizol购自北京索莱宝生物公司; 重组荧光素酶报告质粒、miRNA模拟物及抑制物购自苏州鸿迅生物公司; 丙二醛(MDA)和乳酸脱氢酶(LDH)活性检测试剂盒购自上海碧云天生物公司; 超氧化物歧化酶(SOD)检测试剂盒购自上海翌圣生物公司; 羊抗兔IgG(ab97051)、兔源裂解的半胱氨酸蛋白酶3(Cleaved-caspase3)多抗(ab2302)、兔源甘油醛-3-磷酸脱氢酶(GAPDH)多抗(ab9485)和兔源Cleaved-caspase9单抗(ab2324)购自上海艾博抗公司; SYBR Premix试剂购自北京宝日医公司。
1.2 细胞培养和H2O2处理
H9C2细胞接种在含1%青链霉素、10%胎牛血清的DMEM培养基中,放入含5%CO2、95%空气、37 ℃温箱中孵育。采用150 μmol/L的H2O2诱导H9C2细胞6 h以建立心肌细胞氧化损伤模型[9]。
1.3 转染和实验分组
在24孔板中接种2×104个H9C2细胞, 采用Lipo2000将JHDM1D-AS1过表达质粒(pcDNA-JHDM1D-AS1)、过表达质粒阴性对照pcDNA3.1载体(pcDNA)、小干扰RNA (siRNA)阴性对照(si-NC)、JHDM1D-AS1的siRNA(si-JHDM1D-AS1)、miRNA抑制剂阴性对照(anti-miR-NC)、miR-421抑制剂(anti-miR-421)、JHDM1D-AS1过表达质粒联合miRNA模拟物阴性对照(pcDNA-JHDM1D-AS1+miR-NC)以及JHDM1D-AS1过表达质粒联合miR-421模拟物(pcDNA-JHDM1D-AS1+miR-421)转染60%融合细胞,转染48 h收集H9C2细胞。未处理H9C2细胞设为对照(Con)组; H2O2诱导H9C2细胞设为H2O2组; 采用含150 μmol/L H2O2的培养液孵育转染0.8 μg的pcDNA-JHDM1D-AS1、0.8 μg的pcDNA、0.8 μg的pcDNA-JHDM1D-AS1+50 nmol/L miR-NC、0.8 μg的pcDNA-JHDM1D-AS1+50 nmol/L miR-421、100 nmol/L的anti-miR-NC、100 nmol/L的anti-miR-421的H9C2细胞6 h, 分别设为H2O2+pcDNA组、H2O2+pcDNA-JHDM1D-AS1组、H2O2+pcDNA-JHDM1D-AS1+miR-NC组、H2O2+pcDNA-JHDM1D-AS1+miR-421组、H2O2+anti-miR-NC组、H2O2+anti-miR-421组。转染pcDNA、pcDNA-JHDM1D-AS1、si-NC、si-JHDM1D-AS1的H9C2细胞分别设为pcDNA组、pcDNA-JHDM1D-AS1组、si-NC组、si-JHDM1D-AS1组。
1.4 RT-qPCR检测JHDM1D-AS1、miR-421表达
不同组H9C2细胞经过处理后,采用磷酸盐缓冲液(PBS)洗涤,采用Trizol提取总RNA, 并利用逆转录试剂盒合成cDNA; 采用NanoDrop-1000测定cDNA表达水平后,采用ddH2O稀释; 再用SYBR Premix Ex Taq扩增cDNA以检测JHDM1D-AS1、miR-421表达,其相对表达水平用2-△△CT法计算。
1.5 比色法检测SOD、MDA、LDH水平
将H9C2细胞培养在24孔板中,经150 μmol/L H2O2处理6 h后,将每组中的细胞上清液收集到离心管中,随后将细胞样品收集到离心管中。取适量细胞上清液,采用LDH活性检测试剂盒检测LDH水平。将收集到离心管中的细胞依次行超声破碎,通过离心收集上清液以检测SOD和MDA水平。
1.6 Western blot检测Cleaved-caspase 3和Cleaved-caspase 9蛋白水平
收集各组H9C2细胞,按照RIPA法提取总蛋白。每组样品加样量为40 μg, 通过SDS-PAGE分离蛋白并转移到PVDF膜。膜封闭后,加入稀释为Cleaved-caspase 3、GAPDH和Cleaved-caspase 9的一抗在室温孵育2 h, 然后加入二抗在室温孵育2 h。在每个膜上涂上化学发光试剂,利用生物光谱成像系统曝光条带。
1.7 流式细胞术评估H9C2细胞凋亡率
收集各组H9C2细胞并用冷PBS洗涤2次,各组均加入500 μL的1×结合缓冲液、5 μL的FITC-Annexin V和5 μL的碘化丙啶,混匀,避光染色15 min。采用流式细胞仪和Cell Quest软件检测细胞凋亡率。
1.8 双荧光素酶报告实验
将包含miR-421结合位点的JHDM1D片段利用PCR扩增,扩增的条带克隆到pGL3质粒,以构建WT-JHDM1D-AS1; 将与miR-421互补的位点突变,突变后的JHDM1D片段经生物公司合成,克隆到pGL3质粒,以构建MUT-JHDM1D-AS1; 将报告质粒和miR-421模拟物或miR-NC共转染至H9C2细胞。48 h后将磷酸缓冲液加入到培养孔中清洗细胞,收集细胞并计算细胞的相对荧光素酶活性。
1.9 统计学方法
采用SPSS 20.0软件进行数据分析,计量资料以(x±s)表示, 2组比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较行LSD-t检验。P < 0.05为差异有统计学意义。
2. 结果
2.1 H2O2处理对lncRNA JHDM1D-AS1和miR-421表达的影响
与Con组比较, H2O2处理的H9C2细胞中JHDM1D-AS1的表达降低了52%,而miR-421的表达增高了1.89倍,差异有统计学意义(P < 0.01), 见表 1。
表 1 H2O2处理对lncRNA JHDM1D-AS1和miR-421表达的影响(x±s)(n=9)组别 JHDM1D-AS1 miR-421 Con组 1.00±0 1.00±0 H2O2组 0.48±0.04** 2.89±0.24** JHDM1D-AS1: 组蛋白去甲基化酶1同系物D反义RNA1; miR-421: 微小RNA-421。与Con组比较, **P < 0.01。 2.2 lncRNA JHDM1D-AS1过表达对H2O2诱导的心肌细胞氧化应激的影响
与Con组比较, H2O2组H9C2细胞JHDM1D-AS1表达水平、SOD活性降低, miR-421、MDA、LDH水平升高, 差异有统计学意义(P < 0.05); 与H2O2+pcDNA组比较, H2O2+pcDNA-JHDM1D-AS1组H9C2细胞JHDM1D-AS1表达水平、SOD活性升高, miR-421、MDA、LDH水平降低,差异有统计学意义(P < 0.05)。见表 2。
表 2 lncRNA JHDM1D-AS1过表达对H2O2诱导的心肌细胞氧化应激的影响(x±s)(n=9)组别 JHDM1D-AS1 miR-421 MDA/(nmol/L) SOD/(U/mL) LDH/(U/L) Con组 1.00±0 1.00±0 3.36±0.34 63.90±5.97 32.42±3.22 H2O2组 0.47±0.04* 2.86±0.23* 18.26±1.30* 22.86±2.09* 146.01±13.07* H2O2+pcDNA组 0.45±0.04 2.75±0.21 19.32±1.62 21.68±2.12 148.55±12.73 H2O2+pcDNA-JHDM1D-AS1组 0.91±0.13# 1.56±0.10# 6.04±0.59# 54.35±4.26# 47.09±4.02# JHDM1D-AS1: 组蛋白去甲基化酶1同系物D反义RNA1; miR-421: 微小RNA-421; MDA: 丙二醛; SOD: 超氧化物歧化酶;
LDH: 乳酸脱氢酶。与Con组比较, *P < 0.05; 与H2O2+pcDNA组比较, #P < 0.05。2.3 lncRNA JHDM1D-AS1过表达对H2O2诱导的心肌细胞凋亡的影响
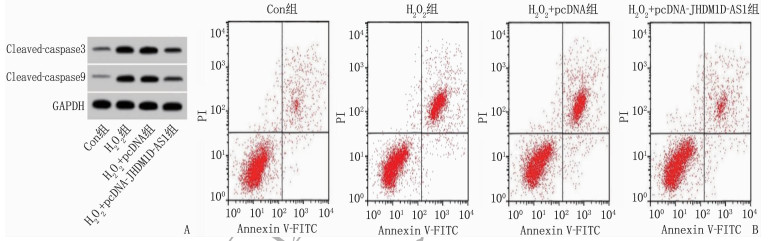
H2O2处理后H9C2细胞中Cleaved-caspase 3蛋白水平增高了2.13倍, Cleaved-caspase 9蛋白水平增高了3.20倍,凋亡率增高了3.75倍; 与H2O2+pcDNA组比较, H2O2+pcDNA- JHDM1D-AS1共处理后H9C2细胞中Cleaved-caspase 3蛋白水平、Cleaved-caspase 9蛋白水平、凋亡率均降低,差异有统计学意义(P < 0.05)。见图 1、表 3。
表 3 lncRNA JHDM1D-AS1过表达对H2O2诱导的心肌细胞凋亡的影响(x±s)(n=9)组别 凋亡率/% Cleaved-caspase 3蛋白 Cleaved-caspase 9蛋白 Con组 5.55±0.51 0.23±0.02 0.15±0.02 H2O2组 26.37±2.31* 0.72±0.07* 0.63±0.05* H2O2+pcDNA组 28.03±2.76 0.74±0.06 0.65±0.05 H2O2+pcDNA-JHDM1D-AS1组 8.75±0.78# 0.31±0.03# 0.24±0.02# Cleaved-caspase 3: 裂解的半胱氨酸蛋白酶3; Cleaved-caspase 9: 裂解的半胱氨酸蛋白酶9。
与Con组比较, *P < 0.05; 与H2O2+pcDNA组比较, #P < 0.05。2.4 lncRNA JHDM1D-AS1靶向miR-421
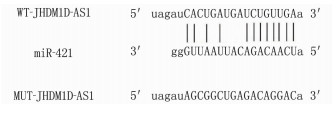
LncBase Predicted v.2预测显示JHDM1D-AS1的序列中存在miR-421的结合位点, 见图 2。在与WT-JHDM1D-AS1共转染实验中,与转染miR-NC比较,转染miR-421模拟物导致H9C2细胞相对荧光素酶活性降低,差异有统计学意义(P < 0.01), 见表 4。此外, JHDM1D-AS1过表达抑制H9C2细胞miR-421表达,而敲低JHDM1D-AS1表达促进H9C2细胞miR-421表达,差异有统计学意义(P < 0.05), 见表 5。
表 4 双荧光素酶报告实验(x±s)(n=9)组别 WT-JHDM1D-AS1 MUT-JHDM1D-AS1 miR-NC组 1.01±0.06 1.03±0.08 miR-421组 0.50±0.04** 1.00±0.07 与miR-NC组比较, **P < 0.01。 表 5 lncRNA JHDM1D-AS1调控miR-421的表达(x±s)(n=9)组别 miR-421 pcDNA组 1.00±0 pcDNA-JHDM1D-AS1组 0.42±0.04* si-NC组 1.02±0.06 si-JHDM1D-AS1组 3.08±0.30# 与pcDNA组比较, *P < 0.05; 与si-NC组比较, #P < 0.05。 2.5 miR-421抑制剂转染在H2O2诱导的H9C2细胞中对细胞损伤的影响
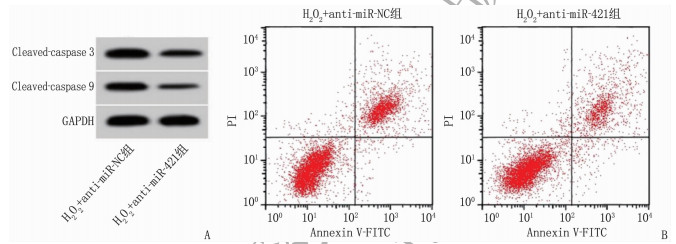
与H2O2单独处理比较, H2O2和anti-miR-421共处理可降低miR-421表达、MDA水平、LDH水平、Cleaved-caspase 3和Cleaved-caspase 9蛋白水平以及凋亡率, 增强SOD表达活性,差异有统计学意义(P < 0.01), 见图 3、表 6。
表 6 miR-421抑制剂转染在H2O2诱导的条件下对H9C2细胞损伤的影响(x±s)(n=9)组别 miR-421 MDA/(nmol/L) SOD/(U/mL) LDH/(U/L) 凋亡率/% Cleaved-caspase 3蛋白 Cleaved-caspase 9蛋白 H2O2+anti-miR-NC组 1.00±0 20.08±1.88 21.23±1.99 149.05±12.65 27.94±2.51 0.77±0.06 0.67±0.05 H2O2+anti-miR-421组 0.35±0.03** 11.94±1.08** 46.51±4.22** 55.19±4.14** 12.49±1.05** 0.39±0.03** 0.30±0.03** miR-421: 微小RNA-421; MDA: 丙二醛; SOD: 超氧化物歧化酶; LDH: 乳酸脱氢酶; Cleaved-caspase 3: 裂解的半胱氨酸蛋白酶3;
Cleaved-caspase 9: 裂解的半胱氨酸蛋白酶9。与H2O2+anti-miR-NC组比较, **P < 0.01。2.6 lncRNA JHDM1D-AS1通过调控miR-421缓解H2O2诱导的心肌细胞损伤
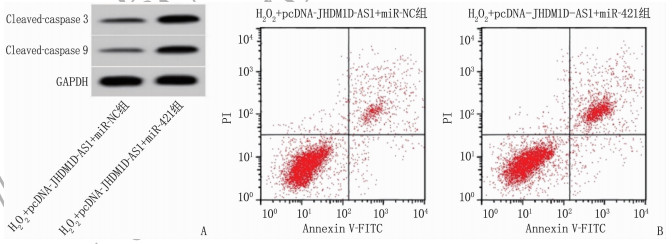
在H2O2诱导的条件下, JHDM1D-AS1过表达质粒和miR-421模拟物共转染与miR-421模拟物单独转染相比,细胞miR-421表达水平、MDA水平、LDH水平、Cleaved-caspase 3和Cleaved-caspase 9蛋白水平以及凋亡率升高, SOD活性降低,差异有统计学意义(P < 0.05), 见图 4、表 7。
表 7 lncRNA JHDM1D-AS1通过调控miR-421缓解H2O2诱导的心肌细胞损伤(x±s)(n=9)组别 miR-421 MDA/(nmol/L) SOD/(U/mL) LDH/(U/L) 凋亡率/% Cleaved-caspase 3蛋白 Cleaved-caspase 9蛋白 H2O2+pcDNA-JHDM1D-AS1+miR-NC组 1.00±0 5.89±0.53 57.11±5.15 45.22±4.12 8.14±0.67 0.30±0.03 0.22±0.02 H2O2+pcDNA-JHDM1D-AS1+miR-421组 2.93±0.24** 12.88±1.18** 30.67±2.95** 117.26±11.38** 20.09±1.08** 0.62±0.05** 0.56±0.04** JHDM1D-AS1: 组蛋白去甲基化酶1同系物D反义RNA1; miR-421: 微小RNA-421; MDA: 丙二醛; SOD: 超氧化物歧化酶; LDH: 乳酸脱氢酶;
Cleaved-caspase 3: 裂解的半胱氨酸蛋白酶3; Cleaved-caspase 9: 裂解的半胱氨酸蛋白酶9。与H2O2+pcDNA-JHDM1D-AS1+miR-NC组比较, **P < 0.01。3. 讨论
氧化应激和细胞凋亡是I/R损伤的关键促成因素[10]。H2O2易获得且性质相对稳定, 常被用作建立体外氧化应激损伤模型[11]。本研究结果表明, H2O2处理导致H9C2细胞抗氧化酶SOD活性降低,细胞损伤标记分子LDH释放增加,凋亡率和脂质过氧化产物MDA水平增高,表明H2O2介导的心肌细胞损伤模型建立成功。研究[12]报道称lncRNA表达失调与AMI和心肌I/R损伤有关, 例如干扰lncRNA ANRIL可改善急性心肌缺血(AMI)小鼠心脏功能,减少心肌细胞凋亡; lncRNA Gpr19诱导细胞凋亡和氧化应激可加剧心肌I/R损伤[13]。
本研究检测到H2O2处理后H9C2细胞JHDM1D-AS1表达降低,提示JHDM1D-AS1低表达可能参与H2O2所致心肌细胞损伤。有研究[14]报道JHDM1D-AS1在帕金森病细胞模型中表达下调, JHDM1D-AS1过表达可减弱1-甲基-4苯基吡啶离子(MPP+)诱发的神经元凋亡、炎症和氧化应激。本研究中JHDM1D-AS1过表达显著抑制H2O2诱导的MDA水平、LDH释放增加以及细胞凋亡, 并提高SOD活性,这表明JHDM1D-AS1可增强心肌细胞抗氧化能力,抑制H2O2诱导的氧化损伤。Caspase家族是细胞凋亡调节因子, Cleaved-caspase 9和Cleaved-caspase 3在细胞凋亡中分别发挥启动子和执行子功能[15]。本研究中, JHDM1D-AS1过表达显著抑制H2O2诱导的H9C2细胞中Cleaved-caspase 9和Cleaved-caspase 3蛋白表达上调,这与凋亡检测结果一致,提示JHDM1D-AS1在H2O2诱导的心肌细胞氧化损伤中发挥保护作用。
为揭示JHDM1D-AS1在H2O2诱导的心肌细胞氧化损伤中的保护机制,本研究探索其下游靶miRNA。实验[16-17]表明miR-421是JHDM1D-AS1的靶基因, miR-421的差异表达已被证实参与骨肉瘤、非小细胞肺癌的进展。miR-421上调还可加重帕金森病模型细胞的神经毒性[18]。此外, 下调miR-421可抑制心肌细胞自噬和凋亡,减小心肌梗死面积,是circPAN3介导心肌I/R损伤的下游靶点[19]。本研究中, miR-421在H2O2处理H9C2细胞中表达上调,抑制miR-421表达可显著抑制H2O2诱导的MDA水平、LDH释放增加以及细胞凋亡,降低Cleaved-caspase 9和Cleaved-caspase 3蛋白表达水平,并提高SOD活性。同时, miR-421的表达受JHDM1D-AS1的负性调控,提示JHDM1D-AS1靶向miR-421调控H2O2诱导的H9C2细胞氧化损伤。上调miR-421表达显著减弱了JHDM1D-AS1过表达对H2O2诱导的H9C2细胞凋亡和氧化损伤的保护作用,表明miR-421是JHDM1D-AS1缓解H2O2诱导的心肌细胞氧化损伤的功能靶点。
综上所述,本研究表明JHDM1D-AS1通过靶向下调miR-421抑制H2O2诱导的心肌细胞氧化损伤,为心肌细胞氧化损伤的治疗提供了新的思路。
-
表 1 H2O2处理对lncRNA JHDM1D-AS1和miR-421表达的影响(x±s)(n=9)
组别 JHDM1D-AS1 miR-421 Con组 1.00±0 1.00±0 H2O2组 0.48±0.04** 2.89±0.24** JHDM1D-AS1: 组蛋白去甲基化酶1同系物D反义RNA1; miR-421: 微小RNA-421。与Con组比较, **P < 0.01。 表 2 lncRNA JHDM1D-AS1过表达对H2O2诱导的心肌细胞氧化应激的影响(x±s)(n=9)
组别 JHDM1D-AS1 miR-421 MDA/(nmol/L) SOD/(U/mL) LDH/(U/L) Con组 1.00±0 1.00±0 3.36±0.34 63.90±5.97 32.42±3.22 H2O2组 0.47±0.04* 2.86±0.23* 18.26±1.30* 22.86±2.09* 146.01±13.07* H2O2+pcDNA组 0.45±0.04 2.75±0.21 19.32±1.62 21.68±2.12 148.55±12.73 H2O2+pcDNA-JHDM1D-AS1组 0.91±0.13# 1.56±0.10# 6.04±0.59# 54.35±4.26# 47.09±4.02# JHDM1D-AS1: 组蛋白去甲基化酶1同系物D反义RNA1; miR-421: 微小RNA-421; MDA: 丙二醛; SOD: 超氧化物歧化酶;
LDH: 乳酸脱氢酶。与Con组比较, *P < 0.05; 与H2O2+pcDNA组比较, #P < 0.05。表 3 lncRNA JHDM1D-AS1过表达对H2O2诱导的心肌细胞凋亡的影响(x±s)(n=9)
组别 凋亡率/% Cleaved-caspase 3蛋白 Cleaved-caspase 9蛋白 Con组 5.55±0.51 0.23±0.02 0.15±0.02 H2O2组 26.37±2.31* 0.72±0.07* 0.63±0.05* H2O2+pcDNA组 28.03±2.76 0.74±0.06 0.65±0.05 H2O2+pcDNA-JHDM1D-AS1组 8.75±0.78# 0.31±0.03# 0.24±0.02# Cleaved-caspase 3: 裂解的半胱氨酸蛋白酶3; Cleaved-caspase 9: 裂解的半胱氨酸蛋白酶9。
与Con组比较, *P < 0.05; 与H2O2+pcDNA组比较, #P < 0.05。表 4 双荧光素酶报告实验(x±s)(n=9)
组别 WT-JHDM1D-AS1 MUT-JHDM1D-AS1 miR-NC组 1.01±0.06 1.03±0.08 miR-421组 0.50±0.04** 1.00±0.07 与miR-NC组比较, **P < 0.01。 表 5 lncRNA JHDM1D-AS1调控miR-421的表达(x±s)(n=9)
组别 miR-421 pcDNA组 1.00±0 pcDNA-JHDM1D-AS1组 0.42±0.04* si-NC组 1.02±0.06 si-JHDM1D-AS1组 3.08±0.30# 与pcDNA组比较, *P < 0.05; 与si-NC组比较, #P < 0.05。 表 6 miR-421抑制剂转染在H2O2诱导的条件下对H9C2细胞损伤的影响(x±s)(n=9)
组别 miR-421 MDA/(nmol/L) SOD/(U/mL) LDH/(U/L) 凋亡率/% Cleaved-caspase 3蛋白 Cleaved-caspase 9蛋白 H2O2+anti-miR-NC组 1.00±0 20.08±1.88 21.23±1.99 149.05±12.65 27.94±2.51 0.77±0.06 0.67±0.05 H2O2+anti-miR-421组 0.35±0.03** 11.94±1.08** 46.51±4.22** 55.19±4.14** 12.49±1.05** 0.39±0.03** 0.30±0.03** miR-421: 微小RNA-421; MDA: 丙二醛; SOD: 超氧化物歧化酶; LDH: 乳酸脱氢酶; Cleaved-caspase 3: 裂解的半胱氨酸蛋白酶3;
Cleaved-caspase 9: 裂解的半胱氨酸蛋白酶9。与H2O2+anti-miR-NC组比较, **P < 0.01。表 7 lncRNA JHDM1D-AS1通过调控miR-421缓解H2O2诱导的心肌细胞损伤(x±s)(n=9)
组别 miR-421 MDA/(nmol/L) SOD/(U/mL) LDH/(U/L) 凋亡率/% Cleaved-caspase 3蛋白 Cleaved-caspase 9蛋白 H2O2+pcDNA-JHDM1D-AS1+miR-NC组 1.00±0 5.89±0.53 57.11±5.15 45.22±4.12 8.14±0.67 0.30±0.03 0.22±0.02 H2O2+pcDNA-JHDM1D-AS1+miR-421组 2.93±0.24** 12.88±1.18** 30.67±2.95** 117.26±11.38** 20.09±1.08** 0.62±0.05** 0.56±0.04** JHDM1D-AS1: 组蛋白去甲基化酶1同系物D反义RNA1; miR-421: 微小RNA-421; MDA: 丙二醛; SOD: 超氧化物歧化酶; LDH: 乳酸脱氢酶;
Cleaved-caspase 3: 裂解的半胱氨酸蛋白酶3; Cleaved-caspase 9: 裂解的半胱氨酸蛋白酶9。与H2O2+pcDNA-JHDM1D-AS1+miR-NC组比较, **P < 0.01。 -
[1] 易红, 张政. lncRNA与miRNA相互作用对疾病的影响[J]. 基础医学与临床, 2016, 36(2): 267-271. [2] SU Q, LIU Y, LV X W, et al. LncRNA TUG1 mediates ischemic myocardial injury by targeting miR-132-3p/HDAC3 axis[J]. Am J Physiol Heart Circ Physiol, 2020, 318(2): H332-H344. doi: 10.1152/ajpheart.00444.2019
[3] CAI X Y, WANG S, HONG L, et al. Long noncoding RNA taurine-upregulated gene 1 knockdown protects cardiomyocytes against hypoxia/reoxygenation-induced injury through regulating miR-532-5p/Sox8 axis[J]. J Cardiovasc Pharmacol, 2020, 76(5): 556-563. doi: 10.1097/FJC.0000000000000895
[4] SHI B, SHAO B Y, YANG C, et al. Upregulation of JHDM1D-AS1 protects PDLSCs from H2O2-induced apoptosis by decreasing DNAJC10 via phosphorylation of eIF2α[J]. Biochimie, 2019, 165: 48-56. doi: 10.1016/j.biochi.2019.06.018
[5] LIU L P, ZHANG J, PU B, et al. Upregulation of JHDM1D-AS1 alleviates neuroinflammation and neuronal injury via targeting miR-101-3p-DUSP1 in spinal cord after brachial plexus injury[J]. Int Immunopharmacol, 2020, 89(Pt A): 106962.
[6] WANG K, ZHOU L Y, WANG J X, et al. E2F1-dependent miR-421 regulates mitochondrial fragmentation and myocardial infarction by targeting Pink1[J]. Nat Commun, 2015, 6: 7619. doi: 10.1038/ncomms8619
[7] LIU Y, QIAN X M, HE Q C, et al. MiR-421 inhibition protects H9c2 cells against hypoxia/reoxygenation-induced oxidative stress and apoptosis by targeting Sirt3[J]. Perfusion, 2020, 35(3): 255-262. doi: 10.1177/0267659119870725
[8] CHEN J Y, YU W Q, RUAN Z H, et al. TUG1/miR-421/PINK1: a potential mechanism for treating myocardial ischemia-reperfusion injury[J]. Int J Cardiol, 2019, 292: 197. doi: 10.1016/j.ijcard.2019.04.068
[9] 段卡丹, 张守彦, 李松森. MiR-92a对H2O2诱导的H9C2心肌细胞凋亡以及MAPK-ERK通路的影响[J]. 中国循证心血管医学杂志, 2020, 12(3): 312-316. [10] 贾增芹, 杜胜利, 荀志红, 等. 稳心颗粒对心肌细胞氧化应激及凋亡损伤的影响[J]. 现代中西医结合杂志, 2020, 29(22): 2405-2409, 2428. [11] 徐博, 郭伟, 刘丹平, 等. 哈巴苷对H2O2诱导的大鼠心肌细胞H9c2氧化应激损伤的保护作用[J]. 中西医结合心脑血管病杂志, 2019, 17(15): 2276-2281. [12] YANG J H, HUANG X W, HU F D, et al. LncRNA ANRIL knockdown relieves myocardial cell apoptosis in acute myocardial infarction by regulating IL-33/ST2[J]. Cell Cycle, 2019, 18(23): 3393-3403.
[13] HUANG L, GUO B Y, LIU S Y, et al. Inhibition of the LncRNA Gpr19 attenuates ischemia-reperfusion injury after acute myocardial infarction by inhibiting apoptosis and oxidative stress via the miR-324-5p/Mtfr1 axis[J]. IUBMB Life, 2020, 72(3): 373-383.
[14] WANG C H, ZHANG H Y, LI J. LncRNA JHDM1D-AS1 suppresses MPP+-induced neuronal injury in Parkinson's disease via miR-134-5p/PIK3R3 axis[J]. Neurotox Res, 2021, 39(6): 1771-1781.
[15] 黄县立, 饶玲璋, 熊慧, 等. 神经调节蛋白1通过ERK1-2通路减轻心肌细胞缺氧复氧损伤[J]. 中国动脉硬化杂志, 2019, 27(11): 950-955. [16] REN Z Z, HE M, SHEN T, et al. MiR-421 promotes the development of osteosarcoma by regulating MCPIP1 expression[J]. Cancer Biol Ther, 2020, 21(3): 231-240.
[17] LI X, CHEN S H, ZENG J W. MiR-421 is overexpressed and promotes cell proliferation in non-small cell lung cancer[J]. Med Princ Pract, 2020, 29(1): 80-89.
[18] DONG Y R, XIONG J, JI L Y, et al. MiR-421 aggravates neurotoxicity and promotes cell death in Parkinson's disease models by directly targeting MEF2D[J]. Neurochem Res, 2021, 46(2): 299-308.
[19] ZHANG C L, LONG T Y, BI S S, et al. CircPAN3 ameliorates myocardial ischaemia/reperfusion injury by targeting miR-421/Pink1 axis-mediated autophagy suppression[J]. Lab Invest, 2021, 101(1): 89-103.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号