Experimental study on treatment of relapsed and refractory acute myeloid leukemia with DNA methyltransferase 1 inhibitor combined with extracellular signal-regulated kinase 1, homeodomain-interacting protein kinase 2, and glycogen synthase kinase 3β inhibitors
-
摘要:目的
探讨DNA甲基转移酶1(DNMT1)抑制剂联合外胚层信号调节激酶1(ERK1)、同源结构域相互作用蛋白激酶2(HIPK2)及糖原合成酶激酶3β(GSK3β)抑制剂协同诱导复发难治性急性髓系白血病(AML)细胞凋亡和蛋白阻滞的机制。
方法基于表达综合数据库(GEO)、癌症基因组图谱(TCGA)数据库以及Expression2Kinases等数据库筛选出ERK1、HIPK2和GSK3β等3个治疗靶点。DNMT1抑制剂单独或联合ERK1、HIPK2或GSK3β抑制剂处理人AML细胞系U937细胞; 采用CCK-8法检测细胞活力; 采用流式细胞术分析细胞凋亡率,采用碘化丙啶单染色法染色法(PI)测定细胞周期分布; 采用实时荧光定量逆转录聚合酶链反应(RT-qPCR)检测DNMT1、ERK1、HIPK2和GSK3β的mRNA表达水平; 采用免疫印迹法检测DNMT1、ERK1、HIPK2和GSK3β的蛋白表达水平。
结果DNMT1抑制剂能显著抑制U937细胞的细胞活力(P < 0.05),显著诱导U937细胞凋亡和周期阻滞(P < 0.05); DNMT1抑制剂与ERK1、HIPK2或GSK3β抑制剂联合使用时,细胞活力和细胞凋亡率显著降低(P < 0.05)。DNMT1抑制剂及其与ERK1、HIPK2、GSK3β抑制剂联合诱导U937细胞停留在G0/G1期,其中两药联合组G0/G1期比例显著增高(P < 0.05)。DNMT1抑制剂与ERK1、HIPK2、GSK3β抑制剂联合能显著降低U937细胞DNMT1、ERK1、HIPK2和GSK3β的mRNA表达水平(P < 0.05); DNMT1抑制剂与ERK1、HIPK2、GSK3β抑制剂联合能显著降低U937细胞DNMT1、ERK1、HIPK2和GSK3β的蛋白表达水平(P < 0.05)。
结论DNMT1抑制剂联合ERK1、HIPK2和GSK3β抑制剂可协同诱导复发难治性AML细胞凋亡和蛋白阻滞,为联合靶向治疗AML提供一种新的策略。
-
关键词:
- 抑制剂 /
- DNA甲基转移酶1 /
- 急性髓系白血病 /
- 外胚层信号调节激酶1 /
- 同源结构域相互作用蛋白激酶2 /
- 糖原合成酶激酶3β /
- 靶向治疗 /
- 细胞凋亡 /
- 蛋白阻滞
Abstract:ObjectiveTo investigate the mechanism of DNA methyltransferase 1 (DNMT1) inhibitor combined with extracellular signal-regulated kinase 1 (ERK1), homeodomain-interacting protein kinase 2 (HIPK2), and glycogen synthase kinase 3β (GSK3β) inhibitors in synergistically inducing apoptosis and protein arrest in relapsed and refractory acute myeloid leukemia (AML) cells.
MethodsThree therapeutic targets, including ERK1, HIPK2, and GSK3β, were screened based on the Gene Expression Omnibus (GEO), The Cancer Genome Atlas (TCGA) database, and Expression 2 Kinases database. Human AML cell line U937 cells were treated with DNMT1 inhibitor alone or combined with ERK1, HIPK2, or GSK3β inhibitors. Cell viability was detected using the CCK-8 method. Apoptosis rate was analyzed by flow cytometry, and cell cycle distribution was determined by propidium iodide (PI)staining. The mRNA expression levels of DNMT1, ERK1, HIPK2, and GSK3β were detected by real-time fluorescent quantitative reverse transcriptionpolymerase chain reaction (RT-qPCR). Protein expressionlevels of DNMT1, ERK1, HIPK2, and GSK3β were detected by immunoblotting.
ResultsDNMT1 inhibitor significantly inhibited the cell viability of U937 cells, and significantly induced apoptosis and cell cycle arrest in U937 cells (P < 0.05). When DNMT1 inhibitor was combined with ERK1, HIPK2, or GSK3β inhibitors, cell viability and apoptosis rate were significantly reduced (P < 0.05). DNMT1 inhibitor alone or its combination with ERK1, HIPK2, and GSK3β inhibitors induced U937 cell arrest in the G0/G1 phase, with a significant increase in the proportion of cells in the G0/G1 phase in the combination group (P < 0.05). The combination of DNMT1 inhibitor with ERK1, HIPK2, and GSK3β inhibitors significantly reduced the mRNA expression levels in DNMT1, ERK1, HIPK2, and GSK3β in U937 cells (P < 0.05). Similarly, the combination therapy significantly reduced the protein expression levels of DNMT1, ERK1, HIPK2, and GSK3β in U937 cells (P < 0.05).
ConclusionDNMT1 inhibitor combined with ERK1, HIPK2, and GSK3β inhibitors can synergistically induce apoptosis and protein arrest in relapsed and refractory AML cells, providing a novel strategy for combined targeted therapy of AML.
-
急性髓系白血病(AML)是一种严重的血液系统恶性肿瘤, 主要影响老年人群[1]。异基因造血干细胞移植是AML唯一的治愈方法, 但30%以上患者移植后复发导致预后不佳, 2年总生存率不足15%[2-3]。近年来,靶向治疗在AML中具有重要的应用潜力[4]。DNA甲基转移酶1(DNMT1)作为表观遗传修饰酶,在AML细胞增殖和存活中发挥重要作用[5]。去甲基化药物可通过抑制DNMT1,恢复抑癌基因的表达,抑制癌细胞的增殖和存活[6-7]。除DNMT1以外,外胚层信号调节激酶1(ERK1)、同源结构域相互作用蛋白激酶2(HIPK2)及糖原合成酶激酶3β(GSK3β)等蛋白质也在AML细胞生存中发挥作用。针对这些靶点的抑制剂已经应用于临床,极大地丰富和增强了治疗的多样性和有效性[8-10]。本研究探讨DNMT1抑制剂与ERK1、HIPK2、GSK3β抑制剂联合使用对AML细胞系U937的影响,现报告如下。
1. 材料与方法
1.1 数据收集
利用表达综合数据库(GEO, https://www.ncbi.nlm.nih.gov/geo/)、癌症基因组图谱(TCGA, https://www.cancer.gov/ccg/research/genome-sequencing/tcga)数据库以及Expression2Kinases(X2K Web, https://maayanlab.cloud/X2K/)检索包含诊断AML患者的癌相关基因,获得激酶与靶蛋白的调控关系。共筛选出3个潜在的治疗靶点,即ERK1、HIPK2、GSK3β。
1.2 材料
IMDM培养基(Gibco公司), CCK-8试剂盒(日本同仁化学研究所),细胞凋亡检测试剂盒、细胞周期试剂盒(美国BD公司), ERK1、HIPK2、GSK3β抑制剂(美国MCE公司),荧光定量PCR试剂盒(美国Elab-science公司),实时荧光定量逆转录聚合酶链反应(RT-qPCR)仪、凝胶成像系统(QuantStudio 3, 美国应用生物系统公司),人AML细胞系U937(武汉普诺赛生命科技有限公司)。
1.3 方法
1.3.1 细胞分组及处理
将U937细胞分为对照组、DNMT1抑制剂组、DNMT1+ERK1抑制剂组、DNMT1+HIPK2抑制剂组、DNMT1+GSK3β抑制剂组。抑制剂浓度方面, ERK1、HIPK2、GSK3β为2 μmol/L,DNMT1为1 μmol/L。
1.3.2 CCK-8法检测各组细胞活性
处理24、36、48 h后,加入CCK-8溶液孵育2 h, 在450 nm波长下测定吸光度值。
1.3.3 流式细胞术检测各组U937细胞凋亡
加入磷酸盐缓冲液(PBS)重悬细胞,加入Annexin V/7AAD孵育15 min, 2 h内采用流式细胞仪检测,采用FlowJo软件分析细胞凋亡率。
1.3.4 碘化丙啶单染色法染色法(PI)测定细胞周期分布
固定细胞,加入核糖核酸酶处理细胞,加入PI试剂染色15 min,采用流式细胞仪检测。
1.3.5 RT-qPCR检测ERK1、HIPK2、GSK3β表达水平
提取总RNA, 逆转录制备cDNA。以GAPDH作为内参基因,扩增条件为: 95 ℃预变性20 s; 95 ℃变性3 s, 60 ℃退火20 s, 72 ℃延伸20 s, 共40个循环; 最终72 ℃延伸15 min。引物由北京博迈德基因技术有限公司合成,具体序列见表 1。通过凝胶成像仪获取图像,采用2-ΔΔCt对样本基因进行表达差异相对定量分析。
表 1 RT-qPCR序列引物基因 上游引物 下游引物 GAPDH 5′-GACCACTTTGTCAAGCTCTATTTCC-3′ 5′-GTGAGGGTCTCTCTTCCTCTTGT-3′ DNMT1 5′-AGAAGGCTGGTGGGCGGAGT-3′ 5′-TGCCGTCCCGTAGGTAGTCG-3′ EPK1 5′-ATGCGTGACCTATGACCTG-3′ 5′-TCAGGTCATAGGTCACGCAT-3′ HIPK2 5′-AGTGGTGTTGAGCGGATAAC-3′ 5′-CGTCCAGTTGTCTCCAAAGT-3′ GSK3β 5′-GCTGAGCGACATGGAAGG-3′ 5′-GGAGTCCGTGTTGAGATGAT-3′ 1.3.6 Western blotting检测ERK1、HIPK2、GSK3β通路蛋白质的表达
提取蛋白,采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE); 聚偏氟乙烯(PVDF)分离,转膜,封闭,加一抗过夜,二抗室温孵育2 h。GAPDH作为内参,采用ECL试剂显色,采用Image J软件分析蛋白条带灰度值。
1.4 统计学分析
应用SPSS 25.0软件对数据进行统计学处理,采用GraphPad Prism8.0软件进行图片处理。符合正态的计量资料以(x±s)表示,计数资料以[n(%)]表示,采用卡方检验进行差异性比较,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2. 结果
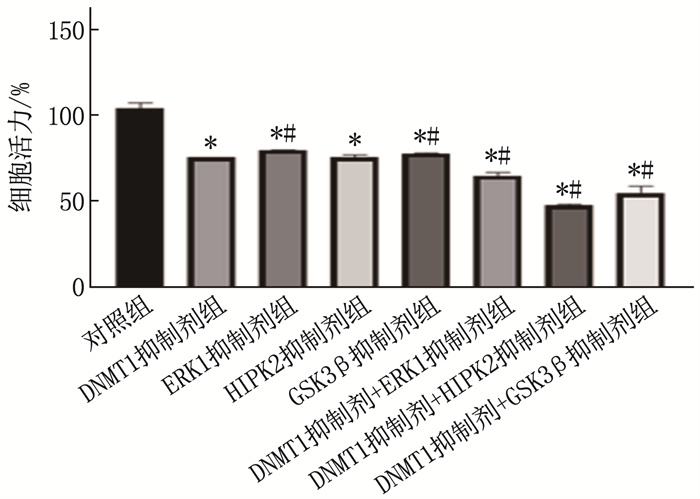
2.1 DNMT1抑制剂与ERK1、HIPK2、GSK3β抑制剂联合抑制U937细胞活力
当DNMT1抑制剂与ERK1、HIPK2或GSK3β抑制剂联合使用时,细胞活力低于对照组和DNMT1抑制剂组,差异均有统计学意义(P < 0.05)。见图 1。
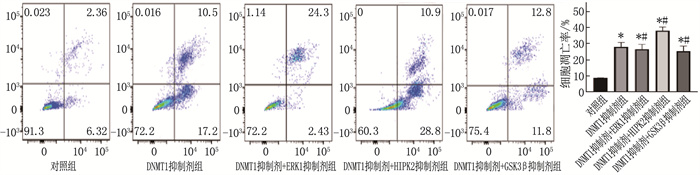
2.2 DNMT1抑制剂与ERK1、HIPK2、GSK3β抑制剂联合诱导AML细胞凋亡
经过48 h处理,相较于对照组, DNMT1抑制剂单独使用或与ERK1、HIPK2、GSK3β抑制剂联合使用时,均促进了U937细胞凋亡,抑制剂联合使用具有更高的细胞凋亡率,差异有统计学意义(P < 0.05)。见图 2。
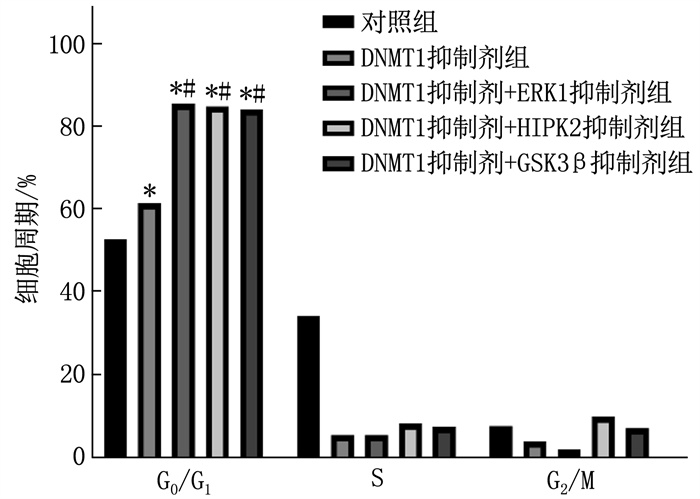
2.3 DNMT1抑制剂与ERK1、HIPK2、GSK3β抑制剂协同诱导U937细胞周期阻滞
DNMT1抑制剂单独处理以及与ERK1、HIPK2、GSK3β抑制剂联合处理均诱导U937细胞停留在G0/G1期,其中两药联合组G0/G1期比例增高,差异有统计学意义(P < 0.05)。见图 3。
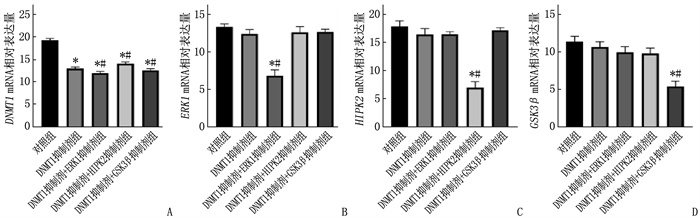
2.4 联合用药抑制DNMT1 mRNA、ERK1 mRNA、HIPK2 mRNA、GSK3β mRNA表达
与对照组比较, DNMT1抑制剂显著降低了 DNMT1 mRNA表达水平,而联合用药可抑制 ERK1 mRNA、 HIPK2 mRNA、 GSK3β mRNA表达,差异有统计学意义(P < 0.05)。见图 4。
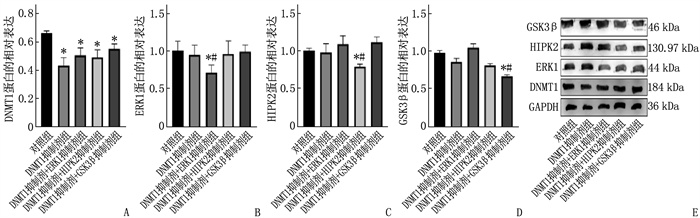
2.5 联合用药抑制DNMT1、ERK1、HIPK2和GSK3β蛋白表达水平
与对照组比较, DNMT1抑制剂降低了DNMT1蛋白表达水平,联合用药抑制ERK1、HIPK2、GSK3β的蛋白表达水平,差异有统计学意义(P < 0.05)。见图 5。
3. 讨论
AML是一种异质性极高的恶性肿瘤[12]。传统的“3+7”化疗方案(3 d使用蒽环类药物, 7 d使用阿糖胞苷药物)仅对部分患者有效,对于不适合强化化疗的患者效果有限,整体生存率低[13]。免疫治疗和DNMT1抑制剂具有一定的治疗潜力,但单药治疗效果有限且伴随副作用,因此需要开发新药物来增强疗效[14]。
本研究显示, DNMT1抑制剂能显著降低U937细胞活力。当DNMT1抑制剂与ERK1、HIPK2和GSK3β抑制剂联合使用时,细胞活力显著降低,表明这些信号通路可能存在协同作用。ERK1是丝裂原活化蛋白激酶/细胞外调节蛋白激酶(MAPK/ERK)信号通路的核心,参与细胞生长和分化[15]; HIPK2通过磷酸化调节多种转录因子,在肝细胞癌中通过促进缺氧诱导因子-1α(HIF-1α)降解而抑制肿瘤活力[16]; GSK3β对哺乳动物雷帕霉素靶蛋白(mTOR)信号通路有正向影响,促进神经元的生存信号传导[17]。
本研究显示, DNMT1抑制剂显著诱导U937细胞凋亡,与ERK1、HIPK2、GSK3β抑制剂联合使用时,凋亡率显著增高; 同时,联合用药导致G0/G1期细胞周期阻滞。MAPK信号抑制会导致AML细胞周期停滞。RT-qPCR和蛋白质印迹结果表明,联合用药显著降低了相关基因和蛋白的表达,影响细胞增殖和存活,改变基因表达模式[18]。
研究[19]显示,姜黄素联合DNMT1抑制剂可显著调控多种蛋白表达。国外研究[20-21]通过多维组学分析揭示了阿扎胞苷对AML治疗下单基因表达水平变化及不同功能调控通路的影响,结果表明通过DNA甲基化、转录组和蛋白组3个层次,阿扎胞苷能引起AML细胞基因沉默和蛋白阻滞。
综上所述, DNMT1抑制剂联合ERK1、HIPK2和GSK3β抑制剂的多靶点治疗策略能显著抑制AML细胞活力,诱导细胞凋亡和细胞周期阻滞,这为AML的联合靶向治疗提供了理论基础。
-
表 1 RT-qPCR序列引物
基因 上游引物 下游引物 GAPDH 5′-GACCACTTTGTCAAGCTCTATTTCC-3′ 5′-GTGAGGGTCTCTCTTCCTCTTGT-3′ DNMT1 5′-AGAAGGCTGGTGGGCGGAGT-3′ 5′-TGCCGTCCCGTAGGTAGTCG-3′ EPK1 5′-ATGCGTGACCTATGACCTG-3′ 5′-TCAGGTCATAGGTCACGCAT-3′ HIPK2 5′-AGTGGTGTTGAGCGGATAAC-3′ 5′-CGTCCAGTTGTCTCCAAAGT-3′ GSK3β 5′-GCTGAGCGACATGGAAGG-3′ 5′-GGAGTCCGTGTTGAGATGAT-3′ -
[1] DÖHNER H, WEI A H, APPELBAUM F R, et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN[J]. Blood, 2022, 140(12): 1345-1377.
[2] 王洪玲, 刘梦娜, 白萍, 等. AML患者异基因造血干细胞移植后复发危险因素分析[J]. 检验医学, 2023, 38(12): 1160-1166. [3] 陈静, 史利欢, 谢昕, 等. TEL-AML1融合基因在儿童急性淋巴细胞白血病中的表达及对其疗效及预后的影响[J]. 实用癌症杂志, 2024, 39(6): 891-894. [4] 邵若男, 辛红蕾, 施小凤. 急性髓系白血病CAR-T治疗的靶点选择[J]. 中国实验血液学杂志, 2024, 32(3): 965-969. [5] 卢钊鸿, 唐焕文. DNA甲基化与急性髓系白血病的研究进展[J]. 环境与健康杂志, 2024, 41(2): 174-178. [6] 邹浩冬, 杨飞, 张莞嫣, 等. DNMT1在口腔鳞状细胞癌中的表达及作用机制研究[J]. 川北医学院学报, 2024, 39(1): 12-17. [7] LEBLANC F R, BREESE E H, BURNS K C, et al. Clinical outcomes of hypomethylating agents and venetoclax in newly diagnosed unfit and relapsed/refractory paediatric, adolescent and young adult acute myeloid leukaemia patients[J]. Br J Haematol, 2024, 205(3): 1055-1066.
[8] 张悦. 去甲基化药物治疗伴DNMT3A和TET2基因突变的老年急性髓系白血病临床及实验研究[D]. 苏州: 苏州大学, 2022. [9] 李梦月, 邵杨柳, 李雨晴, 等. 地西他滨对AML1-ETO阳性急性髓系白血病细胞中PD-L2分子表达的影响[J]. 解放军医学院学报, 2023, 44(3): 239-247. [10] 杨晶晶, 张夏玮, 栾松华, 等. RNA甲基转移酶METTL3在急性髓系白血病发生发展及耐药中的研究进展[J]. 解放军医学院学报, 2024, 45(5): 567-571. [11] 尹金玉, 徐子瑶, 孙倩, 等. 维奈克拉联合地西他滨、阿柔比星对急性髓系白血病细胞增殖和凋亡的影响[J]. 南京医科大学学报: 自然科学版, 2022, 42(10): 1349-1356. [12] 姚云, 廖冬, 周双雄, 等. 长链非编码RNA CYP1B1-AS1对急性髓系白血病细胞增殖和迁移的影响及机制实验研究[J]. 陕西医学杂志, 2024, 53(6): 723-728. [13] ROMAN DIAZ J L, VAZQUEZ MARTINEZ M, KHIMANI F. New approaches for the treatment of AML beyond the 7+3 regimen: current concepts and new approaches[J]. Cancers (Basel), 2024, 16(3): 677.
[14] 陈杰甫, 武永强, 唐广. 去甲基化药物联合小剂量阿糖胞苷治疗难治复发急性髓系白血病的效果[J]. 河南医学研究, 2024, 33(9): 1671-1674. [15] SUN H, LIN Z Z, GONG Y R, et al. DUSP8-attenuated ERK1/2 signaling mediates lipogenesis and steroidogenesis in chicken granulosa cells[J]. Theriogenology, 2024, 226: 10-19.
[16] LI S N, YANG S, WANG H Q, et al. Upregulated lncRNA PRNT promotes progression and oxaliplatin resistance of colorectal cancer cells by regulating HIPK2 transcription[J]. World J Gastrointest Oncol, 2024, 16(4): 1564-1577.
[17] UENO K, KURAZUMI H, SUZUKI R, et al. miR-709 exerts an angiogenic effect through a FGF2 upregulation induced by a GSK3B downregulation[J]. Sci Rep, 2024, 14(1): 11372.
[18] ZHOU X Y, OHGAKI R, JIN C H, et al. Inhibition of amino acid transporter LAT1 in cancer cells suppresses G0/G1-S transition by downregulating cyclin D1 via p38 MAPK activation[J]. J Pharmacol Sci, 2024, 154(3): 182-191.
[19] LIU F R, GAO S, YANG Y X, et al. Antitumor activity of curcumin by modulation of apoptosis and autophagy in human lung cancer A549 cells through inhibiting PI3K/Akt/mTOR pathway[J]. Oncol Rep, 2018, 39(3): 1523-1531.
[20] HOU H A, TIEN H F. Genomic landscape in acute myeloid leukemia and its implications in risk classification and targeted therapies[J]. J Biomed Sci, 2020, 27(1): 81.
[21] JEYARAJU D V, ALAPA M, POLONSKAIA A, et al. Extended exposure to low doses of azacitidine induces differentiation of leukemic stem cells through activation of myeloperoxidase[J]. Haematologica, 2024, 109(4): 1082-1094.




 下载:
下载:
 苏公网安备 32100302010246号
苏公网安备 32100302010246号