Characteristics of coagulation function and immune function in children with severe adenovirus pneumonia and their clinical significance
-
摘要:目的
探讨重症腺病毒肺炎患儿凝血功能和免疫功能特征及其临床意义。
方法选取122例重症腺病毒肺炎患儿和120例非重症腺病毒肺炎患儿为研究对象, 分别设为重症组和非重症组; 根据预后将重症组患儿分为预后良好组(n=105)和预后不良组(n=17)。另选取同期120例体检健康儿童为对照组。检测凝血功能指标,包括凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)、凝血酶时间(TT); 采用散射免疫比浊法检测免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)水平; 采用多因素Cox回归分析探讨预后不良的影响因素。
结果与对照组比较,非重症组和重症组患儿白细胞(WBC)、中性粒细胞(N)、C反应蛋白(CRP)、红细胞沉降率(ESR)、白细胞介素-6(IL-6)、降钙素原(PCT)、FIB、IgG水平升高, B淋巴细胞、自然杀伤(NK) 细胞、PT、APTT、IgA、IgM水平降低,差异有统计学意义(P < 0.05); 与非重症组比较,重症组患儿WBC、N、CRP、ESR、IL-6、PCT、FIB、IgG水平升高,B淋巴细胞、NK细胞、PT、APTT、IgA、IgM水平降低,差异有统计学意义(P < 0.05)。与预后良好组相比,预后不良组CRP、IL-6、PCT、IgG水平升高, APTT、IgM、IgA水平降低,差异有统计学意义(P < 0.05)。多因素Cox回归分析结果显示, PCT、APTT、IgM为重症患儿预后不良的影响因素(P < 0.05)。
结论重症腺病毒肺炎患儿PT、APTT、IgA、IgM水平降低, FIB、IgG水平升高,凝血和免疫功能指标与重症腺病毒肺炎预后状况相关。
Abstract:ObjectiveTo explore the characteristics of coagulation and immune function and their clinical significance in children with severe adenovirus pneumonia (SAP).
MethodsA total of 122 children with SAP and 120 children with non-severe adenovirus pneumonia (NSAP) were enrolled and assigned to severe group and non-severe group. The severe group was further subdivided into good prognosis subgroup (n=105) and poor prognosis subgroup (n=17) according to prognosis. Additionally, 120 healthy children undergoing physical examination during the same period were included as control group. Coagulation function indicators, including prothrombin time (PT), activated partial thromboplastin time (APTT), fibrinogen (FIB), and thrombin time (TT) were measured. Levels of immunoglobulin A (IgA), immunoglobulin G (IgG), and immunoglobulin M (IgM) were determined using the nephelometric immunoassay. Multivariate Cox regression analysis was conducted to explore the influencing factors of poor prognosis.
ResultsCompared with the control group, children in both the non-severe and severe groups exhibited increased levels of white blood cells (WBC), neutrophils (N), C-reactive protein (CRP), erythrocyte sedimentation rate (ESR), interleukin-6 (IL-6), procalcitonin (PCT), FIB, and IgG, as well as decreased levels of B lymphocytes, natural killer (NK) cells, PT, APTT, IgA, and IgM (P < 0.05). Compared with the non-severe group, children in the severe group showed increased levels of WBC, N, CRP, ESR, IL-6, PCT, FIB, and IgG, as well as decreased levels of B lymphocytes, NK cells, PT, APTT, IgA, and IgM (P < 0.05). Compared with the good prognosis subgroup, the poor prognosis subgroup exhibited increased levels of CRP, IL-6, PCT, and IgG, as well as decreased levels of APTT, IgM, and IgA (P < 0.05). The results of multivariate Cox regression analysis showed that PCT, APTT, and IgM were influencing factors of poor prognosis in children with SAP (P < 0.05).
ConclusionChildren with SAP have decreased levels of PT, APTT, IgA, and IgM, as well as increased levels of FIB and IgG. Coagulation and immune function indicators are correlated with the prognosis of SAP.
-
经导管主动脉瓣置换术(TAVR)是治疗重度主动脉瓣狭窄的方法,急性感染性心内膜炎(AIE)为其少见严重并发症。本研究报道1例TAVR术后迟发血栓并发AIE案例,经外科手术后好转出院。
1. 临床资料
患者女,75岁,因“发热伴恶心呕吐20 h”入院。患者既往有高血压及乳腺肿瘤手术史,2023年7月12日因重度主动脉瓣狭窄在外院接受TAVR治疗,术后规律行华法林抗凝治疗,复查凝血功能示国际标准化比值(INR)维持2~3。2024年1月19日外院复查超声心动图(TTE)显示人工瓣膜支架前方与自体主动脉瓣根部间可见等回声团块(10 mm×10 mm), 考虑血栓可能,患者无明显不适,继续抗凝治疗。2024年7月31日复查TTE, 仍提示该部位等回声团块(6 mm×8 mm)。
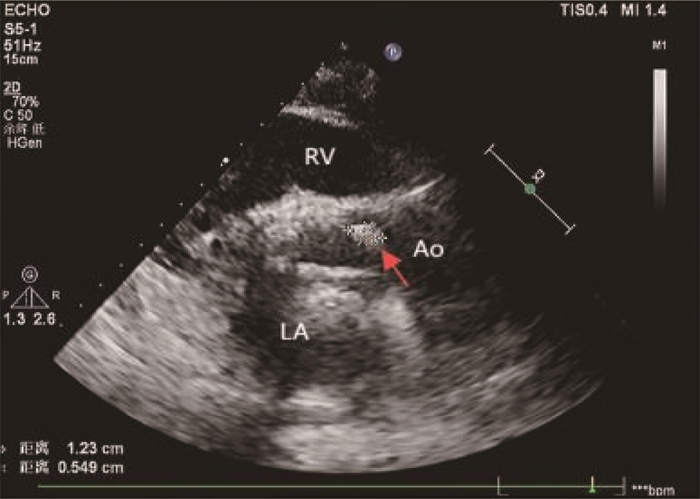
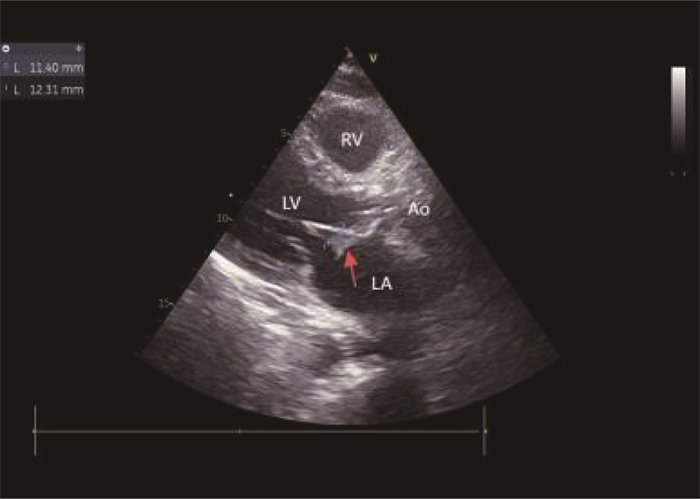
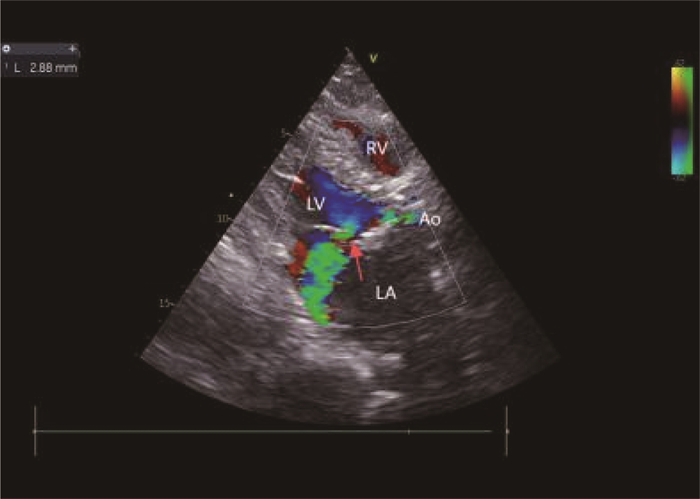
2024年8月6日患者突发畏寒、高热(体温40 ℃), 伴恶心、呕吐,无腹痛、腹泻、咳嗽、咳痰、头晕、头痛,退热治疗效果不佳后入院。查体: 体温38 ℃, 脉搏78次/min, 呼吸频率20次/min, 收缩压84 mmHg(1 mmHg=0.133 kPa), 舒张压41 mmHg。患者神志清楚,精神欠佳,双肺呼吸音粗,未闻及明显干湿性啰音; 心律齐,各瓣膜区未闻及病理性杂音; 腹软,无压痛、反跳痛,肠鸣音4次/min, 无双下肢水肿。血常规: 白细胞7.27×109/L、中性粒细胞92.7%、淋巴细胞百分比5.0%、血小板48×109/L。肝功能: 谷丙转氨酶28.1 U/L、谷草转氨酶67 U/L。肾功能: 尿酸292 μmol/L、尿素13.67 μmol/L、肌酐162 μmol/L。予以哌拉西林钠他唑巴坦钠经验性抗感染治疗,体温仍持续波动在39 ℃左右, 3 d后血培养提示金黄色葡萄球菌感染。TTE显示(见图 1): 左房内径38 mm、左室舒张末径47 mm、左室射血分数62%, 生物瓣局部强回声团块(12 mm×5 mm), 二尖瓣、三尖瓣轻度反流,诊断AIE。根据药敏试验结果及肝肾功能调整抗生素为万古霉素500 mg(每12 h 1次),治疗5 d后血象稍有下降,但仍高热不退。8月10日患者出现气喘,考虑心力衰竭,予扩血管、利尿等治疗,万古霉素联用头孢西丁1 g(每12 h 1次),治疗3 d, 体温降至38.5 ℃, 但呼吸困难加重。8月16日复查TTE: 二尖瓣前叶左房面赘生物形成(约12 mm×11 mm, 见图 2), 前叶穿孔可能(见图 3)伴二尖瓣重度反流,三尖瓣中-重度反流,主动脉瓣轻度反流。
请心脏外科会诊后转科进一步诊治,于8月20日行主动脉瓣生物瓣置换+二尖瓣生物瓣置换+三尖瓣成形+感染病灶清除+室间隔缺损修补+左心耳封堵+冠状动脉搭桥+心脏临时起搏器植入术。术中心内探查示二尖瓣前叶赘生物伴中度关闭不全, TAVR瓣膜在位但伴赘生物及瓣周脓肿,室间隔膜部右冠瓣下方穿孔(0.5 cm), 三尖瓣环扩大并伴中-重度关闭不全,二尖瓣前隔交界处脓肿形成并与室间隔穿孔相通,术中取出TAVR瓣膜(见图 4)。术后病理: 灶区黏液样变性,灶区玻璃样变性。术后出现三度房室传导阻滞,予以对症治疗。术后予头孢唑林1 g每8 h 1次+邦达4.5 g每8 h 1次联用9 d, 后改用邦达4.5 g每8 h 1次+达托霉素0.5 g(1次/d) 治疗3 d, 后单用达托霉素0.5 g(1次/d)治疗16 d, 并给予其他对症支持治疗,感染控制后植入永久起搏器。出院后继续抗凝治疗,术后3个月随访,患者无发热、胸闷或气促,复查TTE显示: 左房内径32 mm、左室舒张末径42 mm、左室射血分数55%, 生物瓣功能良好,未见赘生物或血栓形成。
2. 讨论
患者为老年女性,既往有高血压及乳腺恶性肿瘤手术史, TAVR术后长期行华法林抗凝治疗,且INR达标,术后6个月复查TTE提示生物瓣架局部出现强回声团块,考虑为血栓,继续抗凝治疗。6个月后复查发现血栓体积有所缩小,患者在此期间未出现任何不适症状。此次患者突发畏寒、发热,经过10 d的抗感染治疗后出现严重并发症,最终行外科手术治疗并得到好转。
回顾性分析本病例,可为TAVR术后并发症的治疗提供启示。⑴血栓形成原因: ① TAVR术中,退化的原生瓣膜被保留在原位作为锚定结构,可能成为血栓形成的诱因[1]。②植入的TAVR瓣叶与自体主动脉瓣瓣叶之间形成了新的解剖结构—新窦,可能导致血液瘀滞,从而增加血栓形成的风险[2]。⑵血栓的治疗: TAVR术后使用华法林抗凝治疗具有临床意义。在服用维生素K拮抗剂的患者中,若发生TAVR血栓,在不添加抗血小板治疗的情况下,目标INR需提升至2.5~3.5, 以有效减少血栓形成[3]。对于耐药或临床不稳定的患者,超低或低剂量的溶栓药物输注可能有效且安全[4]。若患者无法耐受药物治疗,应考虑重新介入TAVR或外科手术[5]。血栓消退后,若患者没有高出血风险特征,建议长期使用维生素K拮抗剂或新型口服抗凝药[5]。
该患者在术后长期服用华法林抗凝治疗期间形成了血栓,继续抗凝治疗6个月后血栓有所缩小,表明此类患者需要加强抗凝治疗。患者还并发了心内膜炎(IE),这可能与血栓继发感染有关。IE是TAVR术后罕见且严重的并发症。TAVR术后IE被视为人工瓣膜心内膜炎(PVE)的一种亚型,但由于其特定的患者群体(通常为合并症较多的老年患者)以及微生物学特征, IE相关并发症的发生率较高,且手术难度大,因此大多数TAVR-IE患者预后不良[6]。
目前,关于TAVR术后感染的治疗缺乏明确的指南。普通IE的治疗原则为足量、长程抗生素治疗,并在适当时机选择手术治疗。静脉抗生素治疗应基于微生物学特征和药敏试验结果,并且治疗时间应超过原发性IE患者(通常至少6周)。该患者接受抗生素治疗后未见显著效果,病情进一步加重,并出现了瓣周脓肿、二尖瓣赘生物、室间隔穿孔及急性心力衰竭等严重并发症。对于PVE患者,欧洲心脏协会指南推荐存在心力衰竭、严重假体功能障碍、脓肿或由葡萄球菌或非发酵革兰氏阴性菌引起的PVE时,应考虑紧急或择期手术治疗[7]。
TAVR-IE患者的手术治疗具有较高的挑战性。TAVR瓣膜支架框架内皮细胞生长,且膨胀装置的大型支架框架与升主动脉粘连,导致取出TAVR瓣膜的难度增加。此外,该患者还合并了二尖瓣赘生物、室间隔穿孔、三尖瓣关闭不全以及冠心病等,手术复杂且难度较大。由于涉及多个瓣膜手术以及冠状动脉旁路移植,手术时间延长,进一步增加了预后风险。如果合并主动脉根受累,还需进行主动脉根重建,进一步增加了手术难度。老年患者,尤其是对于合并基础疾病多、并发IE的患者,手术风险大,预后差。研究[8]表明,除了手术本身的挑战外,术后出现急性肾衰竭、呼吸衰竭、房颤、肺炎等并发症,或需要植入永久性起搏器的完全性心脏传导阻滞,都会对患者预后产生负面影响。
本例患者成功取出TAVR瓣膜及瓣架,并植入人工生物主动脉瓣,实现主动脉瓣置换,同时还成功完成了二尖瓣生物瓣置换、三尖瓣成形、室间隔修补以及冠状动脉搭桥术。术后,患者出现三度房室传导阻滞,待感染控制后行起搏器植入[9]。经过术后积极抗感染治疗,患者的感染和心力衰竭得到控制,病情显著好转,最终挽救生命。尽管如此,目前对于这类人群的手术并未有明确的治疗建议,且适应证通常根据经验个性化处理,因此未来仍需进一步研究以确定最佳的治疗时机和手术适应证。本病例为指导此类患者的治疗提供了有益的临床经验。
-
表 1 3组一般资料比较(x±s)[n(%)]
指标 重症组(n=122) 非重症组(n=120) 对照组(n=120) F/χ2 P 性别 男 62(50.82) 62(51.67) 61(50.83) 0.023 0.989 女 60(49.18) 58(48.33) 59(49.17) 年龄/月 15.06±3.20 15.12±2.68 15.08±2.95 0.013 0.987 WBC/(×109/L) 12.61±1.62*# 10.54±1.12* 6.42±1.74 520.436 < 0.001 N/% 72.60±7.32*# 58.60±6.01* 43.62±4.53 689.805 < 0.001 CRP/(mg/L) 25.52±3.92*# 19.42±3.95* 10.32±3.96 454.773 < 0.001 ESR/(mm/h) 45.25±5.69*# 39.14±4.02* 16.32±2.81 1 484.460 < 0.001 IL-6/(ng/mL) 65.12±6.72*# 48.39±4.92* 40.51±4.15 661.123 < 0.001 PCT/(ng/mL) 0.42±0.05*# 0.37±0.04* 0.02±0.01 4 069.602 < 0.001 B淋巴细胞/% 29.62±3.05*# 27.53±3.01* 22.62±2.96 173.017 < 0.001 NK细胞/% 11.52±1.62*# 13.84±1.61* 15.93±1.64 223.495 < 0.001 WBC: 白细胞; N: 中性粒细胞; CRP: C反应蛋白; ESR: 红细胞沉降率; IL-6: 白细胞介素-6; PCT: 降钙素原;
NK细胞: 自然杀伤细胞。与对照组比较, * P < 0.05; 与非重症组比较, #P < 0.05。表 2 3组凝血功能指标比较(x±s)
组别 n PT/s APTT/s FIB/(g/L) TT/s 重症组 122 8.50±0.91*# 26.85±2.81*# 6.62±0.68*# 17.20±1.82 非重症组 120 9.69±0.98* 29.14±3.01* 5.25±0.61* 16.95±1.70 对照组 120 13.50±1.42 35.97±3.68 3.15±0.66 16.72±1.69 PT: 凝血酶原时间; APTT: 活化部分凝血活酶时间; FIB: 纤维蛋白原; TT: 凝血酶时间。
与对照组比较, * P < 0.05; 与非重症组比较, #P < 0.05。表 3 3组免疫功能指标比较(x±s)
g/L 组别 n IgA IgG IgM 重症组 122 0.81±0.16*# 9.50±0.24*# 0.95±0.10*# 非重症组 120 1.11±0.18* 8.62±0.92* 1.15±0.14* 对照组 120 1.38±0.25 6.58±0.68 1.34±0.21 IgA: 免疫球蛋白A; IgG: 免疫球蛋白G; IgM: 免疫球蛋白M。与对照组比较, * P < 0.05; 与非重症组比较, #P < 0.05。 表 4 预后良好组与预后不良组指标比较(x±s)
指标 预后不良组
(n=17)预后良好组
(n=105)t P WBC/(×109/L) 13.20±1.60 12.52±1.62 1.608 0.110 N/% 73.00±7.33 72.54±7.32 0.240 0.810 CRP/(mg/L) 42.62±3.90 22.75±3.92 19.402 < 0.001 ESR/(mm/h) 45.51±5.65 45.21±5.70 0.202 0.841 IL-6/(ng/mL) 79.31±7.02 62.82±6.67 9.389 < 0.001 PCT/(ng/mL) 0.52±0.06 0.40±0.05 8.922 < 0.001 B淋巴细胞/% 29.95±3.11 29.57±3.04 0.477 0.634 NK细胞/% 11.50±1.64 11.52±1.62 0.047 0.962 PT/s 8.24±0.90 8.57±0.91 1.389 0.167 APTT/s 25.89±0.92 27.00±0.91 4.659 < 0.001 FIB/(g/L) 6.75±0.70 6.60±0.68 0.840 0.402 IgA/(g/L) 0.70±0.17 0.83±0.16 3.081 0.003 IgG/(g/L) 9.62±0.25 9.48±0.24 2.219 0.028 IgM/(g/L) 0.85±0.11 0.97±0.10 4.527 < 0.001 WBC: 白细胞; N: 中性粒细胞; CRP: C反应蛋白;
ESR: 红细胞沉降率; IL-6: 白细胞介素-6; PCT: 降钙素原;
NK细胞: 自然杀伤细胞; PT: 凝血酶原时间;
APTT: 活化部分凝血活酶时间; FIB: 纤维蛋白原;
IgA: 免疫球蛋白A; IgG: 免疫球蛋白G; IgM: 免疫球蛋白M。表 5 预后不良影响因素的多因素Cox回归分析
因素 β 标准误 Wald χ2 P HR 95%CI PCT 1.396 0.406 11.823 0.001 4.039 1.823~8.951 APTT 1.386 0.446 9.654 0.002 3.998 1.668~9.583 IgM 1.394 0.553 6.357 0.012 4.032 1.364~11.919 CRP 0.831 0.459 3.276 0.070 2.295 0.933~5.643 IL-6 0.985 0.562 3.075 0.080 2.679 0.890~8.060 IgG 0.698 0.390 3.200 0.074 2.009 0.935~4.315 IgA 0.785 0.459 2.927 0.087 2.193 0.892~5.392 -
[1] ZHONG H Q, DONG X Y. Analysis of clinical characteristics and risk factors of severe adenovirus pneumonia in children[J]. Front Pediatr, 2021, 9: 566797.
[2] 江三红. 人腺病毒重症感染的特点及其感染早期重症预警[J]. 武警医学, 2022, 33(5): 450-454. [3] XU X H, FAN H F, SHI T T, et al. Analysis of mortality risk factors in children with severe adenovirus pneumonia: a single-center retrospective study[J]. Pediatr Neonatol, 2023, 64(3): 280-287.
[4] 宋文良, 刘春峰. 儿童腺病毒肺炎免疫学特点及免疫学治疗方法[J]. 中国小儿急救医学, 2019, 26(10): 746-751. [5] 任哲, 刘鸿博, 袁月, 等. 新冠肺炎患者病房内新冠病毒污染的物体表面和空气消毒措施及效果[J]. 中国消毒学杂志, 2022, 39(1): 17-19. [6] SHI T T, CHEN C, FAN H F, et al. Impact of extracorporeal membrane oxygenation in immunocompetent children with severe adenovirus pneumonia[J]. BMC Pulm Med, 2023, 23(1): 41.
[7] ZHANG J, ZHU Y T, ZHOU Y Y, et al. Pediatric adenovirus pneumonia: clinical practice and current treatment[J]. Front Med, 2023, 10: 1207568.
[8] 中华人民共和国国家卫生健康委员会, 国家中医药管理局. 儿童腺病毒肺炎诊疗规范(2019年版)[J]. 临床医学研究与实践, 2019, 4(20): 201-201. [9] 中华人民共和国国家健康委员会, 国家中医药局. 儿童社区获得性肺炎诊疗规范(2019年版)[J]. 中华临床感染病杂志, 2019, 12(1): 6-13. [10] WANG N, FANG Y L, DONG H Q, et al. Clinical features and prediction of risk factors for severe adenovirus pneumonia in children[J]. Transl Pediatr, 2024, 13(1): 63-71. doi: 10.21037/tp-23-312
[11] 杨瑞利, 张慧丽, 郭晓波, 等. 血清VEGF、sICAM-1、25-(OH)D3水平与腺病毒肺炎患儿炎症因子和喘息的关系研究[J]. 检验医学与临床, 2023, 20(22): 3370-3374. [12] 荣道香, 宣爱丽, 方姗姗, 等. 儿童腺病毒肺炎120例临床特征分析[J]. 中华全科医学, 2020, 18(7): 1096-1098, 1142. [13] YANG T, LIU L L, WU X H, et al. Serum hyaluronic acid and procollagen Ⅲ, N-terminal propeptide levels are highly associated with disease severity and predict the progression of COVID-19[J]. Front Cell Infect Microbiol, 2023, 13: 1249038.
[14] 曾洲榆, 官燕飞, 倪文鹏, 等. 呼吸道腺病毒感染儿童血清PCT、SAA、25(OH)D的检测及临床意义[J]. 检验医学与临床, 2022, 19(3): 408-410. [15] 尹标, 黄桂付. 支气管哮喘合并病毒感染患儿血清单核细胞趋化蛋白-1、基质金属蛋白酶-9、白细胞介素-6水平变化[J]. 中国临床医生杂志, 2022, 50(1): 104-107. [16] 罗素云. APTT、PT、FIB与D-D水平在新生儿早期凝血功能障碍中的诊断价值分析[J]. 中国实用医药, 2019, 14(16): 69-70. [17] 余玲, 贾颖娜, 王轶. 妊娠期肝内胆汁淤积症患者凝血功能相关指标的临床意义[J]. 实用临床医药杂志, 2022, 26(20): 119-123, 135. doi: 10.7619/jcmp.20221818 [18] 李莹莹, 朱晓东, 冯兴勇, 等. 血浆组织因子微粒、脱-γ-羧基凝血酶原、神经元特异性烯醇化酶在胃癌患者血液高凝状态中的临床价值[J]. 国际检验医学杂志, 2022, 43(21): 2677-2679, 2688. [19] 陈妙婵, 蔡葵. 凝血筛选及常规检测评估体外循环心脏瓣膜置换术围手术期输血治疗[J]. 临床输血与检验, 2016, 18(1): 18-21. [20] LIN J, LI Q X, LI W X. Application of magnetic bead method in detecting coagulation function[J]. Ann Palliat Med, 2021, 10(10): 10607-10615.
[21] 王瑶, 俆美琴, 张晓梅. 精神分裂症患者凝血四项指标检查及与患者疾病进展的关系研究[J]. 航空航天医学杂志, 2022, 33(10): 1172-1174. [22] 杨龑, 张海艳, 宋文仕, 等. 反复呼吸道感染患儿血清维生素A与体液免疫水平研究[J]. 中国妇幼保健, 2019, 34(18): 4205-4206. [23] 杨婷, 饶花平, 罗力妍, 等. 重组人干扰素-α1b吸入联合免疫球蛋白对重症腺病毒肺炎患儿细胞免疫功能的影响[J]. 疑难病杂志, 2021, 20(7): 676-679, 684. [24] 张慎荣, 邵启民, 迟迪, 等. 腺病毒感染儿童体液免疫功能分析[J]. 中国妇幼保健, 2021, 36(10): 2272-2274.
计量
- 文章访问数: 17
- HTML全文浏览量: 5
- PDF下载量: 4




 下载:
下载:

 苏公网安备 32100302010246号
苏公网安备 32100302010246号
