MicroRNA-34a regulates the CaMKⅡ/CREB pathway to improve isoflurane anesthesia-induced cognitive dysfunction in aged rats
-
摘要:目的
探讨微小RNA(miR)-34a对异氟烷麻醉引起的老年大鼠认知功能障碍的影响及其作用机制。
方法将40只20月龄大鼠随机分为正常(Con)组、模型(Model)组、miR-34a抑制剂(miR-34a inhibitor)组和miR-34a激动剂(miR-34a mimics)组,每组10只。miR-34a inhibitor组和miR-34a mimics组大鼠尾静脉注射100 nmol/kg对应药物, Con组和Model组大鼠尾静脉注射等剂量生理盐水, 1次/d, 连续5 d。第6天,除正常组外,其余组大鼠均进行单次异氟烷麻醉6 h, 构建术后认知功能障碍(POCD)模型。建模完成后12 h, 采用Morris水迷宫实验观察大鼠逃避潜伏期和目标象限停留时间。采用免疫荧光染色观察大鼠海马组织中离子钙结合衔接分子1(Iba-1)阳性表达率。采用实时荧光定量聚合酶链反应(qRT-PCR)检测大鼠海马组织中miR-34a以及B细胞淋巴瘤-2(Bcl-2)和Bcl-2相关X蛋白(Bax)的mRNA相对表达量。采用酶联免疫吸附实验(ELISA)检测大鼠血清中白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、活性氧(ROS)和谷胱甘肽过氧化物酶(GSH-Px)水平以及海马组织中谷氨酸(Glu)、Ca2+和N-甲基-D-天冬氨酸受体2B(NMDAR2B)含量。采用蛋白质印迹(Western blotting)检测大鼠海马组织中钙-钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)、pCaMKⅡ、环磷腺苷效应元件结合蛋白(CREB)、磷酸化CREB(pCREB)蛋白相对表达量。
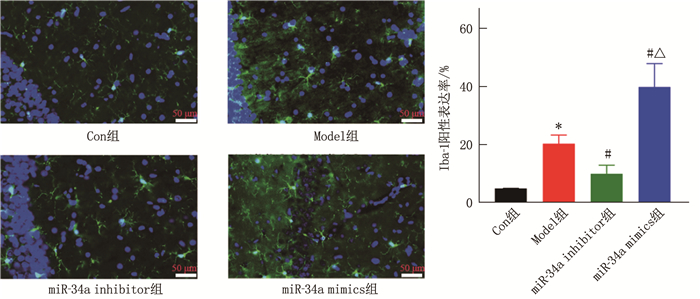
结果与Con组比较, Model组大鼠逃避潜伏期、血清中IL-6、IL-1β、ROS水平以及海马组织中Iba-1阳性表达率、miR-34a、Bax mRNA相对表达水平和Glu、Ca2+、NMDAR2B含量延长或升高, 目标象限停留时间、血清中GSH-Px水平、海马组织中Bcl-2 mRNA相对表达水平、Bcl-2/Bax以及pCaMKⅡ/CaMKⅡ和PCREB/CREB缩短或降低,差异有统计学意义(P < 0.05)。下调miR-34a表达可缩短模型大鼠逃避潜伏期,以及降低血清中IL-6、IL-1β、ROS水平和海马组织中Iba-1阳性表达率、miR-34a、Bax mRNA相对表达水平和Glu、Ca2+、NMDAR2B含量(P < 0.05), 还可延长目标象限停留时间,以及血清中GSH-Px水平、海马组织中Bcl-2 mRNA相对表达水平、Bcl-2/Bax以及pCaMKⅡ/CaMKⅡ和PCREB/CREB(P < 0.05)。上调miR-34a表达可通过促进小胶质细胞的异常激活以及炎症、氧化应激和凋亡,抑制CaMKⅡ/CREB信号通路活化,加重模型大鼠认知障碍。
结论miR-34a在POCD老年大鼠中高表达,抑制miR-34a表达可通过激活CaMKⅡ/CREB信号通路改善老年大鼠因异氟烷麻醉引起的认知功能障碍。
-
关键词:
- 微小RNA-34a /
- 异氟烷 /
- 认知功能障碍 /
- 炎症 /
- 钙-钙调蛋白依赖性蛋白激酶Ⅱ /
- 环磷腺苷效应元件结合蛋白
Abstract:ObjectiveTo investigate the effects and underlying mechanisms of microRNA (miR)-34a on isoflurane anesthesia-induced cognitive dysfunction in aged rats.
MethodsForty rats at 20 months of age were randomly divided into control (Con) group, model group, miR-34a inhibitor group and miR-34a mimics group, with 10 rats in each group. Rats in the miR-34a inhibitor and miR-34a mimics groups received a tail vein injection of 100 nmoL/kg of the corresponding drug, while those in the Con and model groups received an equal volume of saline, once daily for 5 consecutive days. At the 6th day, all groups except the Con group underwent a single 6-hour isoflurane anesthesia to establish a postoperative cognitive dysfunction (POCD) model. Twelve hours after modeling, the Morris water maze test was used to assess the escape latency and time spent in the target quadrant. Immunofluorescence staining was performed to observe the positive expression rate of ionized calcium-binding adapter molecule 1 (Iba-1) in the hippocampal tissue. Real-time quantitative polymerase chain reaction (qRT-PCR) was used to measure the relative expression levels of miR-34a, B-cell lymphoma-2 (Bcl-2) and Bcl-2-associated X-protein (Bax) mRNA in the hippocampal tissue. Enzyme-linked immunosorbent assay (ELISA) was conducted to detect serum levels of interleukin-6 (IL-6), interleukin-1β (IL-1β), reactive oxygen species (ROS) and glutathione peroxidase (GSH-Px), as well as the content of glutamate (Glu), Ca2+ and N-methyl-D-aspartate receptor 2B (NMDAR2B) in the hippocampal tissue. Western blotting was used to determine the relative expression levels of calcium-calmodulin-dependent protein kinase Ⅱ (CaMKⅡ), phosphorylated CaMKⅡ (pCaMKⅡ), cyclophosphoadenosine effector-binding protein (CREB), and phosphorylated CREB (pCREB) in the hippocampal tissue.
ResultsCompared with the Con group, the Model group exhibited significantly prolonged escape latency, elevated serum levels of IL-6 and IL-1β and ROS, as well as increased positive expression rate of Iba-1, relative expression levels of miR-34a and Bax mRNA, contents of Glu, Ca2+ and NMDAR2B in the hippocampal tissue; in contrast, the time spent in the target quadrant, serum GSH-Px levels, Bcl-2 mRNA relative expression levels, Bcl-2/Bax, as well as pCaMKⅡ/CaMKⅡ and pCREB/CREB in the hippocampal tissue were significantly reduced (P < 0.05). Downregulation of miR-34a expression shortened the escape latency and decreased serum levels of IL-6, IL-1β and ROS, as well as Iba-1 positive expression rate, relative expression levels of miR-34a and Bax mRNA, Glu, Ca2+ and NMDAR2B content in the hippocampal tissue (P < 0.05). It also extended the time spent in the target quadrant and increased serum GSH-Px levels, Bcl-2 mRNA expression levels, Bcl-2/Bax, as well as pCaMKⅡ/CaMKⅡ and pCREB/CREB in the hippocampal tissue (P < 0.05). Upregulation of miR-34a expression promoted abnormal activation of microglia, inflammation, oxidative stress and apoptosis, inhibited the activation of the CaMKⅡ/CREB signaling pathway, and exacerbated cognitive dysfunction in the model rats.
ConclusionMiR-34a is highly expressed in POCD in aged rats. Inhibition of miR-34a expression can improve isoflurane anesthesia-induced cognitive dysfunction in aged rats by activating the CaMKⅡ/CREB signaling pathway.
-
术后谵妄(POD)是以意识混乱和认知障碍为主要特征的脑功能异常,常于术后5 d内发生,是外科术后最常见的并发症之一,尤其是心脏外科手术,由于血流循环改变,更易发生POD, 但对于非心脏外科手术患者而言, POD也并不少见[1-3]。POD不仅能导致住院时间延长,而且可影响手术效果甚至增高患者病死率[4-5]。因此,早期预测及识别POD发生风险,并予以个体化干预策略,对于降低POD发生率有重要意义。既往POD相关研究[6-7]主要针对心脏外科手术患者或非心脏手术的单病种患者,得到的结果异质性较强,难以获得具有广泛应用价值的预测指标。衰弱是一种机体综合状态,主要表现为与衰老无关的多器官功能减退,既往研究[8-9]已证实,其与腹部外科手术、骨科手术患者POD的发生具有相关性。营养不良可损伤免疫系统,诱发炎症并影响神经营养因子合成,单病种已被证实是POD的诱发因素,但是否具有推广价值尚需验证[10]。本研究探讨术前营养状况及衰弱对行非心脏手术老年患者POD的预测价值,现报告如下。
1. 资料与方法
1.1 一般资料
本研究为回顾性队列研究,选取2020年1月—2022年12月河北省承德市中医院376例行非心脏手术的老年患者为研究对象。纳入标准: ①年龄>60岁者; ②美国麻醉医师协会(ASA)分级为Ⅱ级或Ⅲ级,采用全身麻醉(吸入麻醉/静脉麻醉)者; ③术前24内行营养风险评估及衰弱评定者。排除标准: ①术前存在认知功能障碍或精神异常者; ②急诊手术患者; ③住院时间不足5 d的患者; ④研究相关资料存在明显缺失者。
1.2 方法
通过电子病历系统收集所有患者的临床资料,主要包括一般资料(性别、年龄、体质量、文化程度、糖尿病、高血压、ASA分级、衰弱状况、营养状况等)、血液学指标(白蛋白、血红蛋白、肌酐)、手术相关情况(手术类型、手术时间、麻醉时间、麻醉方式、术中出血量)。其中衰弱的评定采用Fried衰弱评估量表,主要从体质量下降程度、体质量指数范围、疲惫感、行走速度、活动量5个方面进行评定,每项满足条件者计1分,≥3分判定为衰弱[11]。营养状况的评估采用营养风险指数(NSI), 计算公式为: NSI=1.489×血清白蛋白浓度(g/L)+ 41.7×(目前体质量/既往体质量), < 97.5为中重度营养不良[12]。
术后5 d内采用意识紊乱测试法[13]进行POD评定,主要涉及4个方面: ①思维混乱; ②意识改变; ③起病急骤且具有波动性; ④注意力异常、无法集中。POD诊断标准为满足①或②中的任意1项且同时满足③、④。本研究以术后5 d内是否出现POD为主要结局指标,并据此将376例患者分为POD组80例和非POD组296例。
1.3 统计学分析
采用SPSS 23.0软件进行数据整理和统计学比较。计量资料采用均数±标准差的形式描述,组间比较采用t检验; 计数资料以例数和百分比的形式描述,组间比较采用卡方检验。采用多因素Logistic回归法分析POD的危险因素,并采用受试者工作特征(ROC)曲线对营养不良与衰弱预测POD的价值进行定量评估,结果以曲线下面积(AUC)表示,并分为预测价值良好(AUC>0.8)、一般(AUC 0.6~0.8)、较低(AUC < 0.6)。本研究采用双侧检验,检验水准为α=0.05, 以P < 0.05为差异有统计学意义。
2. 结果
2.1 POD发生危险因素的单因素分析
与非POD组比较, POD组年龄>70岁、糖尿病、初中及以下文化程度、术前衰弱、术前中重度营养不良患者的占比升高,白蛋白水平降低,差异有统计学意义(P < 0.05)。2组性别、手术类型、手术时间、麻醉时间比较,差异无统计学意义(P>0.05), 见表 1。
表 1 POD组与非POD组临床资料单因素分析[n(%)]变量 分类 POD组(n=80) 非POD组(n=296) t/χ2 P 性别 男 49(61.25) 163(55.07) 0.979 0.323 女 31(38.75) 133(44.93) 年龄 >70岁 46(57.50) 118(39.86) 7.964 0.005 ≤70岁 34(42.50) 178(60.14) 文化程度 初中及以下 50(62.50) 146(49.32) 4.381 0.036 高中及以上 30(37.50) 150(50.68) 糖尿病 21(26.25) 36(12.16) 9.718 0.002 高血压病 45(56.25) 177(59.80) 0.328 0.567 ASA分级 Ⅱ级 33(41.25) 103(34.80) 1.136 0.287 Ⅲ级 47(58.75) 193(65.20) 术前衰弱 是 56(70.00) 107(36.15) 29.837 < 0.001 否 24(30.00) 189(60.47) 术前营养状况 无或轻度营养不良 48(60.00) 231(78.04) 10.708 0.001 中重度营养不良 32(40.00) 65(21.96) 白蛋白/(g/L) 28.89±5.73 31.16±5.20 3.389 0.001 血红蛋白/(g/L) 125.64±25.49 130.88±29.25 1.459 0.145 血肌酐/(μmol/L) 105.36±30.81 98.64±27.27 1.901 0.058 手术类型 腹部手术 27(33.75) 82(27.70) 1.822 0.610 骨科手术 24(30.00) 84(28.38) 肺部手术 16(20.00) 76(25.68) 其他 13(16.25) 54(18.24) 手术时间/min 163.32±23.17 155.67±25.82 1.721 0.086 麻醉时间/min 206.53±51.64 195.72±48.36 1.748 0.081 麻醉方式 吸入麻醉 30(37.50) 127(42.91) 0.757 0.384 静脉麻醉 50(62.50) 169(57.09) 术中出血量/mL 212.08±30.45 205.53±34.76 1.534 0.126 2.2 POD发生危险因素的多因素Logistic回归分析
由于单因素分析可能受到混杂因素的影响,为了排除干扰,将本研究上述单因素分析中P < 0.05的指标为自变量,以是否发生POD为因变量,采用多因素Logistic回归分析进一步筛选POD的危险因素。在筛选自变量时,由于白蛋白与营养状况具有共线性,暂时不将白蛋白纳入分析。由于自变量均为二分类变量,分别赋值0或1(见表 2)。多因素Logistic回归分析显示,年龄>70岁、术前衰弱、术前中重度营养不良是非心脏手术老年患者出现POD的独立危险因素,见表 3。
表 2 变量赋值变量 赋值说明 因变量 发生POD为1, 未发生POD为0 自变量 年龄 >70岁为1, ≤70岁为0 糖尿病 有糖尿病为1,无糖尿病为0 文化程度 初中及以下为1,高中及以上为0 术前衰弱 衰弱为1,无衰弱为0 术前营养状况 中重度营养不良为1, 无营养不良或轻度营养不良为0 表 3 多因素Logistic回归分析结果指标 β S.E. Wald OR(95%CI) P 年龄 0.335 0.149 5.054 1.398(1.044~1.872) 0.025 糖尿病 0.278 0.169 2.718 1.320(9.949~1.838) 0.099 文化程度 0.216 0.179 1.459 1.241(0.874~1.762) 0.227 术前衰弱 0.534 0.163 10.690 1.706(1.238~2.349) 0.001 术前中重度营养不良 0.490 0.123 15.782 1.632(1.282~2.079) < 0.001 2.3 预测效能分析
基于多因素分析结果,采用ROC曲线评估术前衰弱、营养状况预测非心脏手术老年患者出现POD的临床效能, AUC分别为0.669、0.584, 提示具有一定预测价值。两者联合预测的AUC为0.801, 预测性能最优,见图 1和表 4。
表 4 ROC曲线分析结果指标 AUC(95%CI) 灵敏度/% 特异度/% 衰弱 0.669(0.603~0.736) 70.00 63.85 中重度营养不良 0.584(0.511~0.657) 37.85 78.04 衰弱联合中重度营养不良 0.801(0.754~0.847) 96.25 63.85 3. 讨论
POD是外科手术的常见并发症,主要为非特异性脑电活动异常,不仅可导致短期预后不良,如住院时间延长、医疗花费增加、致死、致残,而且可导致永久性神经损伤,影响患者远期预后[4-5]。老年人神经调节能力下降,是POD的高发人群。研究[14]证实,高龄是POD的诱发因素,行外科手术的老年人群中高达50%的患者出现不同程度的POD, 因此降低老年人POD发生率具有重要意义。既往针对非心脏手术单病种的研究[3]显示, POD发生率为5%~70%。本研究结果显示, 376例老年患者中, POD发生率为21.28%。
研究认为, POD是外界环境-生理特征-病理改变综合作用的结果,但详细的作用机制尚不明确,由于临床尚缺乏特效的干预措施,因此及时预测POD发生风险具有重要意义。衰弱是一种全身功能异常综合征,患者多器官储备功能低下,导致对炎症损伤、应激损伤等的应对能力减低,患者表现为对疾病的易感性增加,易发生多种不良事件。炎症损伤及创伤应激被认为是衰弱的始动因素,而POD同样与炎症反应、应激反应相关,因此推测衰弱对于POD的发生具有预测作用,有助于早期识别POD。衰老诱发的炎症状态可释放白细胞介素-6、肿瘤坏死因子-α等炎症介质并损伤血脑屏障,诱发神经功能、认知异常,进而促进POD的发生。一项针对老年骨科手术患者的单中心回顾性横断面研究[15]显示, Frail衰弱评分每增加1分, POD风险增加33%(OR=1.33, 95%CI: 1.02~1.72, P=0.03)。一项纳入178例65岁以上非心脏大手术患者的前瞻性队列研究[16]显示,术前衰弱者发生POD的风险是健康人群的2.7倍。一项纳入3 250例接受外科手术的成年患者的Meta分析[17]显示,不管是前瞻性研究还是队列研究,术前衰弱均是POD的独立危险因素,在前瞻性研究中其相关性更显著(OR=3.64, 95%CI: 2.95~4.49, P < 0.001), 且不受患者年龄、择期/急诊手术、心脏/非心脏手术以及POD诊断方法的影响。本研究结果表明,术前衰弱是POD的独立危险因素,进一步验证了两者的相关性。本研究进一步通过ROC曲线评定术前衰弱对POD的预测价值,发现衰弱预测老年非心脏手术患者出现POD的AUC为0.669, 提示预测价值有待提高,可能与POD发生机制较复杂、多个维度受多种因素的影响相关。
营养状况与POD的发生具有密切关系,营养不良一方面会导致蛋白质过量分解,影响神经递质的合成; 另一方面可损伤免疫功能并导致感染,而炎症损伤已被证实是POD的重要影响因素。此外,作为营养评价指标之一的白蛋白水平降低可影响POD的发生。NRI评分综合考虑了白蛋白和体质量变化的影响,可全面、客观地反映机体影响状况。张莹等[18-19]针对老年髋部手术患者的研究表明,术前营养不良是老年髋部骨折患者发生POD的独立危险因素,此结论在其他非心脏外科手术中得到了进一步验证。近年来,一项针对非心脏外科手术的前瞻性队列研究[20]验证了此种相关性的普适性,即在不考虑病种的情况下,与无营养风险的患者相比,严重/中度营养风险的非心脏外科手术患者更有可能出现POD(OR=2.56, 95%CI: 1.11~5.89)。本研究多因素Logistic回归分析校正混杂因素后发现,术前中重度营养不良是非心脏手术老年患者发生POD的独立危险因素。ROC曲线表明,中重度营养不良预测POD发生的AUC为0.584, 提示预测价值仍有改善空间,而衰弱联合中重度营养不良预测POD的AUC最高,预测效能较为优良,可能与两者可从多个方面对POD发生风险进行评定有关。
本研究首次探究了术前营养不良联合衰弱在非心脏外科手术老年患者中POD的预测价值,但也存在一定局限性: 本研究为单中心回顾性研究,可能受混杂因素的干扰; 缺乏详细机制的研究。综上所述,术前营养不良及衰弱与非心脏外科手术老年患者POD具有相关性,联合应用可预测POD发生风险,从而辅助临床早期识别出高危人群,以便进行针对性干预,降低POD发生率。
-
表 1 各组大鼠血气分析指标及血糖比较(x±s)(n=10)
组别 pH值 pa(O2)/mmHg pa(CO2)/mmHg 血糖/(mmol/L) Con组 7.38±0.05 119.30±8.99 39.33±4.01 5.12±0.53 Model组 7.42±0.08 118.45±11.04 41.77±6.28 4.89±0.60 miR-34a inhibitor组 7.40±0.07 120.68±8.32 39.90±4.57 5.00±0.45 miR-34a组mimics 7.41±0.08 117.97±10.11 40.80±5.63 4.97±0.58 pa(O2): 动脉血氧分压; pa(CO2): 动脉血二氧化碳分压。 表 2 各组大鼠Morris水迷宫实验结果(x±s)(n=10)
s 组别 逃避潜伏期 目标象限停留时间 Con组 22.70±3.12 46.31±8.10 Model组 39.45±4.19* 28.57±5.34* miR-34a inhibitor组 30.02±2.96# 41.16±7.20# miR-34a mimics组 45.24±4.60#△ 23.87±4.51#△ 与Con组比较, * P<0.05; 与Model组比较, #P<0.05;
与miR-34a inhibitor组比较, △P<0.05。表 3 各组大鼠海马组织中miR-34a及Bcl-2和Bax mRNA的相对表达水平比较(x±s)(n=10)
组别 miR-34a Bcl-2 mRNA Bax mRNA Bcl-2/Bax Con组 1.00±0.00 1.00±0.00 1.00±0.01 1.00±0.02 Model组 1.87±0.10* 0.40±0.03* 1.73±0.12* 0.23±0.09* miR-34a inhibitor组 0.26±0.04# 0.87±0.15# 1.24±0.11# 0.70±0.11# miR-34a mimics组 7.35±0.51#△ 0.31±0.05#△ 2.34±0.20#△ 0.13±0.10#△ 与Con组比较, * P<0.05; 与Model组比较, #P<0.05; 与miR-34a inhibitor组比较, △P<0.05。 表 4 各组大鼠血清中IL-6、IL-1β、ROS、GSH-Px水平比较(x±s)(n=10)
组别 IL-6/(ng/L) IL-1β/(ng/L) ROS/(ng/L) GSH-Px/(U/mL) Con组 9.20±0.62 3.38±0.24 44.68±3.35 76.59±11.21 Model组 14.93±1.05* 7.25±0.36* 81.52±5.17* 39.96±5.73* miR-34a inhibitor组 10.80±0.78# 4.81±0.35# 54.43±4.22# 62.87±8.08# miR-34a mimics组 19.97±1.33#△ 9.11±0.44#△ 96.64±5.60#△ 30.05±4.32#△ IL-6: 白细胞介素-6; IL-1β: 白细胞介素-1β; ROS: 活性氧; GSH-Px: 谷胱甘肽过氧化物酶。
与Con组比较, * P<0.05; 与Model组比较, #P<0.05; 与miR-34a inhibitor组比较, △P<0.05。表 5 各组大鼠海马组织中Glu、Ca2+和NMDAR2B含量以及CaMKⅡ/CREB信号通路相关蛋白表达量比较(x±s)(n=10)
组别 Glu/(μg/g pro) Ca2+/(μmoL/g pro) NMDAR2B/(ng/g pro) pCaMKⅡ/CaMKⅡ PCREB/CREB Con组 483.94±14.62 50.06±9.88 14.62±6.49 0.93±0.07 0.89±0.08 Model组 630.91±21.04* 81.43±16.91* 27.97±9.23* 0.41±0.03* 0.43±0.04* miR-34a inhibitor组 527.85±17.27# 62.34±12.06# 19.78±7.14# 0.80±0.06# 0.77±0.06# miR-34a mimics组 750.18±26.56#△ 149.99±18.67#△ 39.90±10.06#△ 0.19±0.02#△ 0.22±0.04#△ Glu: 谷氨酸; NMDAR2B: N-甲基-D-天冬氨酸受体2B; CaMKⅡ: 钙-钙调蛋白依赖性蛋白激酶Ⅱ;
CREB: 环磷腺苷效应元件结合蛋白。与Con组比较, * P<0.05; 与Model组比较, #P<0.05; 与miR-34a inhibitor组比较, △P<0.05。 -
[1] 戴敏, 杨子昌, 胡瑞霖, 等. 外周血脑型脂肪酸结合蛋白和激肽释放酶6对高龄髋关节置换患者术后认知功能障碍的预测价值[J]. 实用临床医药杂志, 2023, 27(12): 44-49. [2] NEEDHAM M J, WEBB C E, BRYDEN D C. Postoperative cognitive dysfunction and dementia: what we need to know and do[J]. Br J Anaesth, 2017, 119(suppl_1): i115-i125.
[3] 郑彬, 应彦璐, 张顺才, 等. 嘌呤受体P2X7抑制剂BBG对异氟烷麻醉致老年大鼠认知功能障碍的影响[J]. 解剖学研究, 2016, 38(3): 165-168. [4] JIANG H L, ASHRAF G M, LIU M M, et al. Tilianin ameliorates cognitive dysfunction and neuronal damage in rats with vascular dementia via p-CaMKⅡ/ERK/CREB and ox-CaMKⅡ-dependent MAPK/NF-κB pathways[J]. Oxid Med Cell Longev, 2021, 2021: 6673967. doi: 10.1155/2021/6673967
[5] XU Y Z, GUO B Y, LIU X Y, et al. MiR-34a inhibits melanoma growth by targeting ZEB1[J]. Aging, 2021, 13(11): 15538-15547. doi: 10.18632/aging.203114
[6] SARKAR S, ENGLER-CHIURAZZI E B, CAVENDISH J Z, et al. Over-expression of miR-34a induces rapid cognitive impairment and Alzheimer's disease-like pathology[J]. Brain Res, 2019, 1721: 146327. doi: 10.1016/j.brainres.2019.146327
[7] 曲向东, 徐诚实, 曲智俊, 等. 异氟烷麻醉后老年大鼠学习/记忆功能改变与脑海马CA1区谷氨酸水平及受体变化的关系[J]. 中国老年学杂志, 2016, 36(14): 3384-3386, 3387. [8] MONK T G, WELDON B C, GARVAN C W, et al. Predictors of cognitive dysfunction after major noncardiac surgery[J]. Anesthesiology, 2008, 108(1): 18-30. doi: 10.1097/01.anes.0000296071.19434.1e
[9] 周美兰. 全身麻醉和腰硬联合麻醉对老年骨科患者术后短期认知功能的影响[J]. 实用临床医药杂志, 2018, 22(1): 91-93. doi: 10.7619/jcmp.201801028 [10] ZHANG Y, MENG Q S, YIN J L, et al. Anthocyanins attenuate neuroinflammation through the suppression of MLK3 activation in a mouse model of perioperative neurocognitive disorders[J]. Brain Res, 2020, 1726: 146504. doi: 10.1016/j.brainres.2019.146504
[11] TERRANDO N, ERIKSSON L I, RYU J K, et al. Resolving postoperative neuroinflammation and cognitive decline[J]. Ann Neurol, 2011, 70(6): 986-995. doi: 10.1002/ana.22664
[12] TRAVICA N, LOTFALIANY M, MARRIOTT A, et al. Peri-operative risk factors associated with post-operative cognitive dysfunction (POCD): an umbrella review of meta-analyses of observational studies[J]. J Clin Med, 2023, 12(4): 1610. doi: 10.3390/jcm12041610
[13] WANG H L, LIU H, XUE Z G, et al. Minocycline attenuates post-operative cognitive impairment in aged mice by inhibiting microglia activation[J]. J Cell Mol Med, 2016, 20(9): 1632-1639. doi: 10.1111/jcmm.12854
[14] OKELLO A, EDISON P, ARCHER H A, et al. Microglial activation and amyloid deposition in mild cognitive impairment: a PET study[J]. Neurology, 2009, 72(1): 56-62. doi: 10.1212/01.wnl.0000338622.27876.0d
[15] ALAM J J. Selective brain-targeted antagonism of p38 MAPKα reduces hippocampal IL-1β levels and improves Morris water maze performance in aged rats[J]. J Alzheimers Dis, 2015, 48(1): 219-227. doi: 10.3233/JAD-150277
[16] FU J J, IMANI S, WU M Y, et al. MicroRNA-34 family in cancers: role, mechanism, and therapeutic potential[J]. Cancers, 2023, 15(19): 4723. doi: 10.3390/cancers15194723
[17] MOLLINARI C, RACANIELLO M, BERRY A, et al. MiR-34a regulates cell proliferation, morphology and function of newborn neurons resulting in improved behavioural outcomes[J]. Cell Death Dis, 2015, 6(1): e1622. doi: 10.1038/cddis.2014.589
[18] LI L P, MIAO M, CHEN J R, et al. Role of Ten eleven translocation-2(Tet2) in modulating neuronal morphology and cognition in a mouse model of Alzheimer's disease[J]. J Neurochem, 2021, 157(4): 993-1012.
[19] CHAMGORDANI M K, BARDESTANI A, EBRAHIMPOUR S, et al. In diabetic male Wistar rats, quercetin-conjugated superparamagnetic iron oxide nanoparticles have an effect on the SIRT1/p66Shc-mediated pathway related to cognitive impairment[J]. BMC Pharmacol Toxicol, 2023, 24(1): 81.
[20] GAO H L, XU H, XIN N, et al. Disruption of the CaMKⅡ/CREB signaling is associated with zinc deficiency-induced learning and memory impairments[J]. Neurotox Res, 2011, 19(4): 584-591.
[21] ZHANG C, LIU Q, YU C Y, et al. G protein-coupled estrogen receptor 1 knockout deteriorates MK-801-induced learning and memory impairment in mice[J]. Front Behav Neurosci, 2020, 14: 157.
[22] TAKEMOTO-KIMURA S, SUZUKI K, HORIGANE S I, et al. Calmodulin kinases: essential regulators in health and disease[J]. J Neurochem, 2017, 141(6): 808-818.
[23] NEMETH E, VIG K, RACZ K, et al. Influence of the postoperative inflammatory response on cognitive decline in elderly patients undergoing on-pump cardiac surgery: a controlled, prospective observational study[J]. BMC Anesthesiol, 2017, 17(1): 113.
-
期刊类型引用(7)
1. 张海坡,何建军,佘晓春. 脑动脉瘤破裂行血管内微导管介入治疗的时机选择对患者神经功能与脑前循环系统的影响. 大医生. 2025(06): 136-138 .  百度学术
百度学术
2. 周小荔,谈小红,查继辉,王玉霞,苟理宏,张旭东,杨阳. 双重抗血小板聚集联合血管介入栓塞术对蛛网膜下腔出血患者神经功能、动脉血流指标的影响. 中国煤炭工业医学杂志. 2025(01): 63-68 .  百度学术
百度学术
3. 李奔,付星星,叶鹏. 3D打印技术辅助微导管塑形在颅内动脉瘤栓塞术中的应用探讨. 世界复合医学(中英文). 2024(01): 156-160 .  百度学术
百度学术
4. 钱志平. 熄风解痉加减汤辅助血管内介入栓塞术治疗动脉瘤性蛛网膜下腔出血效果分析. 实用中西医结合临床. 2024(13): 29-31+88 .  百度学术
百度学术
5. 罗轶,朱春伟,陈圣攀,舒航,谢强. 脑动脉瘤夹闭术与支架植入弹簧圈栓塞术治疗颅内动脉瘤的疗效与安全性分析. 吉林医学. 2024(10): 2343-2346 .  百度学术
百度学术
6. 林桂芳,张雅静,胡君霞,龙小容,王湘赣. 基于态势分析的认知行为干预在脑动脉瘤介入栓塞术后的应用价值. 中国当代医药. 2024(25): 185-188+193 .  百度学术
百度学术
7. 孙文强,张婕,王洪亮. 血管内栓塞术治疗中小型颅内动脉瘤患者并发症发生情况及复发高危因素分析. 转化医学杂志. 2024(10): 1694-1697+1702 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载:


 苏公网安备 32100302010246号
苏公网安备 32100302010246号
